총 9건
-
 첫 킬로미크론혈증 증후군 ASO 치료제 '올레자르센'아이오니스 파마슈티컬스(Ionis Pharmaceuticals)의 트린골자(Tryngolza& 9415;, 성분명 올레자르센)는 APOC3 표적 antisense oligonucleotide(ASO) 제제로, 작년 미국 FDA, 올해 9월 유럽 EMA에서 성인 가족성 킬로미크론혈증 증후군(Familial Chylomicronemia Syndrome, FCS) 환자의 중성지방 감소를 위한 식이요법 보조 치료제로 최초 승인됐다.가족성 킬로미크론혈증 증후군(FCS)은 지단백분해효소(Lipoprotein Lipase, LPL) 또는 그 조절 인자의 결함으로 인해 소장에서 유래한 중성지방(TG) 풍부 지단백인 킬로미크론(chylomicron)이 적절히 분해되지 못하고 혈중에 병리적으로 축적되는 질환이다. 이로 인해 급성 췌장염(acute Pancreatitis)과 같은 심각하고 치명적인 합병증이 발생할 수 있다.올레자르센은 antisense RNA 기술을 활용해 간세포 내 APOC3 mRNA를 선택적으로 억제함으로써 apoC-III 단백질 생성량을 감소시키는 제제이다.그 결과 중성지방 분해를 저해하던 apoC-III 수준이 낮아지면서 LPL 매개 지질분해와 킬로미크론 제거가 촉진되고, 궁극적으로 중성지방 대사가 정상화된다. 즉, LPL 기능 저하로 TG가 축적되는 FCS 환자에서 apoC-III 감소를 통해 TG 제거 경로를 간접적으로 활성화하는 기전을 갖는다.이 약제의 허가는 3상 BALANCE 임상시험에서 확인된 유의한 효과와 안전성 결과를 근거로 이뤄졌다. 해당 연구 결과는 New England Journal of Medicine(NEJM)에 게재됐다.임상시험에서는 유전적으로 확진된 FCS 환자 66명을 대상으로 위약군 및 올레자르센 50mg, 80mg 피하 투여군(4주 간격)으로 무작위 배정하였다.그 결과, 6개월 시점에서 80mg군은 위약 대비 혈청 TG를 평균 42.5% 감소(P=0.0084)시켰으며, 급성 췌장염 발생 위험은 약 90% 감소했다. 또한 apoC-III 수치는 유의하게 감소했고, LDL-C는 용량 의존적으로 증가, apoB는 유의한 변화가 없었다.주요 이상반응으로는 주사 부위 반응, 혈소판 감소, 관절통, 경미한 혈당 및 간 효소 상승 등이 보고됐다.가족성 킬로미크론혈증 증후군(Familial Chylomicronemia Syndrome, FCS)은 무슨 질환인가?가족성 킬로미크론혈증 증후군(FCS)은 지단백분해효소(lipoprotein lipase, LPL) 또는 그 조절 단백의 유전적 결함으로 인해 발생하는 상염색체 열성 희귀 유전질환이다. 이로 인해 소장에서 흡수된 중성지방(triglyceride, TG)이 풍부한 킬로미크론(chylomicron, CM)이 적절히 분해되지 못하고 혈중에 병적으로 축적된다.정상 상태에서는 식후 림프계를 통해 혈중으로 유입된 CM이 LPL에 의해 TG가 유리지방산(non-esterified fatty acids)과 글리세롤(glycerol)로 가수분해되며, 약 3~4시간 내에 대부분 제거된다. 반면 FCS에서는 기능성 LPL이 거의 존재하지 않아, 공복 12시간 이상 경과해도 CM이 혈중에 잔류한다. 잔존 LPL의 미미한 활성이나 기타 혈장 리파아제의 보조 작용으로는 이를 보상할 수 없어, 지속적이며 중증의 고중성지방혈증이 발생한다.생화학적으로 FCS는 킬로미크론의 과도한 축적과 VLDL·LDL·HDL의 현저한 감소라는 독특한 지질 프로파일을 보인다. 외인성 TG 대사의 차단으로 CM 잔여입자 생성이 억제되고, 간에서 VLDL 합성에 필요한 지질 기질이 감소해 VLDL 및 LDL 수치가 낮거나 정상 수준에 머무른다. 또한 HDL은 CETP(cholesteryl ester transfer protein) 매개 지질 교환 증가와 불충분한 지질분해(lipolysis)로 인해 감소한다.FCS의 가장 심각한 합병증은 급성 췌장염(acute pancreatitis)으로, 혈중 TG가 1,000 mg/dL 이상에서 위험이 급격히 상승하며, FCS 환자에서는 보통 2,000& 8211;5,000 mg/dL 이상으로 유지되어 재발성 또는 만성 췌장염으로 진행할 수 있다. 병태생리적으로는 순환 중 CM이 췌장 모세혈관을 기계적으로 폐쇄하고, 제한적 LPL 작용으로 생성된 유리지방산(FFA)이 국소적으로 축적되어 세포 독성, 염증, 부종, 괴사를 유발한다.임상적으로는 극심한 상복부 통증, 구토, 발열, 혈청 아밀라아제·리파아제 상승이 특징이며, 반복적 염증은 췌장 섬유화와 외분비기능부전(exocrine insufficiency)으로 이어질 수 있다.또한, 간비대(hepatomegaly) 및 지방간(hepatic steatosis)이 흔히 동반된다. 이는 CM 및 TG의 만성 축적으로 인한 간세포 내 지방 침착이 원인으로, 장기간 지속 시 비알코올성 지방간염(NASH)으로 진행할 수 있으며, 이에 따른 간기능 저하 및 대사 합병증 위험도 보고되고 있다.더불어 혈중 지질입자 과잉은 비장비대(splenomegaly)와 다양한 조직 내 지질 침착(lipid deposition)을 초래할 수 있다. 특히 간, 비장, 망막, 피부 등에서 거품세포(foam cell) 형태의 축적이 관찰되며, 드물게 황색종(xanthomas) 등의 피부 병변으로 나타나기도 한다.킬로미크론(Chylomicrons. CM)이란 어떤 물질인가?음식을 통해 지방을 섭취하면, 소장에서 흡수된 지방은 장세포로 들어가 다시 중성지방(TG) 형태로 재합성된다. 이렇게 만들어진 TG는 일부는 세포 내에 저장되고, 일부는 킬로미크론(CM)이라는 지방 운반 입자를 형성하는 데 사용된다.CM은 처음에 아주 작은 씨앗 같은 형태의 전구체(pre-CM)로 만들어지며, 이때 핵심이 되는 구조 단백질이 바로 apoB-48이다. 이 apoB-48을 중심으로 TG가 차곡차곡 결합하면서 입자가 점차 커지고, 여기에 여러 지단백 관련 단백질이 더해지면 CM의 기본 골격이 완성된다.형성 초기의 CM은 골지체로 이동해 최종 가공을 거친다. 이 과정에서 필요한 단백질이 추가되고 구조가 정돈되며, 완성된 CM이 형성된다.완성된 CM은 장세포 밖으로 바로 혈액으로 들어가는 것이 아니라, 먼저 림프관으로 배출된다. 이후 림프 순환을 따라 이동해 흉관을 거쳐 쇄골하정맥(subclavian vein)으로 유입되면서 비로소 전신 혈액순환에 합류하게 된다.혈액 속으로 들어온 CM은 신체 여러 조직으로 이동해 지방을 전달한다. 근육에서는 에너지원으로 사용되고, 지방조직에서는 저장용으로 축적된다. 이 과정에서 CM 내 TG가 점점 빠져나가면서 입자는 작아지고, 결국 킬로미크론 잔여입자(CM remnant)라는 형태로 변한다.최종적으로 CM 잔여입자는 간으로 운반되어 제거된다. 간세포는 잔여입자 표면에 부착된 단백질 신호를 통해 이를 인식해 세포 내로 흡수하고, 분해하여 처리한다. 이 과정은 체내 지방의 운반과 분배가 효율적으로 이루어지도록 하는 중요한 생리적 단계다.Biogenesis of Lipoproteins(출처: Mass Spec Rev. 2023;42:1397& 8211;1423). 다시 정리하면, 섭취된 식이성 지방은 소장 내강에서 흡수된 후 장세포로 이동해 아포지질단백질 B-48(apoB-48)을 골격으로 CM을 형성한다. 형성된 CM은 림프계를 거쳐 혈액순환으로 유입되며, 순환계에 들어온 CM은 apoC-II에 의해 활성화된 지단백분해효소(LPL)에 의해 빠르게 가수분해된다.이 과정에서 방출된 유리지방산은 근육세포에서는 에너지원으로 산화되고, 지방조직에서는 다시 TG로 재합성되어 저장된다. TG가 제거되면서 입자는 점차 작아져 킬로미크론 잔여입자(CM remnant)가 되며, 이후 간세포 표면 수용체에 의해 인식되어 내재화(endocytosis)되고 분해됨으로써 순환계에서 제거된다.한편, TG는 간에서도 합성되며, 아포지질단백질 B-100(apoB-100)과 결합해 초저밀도지단백(VLDL, very low-density lipoprotein)을 형성한 뒤 혈액으로 분비된다. VLDL 역시 LPL의 작용을 받아 TG를 잃어가면서 중간밀도지단백(IDL, intermediate-density lipoprotein)로 전환되고, 이 과정에서도 유리지방산이 방출된다.생성된 IDL은 두 가지 경로를 따른다. 일부는 간에서 직접 제거되며, 나머지는 추가적인 LPL 및 hepatic lipase의 효소 작용을 통해 저밀도지단백(LDL, low-density lipoprotein)로 전환된다. LDL은 콜레스테롤이 풍부한 지단백으로, 말초 조직에 콜레스테롤을 공급하거나, 간으로 되돌아가 LDL 수용체에 의해 제거되는 등 체내 콜레스테롤 운반과 항상성 유지에 핵심적 역할을 한다.APOC3란 무엇인가APOC3는 간과 장에서 발현되는 유전자로, 이 유전자로부터 생성되는 단백질이 ApoC-III이다. 합성된 ApoC-III는 혈중 중성지방이 풍부한 지단백질(triglyceride-rich lipoproteins, TRLs)의 표면에 결합하여 지질 대사의 핵심 조절자로 기능한다.ApoC-III는 지단백분해효소(lipoprotein lipase, LPL)와 간 리파아제(hepatic lipase)의 활성을 억제하여 TRL의 분해(lipolysis)를 방해하고, 동시에 TRL 및 그 잔여입자의 간섭취(hepatic clearance)를 저해한다. 이러한 작용은 혈중 중성지방 상승과 TRL 잔여입자 축적을 초래하여, 죽상경화 발생 위험을 높이는 병태생리적 기반이 된다.유전역학적 연구는 APOC3/ApoC-III 축이 중성지방 대사 및 심혈관질환 위험에 인과적(causal) 역할을 한다는 명확한 근거를 제시한다. APOC3의 기능상실(loss-of-function, LOF) 변이를 보유한 개인은 ApoC-III 발현이 감소하여 혈중 중성지방 수치가 현저히 낮고, 관상동맥질환(ASCVD) 위험 또한 감소하는 것으로 보고된다.반대로 기능증가(gain-of-function, GOF) 변이나 APOC3의 과발현은 고중성지방혈증과 ASCVD 위험 증가와 밀접하게 연관되어 있다. 이러한 증거들은 APOC3가 단순한 지질 표지자를 넘어, 중성지방 대사를 조절하고 질환의 병태생리를 매개하는 핵심 인자임을 보여준다.APOC3는 주로 간세포(hepatocytes)에서 발현되며, 소장 상피세포(enterocytes)에서도 소량 발현된다. 이 유전자는 79개의 아미노산으로 구성된 소형 아포지단백질인 ApoC-III를 암호화한다.이러한 근거를 바탕으로 APOC3/ApoC-III 축은 고중성지방혈증, 죽상경화, TRL-관련 급성췌장염 등 다양한 대사·심혈관질환의 주요 치료 표적으로 부상하고 있다. 특히 기존 피브레이트나 오메가-3 지방산으로 조절되지 않는 난치성 고중성지방혈증 또는 가족성 킬로미크론혈증(FCS) 환자에서 APOC3 억제는 혈중 중성지방 및 ApoC-III 수치를 효과적으로 감소시키고, 췌장염 위험을 줄이는 잠재력을 보여주고 있다.Antisense oligonucleotide(ASO)는 무엇인가? ASO는 질병 관련 유전자의 발현을 RNA 단계에서 정밀하게 조절하도록 설계된 합성 핵산 치료제로, 표적 mRNA를 직접 억제함으로써 병태생리의 근본 원인을 교정하는 혁신적 치료 플랫폼이다.ASO는 일반적으로 뉴클레오타이드 15~25개로 구성되며, 표적 RNA와 상보적으로 결합하여 RNA 안정성, 스플라이싱, 번역 효율 등에 영향을 미친다. 이를 통해 단백질 생산 과정을 원천적으로 조절할 수 있다. 체내 투여된 ASO는 주로 간, 근육, 중추신경계 등 특정 장기에 분포한 뒤 세포 내로 유입되어 세포질과 핵에서 작용한다.ASO의 가장 대표적인 작용 기전은 RNase H1 매개 mRNA 절단(gene silencing)이다. ASO가 mRNA와 결합해 RNA& 8211;DNA hybrid를 형성하면 RNase H1이 이를 인식해 표적 mRNA를 절단하고, 절단된 mRNA는 신속히 분해된다. 그 결과 해당 단백질의 번역이 억제되며, 이는 과발현된 병적 단백질을 직접 감소시키는 데 매우 효과적이다(Figure 2). 이러한 기전은 대사질환, 염증질환, 신경·근육계 유전질환, 희귀질환 등 다양한 영역에서 임상적 효능이 입증되고 있다.RNase H1 ASO Mechanism of Action(출처: DNA AND CELL BIOLOGYVolume 39, Number 2, 2020).ASO는 스플라이싱 조절(splice modulation)을 통해 질환 원인 돌연변이를 교정하거나 기능적 단백질 아이소폼의 생성을 유도할 수도 있다. ASO가 pre-mRNA의 스플라이싱 조절 부위(exonic/intronic splicing enhancer 또는 silencer 등)에 결합하면, 스플라이싱 machinery의 접근 또는 조립을 선택적으로 억제·촉진하여 특정 엑손의 포함 또는 배제를 유도한다. 대표적 성공 사례로는 척수성 근위축증(SMA) 치료제 누시넨센(nusinersen, Spinraza& 9415;) 이 있다.이 외에도 ASO는 번역 억제, miRNA 기능 차단(antagomir-like effect), RNA 구조 변형을 통한 안정성 조절 등 다양한 분자적 경로로 작용한다. 이러한 약리 기전의 다양성은 ASO가 단일 기전에 국한되지 않고, RNA 수준에서 작동하는 정밀 유전자 조절 치료제임을 의미한다.ASO 기술 발전의 핵심은 화학적 구조 최적화였다. 초기에는 phosphorothioate(PS) 골격 변형을 통해 체내 안정성과 반감기를 연장했고, 이후 2’-O-methyl(2’-O-Me), 2’-O-methoxyethyl(2’-MOE) 및 locked nucleic acid(LNA) 등 2·3세대 핵산 변형 기술이 도입되어 결합 친화력, 선택성, 면역반응 감소, 독성 개선이 크게 진전됐다.최근에는 N-acetylgalactosamine(GalNAc) 결합 플랫폼의 도입으로 ASGPR 수용체를 통한 간세포 특이적 전달이 가능해지며, 효능 증대와 전신 부작용 최소화라는 중요한 기술적 도약이 이루어졌다.따라서 ASO는 DNA-단백질 축 사이의 핵심 매개 단계인 RNA를 직접 조절함으로써 유전자 발현을 분자 수준에서 교정하는 정밀 치료 전략이며, 기존의 단백질 표적 기반 치료제 또는 유전자 치료제와 차별화되는 혁신적 RNA 약물 플랫폼으로 자리매김하고 있다.가족성 킬로미크론혈증증후군(FCS) 기존 치료제에는 어떤 약제들이 있는가?FCS에서 약물치료로 시도되어 온 기존 약제에는 피브레이트, 오메가-3 지방산, 니아신 등이 있다. 그러나 이들 약제는 모두 LPL 의존적 경로를 기반으로 작용하기 때문에, LPL 또는 조절 단백의 유전적 결함을 특징으로 하는 FCS에서는 치료 효과가 제한적이다.피브레이트(fibrates)는 가장 오래된 고중성지방혈증 치료제로, 대표 약제로는 fenofibrate, gemfibrozil, bezafibrate 등이 있다.피브레이트는 PPAR-α(peroxisome proliferator& 8211;activated receptor-α)를 활성화하여 LPL 발현 증가, ApoC-III 발현 억제, 지방산 산화 촉진을 통해 TG를 감소시킨다. 이차성 고중성지방혈증에서는 의미 있는 TG 감소 효과가 있으나, FCS에서는 LPL 자체가 결핍되어 있어 치료 반응이 거의 나타나지 않는다. 또한 간효소 상승, 근육통, 신기능 저하 등의 부작용 가능성도 고려해야 한다.오메가-3 지방산(omega-3 fatty acids)은 EPA(eicosapentaenoic acid) 및 DHA(docosahexaenoic acid)를 기반으로 한 제제로, 간 내 TG 합성 억제 및 VLDL 분비 감소를 통해 TG 저하 효과를 보인다. 일반 고중성지방혈증에서는 20~30%의 TG 감소가 가능하나, 킬로미크론 축적이 근본 문제인 FCS에서는 LPL 비의존적 기전의 한계로 효과가 매우 제한적이며, 대개 10& 8211;20% 수준의 감소에 그친다. 이러한 수준의 감소는 급성 췌장염 위험 감소에는 불충분하다.니아신(niacin; 비타민 B3)은 과거 TG 감소와 HDL 상승 목적으로 사용되었으나, 혈당 상승, 간독성, 안면홍조(flushing) 등의 부작용으로 인해 현재는 임상적 사용이 거의 중단되었다. 특히 FCS 환자에서는 TG 감소 효과가 미미하고 안전성 문제가 커 실제 임상적 적용이 사실상 배제된 상태다.종합하면, 피브레이트, 오메가-3 지방산, 니아신 등 기존 약제들은 LPL 기능 강화 또는 지방 합성 억제에 의존하는 간접적 기전이므로, LPL 결핍이라는 FCS의 근본 병태를 해결하지 못한다. 이 때문에 FCS 치료의 핵심은 여전히 극단적 저지방 식이(< 20g/일)에 의존하고 있으며, 중증 환자에서는 충분한 예방 효과가 보장되지 않는다.최근 들어 ApoC-III 또는 ANGPTL3를 표적하는 RNA 기반 신약이 LPL 비의존적 기전을 통해 직접 병태생리를 교정하는 혁신적 치료 전략(mechanistic innovation)으로 주목받고 있다.APOC3 억제제는 어떤 약제인가?Apolipoprotein C-III(APOC3)는 단순한 지질 표지자를 넘어 중성지방(TG) 대사의 핵심 조절자로, 지단백 분해 억제, TRL 잔여입자 축적, 인슐린 저항성 및 염증 유도 등 다양한 병태생리 기전에 관여한다.특히 유전학적 근거에 따르면, APOC3 유전자의 기능 상실(loss-of-function) 변이 보유자는 중성지방 수치가 현저히 낮고, ASCVD 발생률 및 TRL-연관 급성 췌장염 위험이 감소하는 것으로 보고되었다. 이러한 결과는 APOC3가 질환의 병태생리에 직접적 역할을 한다는 점을 뒷받침하며, 유효한 치료 표적(targetable driver) 으로 확립되는 근거가 되었다.이러한 근거를 바탕으로, APOC3 발현을 선택적으로 억제하는 RNA 기반 치료제 개발이 활발히 진행되고 있다. 대표적인 플랫폼은 antisense oligonucleotide(ASO) 와 small interfering RNA(siRNA) 로, 모두 APOC3 mRNA를 직접 표적하여 ApoC-III 단백질 합성을 감소시키는 정밀 RNA치료 전략이다.초기 ASO 제제인 volanesorsen은 FCS 환자를 대상으로 ApoC-III와 중성지방 수치를 현저히 감소시키며 치료 잠재력을 입증했으나, 혈소판감소증(thrombocytopenia) 등 안전성 문제가 임상적 활용의 제약 요인으로 작용했다. 이러한 한계를 보완하기 위해 간 표적 GalNAc 결합 기술이 적용된 2세대 ASO인 olezarsen이 개발되었으며, 보다 우수한 안전성 프로파일과 강력한 TG 감소 효과가 관찰되고 있다.동시에 siRNA 플랫폼 기반의 plozasiran(ARO-APOC3) 역시 간세포 내 APOC3 발현을 억제하는 기전으로 개발 중이다.이 차세대 APOC3 억제제들은 기존 치료에 반응이 미흡한 난치성·중증 고중성지방혈증 환자군에게 새로운 치료 대안을 제공할 뿐 아니라, TRL-잔여 위험(residual risk) 감소를 통한 심혈관질환 예방 측면에서도 잠재적 가치를 보여주고 있다. 특히 TG 감소 외에도 간·췌장 합병증 개선 가능성, 심혈관 위험 지표 개선, 대사염증 경감 효과 등이 탐색되고 있어 적용 범위가 확장될 전망이다.결론적으로, APOC3 억제제는 중성지방 대사의 근본 조절축을 정밀하게 표적하는 혁신적 RNA 기반 치료 전략으로, 고중성지방혈증, 죽상경화성 심혈관질환, TRL-연관 급성 췌장염 등 다양한 대사 및 심혈관질환 영역에서 새로운 치료 패러다임을 제시하고 있다.올레자르센의 약리적 기전은 어떠한가? 올레자르센은 표적 mRNA와 상보적으로 결합하여 RNA& 8211;DNA hybrid를 형성하고, RNase H1을 활성화해 APOC3 mRNA를 절단·분해한다. 이로써 apoC-III 단백질 발현이 감소하고, LPL 활성이 회복되며, 간으로의 TRL 잔여입자 제거가 촉진되어 혈중 중성지방 농도가 유의하게 감소한다.간세포 선택성을 강화하기 위해 5’ 말단에는 삼지형(triantennary) N-아세틸갈락토사민(GalNAc) 리간드가 결합되어 있다. 이를 통해 asialoglycoprotein receptor(ASGPR)를 매개로 한 간세포 특이적 흡수가 가능해지며, 세포내섭취(endocytosis)를 거쳐 간세포 내로 이동한 후 표적 mRNA를 분해한다.The ASO Drug Olezarsen Targets Familial Chylomicronemia Syndrome[출처: https://www.cell.com/trends/pharmacological-sciences/abstract /S0165-6147(25) 00097-5]APOC3 억제를 통한 기전은 크게 세 가지로 정리된다. 첫째, 잔존 LPL 활성(residual LPL activity)을 강화하여 중성지방 분해를 촉진하고, 둘째, 중성지방이 풍부한 지단백(TG-rich lipoprotein)의 생성과 분비를 억제하며, 셋째, LPL 비의존적 대사 경로(alternative catabolic pathways)를 활성화하여 추가적인 중성지방 감소를 유도한다.올레자르센은 5& 8211;10& 8211;5 gapmer 구조로 설계되었으며, 2’-O-methoxyethyl(2’-MOE) 수식 염기와 phosphorothioate 골격을 적용해 안정성과 결합 친화도를 높였다. 내부 DNA 서열은 RNase H1 유도를 위한 구조적 요건을 유지하며, 5-methylcytosine과 5-methyluridine의 도입은 염기쌍 안정성과 표적 결합력을 강화한다.결과적으로, 올레자르센은 APOC3 mRNA 발현을 선택적으로 억제함으로써 혈중 중성지방을 효과적으로 감소시키는 정밀 RNA 기반 치료제로, 고중성지방혈증 및 가족성 킬로미크론혈증(FCS)의 병태생리를 표적하는 혁신적 치료 옵션으로서 임상적 의의가 크다.올레잘센(TRYNGOLZA)의 허가 임상 결과는 어떠한가?TRYNGOLZA의 효능은 유전적으로 FCS이 확인된 성인 환자 중, 공복 중성지방(TG) 수치가 880mg/dL 이상인 환자를 대상으로 실시된 무작위 배정, 위약 대조, 이중맹검 임상시험(Trial 1)을 통해 입증되었다.시험에 앞서 모든 환자는 1일 지방 섭취량을 20g 이하로 제한하는 저지방 식이요법을 최소 4주 이상 유지하는 준비(run-in) 기간을 거쳤다. 이후 환자들은 무작위로 배정되어, TRYNGOLZA 80mg(n=22) 또는 동일 용량의 위약(placebo, n=23)을 피하 주사 형태로 4주 간격으로 53주간 투여받았다.환자 인구학적 및 기저 특성은 두 치료군 간 전반적으로 유사하였다 등록 시 당뇨병을 동반한 환자 비율은 TRYNGOLZA 80mg 군 32%, 위약군 26%였다.연구 시작 시 TRYNGOLZA 80mg 군과 위약군 모두에서 스타틴(27%), 오메가-3 지방산(42%), 피브레이트(49%), 또는 기타 지질강하제(13%)가 병용 사용되었다.두 군을 합쳐 71%의 환자가 과거 10년 이내에 급성 췌장염(acute pancreatitis) 병력이 있었다. 기저 시점의 공복 중성지방 평균(SD) 수치는 2,604(1,364)mg/dL, 중앙값은 2,303mg/dL이었으며, 범위는 334& 8211;6,898mg/dL이었다.1차 평가변수(primary endpoint)는 기저치 대비 6개월차(23, 25, 27주차 평균)의 공복 중성지방 변화율(%)로, 위약군과 비교하여 분석되었다.그 결과, TRYNGOLZA 80mg 투여군은 위약군 대비 공복 중성지방 변화율이 -42.5%로 유의하게 감소하였다(95% 신뢰구간: -74.1% ~ -10.9%; p = 0.0084). 추가 결과는 Table 2를 참조. 기저치 대비 중앙값 변화율(Figure 1)과 중앙값 절대 중성지방(TG) 수치(Figure 2)는, 12개월 치료 기간 동안 일관된 중성지방 감소 효과를 보여주었다. 12개월의 치료 기간 동안, TRYNGOLZA 80mg을 투여받은 환자군에서 급성 췌장염(acute pancreatitis)의 발생률은 위약군보다 낮았다.TRYNGOLZA 80mg 투여군에서는 1명(5%), 위약군에서는 7명(30%의 환자에서 급성 췌장염이 보고되었다. 이들 모든 환자는 시험 등록 10년 이내에 췌장염 병력을 가지고 있었다.올레잘센의 쟁점이 될 수 있는 부분은?올레잘센은 FCS 최초이자 유일한 치료 옵션으로, 성인 FCS 환자에서 식이요법의 보조요법으로 중성지방(TG)을 유의하게 감소시킨다. 월 1회 80 mg 피하주사라는 단순한 용법 또한 장점으로 꼽힌다. 유사 기전 약물인 volanesorsen과 plozasiran은 아직 미국 FDA 승인을 받지 못했다.올레잘센의 허가 임상은 FCS 및 중증 고중성지방혈증 환자에서 유의미한 TG 감소 효과를 입증하며 치료적 진전을 보여주었으나, 해석 시 고려해야 할 중요한 한계가 존재한다.첫째, 대부분의 임상이 소수의 환자를 대상으로 수행되어 결과의 일반화 가능성에 제약이 있다. 희귀질환 특성상 환자 모집이 어렵지만, 연구 참여자의 인종적·임상적 다양성이 충분히 확보되지 않아 실제 진료 현장에 완전히 적용하기에는 한계가 있다. 또한 평가 기간이 주로 6~12개월에 그쳐 장기 투여 시 효과 지속성 및 누적 부작용에 대한 근거가 부족하다.둘째, 유효성 평가지표로 사용된 TG 감소는 대리결과(surrogate endpoint)에 해당한다. 급성 췌장염 발생 감소, 심혈관 사건 예방, 생존율 향상과 같은 최종 임상결과(hard outcomes)에 대한 근거는 충분히 축적되지 않았다. 이는 약물의 장기적 임상적 가치 평가 측면에서 중요한 한계다.셋째, 희귀질환 치료제 특성상 높은 치료비용과 접근성 제약 문제는 실제 임상 적용과 보건의료 자원 배분에서 중요한 고려 요소로 남아 있다.종합하면, 올레잘센은 고중성지방혈증 치료 영역에서 치료적 가치를 지닌 유망한 옵션으로 부상하고 있으나, 장기 안전성, 하드엔드포인트 근거, 비용-효과성 등 해결해야 할 과제가 여전히 존재한다. 향후 충분한 규모와 이질적 환자군을 포함한 장기 추적 연구가 수행되어, 실제 진료 환경에서의 임상적 유용성과 안전성이 확립되기를 기대한다.참고문헌 1. Erica Gianazza et al. “Proteomic studies on apoB& 8208;containing lipoprotein in cardiovascular research: A comprehensive review” Mass Spec Rev. 2023;42:1397& 8211;1423. 2. Anne V. Smith1 and Sarah J. Tabrizi “Therapeutic Antisense Targeting of Huntingtin” DNA AND CELL BIOLOGYVolume 39, Number 2, 2020). 3. Fiza Javed et al. “Familial chylomicronemia syndrome: An expert clinical review from the National Lipid Association” Journal of Clinical Lipidology, Vol 19, No 3, May/June 2025 4. Kexin Wang et al. “Remnant cholesterol and atherosclerotic cardiovascular disease: Metabolism, mechanism, evidence, and treatment” Front. Cardiovasc. Med. 9:913869. 5. Erik S. et al “Olezarsen, Acute Pancreatitis, and Familial Chylomicronemia Syndrome” N Engl J Med& 160;2024;390:1781-1792. 6. Jan Bor& 233;n et al. “The Roles of ApoC-III on the Metabolism of Triglyceride-Rich Lipoproteins in Humans“ Humans. Front. Endocrinol. 11:474 2020. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-11-06 21:18:18최병철 박사
첫 킬로미크론혈증 증후군 ASO 치료제 '올레자르센'아이오니스 파마슈티컬스(Ionis Pharmaceuticals)의 트린골자(Tryngolza& 9415;, 성분명 올레자르센)는 APOC3 표적 antisense oligonucleotide(ASO) 제제로, 작년 미국 FDA, 올해 9월 유럽 EMA에서 성인 가족성 킬로미크론혈증 증후군(Familial Chylomicronemia Syndrome, FCS) 환자의 중성지방 감소를 위한 식이요법 보조 치료제로 최초 승인됐다.가족성 킬로미크론혈증 증후군(FCS)은 지단백분해효소(Lipoprotein Lipase, LPL) 또는 그 조절 인자의 결함으로 인해 소장에서 유래한 중성지방(TG) 풍부 지단백인 킬로미크론(chylomicron)이 적절히 분해되지 못하고 혈중에 병리적으로 축적되는 질환이다. 이로 인해 급성 췌장염(acute Pancreatitis)과 같은 심각하고 치명적인 합병증이 발생할 수 있다.올레자르센은 antisense RNA 기술을 활용해 간세포 내 APOC3 mRNA를 선택적으로 억제함으로써 apoC-III 단백질 생성량을 감소시키는 제제이다.그 결과 중성지방 분해를 저해하던 apoC-III 수준이 낮아지면서 LPL 매개 지질분해와 킬로미크론 제거가 촉진되고, 궁극적으로 중성지방 대사가 정상화된다. 즉, LPL 기능 저하로 TG가 축적되는 FCS 환자에서 apoC-III 감소를 통해 TG 제거 경로를 간접적으로 활성화하는 기전을 갖는다.이 약제의 허가는 3상 BALANCE 임상시험에서 확인된 유의한 효과와 안전성 결과를 근거로 이뤄졌다. 해당 연구 결과는 New England Journal of Medicine(NEJM)에 게재됐다.임상시험에서는 유전적으로 확진된 FCS 환자 66명을 대상으로 위약군 및 올레자르센 50mg, 80mg 피하 투여군(4주 간격)으로 무작위 배정하였다.그 결과, 6개월 시점에서 80mg군은 위약 대비 혈청 TG를 평균 42.5% 감소(P=0.0084)시켰으며, 급성 췌장염 발생 위험은 약 90% 감소했다. 또한 apoC-III 수치는 유의하게 감소했고, LDL-C는 용량 의존적으로 증가, apoB는 유의한 변화가 없었다.주요 이상반응으로는 주사 부위 반응, 혈소판 감소, 관절통, 경미한 혈당 및 간 효소 상승 등이 보고됐다.가족성 킬로미크론혈증 증후군(Familial Chylomicronemia Syndrome, FCS)은 무슨 질환인가?가족성 킬로미크론혈증 증후군(FCS)은 지단백분해효소(lipoprotein lipase, LPL) 또는 그 조절 단백의 유전적 결함으로 인해 발생하는 상염색체 열성 희귀 유전질환이다. 이로 인해 소장에서 흡수된 중성지방(triglyceride, TG)이 풍부한 킬로미크론(chylomicron, CM)이 적절히 분해되지 못하고 혈중에 병적으로 축적된다.정상 상태에서는 식후 림프계를 통해 혈중으로 유입된 CM이 LPL에 의해 TG가 유리지방산(non-esterified fatty acids)과 글리세롤(glycerol)로 가수분해되며, 약 3~4시간 내에 대부분 제거된다. 반면 FCS에서는 기능성 LPL이 거의 존재하지 않아, 공복 12시간 이상 경과해도 CM이 혈중에 잔류한다. 잔존 LPL의 미미한 활성이나 기타 혈장 리파아제의 보조 작용으로는 이를 보상할 수 없어, 지속적이며 중증의 고중성지방혈증이 발생한다.생화학적으로 FCS는 킬로미크론의 과도한 축적과 VLDL·LDL·HDL의 현저한 감소라는 독특한 지질 프로파일을 보인다. 외인성 TG 대사의 차단으로 CM 잔여입자 생성이 억제되고, 간에서 VLDL 합성에 필요한 지질 기질이 감소해 VLDL 및 LDL 수치가 낮거나 정상 수준에 머무른다. 또한 HDL은 CETP(cholesteryl ester transfer protein) 매개 지질 교환 증가와 불충분한 지질분해(lipolysis)로 인해 감소한다.FCS의 가장 심각한 합병증은 급성 췌장염(acute pancreatitis)으로, 혈중 TG가 1,000 mg/dL 이상에서 위험이 급격히 상승하며, FCS 환자에서는 보통 2,000& 8211;5,000 mg/dL 이상으로 유지되어 재발성 또는 만성 췌장염으로 진행할 수 있다. 병태생리적으로는 순환 중 CM이 췌장 모세혈관을 기계적으로 폐쇄하고, 제한적 LPL 작용으로 생성된 유리지방산(FFA)이 국소적으로 축적되어 세포 독성, 염증, 부종, 괴사를 유발한다.임상적으로는 극심한 상복부 통증, 구토, 발열, 혈청 아밀라아제·리파아제 상승이 특징이며, 반복적 염증은 췌장 섬유화와 외분비기능부전(exocrine insufficiency)으로 이어질 수 있다.또한, 간비대(hepatomegaly) 및 지방간(hepatic steatosis)이 흔히 동반된다. 이는 CM 및 TG의 만성 축적으로 인한 간세포 내 지방 침착이 원인으로, 장기간 지속 시 비알코올성 지방간염(NASH)으로 진행할 수 있으며, 이에 따른 간기능 저하 및 대사 합병증 위험도 보고되고 있다.더불어 혈중 지질입자 과잉은 비장비대(splenomegaly)와 다양한 조직 내 지질 침착(lipid deposition)을 초래할 수 있다. 특히 간, 비장, 망막, 피부 등에서 거품세포(foam cell) 형태의 축적이 관찰되며, 드물게 황색종(xanthomas) 등의 피부 병변으로 나타나기도 한다.킬로미크론(Chylomicrons. CM)이란 어떤 물질인가?음식을 통해 지방을 섭취하면, 소장에서 흡수된 지방은 장세포로 들어가 다시 중성지방(TG) 형태로 재합성된다. 이렇게 만들어진 TG는 일부는 세포 내에 저장되고, 일부는 킬로미크론(CM)이라는 지방 운반 입자를 형성하는 데 사용된다.CM은 처음에 아주 작은 씨앗 같은 형태의 전구체(pre-CM)로 만들어지며, 이때 핵심이 되는 구조 단백질이 바로 apoB-48이다. 이 apoB-48을 중심으로 TG가 차곡차곡 결합하면서 입자가 점차 커지고, 여기에 여러 지단백 관련 단백질이 더해지면 CM의 기본 골격이 완성된다.형성 초기의 CM은 골지체로 이동해 최종 가공을 거친다. 이 과정에서 필요한 단백질이 추가되고 구조가 정돈되며, 완성된 CM이 형성된다.완성된 CM은 장세포 밖으로 바로 혈액으로 들어가는 것이 아니라, 먼저 림프관으로 배출된다. 이후 림프 순환을 따라 이동해 흉관을 거쳐 쇄골하정맥(subclavian vein)으로 유입되면서 비로소 전신 혈액순환에 합류하게 된다.혈액 속으로 들어온 CM은 신체 여러 조직으로 이동해 지방을 전달한다. 근육에서는 에너지원으로 사용되고, 지방조직에서는 저장용으로 축적된다. 이 과정에서 CM 내 TG가 점점 빠져나가면서 입자는 작아지고, 결국 킬로미크론 잔여입자(CM remnant)라는 형태로 변한다.최종적으로 CM 잔여입자는 간으로 운반되어 제거된다. 간세포는 잔여입자 표면에 부착된 단백질 신호를 통해 이를 인식해 세포 내로 흡수하고, 분해하여 처리한다. 이 과정은 체내 지방의 운반과 분배가 효율적으로 이루어지도록 하는 중요한 생리적 단계다.Biogenesis of Lipoproteins(출처: Mass Spec Rev. 2023;42:1397& 8211;1423). 다시 정리하면, 섭취된 식이성 지방은 소장 내강에서 흡수된 후 장세포로 이동해 아포지질단백질 B-48(apoB-48)을 골격으로 CM을 형성한다. 형성된 CM은 림프계를 거쳐 혈액순환으로 유입되며, 순환계에 들어온 CM은 apoC-II에 의해 활성화된 지단백분해효소(LPL)에 의해 빠르게 가수분해된다.이 과정에서 방출된 유리지방산은 근육세포에서는 에너지원으로 산화되고, 지방조직에서는 다시 TG로 재합성되어 저장된다. TG가 제거되면서 입자는 점차 작아져 킬로미크론 잔여입자(CM remnant)가 되며, 이후 간세포 표면 수용체에 의해 인식되어 내재화(endocytosis)되고 분해됨으로써 순환계에서 제거된다.한편, TG는 간에서도 합성되며, 아포지질단백질 B-100(apoB-100)과 결합해 초저밀도지단백(VLDL, very low-density lipoprotein)을 형성한 뒤 혈액으로 분비된다. VLDL 역시 LPL의 작용을 받아 TG를 잃어가면서 중간밀도지단백(IDL, intermediate-density lipoprotein)로 전환되고, 이 과정에서도 유리지방산이 방출된다.생성된 IDL은 두 가지 경로를 따른다. 일부는 간에서 직접 제거되며, 나머지는 추가적인 LPL 및 hepatic lipase의 효소 작용을 통해 저밀도지단백(LDL, low-density lipoprotein)로 전환된다. LDL은 콜레스테롤이 풍부한 지단백으로, 말초 조직에 콜레스테롤을 공급하거나, 간으로 되돌아가 LDL 수용체에 의해 제거되는 등 체내 콜레스테롤 운반과 항상성 유지에 핵심적 역할을 한다.APOC3란 무엇인가APOC3는 간과 장에서 발현되는 유전자로, 이 유전자로부터 생성되는 단백질이 ApoC-III이다. 합성된 ApoC-III는 혈중 중성지방이 풍부한 지단백질(triglyceride-rich lipoproteins, TRLs)의 표면에 결합하여 지질 대사의 핵심 조절자로 기능한다.ApoC-III는 지단백분해효소(lipoprotein lipase, LPL)와 간 리파아제(hepatic lipase)의 활성을 억제하여 TRL의 분해(lipolysis)를 방해하고, 동시에 TRL 및 그 잔여입자의 간섭취(hepatic clearance)를 저해한다. 이러한 작용은 혈중 중성지방 상승과 TRL 잔여입자 축적을 초래하여, 죽상경화 발생 위험을 높이는 병태생리적 기반이 된다.유전역학적 연구는 APOC3/ApoC-III 축이 중성지방 대사 및 심혈관질환 위험에 인과적(causal) 역할을 한다는 명확한 근거를 제시한다. APOC3의 기능상실(loss-of-function, LOF) 변이를 보유한 개인은 ApoC-III 발현이 감소하여 혈중 중성지방 수치가 현저히 낮고, 관상동맥질환(ASCVD) 위험 또한 감소하는 것으로 보고된다.반대로 기능증가(gain-of-function, GOF) 변이나 APOC3의 과발현은 고중성지방혈증과 ASCVD 위험 증가와 밀접하게 연관되어 있다. 이러한 증거들은 APOC3가 단순한 지질 표지자를 넘어, 중성지방 대사를 조절하고 질환의 병태생리를 매개하는 핵심 인자임을 보여준다.APOC3는 주로 간세포(hepatocytes)에서 발현되며, 소장 상피세포(enterocytes)에서도 소량 발현된다. 이 유전자는 79개의 아미노산으로 구성된 소형 아포지단백질인 ApoC-III를 암호화한다.이러한 근거를 바탕으로 APOC3/ApoC-III 축은 고중성지방혈증, 죽상경화, TRL-관련 급성췌장염 등 다양한 대사·심혈관질환의 주요 치료 표적으로 부상하고 있다. 특히 기존 피브레이트나 오메가-3 지방산으로 조절되지 않는 난치성 고중성지방혈증 또는 가족성 킬로미크론혈증(FCS) 환자에서 APOC3 억제는 혈중 중성지방 및 ApoC-III 수치를 효과적으로 감소시키고, 췌장염 위험을 줄이는 잠재력을 보여주고 있다.Antisense oligonucleotide(ASO)는 무엇인가? ASO는 질병 관련 유전자의 발현을 RNA 단계에서 정밀하게 조절하도록 설계된 합성 핵산 치료제로, 표적 mRNA를 직접 억제함으로써 병태생리의 근본 원인을 교정하는 혁신적 치료 플랫폼이다.ASO는 일반적으로 뉴클레오타이드 15~25개로 구성되며, 표적 RNA와 상보적으로 결합하여 RNA 안정성, 스플라이싱, 번역 효율 등에 영향을 미친다. 이를 통해 단백질 생산 과정을 원천적으로 조절할 수 있다. 체내 투여된 ASO는 주로 간, 근육, 중추신경계 등 특정 장기에 분포한 뒤 세포 내로 유입되어 세포질과 핵에서 작용한다.ASO의 가장 대표적인 작용 기전은 RNase H1 매개 mRNA 절단(gene silencing)이다. ASO가 mRNA와 결합해 RNA& 8211;DNA hybrid를 형성하면 RNase H1이 이를 인식해 표적 mRNA를 절단하고, 절단된 mRNA는 신속히 분해된다. 그 결과 해당 단백질의 번역이 억제되며, 이는 과발현된 병적 단백질을 직접 감소시키는 데 매우 효과적이다(Figure 2). 이러한 기전은 대사질환, 염증질환, 신경·근육계 유전질환, 희귀질환 등 다양한 영역에서 임상적 효능이 입증되고 있다.RNase H1 ASO Mechanism of Action(출처: DNA AND CELL BIOLOGYVolume 39, Number 2, 2020).ASO는 스플라이싱 조절(splice modulation)을 통해 질환 원인 돌연변이를 교정하거나 기능적 단백질 아이소폼의 생성을 유도할 수도 있다. ASO가 pre-mRNA의 스플라이싱 조절 부위(exonic/intronic splicing enhancer 또는 silencer 등)에 결합하면, 스플라이싱 machinery의 접근 또는 조립을 선택적으로 억제·촉진하여 특정 엑손의 포함 또는 배제를 유도한다. 대표적 성공 사례로는 척수성 근위축증(SMA) 치료제 누시넨센(nusinersen, Spinraza& 9415;) 이 있다.이 외에도 ASO는 번역 억제, miRNA 기능 차단(antagomir-like effect), RNA 구조 변형을 통한 안정성 조절 등 다양한 분자적 경로로 작용한다. 이러한 약리 기전의 다양성은 ASO가 단일 기전에 국한되지 않고, RNA 수준에서 작동하는 정밀 유전자 조절 치료제임을 의미한다.ASO 기술 발전의 핵심은 화학적 구조 최적화였다. 초기에는 phosphorothioate(PS) 골격 변형을 통해 체내 안정성과 반감기를 연장했고, 이후 2’-O-methyl(2’-O-Me), 2’-O-methoxyethyl(2’-MOE) 및 locked nucleic acid(LNA) 등 2·3세대 핵산 변형 기술이 도입되어 결합 친화력, 선택성, 면역반응 감소, 독성 개선이 크게 진전됐다.최근에는 N-acetylgalactosamine(GalNAc) 결합 플랫폼의 도입으로 ASGPR 수용체를 통한 간세포 특이적 전달이 가능해지며, 효능 증대와 전신 부작용 최소화라는 중요한 기술적 도약이 이루어졌다.따라서 ASO는 DNA-단백질 축 사이의 핵심 매개 단계인 RNA를 직접 조절함으로써 유전자 발현을 분자 수준에서 교정하는 정밀 치료 전략이며, 기존의 단백질 표적 기반 치료제 또는 유전자 치료제와 차별화되는 혁신적 RNA 약물 플랫폼으로 자리매김하고 있다.가족성 킬로미크론혈증증후군(FCS) 기존 치료제에는 어떤 약제들이 있는가?FCS에서 약물치료로 시도되어 온 기존 약제에는 피브레이트, 오메가-3 지방산, 니아신 등이 있다. 그러나 이들 약제는 모두 LPL 의존적 경로를 기반으로 작용하기 때문에, LPL 또는 조절 단백의 유전적 결함을 특징으로 하는 FCS에서는 치료 효과가 제한적이다.피브레이트(fibrates)는 가장 오래된 고중성지방혈증 치료제로, 대표 약제로는 fenofibrate, gemfibrozil, bezafibrate 등이 있다.피브레이트는 PPAR-α(peroxisome proliferator& 8211;activated receptor-α)를 활성화하여 LPL 발현 증가, ApoC-III 발현 억제, 지방산 산화 촉진을 통해 TG를 감소시킨다. 이차성 고중성지방혈증에서는 의미 있는 TG 감소 효과가 있으나, FCS에서는 LPL 자체가 결핍되어 있어 치료 반응이 거의 나타나지 않는다. 또한 간효소 상승, 근육통, 신기능 저하 등의 부작용 가능성도 고려해야 한다.오메가-3 지방산(omega-3 fatty acids)은 EPA(eicosapentaenoic acid) 및 DHA(docosahexaenoic acid)를 기반으로 한 제제로, 간 내 TG 합성 억제 및 VLDL 분비 감소를 통해 TG 저하 효과를 보인다. 일반 고중성지방혈증에서는 20~30%의 TG 감소가 가능하나, 킬로미크론 축적이 근본 문제인 FCS에서는 LPL 비의존적 기전의 한계로 효과가 매우 제한적이며, 대개 10& 8211;20% 수준의 감소에 그친다. 이러한 수준의 감소는 급성 췌장염 위험 감소에는 불충분하다.니아신(niacin; 비타민 B3)은 과거 TG 감소와 HDL 상승 목적으로 사용되었으나, 혈당 상승, 간독성, 안면홍조(flushing) 등의 부작용으로 인해 현재는 임상적 사용이 거의 중단되었다. 특히 FCS 환자에서는 TG 감소 효과가 미미하고 안전성 문제가 커 실제 임상적 적용이 사실상 배제된 상태다.종합하면, 피브레이트, 오메가-3 지방산, 니아신 등 기존 약제들은 LPL 기능 강화 또는 지방 합성 억제에 의존하는 간접적 기전이므로, LPL 결핍이라는 FCS의 근본 병태를 해결하지 못한다. 이 때문에 FCS 치료의 핵심은 여전히 극단적 저지방 식이(< 20g/일)에 의존하고 있으며, 중증 환자에서는 충분한 예방 효과가 보장되지 않는다.최근 들어 ApoC-III 또는 ANGPTL3를 표적하는 RNA 기반 신약이 LPL 비의존적 기전을 통해 직접 병태생리를 교정하는 혁신적 치료 전략(mechanistic innovation)으로 주목받고 있다.APOC3 억제제는 어떤 약제인가?Apolipoprotein C-III(APOC3)는 단순한 지질 표지자를 넘어 중성지방(TG) 대사의 핵심 조절자로, 지단백 분해 억제, TRL 잔여입자 축적, 인슐린 저항성 및 염증 유도 등 다양한 병태생리 기전에 관여한다.특히 유전학적 근거에 따르면, APOC3 유전자의 기능 상실(loss-of-function) 변이 보유자는 중성지방 수치가 현저히 낮고, ASCVD 발생률 및 TRL-연관 급성 췌장염 위험이 감소하는 것으로 보고되었다. 이러한 결과는 APOC3가 질환의 병태생리에 직접적 역할을 한다는 점을 뒷받침하며, 유효한 치료 표적(targetable driver) 으로 확립되는 근거가 되었다.이러한 근거를 바탕으로, APOC3 발현을 선택적으로 억제하는 RNA 기반 치료제 개발이 활발히 진행되고 있다. 대표적인 플랫폼은 antisense oligonucleotide(ASO) 와 small interfering RNA(siRNA) 로, 모두 APOC3 mRNA를 직접 표적하여 ApoC-III 단백질 합성을 감소시키는 정밀 RNA치료 전략이다.초기 ASO 제제인 volanesorsen은 FCS 환자를 대상으로 ApoC-III와 중성지방 수치를 현저히 감소시키며 치료 잠재력을 입증했으나, 혈소판감소증(thrombocytopenia) 등 안전성 문제가 임상적 활용의 제약 요인으로 작용했다. 이러한 한계를 보완하기 위해 간 표적 GalNAc 결합 기술이 적용된 2세대 ASO인 olezarsen이 개발되었으며, 보다 우수한 안전성 프로파일과 강력한 TG 감소 효과가 관찰되고 있다.동시에 siRNA 플랫폼 기반의 plozasiran(ARO-APOC3) 역시 간세포 내 APOC3 발현을 억제하는 기전으로 개발 중이다.이 차세대 APOC3 억제제들은 기존 치료에 반응이 미흡한 난치성·중증 고중성지방혈증 환자군에게 새로운 치료 대안을 제공할 뿐 아니라, TRL-잔여 위험(residual risk) 감소를 통한 심혈관질환 예방 측면에서도 잠재적 가치를 보여주고 있다. 특히 TG 감소 외에도 간·췌장 합병증 개선 가능성, 심혈관 위험 지표 개선, 대사염증 경감 효과 등이 탐색되고 있어 적용 범위가 확장될 전망이다.결론적으로, APOC3 억제제는 중성지방 대사의 근본 조절축을 정밀하게 표적하는 혁신적 RNA 기반 치료 전략으로, 고중성지방혈증, 죽상경화성 심혈관질환, TRL-연관 급성 췌장염 등 다양한 대사 및 심혈관질환 영역에서 새로운 치료 패러다임을 제시하고 있다.올레자르센의 약리적 기전은 어떠한가? 올레자르센은 표적 mRNA와 상보적으로 결합하여 RNA& 8211;DNA hybrid를 형성하고, RNase H1을 활성화해 APOC3 mRNA를 절단·분해한다. 이로써 apoC-III 단백질 발현이 감소하고, LPL 활성이 회복되며, 간으로의 TRL 잔여입자 제거가 촉진되어 혈중 중성지방 농도가 유의하게 감소한다.간세포 선택성을 강화하기 위해 5’ 말단에는 삼지형(triantennary) N-아세틸갈락토사민(GalNAc) 리간드가 결합되어 있다. 이를 통해 asialoglycoprotein receptor(ASGPR)를 매개로 한 간세포 특이적 흡수가 가능해지며, 세포내섭취(endocytosis)를 거쳐 간세포 내로 이동한 후 표적 mRNA를 분해한다.The ASO Drug Olezarsen Targets Familial Chylomicronemia Syndrome[출처: https://www.cell.com/trends/pharmacological-sciences/abstract /S0165-6147(25) 00097-5]APOC3 억제를 통한 기전은 크게 세 가지로 정리된다. 첫째, 잔존 LPL 활성(residual LPL activity)을 강화하여 중성지방 분해를 촉진하고, 둘째, 중성지방이 풍부한 지단백(TG-rich lipoprotein)의 생성과 분비를 억제하며, 셋째, LPL 비의존적 대사 경로(alternative catabolic pathways)를 활성화하여 추가적인 중성지방 감소를 유도한다.올레자르센은 5& 8211;10& 8211;5 gapmer 구조로 설계되었으며, 2’-O-methoxyethyl(2’-MOE) 수식 염기와 phosphorothioate 골격을 적용해 안정성과 결합 친화도를 높였다. 내부 DNA 서열은 RNase H1 유도를 위한 구조적 요건을 유지하며, 5-methylcytosine과 5-methyluridine의 도입은 염기쌍 안정성과 표적 결합력을 강화한다.결과적으로, 올레자르센은 APOC3 mRNA 발현을 선택적으로 억제함으로써 혈중 중성지방을 효과적으로 감소시키는 정밀 RNA 기반 치료제로, 고중성지방혈증 및 가족성 킬로미크론혈증(FCS)의 병태생리를 표적하는 혁신적 치료 옵션으로서 임상적 의의가 크다.올레잘센(TRYNGOLZA)의 허가 임상 결과는 어떠한가?TRYNGOLZA의 효능은 유전적으로 FCS이 확인된 성인 환자 중, 공복 중성지방(TG) 수치가 880mg/dL 이상인 환자를 대상으로 실시된 무작위 배정, 위약 대조, 이중맹검 임상시험(Trial 1)을 통해 입증되었다.시험에 앞서 모든 환자는 1일 지방 섭취량을 20g 이하로 제한하는 저지방 식이요법을 최소 4주 이상 유지하는 준비(run-in) 기간을 거쳤다. 이후 환자들은 무작위로 배정되어, TRYNGOLZA 80mg(n=22) 또는 동일 용량의 위약(placebo, n=23)을 피하 주사 형태로 4주 간격으로 53주간 투여받았다.환자 인구학적 및 기저 특성은 두 치료군 간 전반적으로 유사하였다 등록 시 당뇨병을 동반한 환자 비율은 TRYNGOLZA 80mg 군 32%, 위약군 26%였다.연구 시작 시 TRYNGOLZA 80mg 군과 위약군 모두에서 스타틴(27%), 오메가-3 지방산(42%), 피브레이트(49%), 또는 기타 지질강하제(13%)가 병용 사용되었다.두 군을 합쳐 71%의 환자가 과거 10년 이내에 급성 췌장염(acute pancreatitis) 병력이 있었다. 기저 시점의 공복 중성지방 평균(SD) 수치는 2,604(1,364)mg/dL, 중앙값은 2,303mg/dL이었으며, 범위는 334& 8211;6,898mg/dL이었다.1차 평가변수(primary endpoint)는 기저치 대비 6개월차(23, 25, 27주차 평균)의 공복 중성지방 변화율(%)로, 위약군과 비교하여 분석되었다.그 결과, TRYNGOLZA 80mg 투여군은 위약군 대비 공복 중성지방 변화율이 -42.5%로 유의하게 감소하였다(95% 신뢰구간: -74.1% ~ -10.9%; p = 0.0084). 추가 결과는 Table 2를 참조. 기저치 대비 중앙값 변화율(Figure 1)과 중앙값 절대 중성지방(TG) 수치(Figure 2)는, 12개월 치료 기간 동안 일관된 중성지방 감소 효과를 보여주었다. 12개월의 치료 기간 동안, TRYNGOLZA 80mg을 투여받은 환자군에서 급성 췌장염(acute pancreatitis)의 발생률은 위약군보다 낮았다.TRYNGOLZA 80mg 투여군에서는 1명(5%), 위약군에서는 7명(30%의 환자에서 급성 췌장염이 보고되었다. 이들 모든 환자는 시험 등록 10년 이내에 췌장염 병력을 가지고 있었다.올레잘센의 쟁점이 될 수 있는 부분은?올레잘센은 FCS 최초이자 유일한 치료 옵션으로, 성인 FCS 환자에서 식이요법의 보조요법으로 중성지방(TG)을 유의하게 감소시킨다. 월 1회 80 mg 피하주사라는 단순한 용법 또한 장점으로 꼽힌다. 유사 기전 약물인 volanesorsen과 plozasiran은 아직 미국 FDA 승인을 받지 못했다.올레잘센의 허가 임상은 FCS 및 중증 고중성지방혈증 환자에서 유의미한 TG 감소 효과를 입증하며 치료적 진전을 보여주었으나, 해석 시 고려해야 할 중요한 한계가 존재한다.첫째, 대부분의 임상이 소수의 환자를 대상으로 수행되어 결과의 일반화 가능성에 제약이 있다. 희귀질환 특성상 환자 모집이 어렵지만, 연구 참여자의 인종적·임상적 다양성이 충분히 확보되지 않아 실제 진료 현장에 완전히 적용하기에는 한계가 있다. 또한 평가 기간이 주로 6~12개월에 그쳐 장기 투여 시 효과 지속성 및 누적 부작용에 대한 근거가 부족하다.둘째, 유효성 평가지표로 사용된 TG 감소는 대리결과(surrogate endpoint)에 해당한다. 급성 췌장염 발생 감소, 심혈관 사건 예방, 생존율 향상과 같은 최종 임상결과(hard outcomes)에 대한 근거는 충분히 축적되지 않았다. 이는 약물의 장기적 임상적 가치 평가 측면에서 중요한 한계다.셋째, 희귀질환 치료제 특성상 높은 치료비용과 접근성 제약 문제는 실제 임상 적용과 보건의료 자원 배분에서 중요한 고려 요소로 남아 있다.종합하면, 올레잘센은 고중성지방혈증 치료 영역에서 치료적 가치를 지닌 유망한 옵션으로 부상하고 있으나, 장기 안전성, 하드엔드포인트 근거, 비용-효과성 등 해결해야 할 과제가 여전히 존재한다. 향후 충분한 규모와 이질적 환자군을 포함한 장기 추적 연구가 수행되어, 실제 진료 환경에서의 임상적 유용성과 안전성이 확립되기를 기대한다.참고문헌 1. Erica Gianazza et al. “Proteomic studies on apoB& 8208;containing lipoprotein in cardiovascular research: A comprehensive review” Mass Spec Rev. 2023;42:1397& 8211;1423. 2. Anne V. Smith1 and Sarah J. Tabrizi “Therapeutic Antisense Targeting of Huntingtin” DNA AND CELL BIOLOGYVolume 39, Number 2, 2020). 3. Fiza Javed et al. “Familial chylomicronemia syndrome: An expert clinical review from the National Lipid Association” Journal of Clinical Lipidology, Vol 19, No 3, May/June 2025 4. Kexin Wang et al. “Remnant cholesterol and atherosclerotic cardiovascular disease: Metabolism, mechanism, evidence, and treatment” Front. Cardiovasc. Med. 9:913869. 5. Erik S. et al “Olezarsen, Acute Pancreatitis, and Familial Chylomicronemia Syndrome” N Engl J Med& 160;2024;390:1781-1792. 6. Jan Bor& 233;n et al. “The Roles of ApoC-III on the Metabolism of Triglyceride-Rich Lipoproteins in Humans“ Humans. Front. Endocrinol. 11:474 2020. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-11-06 21:18:18최병철 박사 -
 고혈압 복합제 '텔미누보' 저용량 품목 허가[데일리팜=이혜경 기자] 종근당이 본태성 고혈압 치료제 '텔미누보정' 저용량 품목을 허가 받았다.식품의약품안전처는 29일 종근당의 '텔미누보정20/1.25mg(텔미사르탄·에스암로디핀)'을 허가했다.이번에 허가 받은 텔미누보정은 텔미사르탄20㎎과 에스암로디핀1.25㎎을 표준 치료 용량 미만으로 조합한 복합제다.고혈압 임상시험 가이드라인에서 요구하는 초기 요법 저용량 복합제 요건을 충족하는 만큼 환자 치료에 새로운 선택지가 될 수 있을 것으로 보인다.이번 저용량 품목 허가로 종근당은 텔미사르탄과 에스암로디핀 용량의 복합제 용량으로 기존의40/2.5mg, 40/5mg, 80/2.5mg, 80/5mg, 20/2.5mg 등 5개 품목에 더해 20/1.25mg까지 총 6개 품목을 갖추게 됐다.특히 텔미사르탄과 에스암로디핀 저용량인 20/2.5mg, 20/1.25mg 조합은 지난 2021년부터 후발주자로 제네릭을 허가받은 2개 제약회사들이 보유하지 못한 품목이다.텔미누보는 베링거인겔하임의 '트윈스타정(텔미사르탄·암로디핀베실산염)'의 개량신약이다. 암로디핀 대신 에스암로디핀베실산염이수화물과 텔미사르탄 성분을 결합해 지난 2013년 1월 허가받았다.의약품 조사기관 유비스트에 따르면 텔미누보는 지난해 500억원 이상의 원외처방액을 기록하면서 대형품목으로 성장했다. 올해 1분기 처방액만 봐도 전년대비 3.5% 증가한 138억원을 보이고 있다.이번에 허가 받은 텔미누보정20/1.25mg은 PPS(Per Protocol Set)에 해당하는 319명을 대상으로 8주 후 평균 MSSBP(Mean Seated Systolic Blood Pressure) 변화량을 분석한 3상 임상 시험 결과, 텔미사르탄·에스암로디핀 병용 투여군의 MSSBP 강하 효과가 암로디핀 단독 투여군에 비해 통계적으로 유의하게 큰 것으로 나타났다.또한, 95% 신뢰구간 상한값이 허용 한계인 3mmHg보다 작아 혈압 강하 효과에 있어 비열등함을 입증했다고 종근당 측은 설명했다. FAS(Full Analysis Set) 분석 결과에서도 동일한 경향이 나타났다.종근당 측은 텔미누보정20/1.25mg이 표준 용량 미만의 텔미사르탄과 에스암로디핀을 조합한 초기 요법용 저용량 복합제로, 하반기 국내 시장에 출시를 목표로 하고 있다.2025-08-29 16:24:33이혜경
고혈압 복합제 '텔미누보' 저용량 품목 허가[데일리팜=이혜경 기자] 종근당이 본태성 고혈압 치료제 '텔미누보정' 저용량 품목을 허가 받았다.식품의약품안전처는 29일 종근당의 '텔미누보정20/1.25mg(텔미사르탄·에스암로디핀)'을 허가했다.이번에 허가 받은 텔미누보정은 텔미사르탄20㎎과 에스암로디핀1.25㎎을 표준 치료 용량 미만으로 조합한 복합제다.고혈압 임상시험 가이드라인에서 요구하는 초기 요법 저용량 복합제 요건을 충족하는 만큼 환자 치료에 새로운 선택지가 될 수 있을 것으로 보인다.이번 저용량 품목 허가로 종근당은 텔미사르탄과 에스암로디핀 용량의 복합제 용량으로 기존의40/2.5mg, 40/5mg, 80/2.5mg, 80/5mg, 20/2.5mg 등 5개 품목에 더해 20/1.25mg까지 총 6개 품목을 갖추게 됐다.특히 텔미사르탄과 에스암로디핀 저용량인 20/2.5mg, 20/1.25mg 조합은 지난 2021년부터 후발주자로 제네릭을 허가받은 2개 제약회사들이 보유하지 못한 품목이다.텔미누보는 베링거인겔하임의 '트윈스타정(텔미사르탄·암로디핀베실산염)'의 개량신약이다. 암로디핀 대신 에스암로디핀베실산염이수화물과 텔미사르탄 성분을 결합해 지난 2013년 1월 허가받았다.의약품 조사기관 유비스트에 따르면 텔미누보는 지난해 500억원 이상의 원외처방액을 기록하면서 대형품목으로 성장했다. 올해 1분기 처방액만 봐도 전년대비 3.5% 증가한 138억원을 보이고 있다.이번에 허가 받은 텔미누보정20/1.25mg은 PPS(Per Protocol Set)에 해당하는 319명을 대상으로 8주 후 평균 MSSBP(Mean Seated Systolic Blood Pressure) 변화량을 분석한 3상 임상 시험 결과, 텔미사르탄·에스암로디핀 병용 투여군의 MSSBP 강하 효과가 암로디핀 단독 투여군에 비해 통계적으로 유의하게 큰 것으로 나타났다.또한, 95% 신뢰구간 상한값이 허용 한계인 3mmHg보다 작아 혈압 강하 효과에 있어 비열등함을 입증했다고 종근당 측은 설명했다. FAS(Full Analysis Set) 분석 결과에서도 동일한 경향이 나타났다.종근당 측은 텔미누보정20/1.25mg이 표준 용량 미만의 텔미사르탄과 에스암로디핀을 조합한 초기 요법용 저용량 복합제로, 하반기 국내 시장에 출시를 목표로 하고 있다.2025-08-29 16:24:33이혜경 -
 세 번째 RNAi 치료제...원발성옥살산뇨증 치료 '옥슬루모'차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼 ② 옥슬루모(Lumasiran) 옥슬루모(Oxlumo, 성분명: 루마시란, Lumasiran, Alnylam Pharmaceuticals)는 세 번째 RNA 간섭(siRNA) 기반 치료제로, 2020년 11월 미국 FDA와 유럽 EMA에서 희귀 유전 대사질환인 ‘원발성 고옥살산뇨증 1형(primary hyperoxaluria type 1, PH1)치료제’로 승인되었다. 국내에서는 2024년 식품의약품안전처에서 글로벌 혁신제품 신속심사 지원체계(GIFT, Global Innovative products on Fast Track) 대상으로 지정되었다.루마시란은 소아 및 성인 PH1 환자에서 요 및 혈장 옥살산 수치를 낮추는 목적으로 승인되었으며, 2022년 10월에는 고도 신부전 또는 투석 중인 환자에서도 혈장 옥살산(plasma oxalate) 수치 감소를 위한 적응증이 추가되었다.PH1은 간에서 옥살산(oxalate)이 과도하게 생성되어 발생하는 희귀질환으로, 신장과 요로에 옥살산 또는 옥살산칼슘 결정이 침착한다. 질환이 진행되면 신장 기능이 악화되어 투석이 필요하며, 최종적으로는 간이식이나 신장이식을 받아야 하는 경우가 많다. 기존에는 이뇨제를 통한 칼슘 배설 증가, 식이 조절을 통한 옥살산 섭취 제한 등 보존적 관리만 가능했으며, 승인된 표적 치료제는 없었다.루마시란은 HAO1(hydroxyacid oxidase 1) 유전자의 mRNA를 표적으로 하는 siRNA로, 이 유전자가 암호화하는 glycolate oxidase(GO) 효소의 생성을 억제한다. 결과적으로 간에서의 옥살산 생성이 감소하며, 요 및 혈장 옥살산 수치가 낮아져 PH1의 주요 병태인 신장 손상과 석회화 진행을 억제한다.이번 FDA 승인은 ILLUMINATE-A임상 3상 결과를 근거로 하였고, ILLUMINATE-B임상 3상 중간분석 결과도 참고했다. ILLUMINATE-A에서는 6세 이상 PH1 환자 39명을 대상으로 한 연구에서 루마시란 투여군의 소변 옥살산 수치가 위약군 대비 65.4% 감소했다. 또한 투여 환자의 84%는 소변 옥살산 수치가 정상 범위에 이르렀으며, 52%는 정상 범위로 회복되었다.원발성옥살산뇨증(Primary hyperoxaluria type 1, PH1)는 아떤 질환인가? PH1은 간에서 옥살산의 생성이 과도하게 증가하여 신장 기능 저하 및 전신성 합병증을 유발하고, 이로 인해 심각한 전신적 쇠약과 생명을 위협하는 임상 증상을 초래하는 희귀하고 진행성의 유전 질환이다.PH1의 대사적 결함은 간 특이적 퍼옥시좀(peroxisome) 효소인 알라닌& 8211;글리옥실산 아미노전이효소(alanine& 8211;glyoxylate aminotransferase, AGT)의 결핍으로 인해 발생한다. AGT는 옥살산의 전구체인 glyoxylate를 glycine으로 전환하는 핵심 효소이다.AGT 활성이 결여되거나 부족하면 glyoxylate이 oxalate로 산화되어 혈중 옥살산 농도가 상승한다. 간에서 생성된 oxalate는 주로 신장을 통해 배설되며, PH1에서 말초 장기 손상을 매개하는 주요 독성 물질로 작용한다.임상적으로 PH1 환자들은 주로 소아기에 신장 결석, 신석회증(nephrocalcinosis), 말기 신장 질환(end-stage renal disease, ESㄲD) 등을 경험한다. 혈중 옥살산 농도가 충분히 높아지면 전신성 옥살산침착증(systemic oxalosis)이 발생하여 뼈, 망막, 심장, 피부 등 여러 장기에 침착이 나타날 수 있다. 질환은 수년간 진단되지 않거나 오진되는 경우도 흔하다. 따라서 PH1 치료의 핵심 목표는 소변 옥살산 농도를 가능한 한 낮추는 데 두고 있다.현재 이용 가능한 치료 옵션은 제한적이다. 과도한 수분 섭취(hyperhydration), AGT의 보조효소 역할을 하는 고용량 피리독신(pyridoxine), 그리고 구연산(citrate)과 같은 수산칼슘 결정 억제제를 통해 신장 결석 발생을 줄이고 질환의 진행을 늦출 수 있다. 그러나 과도한 수분 섭취는 환자에게 큰 부담이 되며, 순응도가 낮아지고 일부 소아에서는 위루관(gastrostomy tube) 삽입이 필요할 수 있다.질환이 진행하여 신부전에 이르게 되면 과잉의 옥살산을 효과적으로 배출할 수 없으므로 주 6일에 달하는 집중적인 혈액투석과 경우에 따라 보조적 복막투석이 요구된다.현재까지 PH1에서 유일하게 유전적 결함 자체를 교정할 수 있는 치료법은 간이식(liver transplantation)이다. AGXT 유전자가 간세포에서만 발현되므로, 정상 AGXT를 가진 간을 이식하면 옥살산 과생성이 본질적으로 중단된다. 이는 진정한 의미의 근치적 치료(curative treatment)로 간주된다.그러나 간이식은 상당한 이환율과 사망률, 평생의 면역억제 치료가 수반되는 한계가 있으며, 종종 간이식과 신장이식을 동시에 시행하는 간-신장 동시이식(combined liver& 8211;kidney transplantation)이 필요하다. 이 경우 간의 대사 결함을 교정하면서 동시에 손상된 신기능을 회복할 수 있다.Alanine:glyoxylate aminotransferase(AGT)는 어떤 물질인가?정상 생리 상태에서 glycolate는 간세포 퍼옥시좀(peroxisome) 내에서 glycolate oxidase(GO)의 촉매 작용을 받아 glyoxylate로 산화된다. 생성된 glyoxylate는 세포 내에서 잠재적으로 독성을 지닌 중간대사산물이므로, 즉시 해독 경로를 통해 제거된다.주요 대사 경로는 AGT에 의한 전환으로, 이 과정에서 alanine의 아미노기가 glyoxylate로 전달되어 glycine과 pyruvate가 형성된다. 이러한 반응은 glyoxylate가 독성 종말대사산물인 oxalate로 전환되기 이전에 대사된다.그러나 퍼옥시좀 내에서 처리되지 못한 과잉의 glyoxylate는 세포질로 이동하며, 이후 두 가지 대사 경로 중 하나를 따른다. 첫째, glyoxylate reductase/hydroxypyruvate reductase(GRHPR)의 작용으로 다시 glycolate로 환원되는 경로이고, 둘째, lactate dehydrogenase(LDH)에 의해 oxalate로 산화되는 경로이다. 생성된 oxalate는 인체 내에서 추가적인 대사 경로가 존재하지 않기 때문에, 전적으로 신장을 통한 소변 배설에 의존한다(Figure 1). PH1 환자에서는 AGXT 유전자의 돌연변이로 인해 AGT 효소가 결핍되거나 비활성 상태가 되어 glyoxylate가 glycine으로 전환되지 못한다. 이로 인해 대부분의 glyoxylate가 LDH에 의해 oxalate로 산화된다. 일부 환자에서는 HAO1 유전자의 상대적 과발현으로 glycolate가 과도하게 glyoxylate로 전환되어 oxalate 생성이 더욱 증가한다.그 결과 소변 내 oxalate 배설량이 비정상적으로 상승하며, 일반적으로 하루 1.73m² 체표면적당 1 mmol을 초과하여 정상 범위(0.5 mmol/1.73m² 미만)를 현저히 상회한다.Oxalate는 수용성이 매우 낮기 때문에 소변 내 농도가 증가하면 과포화 상태에 도달하고, 이에 따라 신세뇨관 내강에서 칼슘 옥살레이트(calcium oxalate)결정이 형성된다. 형성된 결정은 서로 응집하여 결석을 만들거나, 세뇨관 상피세포에 부착되어 세포 내로 유입된 후 간질(interstitium) 공간으로 배출된다. 이러한 침착은 염증 반응을 유발하며, 결국 신석회증(nephrocalcinosis)과 신기능 저하로 이어질 수 있다.루마시란(Lumasiran)은 어떤 약제인가?루마시란은 합성 이중가닥 소간섭 RNA(siRNA)로, N-아세틸갈락토사민(GalNAc) 삼분지 구조가 공유결합 형태로 siRNA의 센스 가닥에 부착되어 있다. 이 약제는 내인성 RNA 간섭(RNA interference) 경로를 활용하여 간세포 내 HAO1 유전자 mRNA의 3’ 비번역영역을 표적으로 하여 해당 mRNA를 분해한다.루마시란은 간세포에 존재하는 HAO1 유전자를 표적으로하여 GO 효소의 발현을 억제함으로써 glyoxylate 생성을 근원적으로 감소시킨다(Figure 2). 따라서 HAO1을 침묵시키고 GO 효소를 고갈시킴으로써 간에서 옥살산의 생성을 억제하고 정상화하여 잠재적으로 PH1 질병의 진행을 예방할 수 있다. 루마시란(Lumasiran)의 약리 기전은?루마시란은 GalNAc가 결합된 이중가닥 RNA(GalNAc-double-stranded RNA conjugate)이다. 루마시란의 GalNAc 잔기는 간세포 표면에 존재하는 ASGPR 수용체에 결합하며, 이를 통해 이중가닥 RNA가 세포 내로 엔도사이토시스를 통해 유입된다(1).세포질 내에서는 이중가닥 RNA가 엔도좀에서 탈출하여 RNA 유도 침묵 복합체(RISC)에 탑재되고(2a), 동시에 ASGPR은 재활용되어(2b) 다시 세포 표면으로 이동해 루마시란의 반복적인 흡수를 가능하게 한다.이후 RISC는 루마시란의 안티센스 RNA 가닥의 상동성을 이용해 HAO1 mRNA를 인식하고 절단함(3)으로써, 해당 mRNA가 GO 효소로 번역되는 것을 차단한다(Figure 3). 이로 인해 GO 단백질의 합성이 차단되고, 그 결과 GO에 의해 생성되던 glyoxylate의 양이 감소하며, 이는 곧 oxalate 생성을 억제하는 효과로 이어진다. 루마시란(Lumasiran)의 임상 결과는 어떠한가?1. ILLUMINATE-A ILLUMINATE-A는 PH1(원발성 고옥살산뇨증 1형) 환자 중 6세 이상이며 사구체여과율(eGFR)이 30mL/min/1.73m² 이상인 환자 39명을 대상으로 루마시란(OXLUMO)과 위약(placebo)을 비교한 무작위 배정, 이중맹검 임상시험이다.환자들은 OXLUMO 3mg/kg을 월 1회, 3회에 걸쳐 초기 투여한 뒤, 이후에는 3개월 간격으로 유지 투여를 받았다. 위약군 역시 동일한 투여 스케줄을 따랐으며, 6개월 경과 후 모든 환자에게 OXLUMO가이 투여되었다. 시험 대상자의 중앙값 연령은 15세(범위: 6~61세)였고, 67%는 남성, 77%는 백인이었다.Base line에서의 24시간 요 옥살산 배출량(BSA로 보정한 값)의 중앙값은 1.7mmol/24시간/1.73 m², 혈장 옥살산 농도는 중앙값 13.1 μmol/L이었다.주요 평가 변수는 기저치 대비 3~6개월 동안 평균된 24시간 요 옥살산 배출량(BSA 보정)의 백분율 감소율이었다.결과적으로, OXLUMO 투여군에서는 요 옥살산 배출량이 평균 -65% 감소하였으며(95% CI: & 8211;71, & 8211;59%), 위약군에서는 & 8211;12% 감소(95% CI: & 8211;20, & 8211;4)로, 두 군 간 차이는 53%(95% CI: 45, 62), p< 0.0001로 통계적으로 유의미하였다. 이 결과는 OXLUMO가 PH1 환자에서 요 옥살산 수치를 임상적으로 의미 있게 감소시킴을 입증하였다(Figure 1). 6개월 시점까지, OXLUMO 투여군의 52%(95% 신뢰구간: 31%, 72%)가 정상 범위의 24시간 요 옥살산 배출량(BSA 보정값 기준 ≤0.514mmol/24시간/1.73m²)에 도달하였다.반면, 위약군 중 정상 범위에 도달한 비율은 0%(95% CI: 0%& 8211;25%)였으며, 그 차이는 통계적으로 유의미하였다(p=0.001). 또한, 루마시란을 투여받은 환자에서는 감소된 요 옥살산 수치가 24개월 시점까지 지속적으로 유지되었다.2. ILLUMINATE-B ILLUMINATE-B는 6세 미만의 PH1 환자 18명을 대상으로 한 단일군(single-arm) 임상시험이었다. 대상자는 12개월 이상인 경우 eGFR이 45mL/min/1.73m² 초과, 12개월 미만인 경우는 혈청 크레아티닌 수치가 정상 범위인 환자들로 구성되었다.OXLUMO의 용량은 체중에 따라 결정되었다. 첫 투여 시 환자의 중앙값 연령은 51개월(범위: 4~74개월)이었으며, 56%는 여성, 88%는 백인이었다.체중 분포는 10kg 미만 3명, 10kg 이상 20kg 미만 12명, 20kg 이상 3명이었다. 기저 상태에서의 요 옥살산:크레아티닌 비율(spot urinary oxalate:creatinine ratio)의 중앙값은 0.47 mmol/mmol이었다.주요 평가 변수는 3~6개월 동안 평균된 요 옥살산:크레아티닌 비율의 기저치 대비 백분율 감소율이었다. 그 결과, OXLUMO 투여군은 기저치 대비 평균 72%의 요 옥살산:크레아티닌 비율 감소를 나타냈으며(95% CI: 66, 78), 요 옥살산 배출 감소 효과는 12개월 시점까지 유지되었다.(Figure 2). 3. ILLUMINATE-C ILLUMINATE-C은 총 21명의 환자가 다기관 단일군 연구에 등록되어 OXLUMO 치료를 받았다. 이 연구는 원발성 고옥살산뇨증 1형(PH1) 환자 중 eGFR ≤45mL/min/1.73m²인 12개월 이상 환자, 또는 12개월 미만이면서 연령에 비해 혈청 크레아티닌 수치가 상승한 환자(혈액투석 중인 환자 포함)를 대상으로 시행되었다.환자들은 두 개의 코호트(cohort)로 나뉘었다. Cohort A는 등록 시점에서 투석이 필요하지 않은 환자 6명, Cohort B는 안정적인 혈액투석(hemodialysis) 치료를 받고 있던 환자 15명으로, 이들의 투석 일정은 임상시험 초기 6개월 동안 변경되지 않도록 유지되었다.환자들은 체중에 따라 권장된 OXLUMO 용량을 투여받았다. 복막투석 환자는 연구에서 제외되었다. 첫 투여 시 환자의 중앙값 연령은 9세(범위: 0~59세)였으며, 57%는 남성, 76%는 백인이었다.기저 상태에서의 혈장 옥살산 농도 중앙값은 Cohort A가 58μmol/L, Cohort B(투석 환자)가 투석 전 기준 104μmol/L이었다.주요 평가 변수는 Cohort A(N=5명)의 경우 기저치 대비 6개월 시점(3~6개월 평균)의 혈장 옥살산 농도 변화율, Cohort B(N=15명)의 경우 투석 전 혈장 옥살산 농도의 기저치 대비 6개월 시점(3~6개월 평균)의 변화율이었다.그 결과, Cohort A에서는 혈장 옥살산 농도가 기저치 대비 33% 감소(LS 평균, 95% CI: & 8211;82, 15)하였고, Cohort B에서는 42% 감소(95% CI: & 8211;51, & 8211;34%)하였다.구체적으로, Cohort A의 평균 혈장 옥살산 농도는 기저치 65μmol/L(95% CI: 21, 108)에서 6개월 시점 33μmol/L(95% CI: 10, 56)로 감소하였다.Cohort B의 평균 혈장 옥살산 농도는 기저치 108μmol/L(95% CI: 92, 125)에서 6개월 시점 62μmol/L(95% CI: 51, 72)로 감소하였다(Figure 3). 루마시란(Lumasiran)의 예상되는 쟁점은 무엇인가?루마시란(Lumasiran, 제품명 Oxlumo)은 원발성 고옥살산뇨증 1형(PH1)에 대한 최초의 siRNA 기반 치료제로, 임상시험에서 유의한 옥살산 감소 효과를 입증하였다. 이 약제는 RNA 간섭(RNA interference) 기술을 이용해 간세포 내 HAO1 유전자의 발현을 억제함으로써 glycolate oxidase(GO) 효소 생성을 차단하고, 결과적으로 glyoxylate 및 oxalate 생성을 줄인다.다만 루마시란은 PH1의 근본 원인인 AGXT 유전자의 기능 결손을 교정하지는 않는다. 즉, glyoxylate가 해독되지 못해 oxalate로 전환되는 병태생리에서, 루마시란은 상류 단계인 GO 발현을 억제하여 glyoxylate 생성 자체를 줄이는 간접적 치료 전략에 해당한다.루마시란은 피하 주사를 통해 주기적으로 투여해야 하며, 치료를 중단하면 GO 발현이 다시 활성화되어 glyoxylate 및 oxalate 생성이 재개된다. 이는 질환 재악화를 초래할 수 있어 지속적인 유지 치료가 필수적이다. 또한 이미 신장, 뼈, 망막 등에 침착된 옥살산, 즉 전신 옥살산증(systemic oxalosis)은 제거하거나 역전시키지 못한다. 따라서 말기 신부전이나 광범위한 옥살산 침착 환자의 경우 투석이나 간·신장 이식 등 추가 치료가 필요하다.결국 루마시란은 유전적 결함 자체를 교정하지는 않지만, PH1의 대사 경로를 효과적으로 차단하여 질환의 진행을 억제하고 옥살산 축적을 완화하는 표적 치료제이다. 이는 대사산물 생성을 억제하는 전략으로, 유전자 교정이나 단백질 기능 복원과는 구별된다.그럼에도 불구하고 루마시란은 간 이식 외에는 근본적 치료가 없던 PH1 치료 영역에 중요한 전환점을 마련하였다. 특히 조기 진단과 개입을 통해 신기능 보존과 예후 개선에 기여할 수 있으며, 향후 장기적 안전성 확보, 접근성 향상, 유전자 치료제와의 병용 또는 전환 전략이 논의될 경우 PH1 치료의 새로운 패러다임으로 자리매김할 수 있을 것으로 기대된다.참고문헌 1. Sally-Anne Hulton “Lumasiran: expanding the treatment options for patients with primary hyperoxaluria type 1” EXPERT OPINION ON ORPHAN DRUGS 2021, VOL. 9, NOS. 7& 8211;10, 189& 8211;198. 2. Xuan Gang et al. “Lumasiran for primary hyperoxaluria type 1: What we have learned?” Front. Pediatr. 10:1052625. 3. Viola D’Ambrosioet al. “Lumasiran in the Management of Patients with Primary Hyperoxaluria Type 1: From Bench to Bedside“ International Journal of Nephrology and Renovascular Disease 2022:15 197& 8211;206. 4. Sander F. Garrelfs at al. “Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1” N Engl J Med 2021;384:1216-26. 5. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-08-22 06:02:44최병철 박사
세 번째 RNAi 치료제...원발성옥살산뇨증 치료 '옥슬루모'차세대 유전자 침묵 치료, 'RNAi' 치료제 플랫폼 ② 옥슬루모(Lumasiran) 옥슬루모(Oxlumo, 성분명: 루마시란, Lumasiran, Alnylam Pharmaceuticals)는 세 번째 RNA 간섭(siRNA) 기반 치료제로, 2020년 11월 미국 FDA와 유럽 EMA에서 희귀 유전 대사질환인 ‘원발성 고옥살산뇨증 1형(primary hyperoxaluria type 1, PH1)치료제’로 승인되었다. 국내에서는 2024년 식품의약품안전처에서 글로벌 혁신제품 신속심사 지원체계(GIFT, Global Innovative products on Fast Track) 대상으로 지정되었다.루마시란은 소아 및 성인 PH1 환자에서 요 및 혈장 옥살산 수치를 낮추는 목적으로 승인되었으며, 2022년 10월에는 고도 신부전 또는 투석 중인 환자에서도 혈장 옥살산(plasma oxalate) 수치 감소를 위한 적응증이 추가되었다.PH1은 간에서 옥살산(oxalate)이 과도하게 생성되어 발생하는 희귀질환으로, 신장과 요로에 옥살산 또는 옥살산칼슘 결정이 침착한다. 질환이 진행되면 신장 기능이 악화되어 투석이 필요하며, 최종적으로는 간이식이나 신장이식을 받아야 하는 경우가 많다. 기존에는 이뇨제를 통한 칼슘 배설 증가, 식이 조절을 통한 옥살산 섭취 제한 등 보존적 관리만 가능했으며, 승인된 표적 치료제는 없었다.루마시란은 HAO1(hydroxyacid oxidase 1) 유전자의 mRNA를 표적으로 하는 siRNA로, 이 유전자가 암호화하는 glycolate oxidase(GO) 효소의 생성을 억제한다. 결과적으로 간에서의 옥살산 생성이 감소하며, 요 및 혈장 옥살산 수치가 낮아져 PH1의 주요 병태인 신장 손상과 석회화 진행을 억제한다.이번 FDA 승인은 ILLUMINATE-A임상 3상 결과를 근거로 하였고, ILLUMINATE-B임상 3상 중간분석 결과도 참고했다. ILLUMINATE-A에서는 6세 이상 PH1 환자 39명을 대상으로 한 연구에서 루마시란 투여군의 소변 옥살산 수치가 위약군 대비 65.4% 감소했다. 또한 투여 환자의 84%는 소변 옥살산 수치가 정상 범위에 이르렀으며, 52%는 정상 범위로 회복되었다.원발성옥살산뇨증(Primary hyperoxaluria type 1, PH1)는 아떤 질환인가? PH1은 간에서 옥살산의 생성이 과도하게 증가하여 신장 기능 저하 및 전신성 합병증을 유발하고, 이로 인해 심각한 전신적 쇠약과 생명을 위협하는 임상 증상을 초래하는 희귀하고 진행성의 유전 질환이다.PH1의 대사적 결함은 간 특이적 퍼옥시좀(peroxisome) 효소인 알라닌& 8211;글리옥실산 아미노전이효소(alanine& 8211;glyoxylate aminotransferase, AGT)의 결핍으로 인해 발생한다. AGT는 옥살산의 전구체인 glyoxylate를 glycine으로 전환하는 핵심 효소이다.AGT 활성이 결여되거나 부족하면 glyoxylate이 oxalate로 산화되어 혈중 옥살산 농도가 상승한다. 간에서 생성된 oxalate는 주로 신장을 통해 배설되며, PH1에서 말초 장기 손상을 매개하는 주요 독성 물질로 작용한다.임상적으로 PH1 환자들은 주로 소아기에 신장 결석, 신석회증(nephrocalcinosis), 말기 신장 질환(end-stage renal disease, ESㄲD) 등을 경험한다. 혈중 옥살산 농도가 충분히 높아지면 전신성 옥살산침착증(systemic oxalosis)이 발생하여 뼈, 망막, 심장, 피부 등 여러 장기에 침착이 나타날 수 있다. 질환은 수년간 진단되지 않거나 오진되는 경우도 흔하다. 따라서 PH1 치료의 핵심 목표는 소변 옥살산 농도를 가능한 한 낮추는 데 두고 있다.현재 이용 가능한 치료 옵션은 제한적이다. 과도한 수분 섭취(hyperhydration), AGT의 보조효소 역할을 하는 고용량 피리독신(pyridoxine), 그리고 구연산(citrate)과 같은 수산칼슘 결정 억제제를 통해 신장 결석 발생을 줄이고 질환의 진행을 늦출 수 있다. 그러나 과도한 수분 섭취는 환자에게 큰 부담이 되며, 순응도가 낮아지고 일부 소아에서는 위루관(gastrostomy tube) 삽입이 필요할 수 있다.질환이 진행하여 신부전에 이르게 되면 과잉의 옥살산을 효과적으로 배출할 수 없으므로 주 6일에 달하는 집중적인 혈액투석과 경우에 따라 보조적 복막투석이 요구된다.현재까지 PH1에서 유일하게 유전적 결함 자체를 교정할 수 있는 치료법은 간이식(liver transplantation)이다. AGXT 유전자가 간세포에서만 발현되므로, 정상 AGXT를 가진 간을 이식하면 옥살산 과생성이 본질적으로 중단된다. 이는 진정한 의미의 근치적 치료(curative treatment)로 간주된다.그러나 간이식은 상당한 이환율과 사망률, 평생의 면역억제 치료가 수반되는 한계가 있으며, 종종 간이식과 신장이식을 동시에 시행하는 간-신장 동시이식(combined liver& 8211;kidney transplantation)이 필요하다. 이 경우 간의 대사 결함을 교정하면서 동시에 손상된 신기능을 회복할 수 있다.Alanine:glyoxylate aminotransferase(AGT)는 어떤 물질인가?정상 생리 상태에서 glycolate는 간세포 퍼옥시좀(peroxisome) 내에서 glycolate oxidase(GO)의 촉매 작용을 받아 glyoxylate로 산화된다. 생성된 glyoxylate는 세포 내에서 잠재적으로 독성을 지닌 중간대사산물이므로, 즉시 해독 경로를 통해 제거된다.주요 대사 경로는 AGT에 의한 전환으로, 이 과정에서 alanine의 아미노기가 glyoxylate로 전달되어 glycine과 pyruvate가 형성된다. 이러한 반응은 glyoxylate가 독성 종말대사산물인 oxalate로 전환되기 이전에 대사된다.그러나 퍼옥시좀 내에서 처리되지 못한 과잉의 glyoxylate는 세포질로 이동하며, 이후 두 가지 대사 경로 중 하나를 따른다. 첫째, glyoxylate reductase/hydroxypyruvate reductase(GRHPR)의 작용으로 다시 glycolate로 환원되는 경로이고, 둘째, lactate dehydrogenase(LDH)에 의해 oxalate로 산화되는 경로이다. 생성된 oxalate는 인체 내에서 추가적인 대사 경로가 존재하지 않기 때문에, 전적으로 신장을 통한 소변 배설에 의존한다(Figure 1). PH1 환자에서는 AGXT 유전자의 돌연변이로 인해 AGT 효소가 결핍되거나 비활성 상태가 되어 glyoxylate가 glycine으로 전환되지 못한다. 이로 인해 대부분의 glyoxylate가 LDH에 의해 oxalate로 산화된다. 일부 환자에서는 HAO1 유전자의 상대적 과발현으로 glycolate가 과도하게 glyoxylate로 전환되어 oxalate 생성이 더욱 증가한다.그 결과 소변 내 oxalate 배설량이 비정상적으로 상승하며, 일반적으로 하루 1.73m² 체표면적당 1 mmol을 초과하여 정상 범위(0.5 mmol/1.73m² 미만)를 현저히 상회한다.Oxalate는 수용성이 매우 낮기 때문에 소변 내 농도가 증가하면 과포화 상태에 도달하고, 이에 따라 신세뇨관 내강에서 칼슘 옥살레이트(calcium oxalate)결정이 형성된다. 형성된 결정은 서로 응집하여 결석을 만들거나, 세뇨관 상피세포에 부착되어 세포 내로 유입된 후 간질(interstitium) 공간으로 배출된다. 이러한 침착은 염증 반응을 유발하며, 결국 신석회증(nephrocalcinosis)과 신기능 저하로 이어질 수 있다.루마시란(Lumasiran)은 어떤 약제인가?루마시란은 합성 이중가닥 소간섭 RNA(siRNA)로, N-아세틸갈락토사민(GalNAc) 삼분지 구조가 공유결합 형태로 siRNA의 센스 가닥에 부착되어 있다. 이 약제는 내인성 RNA 간섭(RNA interference) 경로를 활용하여 간세포 내 HAO1 유전자 mRNA의 3’ 비번역영역을 표적으로 하여 해당 mRNA를 분해한다.루마시란은 간세포에 존재하는 HAO1 유전자를 표적으로하여 GO 효소의 발현을 억제함으로써 glyoxylate 생성을 근원적으로 감소시킨다(Figure 2). 따라서 HAO1을 침묵시키고 GO 효소를 고갈시킴으로써 간에서 옥살산의 생성을 억제하고 정상화하여 잠재적으로 PH1 질병의 진행을 예방할 수 있다. 루마시란(Lumasiran)의 약리 기전은?루마시란은 GalNAc가 결합된 이중가닥 RNA(GalNAc-double-stranded RNA conjugate)이다. 루마시란의 GalNAc 잔기는 간세포 표면에 존재하는 ASGPR 수용체에 결합하며, 이를 통해 이중가닥 RNA가 세포 내로 엔도사이토시스를 통해 유입된다(1).세포질 내에서는 이중가닥 RNA가 엔도좀에서 탈출하여 RNA 유도 침묵 복합체(RISC)에 탑재되고(2a), 동시에 ASGPR은 재활용되어(2b) 다시 세포 표면으로 이동해 루마시란의 반복적인 흡수를 가능하게 한다.이후 RISC는 루마시란의 안티센스 RNA 가닥의 상동성을 이용해 HAO1 mRNA를 인식하고 절단함(3)으로써, 해당 mRNA가 GO 효소로 번역되는 것을 차단한다(Figure 3). 이로 인해 GO 단백질의 합성이 차단되고, 그 결과 GO에 의해 생성되던 glyoxylate의 양이 감소하며, 이는 곧 oxalate 생성을 억제하는 효과로 이어진다. 루마시란(Lumasiran)의 임상 결과는 어떠한가?1. ILLUMINATE-A ILLUMINATE-A는 PH1(원발성 고옥살산뇨증 1형) 환자 중 6세 이상이며 사구체여과율(eGFR)이 30mL/min/1.73m² 이상인 환자 39명을 대상으로 루마시란(OXLUMO)과 위약(placebo)을 비교한 무작위 배정, 이중맹검 임상시험이다.환자들은 OXLUMO 3mg/kg을 월 1회, 3회에 걸쳐 초기 투여한 뒤, 이후에는 3개월 간격으로 유지 투여를 받았다. 위약군 역시 동일한 투여 스케줄을 따랐으며, 6개월 경과 후 모든 환자에게 OXLUMO가이 투여되었다. 시험 대상자의 중앙값 연령은 15세(범위: 6~61세)였고, 67%는 남성, 77%는 백인이었다.Base line에서의 24시간 요 옥살산 배출량(BSA로 보정한 값)의 중앙값은 1.7mmol/24시간/1.73 m², 혈장 옥살산 농도는 중앙값 13.1 μmol/L이었다.주요 평가 변수는 기저치 대비 3~6개월 동안 평균된 24시간 요 옥살산 배출량(BSA 보정)의 백분율 감소율이었다.결과적으로, OXLUMO 투여군에서는 요 옥살산 배출량이 평균 -65% 감소하였으며(95% CI: & 8211;71, & 8211;59%), 위약군에서는 & 8211;12% 감소(95% CI: & 8211;20, & 8211;4)로, 두 군 간 차이는 53%(95% CI: 45, 62), p< 0.0001로 통계적으로 유의미하였다. 이 결과는 OXLUMO가 PH1 환자에서 요 옥살산 수치를 임상적으로 의미 있게 감소시킴을 입증하였다(Figure 1). 6개월 시점까지, OXLUMO 투여군의 52%(95% 신뢰구간: 31%, 72%)가 정상 범위의 24시간 요 옥살산 배출량(BSA 보정값 기준 ≤0.514mmol/24시간/1.73m²)에 도달하였다.반면, 위약군 중 정상 범위에 도달한 비율은 0%(95% CI: 0%& 8211;25%)였으며, 그 차이는 통계적으로 유의미하였다(p=0.001). 또한, 루마시란을 투여받은 환자에서는 감소된 요 옥살산 수치가 24개월 시점까지 지속적으로 유지되었다.2. ILLUMINATE-B ILLUMINATE-B는 6세 미만의 PH1 환자 18명을 대상으로 한 단일군(single-arm) 임상시험이었다. 대상자는 12개월 이상인 경우 eGFR이 45mL/min/1.73m² 초과, 12개월 미만인 경우는 혈청 크레아티닌 수치가 정상 범위인 환자들로 구성되었다.OXLUMO의 용량은 체중에 따라 결정되었다. 첫 투여 시 환자의 중앙값 연령은 51개월(범위: 4~74개월)이었으며, 56%는 여성, 88%는 백인이었다.체중 분포는 10kg 미만 3명, 10kg 이상 20kg 미만 12명, 20kg 이상 3명이었다. 기저 상태에서의 요 옥살산:크레아티닌 비율(spot urinary oxalate:creatinine ratio)의 중앙값은 0.47 mmol/mmol이었다.주요 평가 변수는 3~6개월 동안 평균된 요 옥살산:크레아티닌 비율의 기저치 대비 백분율 감소율이었다. 그 결과, OXLUMO 투여군은 기저치 대비 평균 72%의 요 옥살산:크레아티닌 비율 감소를 나타냈으며(95% CI: 66, 78), 요 옥살산 배출 감소 효과는 12개월 시점까지 유지되었다.(Figure 2). 3. ILLUMINATE-C ILLUMINATE-C은 총 21명의 환자가 다기관 단일군 연구에 등록되어 OXLUMO 치료를 받았다. 이 연구는 원발성 고옥살산뇨증 1형(PH1) 환자 중 eGFR ≤45mL/min/1.73m²인 12개월 이상 환자, 또는 12개월 미만이면서 연령에 비해 혈청 크레아티닌 수치가 상승한 환자(혈액투석 중인 환자 포함)를 대상으로 시행되었다.환자들은 두 개의 코호트(cohort)로 나뉘었다. Cohort A는 등록 시점에서 투석이 필요하지 않은 환자 6명, Cohort B는 안정적인 혈액투석(hemodialysis) 치료를 받고 있던 환자 15명으로, 이들의 투석 일정은 임상시험 초기 6개월 동안 변경되지 않도록 유지되었다.환자들은 체중에 따라 권장된 OXLUMO 용량을 투여받았다. 복막투석 환자는 연구에서 제외되었다. 첫 투여 시 환자의 중앙값 연령은 9세(범위: 0~59세)였으며, 57%는 남성, 76%는 백인이었다.기저 상태에서의 혈장 옥살산 농도 중앙값은 Cohort A가 58μmol/L, Cohort B(투석 환자)가 투석 전 기준 104μmol/L이었다.주요 평가 변수는 Cohort A(N=5명)의 경우 기저치 대비 6개월 시점(3~6개월 평균)의 혈장 옥살산 농도 변화율, Cohort B(N=15명)의 경우 투석 전 혈장 옥살산 농도의 기저치 대비 6개월 시점(3~6개월 평균)의 변화율이었다.그 결과, Cohort A에서는 혈장 옥살산 농도가 기저치 대비 33% 감소(LS 평균, 95% CI: & 8211;82, 15)하였고, Cohort B에서는 42% 감소(95% CI: & 8211;51, & 8211;34%)하였다.구체적으로, Cohort A의 평균 혈장 옥살산 농도는 기저치 65μmol/L(95% CI: 21, 108)에서 6개월 시점 33μmol/L(95% CI: 10, 56)로 감소하였다.Cohort B의 평균 혈장 옥살산 농도는 기저치 108μmol/L(95% CI: 92, 125)에서 6개월 시점 62μmol/L(95% CI: 51, 72)로 감소하였다(Figure 3). 루마시란(Lumasiran)의 예상되는 쟁점은 무엇인가?루마시란(Lumasiran, 제품명 Oxlumo)은 원발성 고옥살산뇨증 1형(PH1)에 대한 최초의 siRNA 기반 치료제로, 임상시험에서 유의한 옥살산 감소 효과를 입증하였다. 이 약제는 RNA 간섭(RNA interference) 기술을 이용해 간세포 내 HAO1 유전자의 발현을 억제함으로써 glycolate oxidase(GO) 효소 생성을 차단하고, 결과적으로 glyoxylate 및 oxalate 생성을 줄인다.다만 루마시란은 PH1의 근본 원인인 AGXT 유전자의 기능 결손을 교정하지는 않는다. 즉, glyoxylate가 해독되지 못해 oxalate로 전환되는 병태생리에서, 루마시란은 상류 단계인 GO 발현을 억제하여 glyoxylate 생성 자체를 줄이는 간접적 치료 전략에 해당한다.루마시란은 피하 주사를 통해 주기적으로 투여해야 하며, 치료를 중단하면 GO 발현이 다시 활성화되어 glyoxylate 및 oxalate 생성이 재개된다. 이는 질환 재악화를 초래할 수 있어 지속적인 유지 치료가 필수적이다. 또한 이미 신장, 뼈, 망막 등에 침착된 옥살산, 즉 전신 옥살산증(systemic oxalosis)은 제거하거나 역전시키지 못한다. 따라서 말기 신부전이나 광범위한 옥살산 침착 환자의 경우 투석이나 간·신장 이식 등 추가 치료가 필요하다.결국 루마시란은 유전적 결함 자체를 교정하지는 않지만, PH1의 대사 경로를 효과적으로 차단하여 질환의 진행을 억제하고 옥살산 축적을 완화하는 표적 치료제이다. 이는 대사산물 생성을 억제하는 전략으로, 유전자 교정이나 단백질 기능 복원과는 구별된다.그럼에도 불구하고 루마시란은 간 이식 외에는 근본적 치료가 없던 PH1 치료 영역에 중요한 전환점을 마련하였다. 특히 조기 진단과 개입을 통해 신기능 보존과 예후 개선에 기여할 수 있으며, 향후 장기적 안전성 확보, 접근성 향상, 유전자 치료제와의 병용 또는 전환 전략이 논의될 경우 PH1 치료의 새로운 패러다임으로 자리매김할 수 있을 것으로 기대된다.참고문헌 1. Sally-Anne Hulton “Lumasiran: expanding the treatment options for patients with primary hyperoxaluria type 1” EXPERT OPINION ON ORPHAN DRUGS 2021, VOL. 9, NOS. 7& 8211;10, 189& 8211;198. 2. Xuan Gang et al. “Lumasiran for primary hyperoxaluria type 1: What we have learned?” Front. Pediatr. 10:1052625. 3. Viola D’Ambrosioet al. “Lumasiran in the Management of Patients with Primary Hyperoxaluria Type 1: From Bench to Bedside“ International Journal of Nephrology and Renovascular Disease 2022:15 197& 8211;206. 4. Sander F. Garrelfs at al. “Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1” N Engl J Med 2021;384:1216-26. 5. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-08-22 06:02:44최병철 박사 -
 "한약, 안전합니다" 한의협, 대국민 캠페인[데일리팜=강혜경 기자] "한의사가 처방한 한약은 안전합니다."대한한의사협회(회장 윤성찬)가 한의의료기관에서 처방된 한약은 안전하다는 내용의 포스터 4종을 제작, 전국 한의원과 한방병원에 배포했다. 30일 한의협이 제작·배포한 포스터는 '한의사가 처방한 한약은 안전합니다'라는 주제로 '내 몸에 맞춘 처방 한약', '한의학은 간 건강을 지키는 의학입니다' 등의 문구와 함께 2011년부터 2019년까지 67만2411명의 대규모 환자를 대상으로 실시된 한약과 간독성 연구 결과가 담겨 있다.학술논문 내용도 소개됐는데, 올해 1월 국제 학술논문지인 'Frontiers in Pharmacology'에 따르면 한의의료기관에 내원했거나 한약 처방을 받은 후 90일 이내에 약물 유발 간손상 발생 위험이 증가하지 않았으며 외래 환자군에서는 위험도가 1.01(95% 신뢰구간:1.00~1.01)로 거의 변동이 없는 것으로 확인됨으로써 한약은 간에 안전하다는 사실이 재차 입증됐다는 설명이다.한의협은 "한약에 대한 잘못된 상식과 불필요한 오해를 불식시키고 한의사가 처방하는 한약에 대한 대국민 신뢰도를 한층 더 높인다는 차원에서 포스터를 제작해 배포하게 됐다"며 "이번 포스터 배포를 계기로 환자를 혼란에 빠뜨리는 한약에 대한 악의적 폄훼가 완전히 근절되기를 기대한다"고 말했다.2025-06-30 13:46:03강혜경
"한약, 안전합니다" 한의협, 대국민 캠페인[데일리팜=강혜경 기자] "한의사가 처방한 한약은 안전합니다."대한한의사협회(회장 윤성찬)가 한의의료기관에서 처방된 한약은 안전하다는 내용의 포스터 4종을 제작, 전국 한의원과 한방병원에 배포했다. 30일 한의협이 제작·배포한 포스터는 '한의사가 처방한 한약은 안전합니다'라는 주제로 '내 몸에 맞춘 처방 한약', '한의학은 간 건강을 지키는 의학입니다' 등의 문구와 함께 2011년부터 2019년까지 67만2411명의 대규모 환자를 대상으로 실시된 한약과 간독성 연구 결과가 담겨 있다.학술논문 내용도 소개됐는데, 올해 1월 국제 학술논문지인 'Frontiers in Pharmacology'에 따르면 한의의료기관에 내원했거나 한약 처방을 받은 후 90일 이내에 약물 유발 간손상 발생 위험이 증가하지 않았으며 외래 환자군에서는 위험도가 1.01(95% 신뢰구간:1.00~1.01)로 거의 변동이 없는 것으로 확인됨으로써 한약은 간에 안전하다는 사실이 재차 입증됐다는 설명이다.한의협은 "한약에 대한 잘못된 상식과 불필요한 오해를 불식시키고 한의사가 처방하는 한약에 대한 대국민 신뢰도를 한층 더 높인다는 차원에서 포스터를 제작해 배포하게 됐다"며 "이번 포스터 배포를 계기로 환자를 혼란에 빠뜨리는 한약에 대한 악의적 폄훼가 완전히 근절되기를 기대한다"고 말했다.2025-06-30 13:46:03강혜경 -
 PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대6편: 최초의 흡입형 PDE3/PDE4 이중 억제 COPD 치료제, 오투베어(Esifentrine)오투베어(Ohtuvayre& 9415;, OH-too-vare 성분명 엔시펜트린 흡입 현탁액, Esifentrine& 9415;, Verona Pharma)는 최초의 흡입용 PDE3/PDE4 효소 선택적 이중 억제제로서, 2024년 6월 미국 FDA에서 '성인 만성폐쇄성폐질환(chronic obstructive pulmonary disease, COPD) 환자의 유지요법제'에 승인되었으며, 유럽에서는 아직 승인되지 않았다. 현재 이 약제와 유사한 PDE4 억제제인 '닥사스(roflumilast)'는 '중증 COPD 환자의 급성 악화 빈도를 감소'에 승인된 약제로 미국 FDA 및 국내에서 소개되어 있다.이 약제는 기도와 폐 실질의 염증세포에서 cAMP 분해 효소인 PDE3 및 PDE4 효소를 선택적으로 억제함으로써, 기관지확장과 비스테로이드성 항염증 효과를 하나로 결합하여 높은 흡기 유속이나 복잡한 손-호흡 조정 없이 표준 제트 네블라이저를 통해 폐에 약물을 직접 전달되도록 설계되었다.이 cAMP 경로는 COPD의 병태 생리를 조절하는 내재적 항염증 기전으로 중요하게 작용하며, 이를 조절하는 약물학적 접근은 기존의 기관지 확장제나 흡입 스테로이드 기반 치료를 보완할 수 있는 새로운 치료 전략으로 자리매김하고 있다.오투베어의 미국 FDA 승인은 미국호흡기중환자 의학저널(American Journal of Respiratory and Critical Care Medicine)에 게재된 임상 3상 시험 ENHANCE의 결과를 포함한 광범위한 데이터를 기반으로 이뤄졌다.ENHANCE 임상시험에서 오투바이어는 단독요법으로 투여하거나 다른 유지요법과 함께 사용했을 때 폐 기능 개선을 포함한 임상적 이점을 제공한 것으로 입증되었다. 이는 중등도에서 중증의 COPD를 가지고 있는 광범위한 그룹에서 내약성이 우수하였다.오투바이어는 COPD 외에도 비-낭성섬유증 기관지확장증, 낭성섬유증, 천식, 기타 호흡기질환에 대한 치료제로 평가되고 있다. 또한 오투바이어와 지속성 항콜린제(LAMA)인 glycopyrrolate의 고정용량 복합제를 COPD 유지요법으로 개발 중이다.만성폐쇄성폐질환(Chronic obstructive pulmonary disease, COPD)은 어떤 질환인가? COPD는 기류 제한이 지속적으로 나타나는 진행성 호흡기 질환으로, 기도 및 폐 실질의 만성 염증과 그에 따른 폐기능 저하가 주요 병리학적 특징이다. 임상적으로는 호흡곤란, 만성 기침, 객담 등 다양한 증상이 발현되며, 반복적인 급성 악화는 삶의 질 저하뿐 아니라 사망률 증가와도 밀접하게 연관되어 있다. 전 세계적으로 COPD는 주요 사망 원인 중 하나로 보고되고 있으며, 고령화와 흡연율 증가에 따라 그 유병률은 지속적으로 상승하고 있다.COPD의 병태생리에는 대식세포(macrophages), 호중구(neutrophils), CD8+ T 림프구(cytotoxic T cells) 등 선천 및 후천 면역세포의 활성화가 중심적인 역할을 하며, 이들 면역세포는 다수의 염증 촉진성 사이토카인(IL-8, TNF-α 등), 프로테아제(matrix metalloproteinases), 그리고 활성산소종(reactive oxygen species)을 과도하게 분비한다. 이러한 염증 반응은 기도 리모델링, 점액 과분비, 폐포 구조의 파괴 및 폐 실질의 손상 등 병리적 변화를 유도하여 기류 제한을 지속시키는 주요 기전으로 작용한다.이러한 만성 염증 반응을 조절하기 위한 내재적 조절 기전 중 하나로 주목받는 것이 cyclic adenosine monophosphate(cAMP) 신호 전달 경로이다. cAMP는 adenylyl cyclase에 의해 생성되는 대표적인 이차 전령(second messenger)으로, 세포 내에서 protein kinase A(PKA) 및 Epac(Exchange Protein directly Activated by cAMP) 등의 하위 효과기를 통해 다양한 생리학적 반응을 매개한다.구체적으로, cAMP는 염증성 유전자 발현 억제, 항산화 반응 촉진, 섬모 운동 촉진, 점액 분비 감소 및 기관지 평활근의 이완 등을 유도함으로써 COPD 병태생리의 여러 측면을 동시에 조절할 수 있는 기능을 한다.그러나 COPD 환자에서는 염증세포 내에서 phosphodiesterase-4(PDE4)의 과발현으로 인해 cAMP가 병태적으로 분해되고, 그 농도가 비정상적으로 낮아지는 현상이 관찰된다. 이러한 기전은 항염 및 기관지 보호 효과를 저해하며, 결과적으로 만성 염증을 악화시키는 데 기여한다.Cyclic nucleotides(고리형 뉴클레오타이드)란 무엇인가? Cyclic nucleotides는 세포 내 신호전달 경로에서 이차 전령으로 작용하는 분자군으로, 다양한 생리학적 자극에 대한 세포 반응을 매개하는 데 중심적인 역할을 수행한다. 이들은 주로 ATP(adenosine triphosphate) 또는 GTP(guanosine triphosphate)로부터 유도되어 생성되며, 대표적인 형태로 cAMP(cyclic adenosine monophosphate)와 cGMP(cyclic guanosine monophosphate)가 있다.cAMP는 adenylyl cyclase(AC)의 촉매 작용에 의해 ATP로부터 생성되며, 이는 G 단백질 연결 수용체(G protein-coupled receptor, GPCR)의 활성화에 의해 유도된다. 이는반면, cGMP는 guanylyl cyclase(GC)에 의해 GTP로부터 유도되며, 이는 나트륨이뇨펩타이드(natriuretic peptides) 또는 산화질소(nitric oxide, NO)와 같은 세포외 신호에 의해 활성화된다. 이 두 경로는 상이한 생리적 자극과 수용체를 통해 선택적으로 작용하면서 세포 특이적 반응을 조절한다(Figure 1). 생성된 cAMP는 주로 PKA와 EPAC(exchange protein directly activated by cAMP, cAMP에 의해 직접 활성화되는 교환 단백질)을 통해 세포 기능을 조절한다. PKA는 대사 조절, 세포 분화, 증식, 생존 등 광범위한 생물학적 과정에 관여하며, EPAC은 integrin 매개 세포 부착, 세포 간 접합 형성, 분비(exocytosis), 인슐린 분비 등 PKA-비의존성 경로를 통해 다양한 세포 기능을 조절한다.특히, 세포 내 cAMP 농도가 상승하면 cAMP-의존성 PKA가 활성화된다. PKA는 두 개의 촉매 서브유닛(C)과 두 개의 조절 서브유닛(R)으로 이루어진 이종사량체(heterotetramer)로 구성되며, 평상시에는 비활성 상태로 존재한다. 그러다 cAMP가 R 서브유닛에 결합하면 촉매 서브유닛이 유리되어 다양한 표적 단백질을 인산화한다. 이 중 대표적인 인산화 표적은 CREB(cAMP response element binding protein)으로, 이는 대사 조절 및 세포 증식에 관여하는 유전자 발현을 조절하는 전사 인자이다.반면, 생성된 cGMP는 주로 PKG를 활성화시키며, 이는 세포 내 여러 표적 단백질을 인산화하여 평활근 수축 조절, 세포자멸사, 염증 반응, 시각 신호전달, 혈소판 응집 등 생리적 반응을 유도한다.이러한 cyclic nucleotide의 생물학적 활성을 종료시키는 주요 기전은 phosphodiesterase (PDE)에 의해 수행된다. PDE는 cAMP 및 cGMP를 각각 5’-AMP 또는 5’-GMP의 비고리형 형태로 분해함으로써 이차 전령 신호를 효과적으로 불활성화시킨다.cAMP 신호전달 경로는 어떤 역할을 하는가? cAMP는 1958년 Sutherland와 Rall에 의해 처음 발견된 이후, cAMP는 호르몬, 신경전달물질, 면역조절 인자 등 외부 자극에 의해 활성화되는 AC(adenyl cyclase)에 의해 ATP로부터 생성되는 고리형 뉴클레오타이드로 정의되었다.세포는 외부 환경으로부터의 자극에 신속하고 정밀하게 반응하기 위해 다양한 신호전달 시스템을 갖추고 있으며, 이에는 cAMP를 생성하는 AC가 존재한다. AC는 세포막에 존재하는 효소로, ATP를 cAMP로 전환하는 반응을 촉매하며, 이 과정은 GPCR의 활성화에 의해 주로 조절된다.GPCR은 세포막을 7회 통과하는 구조의 수용체로, 외부의 호르몬, 신경전달물질, 생리활성 분자 등의 리간드를 인식하여 이질삼합체 G 단백질(heterotrimeric G protein)을 활성화시킨다. 이때 GPCR은 Gs 단백과 결합하여 AC를 활성화하고, 이를 통해 세포 내 cAMP 생성을 유도한다. 반면 Gi 단백을 통해서는 AC 활성을 억제하여 cAMP 생성을 저해한다. 기도 조직에서 cAMP 농도의 증가는 평활근 이완과 염증 반응 억제를 유도하여, 천식을 포함한 폐쇄성 기도 질환의 병태생리 조절에 기여하는 것으로 알려져 있다.아울러, PKA는 세포 내 Ca²& 8314; 농도의 감소, Ca²& 8314;에 대한 민감도 저하, MLC 비의존 경로 조절 등 다양한 기전을 통해 기관지 확장 효과를 나타낸다. 또한, cAMP는 섬모 운동(ciliary motility)을 촉진하여 점액섬모 청소(mucociliary clearance)를 향상시키며, 이는 기도 내 분비물 제거와 염증 완화에 기여한다.이러한 이중 조절 메커니즘은 세포가 자극의 종류와 강도에 따라 cAMP 농도를 정밀하게 조절할 수 있게 하며, 하위 효과기인 PKA, EPAC 등을 통해 궁극적인 생리학적 반응으로 이어진다.cAMP 신호전달 경로의 특이성 및 세포 내 농도는 PDE에 의해 조절되며, PDE는 cAMP를 5’-AMP로 분해하여 신호를 종료시킨다. 특히 PDE4, PDE7, PDE8은 cAMP를 선택적으로 분해하는 isoform으로, 면역세포와 염증세포에 풍부하게 발현되어 있어 염증성 질환에서 중요한 조절 인자로 작용한다. 이에 따라 PDE4 억제제인 닥사스(roflumilast)는 cAMP 농도를 증가시켜 항염증 작용을 유도한다.따라서, cAMP 신호전달 경로는 외부 자극에 대한 세포의 신속하고 정밀한 반응을 유도하는 고차원적인 조절 기전이며, 그 구성 요소와 하위 경로를 표적으로 한 약리학적 개입은 염증성, 대사성, 심혈관성 질환을 포함한 다양한 병태에서 치료적 가능성을 제시한다.최근 연구들은 cAMP 의존성 신호전달 경로의 복잡성과 생물학적 중요성을 더욱 강조하고 있으며, 특히 기도 평활근(airway smooth muscle, ASM) 세포에서 β₂-아드레날린 수용체(β₂-adrenergic receptor, β₂AR)와 같은 GPCR의 활성이 이러한 경로를 중심으로 작동함이 밝혀졌다.Phosphodiesterase(PDE)는 무엇인가? PDE는 세포 내에서 cyclic nucleotide(cAMP 및 cGMP)의 3’,5’-고리형 인산 결합을 가수분해하여 각각 AMP(adenosine monophosphate) 또는 GTP(guanosine momophosphate)로 전환함으로써 이차 전령의 신호를 종료시키는 역할을 수행한다. PDE는 신호 전달의 시간적 지속성과 공간적 국소화, 그리고 신호의 강도 조절에 주요 생화학적 조절자(gatekeeper)로 기능하며, 이에 따라 다양한 생리 및 병리 현상의 미세 조절자로 작용한다.현재까지 확인된 PDE는 총 11개 계열(PDE1& 8211;PDE11)로 구성되며, 이들은 아미노산 서열, 기질 특이성, 약물 감수성, 조절 메커니즘 등의 차이에 따라 구분된다. 각 아형(family)은 서로 다른 조직 특이성 및 세포 내 소분획(localization)을 보이며, 동일한 기질(cAMP 또는 cGMP)에 작용하더라도 그 기능적 결과는 상이할 수 있다. 예를 들어, PDE4, PDE7, PDE8은 cAMP 특이적, PDE5, PDE6, PDE9는 cGMP 특이적, PDE1, PDE2, PDE3, PDE10, PDE11은 양쪽 기질 모두에 작용할 수 있다(Table 1). PDE의 활성 이상은 만성 염증성 질환, 심혈관 질환, 신경정신질환, 악성종양 등 다양한 질환의 병태생리와 밀접한 관련이 있으며, 특히 PDE3와 PDE4는 COPD와 같은 염증성 폐질환에서 병태생리학적 역할을 한다 .PDE3는 상대적으로 높은 cAMP 친화도를 가지며, PDE3A와 PDE3B의 두 아형으로 구분된다. PDE3A는 폐 상피세포, 혈관 내피세포, 기도 평활근세포(airway smooth muscle, ASM), 염증세포 등에서 발현되며, 특히 혈관 평활근세포에서 주요하게 존재하며 평활근 긴장도 조절에 관여한다. 반면, PDE3B는 지방세포, 간세포, 정자세포 등 대사 활성이 높은 조직뿐만 아니라 T세포 및 대식세포에서도 발현되어, 염증 반응 조절 및 대사 경로에 영향을 미친다.PDE4는 네 가지 유전자(PDE4A& 8211;D)와 다양한 스플라이싱 변이체로 구성되며, 호흡기계 조직을 포함한 다양한 기관에 광범위하게 분포한다. 특히 PDE4D는 인간 기도 평활근세포에서 cAMP 분해를 조절하는 주요 효소로 작용하며, PDE4 전체는 백혈구, 대식세포, 호중구 등 염증세포뿐 아니라 기도 상피세포 및 폐 신경계에도 발현되어 염증 반응의 조절자로 기능한다.임상 및 전임상 연구에 따르면, COPD 환자, 특히 흡연자에서 PDE4 발현이 유의하게 증가되어 있음이 보고되었으며, PDE4 억제를 통해 cAMP 농도를 증가시키는 것은 염증 촉진성 사이토카인의 발현 감소, 염증세포의 조직 내 침윤 억제 등 광범위한 항염증 효과를 유도하는 것으로 나타났다. 이러한 기전을 기반으로 PDE4 억제제 닥사스(roflumilast)는 ‘기관지확장제의 부가요법제로서, 증상악화 병력이 있고, 만성기관지염을 수반한 중증의 만성폐쇄성폐질환의 유지요법제’로 승인되어 있다.COPD에는 어떤 약제들을 사용하는가? COPD에 대한 약물 치료의 목적은 증상의 완화, 급성 악화의 예방, 신체활동 능력 향상 및 장기적인 예후 개선에 있다. 이에는 주로 흡입제에 기반하며, 기관지 확장제가 치료의 핵심이다.기관지확장제는 호흡기 질환에서 폐쇄된 기도를 확장시켜 기류를 개선하는 약제로, 천식과 COPD와 같은 기도 폐쇄성 질환에 사용된다. 이러한 약제는 기관지 평활근(bronchial smooth muscle)의 이완을 유도하여 기도 저항을 감소시키며, 환자의 증상을 완화하고 폐기능을 향상시키는 데 기여한다.기관지확장제는 작용 기전에 따라 크게 β2-아드레날린 수용체 작용제(β2-agonists), 항콜린제(Anticholinergics) 또는 무스카린 수용체 길항제(Muscarinic antagonists), 메틸잔틴계(Methylxanthines)가 있다.아울러 약물의 효과 및 부작용 등을 고려하여 흡입제를 주로 사용하며, 흡입기 종류는 크게 건조분말흡입기(dry power inhaler, DPI), 정량흡입기(metered dose inhaler, MDI)로 나뉘고, 다시 MDI는 가압 정량흡입기(pressurized metered dose inhaler, pMDI)와 연무형 흡입기(soft mist inhaler, SMI)로 나뉜다.pMDI는 다시 호흡 작동식 흡입기(breath-operated inhaler, BOI or breath-actuated inhale, BAI)와 비호흡 작동식 호흡기(Non-BOI)로 나뉘는데 호흡 작동식 흡입기는 아직 국내에 없다. 또한 분무기(nebulizer, 네불라이저)도 흡입제 치료에 속한다. 1) 베타-2 작용제(β2-agonists) β2-작용제는 기관지 평활근 세포에 발현된 β2-아드레날린 수용체에 선택적으로 결합하여 Gs 단백질을 통한 adenylyl cyclase 활성화, 이어지는 cAMP 농도 증가 및 PKA 활성화를 유도함으로써, 평활근 세포 내 칼슘 농도를 낮추고 근수축 관련 단백질들의 기능을 억제하여 기관지 확장을 유발한다. 또한 섬모운동 촉진 및 혈관 투과성 감소 등의 부수적 효과를 통해 기도 청소 기능 개선에도 기여할 수 있다.임상적으로 β2-작용제는 작용 시간에 따라 단시간 작용제(short-acting β2-agonists, SABA)와 장시간 작용제(long-acting β2-agonists, LABA)로 구분된다.SABA는 증상 완화를 위한 구제 치료(reliever therapy)로 사용되며, 대표적으로 살부타몰(Salbutamol)과 테르부탈린(Terbutaline)이 있다. SABA의 사용은 FEV1의 호전과 증상을 개선시킬 수 있다. SABA는 4-6시간 지속되고, LABA는 12시간 이상 지속되며, 규칙적인 LABA 사용을 하는 환자에서도 필요시 SABA 사용은 증상 완화에 도움이 될 수 있다.반면, LABA는 하루 12시간 이상 지속되는 작용시간을 가지며 천식의 유지 치료(controller therapy) 혹은 COPD의 증상 조절을 위한 병용 요법에 사용되며, 대표적으로 살메테롤(Salmeterol)과 포르모테롤(Formoterol)이 있다. 이들 약제는 폐기능과 삶의 질을 개선시키고 호흡곤란과 급성 악화와 입원의 빈도를 감소시키지만, 사망률이나 폐기능 감소 속도에는 영향을 주지 못한다.이 외에도 24시간 작용 지속 시간을 가진 초장시간 작용제(ultra-LABA)인 인다카테롤(Indacaterol), 올로다테롤(Olodaterol) 등이 COPD 치료에 활용되고 있다. 이들 약제는 호흡곤란과 악화위험을 감소시키고 삶의 질을 개선시킨다.이러한 β2-작용제는 그 효과의 빠른 발현과 우수한 증상 완화 효과로 인해 널리 사용되고 있으나, 단독 사용 시 특히 천식 환자에서 기도 염증을 충분히 조절하지 못하며 오히려 기전적 내성(tachyphylaxis)이나 염증 악화의 위험을 높일 수 있다는 우려도 제기되어 왔다. 이에 따라 ICS(흡입 스테로이드)와의 병용이 원칙이며, 한 기기 내 고정용량 복합제(FDC) 형태로 투여하는 방법이 표준화되고 있다.2) 항콜린제((Anticholinergics) 항콜린제는 기관지 평활근, 점액선, 혈관 등에 존재하는 무스카린 수용체(muscarinic receptor) 중 특히 M3 수용체에 선택적으로 작용하여, 아세틸콜린이 이 수용체에 결합하는 것을 차단함으로써 평활근 수축 및 점액 분비를 억제한다. 이로 인해 기도 저항이 감소하고 호흡 증상이 완화되며, COPD 환자의 폐기능 개선과 급성 악화 빈도 감소에 기여한다.항콜린제는 작용 지속 시간에 따라 단시간 작용 항무스카린제(short-acting muscarinic antagonists, SAMA)와 장시간 작용 항무스카린제(long-acting muscarinic antagonists, LAMA)로 분류된다.SAMA는 주로 단기 증상 완화에 사용되며, 대표적으로이프라트로피움(Ipratropium)와 옥시트로피움(Oxitropium)이 있다. 이들 약제는 M3 비선택적 억제로, 억제성 신경 수용체인 M2를 차단함으로써 잠재적으로 미주신경을 통해 기관지 수축을 유발시킬 수 있다.LAMA는 하루 1회 또는 2회 흡입으로 지속적인 기도 확장을 유지할 수 있어 COPD 유지 치료의 핵심 약제로 사용된다. 대표적으로 티오트로피움(Tiotropium), 글리코피로니움(Glycopyrronium), 우메클리디늄(Umeclidinium) 등이 있다. 이들 약제는 M3 선택적 억제로, M3 무스카린성 수용체에 대한 장시간의 결합 및 M2 무스카린성 수용체와의 빠른 해리를 통해 기관지 확장제의 효과 지속 시간을 연장시킨다.항콜린제는 β2-작용제와 병용할 경우 상호 보완적인 기전으로 기관지 확장 효과가 증대되며, 특히 COPD 환자에서는 LAMA + LABA 병용요법이 임상적으로 우월한 효과를 보인다.항콜린제는 흡입 제형으로 투여 시 전신 흡수가 거의 없어 안전성이 높고, 주요 부작용은 구강건조, 쓴맛, 드물게 요폐 등의 국소적 반응에 국한된다. 이로 인해 장기적인 유지 요법에 적합한 약제로 간주된다.3) 흡입스테로이드제(Inhaled corticosteroid, ICS) ICS는 합성된 글루코코르티코이드 계열 약제로, 폐로 직접 흡입되어 작용함으로써 전신 노출을 최소화하면서 강력한 항염 작용을 발휘한다. 세포 내 글루코코르티코이드 수용체(glucocorticoid receptor, GR)와 결합한 후 전사조절인자(transcriptional regulator)로 기능하여, 염증 유전자 발현을 억제하고 항염증 단백질 생성을 유도한다.특히 NF-κB, AP-1 등 주요 염증 촉진성 전사인자의 활성을 차단함으로써 IL-4, IL-5, IL-13 등 Th2 관련 사이토카인의 생성을 억제하며, 호산구(eosinophil) 및 비만세포(mast cell)의 기도 내 침윤과 활성을 감소시킨다.이러한 작용기전은 기관지 평활근의 수축성을 저하시켜 기도 과민 반응을 감소시키고, 상피세포의 장벽 기능 회복과 점액선의 과활성 억제를 통해 전반적인 기도 염증 조절에 기여한다.ICS는 흡입제 형태로 국소적으로 투여되어 전신 부작용을 최소화하면서 장기간 안전하게 사용 가능하다는 점에서 ICS는 천식 치료에 있어 핵심적인 치료제로 간주된다. 이는 단독 사용뿐 아니라 LABA 또는 LAMA와의 병용 요법이 표준화되었다.4) Phosphodiesterase-4(PDE4) 억제제 PDE4 억제제는 cAMP의 대사를 억제하여 세포내 cAMP 농도를 높이는데 이는 항 염증 효과를 나타내고 또한 호중구의 이동과 화학 주성을 억제하는 효과도 있다. 로플밀라스트(Roflumilast)는 선택적인 PDE4 억제제 중의 하나로 가래 호중구와 호산구를 감소키는 항염증 작용이 확인되어 PDE4억제제 중 COPD 치료제로 허가 받은 유일한 약제이다. 하루 한번 복용하는 경구용 약제로 기관지 확장제가 아니지만 FEV1과 삶의 질 향상효과가 있다.따라서, 단기간 작용시간을 가지는 SABA와 SAMA는 주로 증상이 갑자기 악화될 때 사용되며, LABA와 LAMA는 유지 치료의 중심으로 사용된다.5) 병용요법 이러한 약제들은 단독 혹은 병합 요법으로 사용되며, 특히 증상이 지속되거나 급성 악화가 반복되는 환자에서는 2제 요법(LABA + LAMA) 또는 ICS를 포함한 3제 요법(ICS + LABA + LAMA)이 권고된다.6) PDE4 억제제 PDE4 억제제는 흡입 치료 외에도 일부 환자에서는 경구용 약제가 보조적으로 사용된다. PDE4 억제제인 로플루밀라스트(roflumilast)는 만성 기관지염 양상을 보이며 급성 악화가 잦은 중증 환자에게 효과적이다. 또한 급성 악화 시에는 경구 스테로이드 및 항생제가 단기간 사용되며, 병원성 감염의 가능성을 고려해 적절히 투여된다.기관지 확장제는 어떤 약제인가? 기도 저항(Airway resistance)의 감소는 기도 자체의 내재적(intrinsic) 요인과 외재적(extrinsic) 요인 모두에 의해 조절되며, 그 주요 기전으로는 평활근 이완, 기관 및 세기관지 벽의 염증 감소, 기도 분비물의 감소 등이 있다.이 중 기도 평활근의 이완은 기관지 확장을 유도하기 위한 핵심 기전으로, 이는 두 가지 주요 약리학적 접근법을 통해 달성될 수 있다. β2-아드레날린 수용체(β2-AR)를 자극하는 β2-작용제(β2-agonist)의 직접적인 작용과 무스카린 수용체를 차단하여 아세틸콜린 신호 전달을 억제하는 항콜린제(antimuscarinic)의 간접적인 작용이다(Figure 2). 먼저, β2-작용제는 기도 평활근 세포, 특히 소기도(small airway)에 존재하는 β2-AR에 직접 결합함으로써 작용한다. 이 결합은 평활근 세포 내에서 AC(adenyl cyclase)를 활성화시켜 ATP로부터 cAMP가 생성시킨다.생성된 cAMP는 두 가지 주요 하위 효과기를 활성화시킨다. 이때 PKA는 평활근 긴장을 조절하는 단백질들을 인산화하여 이완을 유도하고, Epac는 PKA와는 독립적으로 평활근 이완을 유도한다. 또한, cAMP는 세포 내 칼슘을 격리(sequestration)함으로써 추가적으로 수축을 억제하고 평활근 이완을 촉진한다.다음, 항콜린제는 수축 작용을 하는 아세틸콜린(ACh)의 수용체 결합을 경쟁적으로 차단함으로써 간접적으로 평활근 이완을 유도한다. 기도 내 부교감신경 활성은 주로 M1 및 M3 무스카린 수용체를 통해 매개되며, 이들 수용체는 평활근 수축, 점액 분비, 섬모운동 증가를 유도한다. 반면, M2 수용체는 시냅스 전 말단에서 ACh의 방출을 억제하여 음성 되먹임 조절을 수행한다.COPD에서는 특히 콜린성 기도 긴장(cholinergic bronchomotor tone)이 병태생리에 중요한 역할을 하며, 기도 수축 및 점액 과다분비를 통해 기도 폐쇄를 악화시킨다. β2-작용제는 모든 기도 수준, 특히 COPD에 관여하는 소기도의 평활근 세포 표면의 β2-AR에 결합하여 작용한다. 반면, 무스카린 수용체 길항제는 기도 평활근의 M3 수용체를 차단함으로써 수축을 방지한다.비록 소기도에는 미주신경의 직접적인 분포가 부족하지만, COPD와 같은 질환에서는 비신경원성(non-neuronal) 아세틸콜린에 의해 무스카린 수용체가 활성화되는 것으로 알려져 있다. 따라서 항콜린제(무스카린 수용체 길항제)는 대기도와 소기도 모두에서 확장 효과를 나타낼 수 있다.따라서, β2-작용제와 항콜린제와의 복합요법(combination therapy)은 단독요법보다 기도 전 구간에 걸쳐 더 강력한 기관지 확장 효과를 제공할 수 있으며, 각 약물에 대한 환자 간(inter-patient) 및 환자 내(intra-patient) 반응의 이질성을 극복하는 데도 도움을 줄 수 있다. 나아가, 두 기전이 결합된 병용요법은 단순한 약물 투여 방식과 함께 신체활동 내성 증가, 일상 활동 수행 능력 향상, 삶의 질 개선에도 긍정적인 영향을 미친다.PDE 억제제에는 어떤 약제들이 있는가? PDE 억제제는 세포 내 cAMP 및 cGMP의 분해를 억제함으로써 해당 이차 전령의 농도를 증가시키고, 다양한 하위 신호경로인 PKA, PKG, EPAC, 이온 채널 등을 활성화시켜 생리적 반응을 조절한다.이러한 작용은 단일 경로에 국한되지 않고 염증, 혈류역학, 대사, 면역 및 신경전달 등 다양한 체계에 걸쳐 조절 효과를 나타내며, 이에 따라 PDE 억제제는 다기능성 치료 플랫폼으로 진화하고 있다.COPD에서는 PDE 억제를 통해 기도 평활근 이완 및 항염증 효과를 유도하는 치료 전략이 오래전부터 탐색되어 왔다.대표적으로 methylxanthine 계의 테오필린(Theophylline)은 비선택적 PDE 억제제(non-selective phosphodiesterase inhibitor) 로 기관지 확장 작용 외에 횡격막 근력 강화, 기관지 섬모운동 개선과 심박출량을 증가시키는 효과가 있다. 이러한 작용으로 인해 천식 및 COPD 치료에 오랫동안 사용되었으나, 치료역이 좁고 심혈관계 및 중추신경계 부작용이 자주 동반되어 임상 활용에 제한이 있다. 따라서 기관지확장 효과가 약해 흡입 기관지확장제 약물을 사용할 수 없는 상황에서만 제한적으로 사용한다.이에 따라 초기에 개발된 PDE4 선택적 억제제인 롤리프람(Rolipram)은 T 세포 및 대식세포에서의 cAMP 증가를 통해 염증성 사이토카인 분비를 억제하는 기전을 보였으나, 심각한 위장관계 부작용으로 인해 임상 개발이 중단되었다.이후 개발된 로플루밀라스트(Roflumilast)는 위장관계 부작용을 줄인 개선된 PDE4 억제제로, 2010년 미국 FDA에서 “기관지확장제 병용요법으로서, 급성 악화 병력이 있고 만성 기관지염을 수반한 중증 COPD 환자의 유지 치료” 적응증으로 승인되었으며, 유럽 EMA와 국내에도 승인을 받았다.전임상 연구에 따르면, 로플루밀라스트는 기관지 상피세포에서 글루코코르티코이드 수용체 α(GRα)의 전사활성을 증가시키고, 이는 덱사메타손(dexamethasone)의 항염 효과를 GRα 의존적으로 증강시키는 것으로 나타났다. 그러나 여전히 위장 불편감, 체중 감소 등의 부작용이 빈번히 보고되어, 국제 GOLD 가이드라인에서는 LABA, LAMA, ICS를 병용함에도 악화를 반복하는 환자에 한해 3차 치료제(third-line agent)로 제한적 사용을 권고하고 있다.한편, PDE3 역시 평활근세포에서 발현되어 기관지 수축성 조절에 관여하는데, PDE3 억제는 기관지 이완 효과를 유도한다.이에 따라 PDE3 및 PDE4를 동시에 억제함으로써 기관지 확장과 항염 작용을 동시에 달성하려는 전략이 제시되었다. 실제로 전임상 연구에서는 이중 억제제가 단일 억제제보다 더 우수하거나, 상가적 효과를 유도함을 입증한 바 있다.이러한 기전을 기반으로 최근 개발된 엔시펜트린(Ensifentrine)은 PDE3와 PDE4를 모두 억제하는 이중 작용 흡입제로, 기도 평활근 이완과 염증 반응 억제를 병행하는 새로운 기전의 약제가 개발되었다.엔시펜트린(Ensifentrine)는 어떤 약제인가? 엔시펜트린(Ensifentrine, 제품명 : 오투바이어 흡입 현탁액, Ohtuvayre& 9415;)은 PDE3/PDE4 이중 억제제로, 2024년 6월에 미국 FDA로부터 COPD 유지 치료제로 승인되었다. 이는 기관지 수축 및 염증 반응을 동시에 표적으로 삼는 새로운 치료 옵션으로, 기존의 PDE 억제제보다 내약성 및 효능 면에서 개선된 특성을 나타낸다.엔시펜트린의 기본 구조(parent molecule)는 trequinsin으로, 이는 다른 PDE 억제제들에 비해 기도 평활근에서 지속적인 기관지 확장 효과를 나타내며, 중간 수준의 PDE3 억제력과 약한 PDE4 억제력을 가진다.엔시펜트린은 흡입 현탁액(inhalation suspension) 제제로 Jet nebulizer를 ㅛㅏ용하는 기관지 확장제 및 항염증제이다. Jet nebulizer는 호흡기 약물 전달을 위한 대표적인 흡입 장치로, 압축 공기를 이용한 벤츄리(Venturi) 효과를 기반으로 액상 약물을 미세한 에어로졸 입자로 변환시키는 기전으로 작동한다. 이 장치는 폐 말단부위까지 약물을 직접 도달시키는 능력으로 인해 특히 COPD이나 급성 호흡곤란 환자에게 유용하며, 고령 환자, 소아, 또는 기도 협착 환자와 같이 흡입 조절이 어려운 대상군에게 효과적인 약물 전달 수단이라고 할 수 있다.엔시펜트린의 기관지 확장과 항염증 효과는 알레르기성 기관지 수축이 유도된 기니피그 모델 연구에서 기관지 폐포 세척액 및 비강 내 염증세포 침윤을 유의하게 감소시키는 효과가 확인되었다. 또한 항원 유도로 인한 호산구 이동은 흡입형 엔시펜트린 전처리 시 80% 이상 억제되었다.또한, 시험관 내 연구(in vitro)에서 낭성섬유증 전도 조절 단백(CFTR)을 자극하는 효과가 확인되었으며, 이는 기도의 점액섬모 청소 기능(mucociliary clearance)을 개선할 가능성을 보여주었다.엔시트린 허가사항 중 WARNINGS AND PRECAUTIONS에서 다음과 같이 안내하고 있다. 엔시펜트린 투여를 시작하기 전에, 의료진은 우울증 및/또는 자살 생각 또는 행동의 병력이 있는 환자에게서 엔시펜트린 치료의 이점과 위험을 신중히 평가해야 한다. 환자, 보호자 및 가족에게는 불면, 불안, 우울감, 자살 충동 또는 기타 기분 변화의 발생 또는 악화 여부를 주의 깊게 관찰할 필요성이 있음을 안내하고, 이러한 변화가 나타날 경우 즉시 의료진에게 연락할 것을 권고해야 한다. 이와 같은 사건이 발생한 경우, 의료진은 엔시펜트린 치료의 지속 여부에 대해 신중히 재평가해야 한다.엔시펜트린 치료는 정신과적 이상반응 증가와 관련이 있다. 임상시험에서 엔시펜트린를 투여받은 환자 중 자살 관련 이상반응이 보고되었으며, 그 중 자살 시도 1건 및 자살 사례 1건이 포함되었다. 또한, 통합된 24주 안전성 평가 인구집단에서 가장 흔하게 보고된 정신과적 이상반응은 다음과 같다:불면증은 엔시펜트린 3mg 투여군 6명(0.6%), 위약군 2명(0.3%)이었고, 불안은 엔시펜트린 3mg 투여군 2명(0.2%), 위약군 1명(0.2%)이었다. 우울 관련 반응(우울증, 주요우울증, 우울 기분을 동반한 적응장애 포함)은 엔시펜트린를 투여받은 환자 4명(0.4%)에서 발생하였으며, 위약 투여군에서는 보고되지 않았다.엔시펜트린의 약리 기전은? 엔시펜트린은 PDE3와 PDE4를 동시에 억제하는 이중 억제제로, 이러한 신호전달 경로의 조절을 통해 치료 효과를 유도하는 새로운 흡입형 저분자 약물이다. PDE3는 주로 cAMP를 가수분해하지만, cGMP도 기질로 사용할 수 있는 특성을 지니며, PDE4는 cAMP에 특이적으로 작용하는 효소이다.따라서 두 PDE를 동시에 억제함으로써 세포 내 cAMP 및 cGMP 농도가 모두 상승하게 되고, 이는 기도 평활근 이완, 항염작용, 점액 분비 감소 및 섬모 기능 강화 등 복합적인 생리학적 효과를 유도한다(Figure 3).특히 PDE3와 PDE4는 기도 평활근, 염증세포, 기관지 상피세포에 널리 발현되어 있어, 이들에 대한 동시 억제는 단일 PDE 억제보다 상승적 또는 시너지 효과를 유도할 수 있다. 이러한 작용 특성은 엔시펜트린이 기관지 확장, 기도 염증 조절, 점액섬모 청소 기능(mucociliary clearance)에 걸친 통합적 치료 효과를 발휘할 수 있다. 엔시펜트린(OHTUVAYRE& 9415;)의 허가 임상은 어떠한가? 엔시펜트의 유효성은 ENHANCE-1 및 ENHANCE-2의 24주간 무작위 배정, 이중눈가림, 위약 대조, 병렬군 임상시험을 통해 평가되었다. 이 두 연구에는 중등도에서 중증의 COPD를 가진 총 1,553명의 성인 환자가 등록되었다.ENHANCE-1에서는 763명의 환자가 등록되어 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 표준 제트 네불라이저를 통해 흡입하도록 배정되었다. 등록 시점에서 기관지 확장제 투여 후 예측 FEV1 평균은 52%(범위: 27~85%), FEV1/FVC 비율은 평균 0.52(범위: 0.22~0.71)였다. 또한, 전체 환자의 68%는 LAMA, LABA, 또는 LABA/ICS와 같은 병용 치료를 받고 있었으며, 각각 30%, 18%, 20%가 해당 약제를 사용하고 있었다.ENHANCE-2는 총 790명의 환자를 대상으로 동일한 방식으로 설계되었으며, 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 제트 네불라이저를 통해 하루 두 번 흡입하도록 배정하였다.등록 시점의 평균 예측 FEV1은 51%(범위: 23~81%)였고, FEV1/FVC 비율은 평균 0.52(범위: 0.24~0.71)였다. 이 연구에서도 55%의 환자가 병용 치료를 받고 있었으며, LAMA, LABA , LABA/ICS와 같이 병용 치료를 받고 있었으며, 각각 33%, 7%, 15%가 해당 약제를 사용하고 있었다.두 연구 모두에서 주요 평가변수였던 12주차 FEV₁의 시간-농도 곡선 면적(AUC& 8320;& 8211;12h)은 위약 대비 유의하게 개선되었다. ENHANCE-1 및 ENHANCE-2 연구에서는 모든 환자를 대상으로 베이스라인 시점과 12주차에 걸쳐 12시간 동안 연속 폐기능 검사(serial spirometry)가 수행되었다. ENHANCE-1의 12주차 연속 폐기능 검사 결과는 trough FEV1은 아침 투약 직전 마지막으로 측정된 FEV1 값으로 정의되었다.12주차 시점에서 위약 대비 평균 아침 trough FEV1의 개선치는 ENHANCE-1에서 35mL (95% 신뢰구간: 14, 68), ENHANCE-2에서는 49 mL(95% 신뢰구간: 19, 80)로 나타났으며, 이는 ENHANCE-1에서 통계적으로 유의하였으나, ENHANCE-2에서는 분석 단계(hierarchical testing) 상위 단계의 실패로 인해 통계적 유의성이 확보되지 않았다. St. George’s 호흡기 설문지(SGRQ)를 통해 두 시험에서 시행되었으며, SGRQ 반응률은 점수가 4점 이상 개선된 경우로 정의되었다. ENHANCE-1에서 24주차 시점의 SGRQ 반응률은 OHTUVAYRE 투여군에서 58.2%, 위약군에서 45.9%로 나타났고, 이에 대한 Odds Ratio는 1.49(95% CI: 1.07, 2.07)로 통계적 유의성이 있었다.반면, ENHANCE-2에서는 OHTUVAYRE 투여군의 반응률이 45.4%, 위약군이 50.3%였으며, Odds Ratio는 0.92(95% CI: 0.66, 1.29)로, 통계적 유의성은 나타나지 않았다.엔시펜트린의 예상되는 쟁점은 무엇인가? 현재까지의 COPD 치료 전략은 주로 기관지 확장제 및 항염증 흡입제에 기반하였으며, 증상 완화와 급성 악화의 예방을 목표로 했다.그러나 일부 환자에서는 기존 약물요법으로 충분한 치료 효과를 얻지 못하거나, 흡입기 사용에 대한 어려움으로 치료 순응도가 저하되는 문제가 지속적으로 제기되어 왔다.엔시펜트린은 이러한 한계를 극복하기 위해 개발된 약제로, PDE 3와 PDE4를 동시에 억제하는 최초의 흡입형 치료제이다. PDE3 억제를 통해 기관지 평활근을 이완시켜 기관지 확장 효과를 유도하고, PDE4 억제를 통해 염증세포에서의 사이토카인 분비 및 염증 반응을 억제함으로써 항염 효과를 나타낸다. 이러한 이중 작용은 단일 기전 약물에 비해 증상 개선 및 염증 조절에 있어 시너지 효과를 기대할 수 있다.엔시펜트린은 제트 네뷸라이저를 통해 투여되는 제형으로, 흡입기 사용이 어려운 고령 환자나 협조가 부족한 환자에게 유용한 대안이 될 수 있다. 또한 기존 유지 치료제(LABA, LAMA, ICS)와 병용 가능하며, 특히 기존 치료에 반응이 불충분한 환자에게 추가적인 임상적 혜택을 제공할 수 있다.다만, 단시간 작용성 기관지 확장제(SABA/SAMA)에 비해 작용 발현 속도가 느리기 때문에 급성 증상 완화에는 적합하지 않으며, 휴대성과 투여 시간(약 5& 8211;7분) 측면에서도 일상 생활에서 제한점이 존재한다.임상적으로는 두 건의 ENHANCE-1 및 ENHANCE-2 3상 무작위 위약 대조 시험을 통해 엔시펜트린의 유효성과 안전성이 평가되었다. ENHANCE-1에서는 폐기능 개선과 건강 관련 삶의 질 향상(예: SGRQ 점수)의 통계적 유의성이 입증되었으며, 탈락률도 낮아 근거 수준이 높은 연구로 간주된다. 반면 ENHANCE-2는 지역적 인구 구성의 차이 및 통계적 유의성 부족으로 인해 지원적 자료(supportive evidence)로 해석되었으며, 두 연구가 동일한 근거 수준으로 채택되지는 않았다.현재 엔시펜트린은 미국 FDA로부터 승인을 받았으나, 유럽 EMA에서는 정식 승인을 획득하지 못한 상태이다. 이와 같은 규제 환경은 약물의 글로벌 접근성 및 보급에 있어 중요한 장애가 되고 있다.결론적으로, 엔시펜트린은 기전적 이점을 바탕으로 기존 치료의 한계를 보완하고, 특정 환자군에서 치료 옵션의 다양성을 확대할 수 있는 약제로 평가된다. 향후 유럽 EMA 승인과 후속 임상 연구와 실제 임상에서의 사용 경험이 축적됨에 따라, 이중 PDE 억제제는 COPD 약물 치료의 새로운 전환점을 제시할 수 있을 것으로 기대해 본다.참고문헌 1. Isaac Levy et al. “Phosphodiesterase function and endocrine cells: links to human disease and roles in tumor development and treatment” Curr Opin Pharmacol. 2011;11(6):689& 8211;697. 2. Nardini et al. “COPD: maximization of bronchodilationMultidisciplinary Respiratory Medicine” 2014, 9:50. 3. James F Donohue et al. “Ensifentrine as a Novel, Inhaled Treatment for Patients with COPD“ International Journal of Chronic Obstructive Pulmonary Disease 2023:18. 4. Rinzhin T et al. “Advancing Obstructive Airway Disease Treatment: Dual PDE3/4 Inhibition as a Therapeutic Strategy“ Cells 2025, 14, 659. 5. Nicola A. Hanania, Bartolom& 233; R. Celli, ”Phosphodiesterase Inhibition as a Therapeutic Strategy for Chronic Obstructive Pulmonary Disease: Where We Have Been and What Lies Ahead“ Chronic Obstr Pulm Dis. 2025; 12(1): 82-92. 6. COPD 진료지침 대한결핵 및 호흡기학회 2024 개정. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-06-27 06:00:46최병철 박사
PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대6편: 최초의 흡입형 PDE3/PDE4 이중 억제 COPD 치료제, 오투베어(Esifentrine)오투베어(Ohtuvayre& 9415;, OH-too-vare 성분명 엔시펜트린 흡입 현탁액, Esifentrine& 9415;, Verona Pharma)는 최초의 흡입용 PDE3/PDE4 효소 선택적 이중 억제제로서, 2024년 6월 미국 FDA에서 '성인 만성폐쇄성폐질환(chronic obstructive pulmonary disease, COPD) 환자의 유지요법제'에 승인되었으며, 유럽에서는 아직 승인되지 않았다. 현재 이 약제와 유사한 PDE4 억제제인 '닥사스(roflumilast)'는 '중증 COPD 환자의 급성 악화 빈도를 감소'에 승인된 약제로 미국 FDA 및 국내에서 소개되어 있다.이 약제는 기도와 폐 실질의 염증세포에서 cAMP 분해 효소인 PDE3 및 PDE4 효소를 선택적으로 억제함으로써, 기관지확장과 비스테로이드성 항염증 효과를 하나로 결합하여 높은 흡기 유속이나 복잡한 손-호흡 조정 없이 표준 제트 네블라이저를 통해 폐에 약물을 직접 전달되도록 설계되었다.이 cAMP 경로는 COPD의 병태 생리를 조절하는 내재적 항염증 기전으로 중요하게 작용하며, 이를 조절하는 약물학적 접근은 기존의 기관지 확장제나 흡입 스테로이드 기반 치료를 보완할 수 있는 새로운 치료 전략으로 자리매김하고 있다.오투베어의 미국 FDA 승인은 미국호흡기중환자 의학저널(American Journal of Respiratory and Critical Care Medicine)에 게재된 임상 3상 시험 ENHANCE의 결과를 포함한 광범위한 데이터를 기반으로 이뤄졌다.ENHANCE 임상시험에서 오투바이어는 단독요법으로 투여하거나 다른 유지요법과 함께 사용했을 때 폐 기능 개선을 포함한 임상적 이점을 제공한 것으로 입증되었다. 이는 중등도에서 중증의 COPD를 가지고 있는 광범위한 그룹에서 내약성이 우수하였다.오투바이어는 COPD 외에도 비-낭성섬유증 기관지확장증, 낭성섬유증, 천식, 기타 호흡기질환에 대한 치료제로 평가되고 있다. 또한 오투바이어와 지속성 항콜린제(LAMA)인 glycopyrrolate의 고정용량 복합제를 COPD 유지요법으로 개발 중이다.만성폐쇄성폐질환(Chronic obstructive pulmonary disease, COPD)은 어떤 질환인가? COPD는 기류 제한이 지속적으로 나타나는 진행성 호흡기 질환으로, 기도 및 폐 실질의 만성 염증과 그에 따른 폐기능 저하가 주요 병리학적 특징이다. 임상적으로는 호흡곤란, 만성 기침, 객담 등 다양한 증상이 발현되며, 반복적인 급성 악화는 삶의 질 저하뿐 아니라 사망률 증가와도 밀접하게 연관되어 있다. 전 세계적으로 COPD는 주요 사망 원인 중 하나로 보고되고 있으며, 고령화와 흡연율 증가에 따라 그 유병률은 지속적으로 상승하고 있다.COPD의 병태생리에는 대식세포(macrophages), 호중구(neutrophils), CD8+ T 림프구(cytotoxic T cells) 등 선천 및 후천 면역세포의 활성화가 중심적인 역할을 하며, 이들 면역세포는 다수의 염증 촉진성 사이토카인(IL-8, TNF-α 등), 프로테아제(matrix metalloproteinases), 그리고 활성산소종(reactive oxygen species)을 과도하게 분비한다. 이러한 염증 반응은 기도 리모델링, 점액 과분비, 폐포 구조의 파괴 및 폐 실질의 손상 등 병리적 변화를 유도하여 기류 제한을 지속시키는 주요 기전으로 작용한다.이러한 만성 염증 반응을 조절하기 위한 내재적 조절 기전 중 하나로 주목받는 것이 cyclic adenosine monophosphate(cAMP) 신호 전달 경로이다. cAMP는 adenylyl cyclase에 의해 생성되는 대표적인 이차 전령(second messenger)으로, 세포 내에서 protein kinase A(PKA) 및 Epac(Exchange Protein directly Activated by cAMP) 등의 하위 효과기를 통해 다양한 생리학적 반응을 매개한다.구체적으로, cAMP는 염증성 유전자 발현 억제, 항산화 반응 촉진, 섬모 운동 촉진, 점액 분비 감소 및 기관지 평활근의 이완 등을 유도함으로써 COPD 병태생리의 여러 측면을 동시에 조절할 수 있는 기능을 한다.그러나 COPD 환자에서는 염증세포 내에서 phosphodiesterase-4(PDE4)의 과발현으로 인해 cAMP가 병태적으로 분해되고, 그 농도가 비정상적으로 낮아지는 현상이 관찰된다. 이러한 기전은 항염 및 기관지 보호 효과를 저해하며, 결과적으로 만성 염증을 악화시키는 데 기여한다.Cyclic nucleotides(고리형 뉴클레오타이드)란 무엇인가? Cyclic nucleotides는 세포 내 신호전달 경로에서 이차 전령으로 작용하는 분자군으로, 다양한 생리학적 자극에 대한 세포 반응을 매개하는 데 중심적인 역할을 수행한다. 이들은 주로 ATP(adenosine triphosphate) 또는 GTP(guanosine triphosphate)로부터 유도되어 생성되며, 대표적인 형태로 cAMP(cyclic adenosine monophosphate)와 cGMP(cyclic guanosine monophosphate)가 있다.cAMP는 adenylyl cyclase(AC)의 촉매 작용에 의해 ATP로부터 생성되며, 이는 G 단백질 연결 수용체(G protein-coupled receptor, GPCR)의 활성화에 의해 유도된다. 이는반면, cGMP는 guanylyl cyclase(GC)에 의해 GTP로부터 유도되며, 이는 나트륨이뇨펩타이드(natriuretic peptides) 또는 산화질소(nitric oxide, NO)와 같은 세포외 신호에 의해 활성화된다. 이 두 경로는 상이한 생리적 자극과 수용체를 통해 선택적으로 작용하면서 세포 특이적 반응을 조절한다(Figure 1). 생성된 cAMP는 주로 PKA와 EPAC(exchange protein directly activated by cAMP, cAMP에 의해 직접 활성화되는 교환 단백질)을 통해 세포 기능을 조절한다. PKA는 대사 조절, 세포 분화, 증식, 생존 등 광범위한 생물학적 과정에 관여하며, EPAC은 integrin 매개 세포 부착, 세포 간 접합 형성, 분비(exocytosis), 인슐린 분비 등 PKA-비의존성 경로를 통해 다양한 세포 기능을 조절한다.특히, 세포 내 cAMP 농도가 상승하면 cAMP-의존성 PKA가 활성화된다. PKA는 두 개의 촉매 서브유닛(C)과 두 개의 조절 서브유닛(R)으로 이루어진 이종사량체(heterotetramer)로 구성되며, 평상시에는 비활성 상태로 존재한다. 그러다 cAMP가 R 서브유닛에 결합하면 촉매 서브유닛이 유리되어 다양한 표적 단백질을 인산화한다. 이 중 대표적인 인산화 표적은 CREB(cAMP response element binding protein)으로, 이는 대사 조절 및 세포 증식에 관여하는 유전자 발현을 조절하는 전사 인자이다.반면, 생성된 cGMP는 주로 PKG를 활성화시키며, 이는 세포 내 여러 표적 단백질을 인산화하여 평활근 수축 조절, 세포자멸사, 염증 반응, 시각 신호전달, 혈소판 응집 등 생리적 반응을 유도한다.이러한 cyclic nucleotide의 생물학적 활성을 종료시키는 주요 기전은 phosphodiesterase (PDE)에 의해 수행된다. PDE는 cAMP 및 cGMP를 각각 5’-AMP 또는 5’-GMP의 비고리형 형태로 분해함으로써 이차 전령 신호를 효과적으로 불활성화시킨다.cAMP 신호전달 경로는 어떤 역할을 하는가? cAMP는 1958년 Sutherland와 Rall에 의해 처음 발견된 이후, cAMP는 호르몬, 신경전달물질, 면역조절 인자 등 외부 자극에 의해 활성화되는 AC(adenyl cyclase)에 의해 ATP로부터 생성되는 고리형 뉴클레오타이드로 정의되었다.세포는 외부 환경으로부터의 자극에 신속하고 정밀하게 반응하기 위해 다양한 신호전달 시스템을 갖추고 있으며, 이에는 cAMP를 생성하는 AC가 존재한다. AC는 세포막에 존재하는 효소로, ATP를 cAMP로 전환하는 반응을 촉매하며, 이 과정은 GPCR의 활성화에 의해 주로 조절된다.GPCR은 세포막을 7회 통과하는 구조의 수용체로, 외부의 호르몬, 신경전달물질, 생리활성 분자 등의 리간드를 인식하여 이질삼합체 G 단백질(heterotrimeric G protein)을 활성화시킨다. 이때 GPCR은 Gs 단백과 결합하여 AC를 활성화하고, 이를 통해 세포 내 cAMP 생성을 유도한다. 반면 Gi 단백을 통해서는 AC 활성을 억제하여 cAMP 생성을 저해한다. 기도 조직에서 cAMP 농도의 증가는 평활근 이완과 염증 반응 억제를 유도하여, 천식을 포함한 폐쇄성 기도 질환의 병태생리 조절에 기여하는 것으로 알려져 있다.아울러, PKA는 세포 내 Ca²& 8314; 농도의 감소, Ca²& 8314;에 대한 민감도 저하, MLC 비의존 경로 조절 등 다양한 기전을 통해 기관지 확장 효과를 나타낸다. 또한, cAMP는 섬모 운동(ciliary motility)을 촉진하여 점액섬모 청소(mucociliary clearance)를 향상시키며, 이는 기도 내 분비물 제거와 염증 완화에 기여한다.이러한 이중 조절 메커니즘은 세포가 자극의 종류와 강도에 따라 cAMP 농도를 정밀하게 조절할 수 있게 하며, 하위 효과기인 PKA, EPAC 등을 통해 궁극적인 생리학적 반응으로 이어진다.cAMP 신호전달 경로의 특이성 및 세포 내 농도는 PDE에 의해 조절되며, PDE는 cAMP를 5’-AMP로 분해하여 신호를 종료시킨다. 특히 PDE4, PDE7, PDE8은 cAMP를 선택적으로 분해하는 isoform으로, 면역세포와 염증세포에 풍부하게 발현되어 있어 염증성 질환에서 중요한 조절 인자로 작용한다. 이에 따라 PDE4 억제제인 닥사스(roflumilast)는 cAMP 농도를 증가시켜 항염증 작용을 유도한다.따라서, cAMP 신호전달 경로는 외부 자극에 대한 세포의 신속하고 정밀한 반응을 유도하는 고차원적인 조절 기전이며, 그 구성 요소와 하위 경로를 표적으로 한 약리학적 개입은 염증성, 대사성, 심혈관성 질환을 포함한 다양한 병태에서 치료적 가능성을 제시한다.최근 연구들은 cAMP 의존성 신호전달 경로의 복잡성과 생물학적 중요성을 더욱 강조하고 있으며, 특히 기도 평활근(airway smooth muscle, ASM) 세포에서 β₂-아드레날린 수용체(β₂-adrenergic receptor, β₂AR)와 같은 GPCR의 활성이 이러한 경로를 중심으로 작동함이 밝혀졌다.Phosphodiesterase(PDE)는 무엇인가? PDE는 세포 내에서 cyclic nucleotide(cAMP 및 cGMP)의 3’,5’-고리형 인산 결합을 가수분해하여 각각 AMP(adenosine monophosphate) 또는 GTP(guanosine momophosphate)로 전환함으로써 이차 전령의 신호를 종료시키는 역할을 수행한다. PDE는 신호 전달의 시간적 지속성과 공간적 국소화, 그리고 신호의 강도 조절에 주요 생화학적 조절자(gatekeeper)로 기능하며, 이에 따라 다양한 생리 및 병리 현상의 미세 조절자로 작용한다.현재까지 확인된 PDE는 총 11개 계열(PDE1& 8211;PDE11)로 구성되며, 이들은 아미노산 서열, 기질 특이성, 약물 감수성, 조절 메커니즘 등의 차이에 따라 구분된다. 각 아형(family)은 서로 다른 조직 특이성 및 세포 내 소분획(localization)을 보이며, 동일한 기질(cAMP 또는 cGMP)에 작용하더라도 그 기능적 결과는 상이할 수 있다. 예를 들어, PDE4, PDE7, PDE8은 cAMP 특이적, PDE5, PDE6, PDE9는 cGMP 특이적, PDE1, PDE2, PDE3, PDE10, PDE11은 양쪽 기질 모두에 작용할 수 있다(Table 1). PDE의 활성 이상은 만성 염증성 질환, 심혈관 질환, 신경정신질환, 악성종양 등 다양한 질환의 병태생리와 밀접한 관련이 있으며, 특히 PDE3와 PDE4는 COPD와 같은 염증성 폐질환에서 병태생리학적 역할을 한다 .PDE3는 상대적으로 높은 cAMP 친화도를 가지며, PDE3A와 PDE3B의 두 아형으로 구분된다. PDE3A는 폐 상피세포, 혈관 내피세포, 기도 평활근세포(airway smooth muscle, ASM), 염증세포 등에서 발현되며, 특히 혈관 평활근세포에서 주요하게 존재하며 평활근 긴장도 조절에 관여한다. 반면, PDE3B는 지방세포, 간세포, 정자세포 등 대사 활성이 높은 조직뿐만 아니라 T세포 및 대식세포에서도 발현되어, 염증 반응 조절 및 대사 경로에 영향을 미친다.PDE4는 네 가지 유전자(PDE4A& 8211;D)와 다양한 스플라이싱 변이체로 구성되며, 호흡기계 조직을 포함한 다양한 기관에 광범위하게 분포한다. 특히 PDE4D는 인간 기도 평활근세포에서 cAMP 분해를 조절하는 주요 효소로 작용하며, PDE4 전체는 백혈구, 대식세포, 호중구 등 염증세포뿐 아니라 기도 상피세포 및 폐 신경계에도 발현되어 염증 반응의 조절자로 기능한다.임상 및 전임상 연구에 따르면, COPD 환자, 특히 흡연자에서 PDE4 발현이 유의하게 증가되어 있음이 보고되었으며, PDE4 억제를 통해 cAMP 농도를 증가시키는 것은 염증 촉진성 사이토카인의 발현 감소, 염증세포의 조직 내 침윤 억제 등 광범위한 항염증 효과를 유도하는 것으로 나타났다. 이러한 기전을 기반으로 PDE4 억제제 닥사스(roflumilast)는 ‘기관지확장제의 부가요법제로서, 증상악화 병력이 있고, 만성기관지염을 수반한 중증의 만성폐쇄성폐질환의 유지요법제’로 승인되어 있다.COPD에는 어떤 약제들을 사용하는가? COPD에 대한 약물 치료의 목적은 증상의 완화, 급성 악화의 예방, 신체활동 능력 향상 및 장기적인 예후 개선에 있다. 이에는 주로 흡입제에 기반하며, 기관지 확장제가 치료의 핵심이다.기관지확장제는 호흡기 질환에서 폐쇄된 기도를 확장시켜 기류를 개선하는 약제로, 천식과 COPD와 같은 기도 폐쇄성 질환에 사용된다. 이러한 약제는 기관지 평활근(bronchial smooth muscle)의 이완을 유도하여 기도 저항을 감소시키며, 환자의 증상을 완화하고 폐기능을 향상시키는 데 기여한다.기관지확장제는 작용 기전에 따라 크게 β2-아드레날린 수용체 작용제(β2-agonists), 항콜린제(Anticholinergics) 또는 무스카린 수용체 길항제(Muscarinic antagonists), 메틸잔틴계(Methylxanthines)가 있다.아울러 약물의 효과 및 부작용 등을 고려하여 흡입제를 주로 사용하며, 흡입기 종류는 크게 건조분말흡입기(dry power inhaler, DPI), 정량흡입기(metered dose inhaler, MDI)로 나뉘고, 다시 MDI는 가압 정량흡입기(pressurized metered dose inhaler, pMDI)와 연무형 흡입기(soft mist inhaler, SMI)로 나뉜다.pMDI는 다시 호흡 작동식 흡입기(breath-operated inhaler, BOI or breath-actuated inhale, BAI)와 비호흡 작동식 호흡기(Non-BOI)로 나뉘는데 호흡 작동식 흡입기는 아직 국내에 없다. 또한 분무기(nebulizer, 네불라이저)도 흡입제 치료에 속한다. 1) 베타-2 작용제(β2-agonists) β2-작용제는 기관지 평활근 세포에 발현된 β2-아드레날린 수용체에 선택적으로 결합하여 Gs 단백질을 통한 adenylyl cyclase 활성화, 이어지는 cAMP 농도 증가 및 PKA 활성화를 유도함으로써, 평활근 세포 내 칼슘 농도를 낮추고 근수축 관련 단백질들의 기능을 억제하여 기관지 확장을 유발한다. 또한 섬모운동 촉진 및 혈관 투과성 감소 등의 부수적 효과를 통해 기도 청소 기능 개선에도 기여할 수 있다.임상적으로 β2-작용제는 작용 시간에 따라 단시간 작용제(short-acting β2-agonists, SABA)와 장시간 작용제(long-acting β2-agonists, LABA)로 구분된다.SABA는 증상 완화를 위한 구제 치료(reliever therapy)로 사용되며, 대표적으로 살부타몰(Salbutamol)과 테르부탈린(Terbutaline)이 있다. SABA의 사용은 FEV1의 호전과 증상을 개선시킬 수 있다. SABA는 4-6시간 지속되고, LABA는 12시간 이상 지속되며, 규칙적인 LABA 사용을 하는 환자에서도 필요시 SABA 사용은 증상 완화에 도움이 될 수 있다.반면, LABA는 하루 12시간 이상 지속되는 작용시간을 가지며 천식의 유지 치료(controller therapy) 혹은 COPD의 증상 조절을 위한 병용 요법에 사용되며, 대표적으로 살메테롤(Salmeterol)과 포르모테롤(Formoterol)이 있다. 이들 약제는 폐기능과 삶의 질을 개선시키고 호흡곤란과 급성 악화와 입원의 빈도를 감소시키지만, 사망률이나 폐기능 감소 속도에는 영향을 주지 못한다.이 외에도 24시간 작용 지속 시간을 가진 초장시간 작용제(ultra-LABA)인 인다카테롤(Indacaterol), 올로다테롤(Olodaterol) 등이 COPD 치료에 활용되고 있다. 이들 약제는 호흡곤란과 악화위험을 감소시키고 삶의 질을 개선시킨다.이러한 β2-작용제는 그 효과의 빠른 발현과 우수한 증상 완화 효과로 인해 널리 사용되고 있으나, 단독 사용 시 특히 천식 환자에서 기도 염증을 충분히 조절하지 못하며 오히려 기전적 내성(tachyphylaxis)이나 염증 악화의 위험을 높일 수 있다는 우려도 제기되어 왔다. 이에 따라 ICS(흡입 스테로이드)와의 병용이 원칙이며, 한 기기 내 고정용량 복합제(FDC) 형태로 투여하는 방법이 표준화되고 있다.2) 항콜린제((Anticholinergics) 항콜린제는 기관지 평활근, 점액선, 혈관 등에 존재하는 무스카린 수용체(muscarinic receptor) 중 특히 M3 수용체에 선택적으로 작용하여, 아세틸콜린이 이 수용체에 결합하는 것을 차단함으로써 평활근 수축 및 점액 분비를 억제한다. 이로 인해 기도 저항이 감소하고 호흡 증상이 완화되며, COPD 환자의 폐기능 개선과 급성 악화 빈도 감소에 기여한다.항콜린제는 작용 지속 시간에 따라 단시간 작용 항무스카린제(short-acting muscarinic antagonists, SAMA)와 장시간 작용 항무스카린제(long-acting muscarinic antagonists, LAMA)로 분류된다.SAMA는 주로 단기 증상 완화에 사용되며, 대표적으로이프라트로피움(Ipratropium)와 옥시트로피움(Oxitropium)이 있다. 이들 약제는 M3 비선택적 억제로, 억제성 신경 수용체인 M2를 차단함으로써 잠재적으로 미주신경을 통해 기관지 수축을 유발시킬 수 있다.LAMA는 하루 1회 또는 2회 흡입으로 지속적인 기도 확장을 유지할 수 있어 COPD 유지 치료의 핵심 약제로 사용된다. 대표적으로 티오트로피움(Tiotropium), 글리코피로니움(Glycopyrronium), 우메클리디늄(Umeclidinium) 등이 있다. 이들 약제는 M3 선택적 억제로, M3 무스카린성 수용체에 대한 장시간의 결합 및 M2 무스카린성 수용체와의 빠른 해리를 통해 기관지 확장제의 효과 지속 시간을 연장시킨다.항콜린제는 β2-작용제와 병용할 경우 상호 보완적인 기전으로 기관지 확장 효과가 증대되며, 특히 COPD 환자에서는 LAMA + LABA 병용요법이 임상적으로 우월한 효과를 보인다.항콜린제는 흡입 제형으로 투여 시 전신 흡수가 거의 없어 안전성이 높고, 주요 부작용은 구강건조, 쓴맛, 드물게 요폐 등의 국소적 반응에 국한된다. 이로 인해 장기적인 유지 요법에 적합한 약제로 간주된다.3) 흡입스테로이드제(Inhaled corticosteroid, ICS) ICS는 합성된 글루코코르티코이드 계열 약제로, 폐로 직접 흡입되어 작용함으로써 전신 노출을 최소화하면서 강력한 항염 작용을 발휘한다. 세포 내 글루코코르티코이드 수용체(glucocorticoid receptor, GR)와 결합한 후 전사조절인자(transcriptional regulator)로 기능하여, 염증 유전자 발현을 억제하고 항염증 단백질 생성을 유도한다.특히 NF-κB, AP-1 등 주요 염증 촉진성 전사인자의 활성을 차단함으로써 IL-4, IL-5, IL-13 등 Th2 관련 사이토카인의 생성을 억제하며, 호산구(eosinophil) 및 비만세포(mast cell)의 기도 내 침윤과 활성을 감소시킨다.이러한 작용기전은 기관지 평활근의 수축성을 저하시켜 기도 과민 반응을 감소시키고, 상피세포의 장벽 기능 회복과 점액선의 과활성 억제를 통해 전반적인 기도 염증 조절에 기여한다.ICS는 흡입제 형태로 국소적으로 투여되어 전신 부작용을 최소화하면서 장기간 안전하게 사용 가능하다는 점에서 ICS는 천식 치료에 있어 핵심적인 치료제로 간주된다. 이는 단독 사용뿐 아니라 LABA 또는 LAMA와의 병용 요법이 표준화되었다.4) Phosphodiesterase-4(PDE4) 억제제 PDE4 억제제는 cAMP의 대사를 억제하여 세포내 cAMP 농도를 높이는데 이는 항 염증 효과를 나타내고 또한 호중구의 이동과 화학 주성을 억제하는 효과도 있다. 로플밀라스트(Roflumilast)는 선택적인 PDE4 억제제 중의 하나로 가래 호중구와 호산구를 감소키는 항염증 작용이 확인되어 PDE4억제제 중 COPD 치료제로 허가 받은 유일한 약제이다. 하루 한번 복용하는 경구용 약제로 기관지 확장제가 아니지만 FEV1과 삶의 질 향상효과가 있다.따라서, 단기간 작용시간을 가지는 SABA와 SAMA는 주로 증상이 갑자기 악화될 때 사용되며, LABA와 LAMA는 유지 치료의 중심으로 사용된다.5) 병용요법 이러한 약제들은 단독 혹은 병합 요법으로 사용되며, 특히 증상이 지속되거나 급성 악화가 반복되는 환자에서는 2제 요법(LABA + LAMA) 또는 ICS를 포함한 3제 요법(ICS + LABA + LAMA)이 권고된다.6) PDE4 억제제 PDE4 억제제는 흡입 치료 외에도 일부 환자에서는 경구용 약제가 보조적으로 사용된다. PDE4 억제제인 로플루밀라스트(roflumilast)는 만성 기관지염 양상을 보이며 급성 악화가 잦은 중증 환자에게 효과적이다. 또한 급성 악화 시에는 경구 스테로이드 및 항생제가 단기간 사용되며, 병원성 감염의 가능성을 고려해 적절히 투여된다.기관지 확장제는 어떤 약제인가? 기도 저항(Airway resistance)의 감소는 기도 자체의 내재적(intrinsic) 요인과 외재적(extrinsic) 요인 모두에 의해 조절되며, 그 주요 기전으로는 평활근 이완, 기관 및 세기관지 벽의 염증 감소, 기도 분비물의 감소 등이 있다.이 중 기도 평활근의 이완은 기관지 확장을 유도하기 위한 핵심 기전으로, 이는 두 가지 주요 약리학적 접근법을 통해 달성될 수 있다. β2-아드레날린 수용체(β2-AR)를 자극하는 β2-작용제(β2-agonist)의 직접적인 작용과 무스카린 수용체를 차단하여 아세틸콜린 신호 전달을 억제하는 항콜린제(antimuscarinic)의 간접적인 작용이다(Figure 2). 먼저, β2-작용제는 기도 평활근 세포, 특히 소기도(small airway)에 존재하는 β2-AR에 직접 결합함으로써 작용한다. 이 결합은 평활근 세포 내에서 AC(adenyl cyclase)를 활성화시켜 ATP로부터 cAMP가 생성시킨다.생성된 cAMP는 두 가지 주요 하위 효과기를 활성화시킨다. 이때 PKA는 평활근 긴장을 조절하는 단백질들을 인산화하여 이완을 유도하고, Epac는 PKA와는 독립적으로 평활근 이완을 유도한다. 또한, cAMP는 세포 내 칼슘을 격리(sequestration)함으로써 추가적으로 수축을 억제하고 평활근 이완을 촉진한다.다음, 항콜린제는 수축 작용을 하는 아세틸콜린(ACh)의 수용체 결합을 경쟁적으로 차단함으로써 간접적으로 평활근 이완을 유도한다. 기도 내 부교감신경 활성은 주로 M1 및 M3 무스카린 수용체를 통해 매개되며, 이들 수용체는 평활근 수축, 점액 분비, 섬모운동 증가를 유도한다. 반면, M2 수용체는 시냅스 전 말단에서 ACh의 방출을 억제하여 음성 되먹임 조절을 수행한다.COPD에서는 특히 콜린성 기도 긴장(cholinergic bronchomotor tone)이 병태생리에 중요한 역할을 하며, 기도 수축 및 점액 과다분비를 통해 기도 폐쇄를 악화시킨다. β2-작용제는 모든 기도 수준, 특히 COPD에 관여하는 소기도의 평활근 세포 표면의 β2-AR에 결합하여 작용한다. 반면, 무스카린 수용체 길항제는 기도 평활근의 M3 수용체를 차단함으로써 수축을 방지한다.비록 소기도에는 미주신경의 직접적인 분포가 부족하지만, COPD와 같은 질환에서는 비신경원성(non-neuronal) 아세틸콜린에 의해 무스카린 수용체가 활성화되는 것으로 알려져 있다. 따라서 항콜린제(무스카린 수용체 길항제)는 대기도와 소기도 모두에서 확장 효과를 나타낼 수 있다.따라서, β2-작용제와 항콜린제와의 복합요법(combination therapy)은 단독요법보다 기도 전 구간에 걸쳐 더 강력한 기관지 확장 효과를 제공할 수 있으며, 각 약물에 대한 환자 간(inter-patient) 및 환자 내(intra-patient) 반응의 이질성을 극복하는 데도 도움을 줄 수 있다. 나아가, 두 기전이 결합된 병용요법은 단순한 약물 투여 방식과 함께 신체활동 내성 증가, 일상 활동 수행 능력 향상, 삶의 질 개선에도 긍정적인 영향을 미친다.PDE 억제제에는 어떤 약제들이 있는가? PDE 억제제는 세포 내 cAMP 및 cGMP의 분해를 억제함으로써 해당 이차 전령의 농도를 증가시키고, 다양한 하위 신호경로인 PKA, PKG, EPAC, 이온 채널 등을 활성화시켜 생리적 반응을 조절한다.이러한 작용은 단일 경로에 국한되지 않고 염증, 혈류역학, 대사, 면역 및 신경전달 등 다양한 체계에 걸쳐 조절 효과를 나타내며, 이에 따라 PDE 억제제는 다기능성 치료 플랫폼으로 진화하고 있다.COPD에서는 PDE 억제를 통해 기도 평활근 이완 및 항염증 효과를 유도하는 치료 전략이 오래전부터 탐색되어 왔다.대표적으로 methylxanthine 계의 테오필린(Theophylline)은 비선택적 PDE 억제제(non-selective phosphodiesterase inhibitor) 로 기관지 확장 작용 외에 횡격막 근력 강화, 기관지 섬모운동 개선과 심박출량을 증가시키는 효과가 있다. 이러한 작용으로 인해 천식 및 COPD 치료에 오랫동안 사용되었으나, 치료역이 좁고 심혈관계 및 중추신경계 부작용이 자주 동반되어 임상 활용에 제한이 있다. 따라서 기관지확장 효과가 약해 흡입 기관지확장제 약물을 사용할 수 없는 상황에서만 제한적으로 사용한다.이에 따라 초기에 개발된 PDE4 선택적 억제제인 롤리프람(Rolipram)은 T 세포 및 대식세포에서의 cAMP 증가를 통해 염증성 사이토카인 분비를 억제하는 기전을 보였으나, 심각한 위장관계 부작용으로 인해 임상 개발이 중단되었다.이후 개발된 로플루밀라스트(Roflumilast)는 위장관계 부작용을 줄인 개선된 PDE4 억제제로, 2010년 미국 FDA에서 “기관지확장제 병용요법으로서, 급성 악화 병력이 있고 만성 기관지염을 수반한 중증 COPD 환자의 유지 치료” 적응증으로 승인되었으며, 유럽 EMA와 국내에도 승인을 받았다.전임상 연구에 따르면, 로플루밀라스트는 기관지 상피세포에서 글루코코르티코이드 수용체 α(GRα)의 전사활성을 증가시키고, 이는 덱사메타손(dexamethasone)의 항염 효과를 GRα 의존적으로 증강시키는 것으로 나타났다. 그러나 여전히 위장 불편감, 체중 감소 등의 부작용이 빈번히 보고되어, 국제 GOLD 가이드라인에서는 LABA, LAMA, ICS를 병용함에도 악화를 반복하는 환자에 한해 3차 치료제(third-line agent)로 제한적 사용을 권고하고 있다.한편, PDE3 역시 평활근세포에서 발현되어 기관지 수축성 조절에 관여하는데, PDE3 억제는 기관지 이완 효과를 유도한다.이에 따라 PDE3 및 PDE4를 동시에 억제함으로써 기관지 확장과 항염 작용을 동시에 달성하려는 전략이 제시되었다. 실제로 전임상 연구에서는 이중 억제제가 단일 억제제보다 더 우수하거나, 상가적 효과를 유도함을 입증한 바 있다.이러한 기전을 기반으로 최근 개발된 엔시펜트린(Ensifentrine)은 PDE3와 PDE4를 모두 억제하는 이중 작용 흡입제로, 기도 평활근 이완과 염증 반응 억제를 병행하는 새로운 기전의 약제가 개발되었다.엔시펜트린(Ensifentrine)는 어떤 약제인가? 엔시펜트린(Ensifentrine, 제품명 : 오투바이어 흡입 현탁액, Ohtuvayre& 9415;)은 PDE3/PDE4 이중 억제제로, 2024년 6월에 미국 FDA로부터 COPD 유지 치료제로 승인되었다. 이는 기관지 수축 및 염증 반응을 동시에 표적으로 삼는 새로운 치료 옵션으로, 기존의 PDE 억제제보다 내약성 및 효능 면에서 개선된 특성을 나타낸다.엔시펜트린의 기본 구조(parent molecule)는 trequinsin으로, 이는 다른 PDE 억제제들에 비해 기도 평활근에서 지속적인 기관지 확장 효과를 나타내며, 중간 수준의 PDE3 억제력과 약한 PDE4 억제력을 가진다.엔시펜트린은 흡입 현탁액(inhalation suspension) 제제로 Jet nebulizer를 ㅛㅏ용하는 기관지 확장제 및 항염증제이다. Jet nebulizer는 호흡기 약물 전달을 위한 대표적인 흡입 장치로, 압축 공기를 이용한 벤츄리(Venturi) 효과를 기반으로 액상 약물을 미세한 에어로졸 입자로 변환시키는 기전으로 작동한다. 이 장치는 폐 말단부위까지 약물을 직접 도달시키는 능력으로 인해 특히 COPD이나 급성 호흡곤란 환자에게 유용하며, 고령 환자, 소아, 또는 기도 협착 환자와 같이 흡입 조절이 어려운 대상군에게 효과적인 약물 전달 수단이라고 할 수 있다.엔시펜트린의 기관지 확장과 항염증 효과는 알레르기성 기관지 수축이 유도된 기니피그 모델 연구에서 기관지 폐포 세척액 및 비강 내 염증세포 침윤을 유의하게 감소시키는 효과가 확인되었다. 또한 항원 유도로 인한 호산구 이동은 흡입형 엔시펜트린 전처리 시 80% 이상 억제되었다.또한, 시험관 내 연구(in vitro)에서 낭성섬유증 전도 조절 단백(CFTR)을 자극하는 효과가 확인되었으며, 이는 기도의 점액섬모 청소 기능(mucociliary clearance)을 개선할 가능성을 보여주었다.엔시트린 허가사항 중 WARNINGS AND PRECAUTIONS에서 다음과 같이 안내하고 있다. 엔시펜트린 투여를 시작하기 전에, 의료진은 우울증 및/또는 자살 생각 또는 행동의 병력이 있는 환자에게서 엔시펜트린 치료의 이점과 위험을 신중히 평가해야 한다. 환자, 보호자 및 가족에게는 불면, 불안, 우울감, 자살 충동 또는 기타 기분 변화의 발생 또는 악화 여부를 주의 깊게 관찰할 필요성이 있음을 안내하고, 이러한 변화가 나타날 경우 즉시 의료진에게 연락할 것을 권고해야 한다. 이와 같은 사건이 발생한 경우, 의료진은 엔시펜트린 치료의 지속 여부에 대해 신중히 재평가해야 한다.엔시펜트린 치료는 정신과적 이상반응 증가와 관련이 있다. 임상시험에서 엔시펜트린를 투여받은 환자 중 자살 관련 이상반응이 보고되었으며, 그 중 자살 시도 1건 및 자살 사례 1건이 포함되었다. 또한, 통합된 24주 안전성 평가 인구집단에서 가장 흔하게 보고된 정신과적 이상반응은 다음과 같다:불면증은 엔시펜트린 3mg 투여군 6명(0.6%), 위약군 2명(0.3%)이었고, 불안은 엔시펜트린 3mg 투여군 2명(0.2%), 위약군 1명(0.2%)이었다. 우울 관련 반응(우울증, 주요우울증, 우울 기분을 동반한 적응장애 포함)은 엔시펜트린를 투여받은 환자 4명(0.4%)에서 발생하였으며, 위약 투여군에서는 보고되지 않았다.엔시펜트린의 약리 기전은? 엔시펜트린은 PDE3와 PDE4를 동시에 억제하는 이중 억제제로, 이러한 신호전달 경로의 조절을 통해 치료 효과를 유도하는 새로운 흡입형 저분자 약물이다. PDE3는 주로 cAMP를 가수분해하지만, cGMP도 기질로 사용할 수 있는 특성을 지니며, PDE4는 cAMP에 특이적으로 작용하는 효소이다.따라서 두 PDE를 동시에 억제함으로써 세포 내 cAMP 및 cGMP 농도가 모두 상승하게 되고, 이는 기도 평활근 이완, 항염작용, 점액 분비 감소 및 섬모 기능 강화 등 복합적인 생리학적 효과를 유도한다(Figure 3).특히 PDE3와 PDE4는 기도 평활근, 염증세포, 기관지 상피세포에 널리 발현되어 있어, 이들에 대한 동시 억제는 단일 PDE 억제보다 상승적 또는 시너지 효과를 유도할 수 있다. 이러한 작용 특성은 엔시펜트린이 기관지 확장, 기도 염증 조절, 점액섬모 청소 기능(mucociliary clearance)에 걸친 통합적 치료 효과를 발휘할 수 있다. 엔시펜트린(OHTUVAYRE& 9415;)의 허가 임상은 어떠한가? 엔시펜트의 유효성은 ENHANCE-1 및 ENHANCE-2의 24주간 무작위 배정, 이중눈가림, 위약 대조, 병렬군 임상시험을 통해 평가되었다. 이 두 연구에는 중등도에서 중증의 COPD를 가진 총 1,553명의 성인 환자가 등록되었다.ENHANCE-1에서는 763명의 환자가 등록되어 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 표준 제트 네불라이저를 통해 흡입하도록 배정되었다. 등록 시점에서 기관지 확장제 투여 후 예측 FEV1 평균은 52%(범위: 27~85%), FEV1/FVC 비율은 평균 0.52(범위: 0.22~0.71)였다. 또한, 전체 환자의 68%는 LAMA, LABA, 또는 LABA/ICS와 같은 병용 치료를 받고 있었으며, 각각 30%, 18%, 20%가 해당 약제를 사용하고 있었다.ENHANCE-2는 총 790명의 환자를 대상으로 동일한 방식으로 설계되었으며, 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 제트 네불라이저를 통해 하루 두 번 흡입하도록 배정하였다.등록 시점의 평균 예측 FEV1은 51%(범위: 23~81%)였고, FEV1/FVC 비율은 평균 0.52(범위: 0.24~0.71)였다. 이 연구에서도 55%의 환자가 병용 치료를 받고 있었으며, LAMA, LABA , LABA/ICS와 같이 병용 치료를 받고 있었으며, 각각 33%, 7%, 15%가 해당 약제를 사용하고 있었다.두 연구 모두에서 주요 평가변수였던 12주차 FEV₁의 시간-농도 곡선 면적(AUC& 8320;& 8211;12h)은 위약 대비 유의하게 개선되었다. ENHANCE-1 및 ENHANCE-2 연구에서는 모든 환자를 대상으로 베이스라인 시점과 12주차에 걸쳐 12시간 동안 연속 폐기능 검사(serial spirometry)가 수행되었다. ENHANCE-1의 12주차 연속 폐기능 검사 결과는 trough FEV1은 아침 투약 직전 마지막으로 측정된 FEV1 값으로 정의되었다.12주차 시점에서 위약 대비 평균 아침 trough FEV1의 개선치는 ENHANCE-1에서 35mL (95% 신뢰구간: 14, 68), ENHANCE-2에서는 49 mL(95% 신뢰구간: 19, 80)로 나타났으며, 이는 ENHANCE-1에서 통계적으로 유의하였으나, ENHANCE-2에서는 분석 단계(hierarchical testing) 상위 단계의 실패로 인해 통계적 유의성이 확보되지 않았다. St. George’s 호흡기 설문지(SGRQ)를 통해 두 시험에서 시행되었으며, SGRQ 반응률은 점수가 4점 이상 개선된 경우로 정의되었다. ENHANCE-1에서 24주차 시점의 SGRQ 반응률은 OHTUVAYRE 투여군에서 58.2%, 위약군에서 45.9%로 나타났고, 이에 대한 Odds Ratio는 1.49(95% CI: 1.07, 2.07)로 통계적 유의성이 있었다.반면, ENHANCE-2에서는 OHTUVAYRE 투여군의 반응률이 45.4%, 위약군이 50.3%였으며, Odds Ratio는 0.92(95% CI: 0.66, 1.29)로, 통계적 유의성은 나타나지 않았다.엔시펜트린의 예상되는 쟁점은 무엇인가? 현재까지의 COPD 치료 전략은 주로 기관지 확장제 및 항염증 흡입제에 기반하였으며, 증상 완화와 급성 악화의 예방을 목표로 했다.그러나 일부 환자에서는 기존 약물요법으로 충분한 치료 효과를 얻지 못하거나, 흡입기 사용에 대한 어려움으로 치료 순응도가 저하되는 문제가 지속적으로 제기되어 왔다.엔시펜트린은 이러한 한계를 극복하기 위해 개발된 약제로, PDE 3와 PDE4를 동시에 억제하는 최초의 흡입형 치료제이다. PDE3 억제를 통해 기관지 평활근을 이완시켜 기관지 확장 효과를 유도하고, PDE4 억제를 통해 염증세포에서의 사이토카인 분비 및 염증 반응을 억제함으로써 항염 효과를 나타낸다. 이러한 이중 작용은 단일 기전 약물에 비해 증상 개선 및 염증 조절에 있어 시너지 효과를 기대할 수 있다.엔시펜트린은 제트 네뷸라이저를 통해 투여되는 제형으로, 흡입기 사용이 어려운 고령 환자나 협조가 부족한 환자에게 유용한 대안이 될 수 있다. 또한 기존 유지 치료제(LABA, LAMA, ICS)와 병용 가능하며, 특히 기존 치료에 반응이 불충분한 환자에게 추가적인 임상적 혜택을 제공할 수 있다.다만, 단시간 작용성 기관지 확장제(SABA/SAMA)에 비해 작용 발현 속도가 느리기 때문에 급성 증상 완화에는 적합하지 않으며, 휴대성과 투여 시간(약 5& 8211;7분) 측면에서도 일상 생활에서 제한점이 존재한다.임상적으로는 두 건의 ENHANCE-1 및 ENHANCE-2 3상 무작위 위약 대조 시험을 통해 엔시펜트린의 유효성과 안전성이 평가되었다. ENHANCE-1에서는 폐기능 개선과 건강 관련 삶의 질 향상(예: SGRQ 점수)의 통계적 유의성이 입증되었으며, 탈락률도 낮아 근거 수준이 높은 연구로 간주된다. 반면 ENHANCE-2는 지역적 인구 구성의 차이 및 통계적 유의성 부족으로 인해 지원적 자료(supportive evidence)로 해석되었으며, 두 연구가 동일한 근거 수준으로 채택되지는 않았다.현재 엔시펜트린은 미국 FDA로부터 승인을 받았으나, 유럽 EMA에서는 정식 승인을 획득하지 못한 상태이다. 이와 같은 규제 환경은 약물의 글로벌 접근성 및 보급에 있어 중요한 장애가 되고 있다.결론적으로, 엔시펜트린은 기전적 이점을 바탕으로 기존 치료의 한계를 보완하고, 특정 환자군에서 치료 옵션의 다양성을 확대할 수 있는 약제로 평가된다. 향후 유럽 EMA 승인과 후속 임상 연구와 실제 임상에서의 사용 경험이 축적됨에 따라, 이중 PDE 억제제는 COPD 약물 치료의 새로운 전환점을 제시할 수 있을 것으로 기대해 본다.참고문헌 1. Isaac Levy et al. “Phosphodiesterase function and endocrine cells: links to human disease and roles in tumor development and treatment” Curr Opin Pharmacol. 2011;11(6):689& 8211;697. 2. Nardini et al. “COPD: maximization of bronchodilationMultidisciplinary Respiratory Medicine” 2014, 9:50. 3. James F Donohue et al. “Ensifentrine as a Novel, Inhaled Treatment for Patients with COPD“ International Journal of Chronic Obstructive Pulmonary Disease 2023:18. 4. Rinzhin T et al. “Advancing Obstructive Airway Disease Treatment: Dual PDE3/4 Inhibition as a Therapeutic Strategy“ Cells 2025, 14, 659. 5. Nicola A. Hanania, Bartolom& 233; R. Celli, ”Phosphodiesterase Inhibition as a Therapeutic Strategy for Chronic Obstructive Pulmonary Disease: Where We Have Been and What Lies Ahead“ Chronic Obstr Pulm Dis. 2025; 12(1): 82-92. 6. COPD 진료지침 대한결핵 및 호흡기학회 2024 개정. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).2025-06-27 06:00:46최병철 박사 -
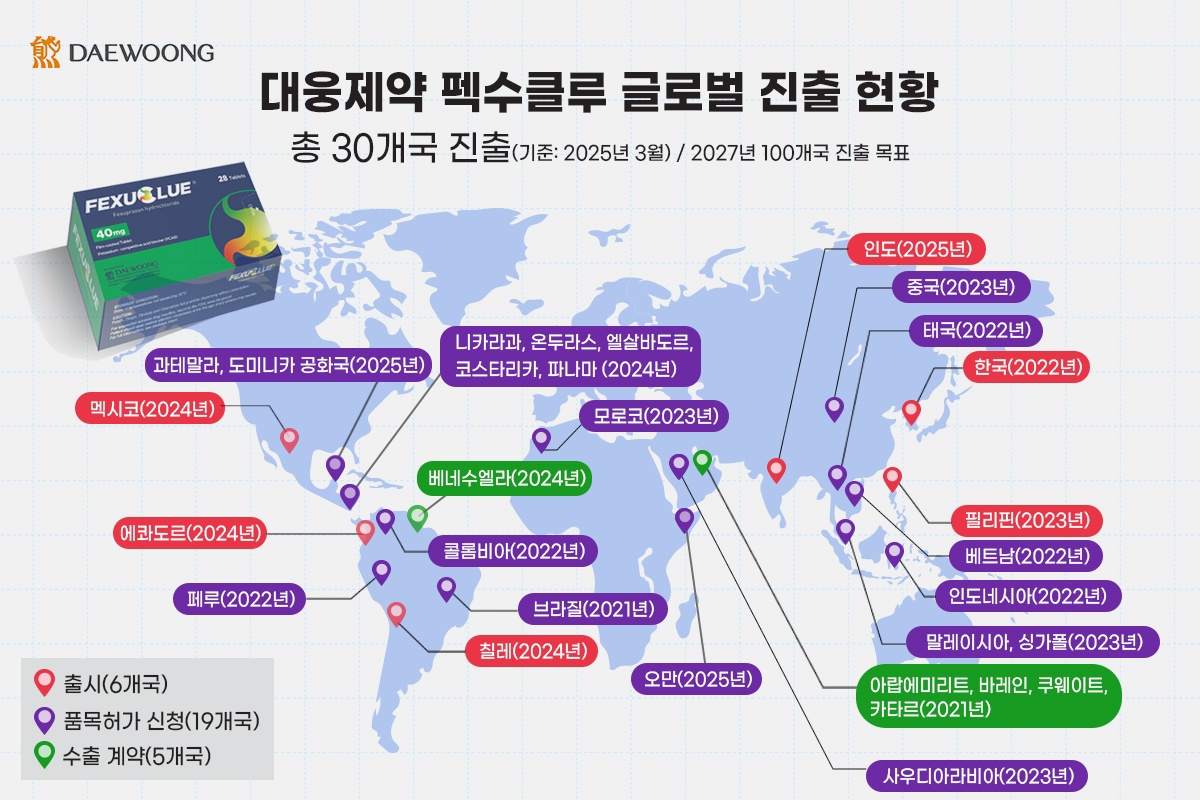 대웅제약 펙수클루, 국산 P-CAB 신약 최초 인도 출시[데일리팜=차지현 기자] 대웅제약이 위식도역류질환 치료 신약 '펙수클루'를 인도 시장에 출시했다. 국산 칼륨경쟁적 위산분비억제제(P-CAB) 계열 신약 중 인도 시장에 출시한 건 펙수클루가 유일하다.대웅제약(대표 박성수& 8729;이창재)은 펙수클루를 인도 시장에 정식 출시했다고 7일 밝혔다. 국산 P-CAB 제제가 인도에 출시되는 건 이번이 처음이다.인도는 글로벌 시장조사기관 IMS 2023년 데이터 기준,중국·미국·일본에 이어 세계 4위 항궤양제 시장이다. 연간 시장 규모는 1조4000억원으로 추산된다.대웅제약은 인도를 펙수클루 글로벌 핵심 거점국으로 선정하고, 2023년 12월 인도 1위 제약사 선파마와 기술이전 계약을 체결했다. 이후 품목허가 신청부터 출시까지 빠른 속도로 진행해 현지 진출을 마무리했다.선파마는 인도 현지에서 모집한 미란성 위식도 역류질환 환자를 대상으로 3상 임상시험을 진행하고 PPI 제제 에스오메프라졸 대비 8주와 4주 치료율에 대해 비열등성과 주 증상 개선 효과를 입증했다. 이를 통해 인도 중앙의약품표준관리국으로부터 품목허가를 획득했다.임상 결과에 따르면 8주 차의 미란성 위식도 역류질환 치유 환자 비율은 펙수클루 투여군에서 95.05%, 대조군인 에스오메프라졸 투여군에서 92.93%였다. 두 군 간 치료 비율 차이는 2.12%(95% 신뢰구간 -4.47%, 8.71%)로 펙수클루 40mg의 하루 1회 투여가 에스오메프라졸 40mg 투여에 비해 비열등한 것으로 나타났다.미란성 위식도 역류질환의 주 증상인 가슴쓰림과 산역류 개선 효과도 확인했다. 주& 8729;야간 및 24시간 동안 가슴쓰림과 산역류 증상이 없는 날에 대한 군별 비율을 확인한 결과, 증상 개선에 대한 두 군 간 통계적으로 유의미한 차이는 확인되지 않았다. 특히 8주차 야간 동안 가슴쓰림과 산역류 증상이 없는 날에 대한 비율은 펙수클루 투여군에서 70.28%, 73.29%로 나타나 에스오메프라졸 투여군 대비 야간 증상 개선 비율이 각각 10.5%, 13.8% 높았다.대웅제약 펙수클루 글로벌 진출 현황 34호 국산신약 펙수클루는 대웅제약이 2022년 출시한 3세대 위식도역류질환 치료제다. 기존 프로톤 펌프 저해제(PPI) 계열 치료제가 지닌 느린 약효 발현과 짧은 반감기, 식전 복용 등 단점을 개선한 게 특징이다.펙수클루는 출시 3년 차인 지난해 연매출 1000억 원을 돌파했다. 이번 인도 출시로 대웅제약은 펙수클루를 한국, 멕시코, 칠레, 에콰도르, 필리핀 등 6개국에서 판매하게 됐다. 이외 19개국에서 품목허가를 신청했고 5개국과 수출 계약을 체결해 총 30개국에 진출한 상태다. 대웅제약은 2027년까지 펙수클루를 전 세계 100개국에 진출시키겠다는 포부다.박성수 대웅제약 대표는 "이번 출시를 통해 펙수클루가 세계 4위 항궤양제 시장인 인도에서 위식도 역류질환 환자들을 위한 획기적인 치료 옵션으로 자리매김할 거라고 확신한다"며 "기존 위식도 역류질환 치료제와 차별화되는 펙수클루의 장점을 바탕으로 2027년까지 100개국 진출하고 2030년 1품 1조 비전을 달성하는 데 더욱 박차를 가하겠다"고 했다.2025-04-07 17:09:19차지현
대웅제약 펙수클루, 국산 P-CAB 신약 최초 인도 출시[데일리팜=차지현 기자] 대웅제약이 위식도역류질환 치료 신약 '펙수클루'를 인도 시장에 출시했다. 국산 칼륨경쟁적 위산분비억제제(P-CAB) 계열 신약 중 인도 시장에 출시한 건 펙수클루가 유일하다.대웅제약(대표 박성수& 8729;이창재)은 펙수클루를 인도 시장에 정식 출시했다고 7일 밝혔다. 국산 P-CAB 제제가 인도에 출시되는 건 이번이 처음이다.인도는 글로벌 시장조사기관 IMS 2023년 데이터 기준,중국·미국·일본에 이어 세계 4위 항궤양제 시장이다. 연간 시장 규모는 1조4000억원으로 추산된다.대웅제약은 인도를 펙수클루 글로벌 핵심 거점국으로 선정하고, 2023년 12월 인도 1위 제약사 선파마와 기술이전 계약을 체결했다. 이후 품목허가 신청부터 출시까지 빠른 속도로 진행해 현지 진출을 마무리했다.선파마는 인도 현지에서 모집한 미란성 위식도 역류질환 환자를 대상으로 3상 임상시험을 진행하고 PPI 제제 에스오메프라졸 대비 8주와 4주 치료율에 대해 비열등성과 주 증상 개선 효과를 입증했다. 이를 통해 인도 중앙의약품표준관리국으로부터 품목허가를 획득했다.임상 결과에 따르면 8주 차의 미란성 위식도 역류질환 치유 환자 비율은 펙수클루 투여군에서 95.05%, 대조군인 에스오메프라졸 투여군에서 92.93%였다. 두 군 간 치료 비율 차이는 2.12%(95% 신뢰구간 -4.47%, 8.71%)로 펙수클루 40mg의 하루 1회 투여가 에스오메프라졸 40mg 투여에 비해 비열등한 것으로 나타났다.미란성 위식도 역류질환의 주 증상인 가슴쓰림과 산역류 개선 효과도 확인했다. 주& 8729;야간 및 24시간 동안 가슴쓰림과 산역류 증상이 없는 날에 대한 군별 비율을 확인한 결과, 증상 개선에 대한 두 군 간 통계적으로 유의미한 차이는 확인되지 않았다. 특히 8주차 야간 동안 가슴쓰림과 산역류 증상이 없는 날에 대한 비율은 펙수클루 투여군에서 70.28%, 73.29%로 나타나 에스오메프라졸 투여군 대비 야간 증상 개선 비율이 각각 10.5%, 13.8% 높았다.대웅제약 펙수클루 글로벌 진출 현황 34호 국산신약 펙수클루는 대웅제약이 2022년 출시한 3세대 위식도역류질환 치료제다. 기존 프로톤 펌프 저해제(PPI) 계열 치료제가 지닌 느린 약효 발현과 짧은 반감기, 식전 복용 등 단점을 개선한 게 특징이다.펙수클루는 출시 3년 차인 지난해 연매출 1000억 원을 돌파했다. 이번 인도 출시로 대웅제약은 펙수클루를 한국, 멕시코, 칠레, 에콰도르, 필리핀 등 6개국에서 판매하게 됐다. 이외 19개국에서 품목허가를 신청했고 5개국과 수출 계약을 체결해 총 30개국에 진출한 상태다. 대웅제약은 2027년까지 펙수클루를 전 세계 100개국에 진출시키겠다는 포부다.박성수 대웅제약 대표는 "이번 출시를 통해 펙수클루가 세계 4위 항궤양제 시장인 인도에서 위식도 역류질환 환자들을 위한 획기적인 치료 옵션으로 자리매김할 거라고 확신한다"며 "기존 위식도 역류질환 치료제와 차별화되는 펙수클루의 장점을 바탕으로 2027년까지 100개국 진출하고 2030년 1품 1조 비전을 달성하는 데 더욱 박차를 가하겠다"고 했다.2025-04-07 17:09:19차지현 -
 난치질환 담도암 정복 가능할까...국내제약, 임상 청신호[데일리팜=손형민 기자] 국내외 제약업계의 담도암 표적항암제 후보물질이 후기 임상에서 속속 효과를 입증하며 상용화 가능성에 청신호가 켜졌다. 한독 미국 파트너사 컴퍼스 테라퓨틱스, 에이치엘비 등 국내외 제약업계가 이 분야에 도전장을 내밀었다.컴퍼스 "토베시미그, 글로벌 임상서 1차 평가변수 충족"3일 제약업계에 따르면 미국 컴퍼스는 전이성 또는 재발성 담도암 환자를 대상으로 한 토베시미그 글로벌 임상 2/3상인 COMPANION-002의 탑라인 결과를 발표했다.토베시미그는 국내 기업 에이비엘바이오가 개발한 담도암 신약후보물질로 국내 판권은 한독이, 글로벌 판권은 컴퍼스가 보유하고 있다. 이 신약후보물질은 델타유사리간드4(DLL4)와 혈관내피성장인자(VEGF)를 동시에 표적하는 이중항체로 종양미세환경에서 신생혈관을 형성하는 것으로 알려진다.이번 임상은 전이성 또는 재발성 담도암 성인 환자 168명을 대상으로 토베시미그+파클리탁셀과 파클리탁셀 단독요법의 유효성과 안전성을 평가하는 방식으로 진행됐다.임상 결과, 1차 평가변수로 설정한 객관적반응률(ORR)에서 토베시미그+파클리탁셀은 17.1%로, 파클리탁셀군 5.3% 대비 높았다. 또한, 토베시미그와 파클리탁셀을 병용투여한 환자에서 진행성 질환(PD)은 16.2%로 나타난 반면, 파클리탁셀만 단독투여한 환자에서는 42.1%로 나타났다.안전성 측면에서 이상반응은 이전 연구와 동일하게 나타났다. 임상2상에서 토베시미그+파클리탁셀 병용요법의 3등급 이상 부작용은 호중구감소증(50%), 고혈압(16.7%), 빈혈(12.5%), 혈소판감소증(8.3%) 등이었다. 이 중에는 5등급의 폐렴도 1개 사례가 보고됐다. 환자 중 25%는 혼란 상태, 폐색전증, 혈액 크레아티닌 수치 증가 등으로 치료를 중단한 바 있다.한독은 이번 임상 결과를 토베시미그의 한국 허가를 위한 데이터로 활용할 계획이다. 컴퍼스는 이번 톱라인 결과에 이어, 올해 4분기에 주요 2차 지표를 포함한 COMPANION-002의 추가 데이터를 발표할 계획이다.현재 컴퍼스는 COMPANION-002 외에도 토베시미그를 담도암 환자 대상 1차 치료제로 평가하는 연구자 주도 임상시험을 지원하고 있다.해당 임상은 미국 텍사스 대학교의 MD 앤더슨 암 센터에서 주도하고 있으며, 표준치료요법인 임핀지+항암화학요법에 토베시미그를 추가하는 방식으로 진행되고 있다.리보세라닙, 담도암서도 가능성 타진 담도암은 고형암 중에서도 생존율이 낮고 표적항암제 신약이 부족한 난치성 질환으로 꼽힌다.담도암은 환자 수가 다른 암종 대비 비교적 적지만, 조기 진단이 어렵고 주변 장기로의 빠른 전이와 재발로 인해 5년 상대생존율(2017~2021년)이 28.9%에 불과하다. 담도암 환자 10명 중 7명이 사망하는 것으로 알려지며 국내 담도암 환자의 사망률은 11.6%로 집계된다.담도암 환자의 생존율이 낮은 또 다른 이유는 치료 옵션이 제한적이기 때문이다. 수술이 불가능한 국소 진행형 또는 전이성 담도암에서 1차 치료에 실패한 경우, 2차 치료제로 사용할 치료옵션이 부족한 상황이다.폐암처럼 담관암도 다양한 표적치료제 개발이 가능한 암이었으나 환자 수가 부족해 그간 연구와 투자가 충분하지 않았다. 다만 최근 제약업계의 관심이 높아져 좋은 연구 결과들이 점점 나오고 있는 상황이다.한독 도입신약 '페마자이레'최근에는 한독이 국내 도입한 FGFR2 타깃 표적치료제 ‘페마자이레’와 세르비에의 IDH1 타깃 표적치료제 팁소보가 등장하며 치료 범위를 확대하고 있다. 또 다양한 국내외 제약업계가 이 분야 표적치료제 개발에 도전장을 내밀었다.FGFR 유전적 이상은 암세포의 증식, 생존, 이동뿐만 아니라 종양 혈관 신생 및 약물 내성에 깊이 관여하는 것으로 알려져 있다. IDH1 유전자 변이는 전체 고형암 중 주로 신경교종(glioma)과 담관암에서 발현된다. 담관암 중에서는 간내 담관암에서 주로 IDH1 변이가 보고되는 것으로 알려진다.한독뿐만 아니라 국내 기업 중에선 에이치엘비가 담도암 신약 가능성을 확인 중이다.에이치엘비와 항서제약은 종양 내 신생혈관 형성에 관여하는 혈관내피세포성장인자수용체2(VEGFR2) 억제제 리보세라닙과 면역항암제 캄렐리주맙 병용요법을 통해 간암, 담도암 등 여러 고형암에서 임상적 효능을 평가하고 있다.이번 임상은 진행성 담도암 환자 28명을 대상으로 2021년 1월부터 약 2년 간 진행된 연구로 환자에 따라 리보세라닙 병용요법을 1차 또는 2차 치료제로 나눠 효능을 평가했다.임상 결과, 리보세라닙 병용요법의 전체생존율(OS)은 12.8개월, 무진행생존기간(PFS)은 6.3개월을 확인됐다. 통상 수술이 불가능한 환자의 평균 생존기간인 6~7개월 대비 2배 수준의 생존기간을 확인했다. 특히 1차 치료로 리보세라닙 병용요법을 처방받은 환자의 경우 ORR이 50.0%로 확인됐다.에이치엘비는 추가적으로 진행되는 연구자 주도 임상 데이터를 검토해 향후 파이프라인 확대에 활용하겠다는 계획이다.해외서도 담도암 신약 연구개발 꾸준중국 트랜스테라는 담도암 환자를 대상으로 임상3상 연구를 진행 중이다. 현재 국내를 비롯해 미국, 영국, 중국 등에서 임상이 진행되고 있다.티넨고티닙은 이전에 치료경험이 있는 진행성 FGFR 변이 담도암 환자를 치료하기 위한 차세대 FGFR 억제제다. 트랜스테라에 따르면 다중 키나아제 억제제인 티넨고티닙은 후천적 내성 기전을 우회하는 독특한 FGFR 결합 기전을 특징으로 한다.임상에서 티넨고티닙은 최소 1회 이상 전신 항암화학요법을 받은 이력이 있는 환자에게 효과를 나타냈다.환자들은 FGFR 돌연변이 상태 및 치료 이력에 따라 4개 군으로 분류됐다. ▲A1군(13명): FGFR2 융합을 보유하고 있으며 기존 FGFR 저해제 치료 후 질병이 진행된 환자 ▲A2군(10명): FGFR2 융합을 보유하고 있으며 기존 FGFR 저해제에 반응한 후 재발한 환자 ▲B군(12명): FGFR 비융합 변이를 가진 환자 ▲C군(13명): FGFR 변이가 없는 환자(FGFRwt)로 분류됐다.유효성 평가가 가능한 40명의 환자를 분석한 결과, A1군에서는 9.1%(1명)의 환자가 부분반응(PR)을 보였으며 종양 크기는 31.8% 감소했다. A2군에서는 37.5%(3명)의 환자가 PR을 나타냈으며, 종양 감소율은 각각 40.7%, 47.0%, 54.6%로 확인됐다. B군에서는 3명(33.3%)이 PR을 기록했으며, 종양 감소율은 36.5%, 48.6%, 60.6%였다. 반면, C군에서는 PR이 확인되지 않았다.에자이 역시 최근 FGFR2 억제제인 ‘타스피고’를 일본에서 출시하며 담도암 시장에 도전장을 내밀었다. 타스피고는 임사2상에서 30.2%(90% 신뢰구간: 20.7-41.0)로 나타나, 사전에 설정된 종양 반응 기준(15%)을 통계적으로 유의하게 초과했다.또 미국 재즈파마슈티컬스는 HER2를 타깃하는 표적치료체 ‘지히라’를 글로벌 시장에 출시할 계획이다. 재즈파마는 지난 2022년 미국 바이오회사 자임웍스로부터 자히라 개발 권리를 확보해 임상을 진행해 왔다.이 치료제는 지난해 11월 미국에서 신속승인됐으며 현재 국내를 비롯해 전 세계 시장에 진출을 노리고 있다. 이 치료제는 허가 임상인 ‘HERIZON-BTC-01’ 에서 ORR 52%와 반응지속기간(DOR) 14.9개월을 나타냈다.2025-04-03 06:20:47손형민
난치질환 담도암 정복 가능할까...국내제약, 임상 청신호[데일리팜=손형민 기자] 국내외 제약업계의 담도암 표적항암제 후보물질이 후기 임상에서 속속 효과를 입증하며 상용화 가능성에 청신호가 켜졌다. 한독 미국 파트너사 컴퍼스 테라퓨틱스, 에이치엘비 등 국내외 제약업계가 이 분야에 도전장을 내밀었다.컴퍼스 "토베시미그, 글로벌 임상서 1차 평가변수 충족"3일 제약업계에 따르면 미국 컴퍼스는 전이성 또는 재발성 담도암 환자를 대상으로 한 토베시미그 글로벌 임상 2/3상인 COMPANION-002의 탑라인 결과를 발표했다.토베시미그는 국내 기업 에이비엘바이오가 개발한 담도암 신약후보물질로 국내 판권은 한독이, 글로벌 판권은 컴퍼스가 보유하고 있다. 이 신약후보물질은 델타유사리간드4(DLL4)와 혈관내피성장인자(VEGF)를 동시에 표적하는 이중항체로 종양미세환경에서 신생혈관을 형성하는 것으로 알려진다.이번 임상은 전이성 또는 재발성 담도암 성인 환자 168명을 대상으로 토베시미그+파클리탁셀과 파클리탁셀 단독요법의 유효성과 안전성을 평가하는 방식으로 진행됐다.임상 결과, 1차 평가변수로 설정한 객관적반응률(ORR)에서 토베시미그+파클리탁셀은 17.1%로, 파클리탁셀군 5.3% 대비 높았다. 또한, 토베시미그와 파클리탁셀을 병용투여한 환자에서 진행성 질환(PD)은 16.2%로 나타난 반면, 파클리탁셀만 단독투여한 환자에서는 42.1%로 나타났다.안전성 측면에서 이상반응은 이전 연구와 동일하게 나타났다. 임상2상에서 토베시미그+파클리탁셀 병용요법의 3등급 이상 부작용은 호중구감소증(50%), 고혈압(16.7%), 빈혈(12.5%), 혈소판감소증(8.3%) 등이었다. 이 중에는 5등급의 폐렴도 1개 사례가 보고됐다. 환자 중 25%는 혼란 상태, 폐색전증, 혈액 크레아티닌 수치 증가 등으로 치료를 중단한 바 있다.한독은 이번 임상 결과를 토베시미그의 한국 허가를 위한 데이터로 활용할 계획이다. 컴퍼스는 이번 톱라인 결과에 이어, 올해 4분기에 주요 2차 지표를 포함한 COMPANION-002의 추가 데이터를 발표할 계획이다.현재 컴퍼스는 COMPANION-002 외에도 토베시미그를 담도암 환자 대상 1차 치료제로 평가하는 연구자 주도 임상시험을 지원하고 있다.해당 임상은 미국 텍사스 대학교의 MD 앤더슨 암 센터에서 주도하고 있으며, 표준치료요법인 임핀지+항암화학요법에 토베시미그를 추가하는 방식으로 진행되고 있다.리보세라닙, 담도암서도 가능성 타진 담도암은 고형암 중에서도 생존율이 낮고 표적항암제 신약이 부족한 난치성 질환으로 꼽힌다.담도암은 환자 수가 다른 암종 대비 비교적 적지만, 조기 진단이 어렵고 주변 장기로의 빠른 전이와 재발로 인해 5년 상대생존율(2017~2021년)이 28.9%에 불과하다. 담도암 환자 10명 중 7명이 사망하는 것으로 알려지며 국내 담도암 환자의 사망률은 11.6%로 집계된다.담도암 환자의 생존율이 낮은 또 다른 이유는 치료 옵션이 제한적이기 때문이다. 수술이 불가능한 국소 진행형 또는 전이성 담도암에서 1차 치료에 실패한 경우, 2차 치료제로 사용할 치료옵션이 부족한 상황이다.폐암처럼 담관암도 다양한 표적치료제 개발이 가능한 암이었으나 환자 수가 부족해 그간 연구와 투자가 충분하지 않았다. 다만 최근 제약업계의 관심이 높아져 좋은 연구 결과들이 점점 나오고 있는 상황이다.한독 도입신약 '페마자이레'최근에는 한독이 국내 도입한 FGFR2 타깃 표적치료제 ‘페마자이레’와 세르비에의 IDH1 타깃 표적치료제 팁소보가 등장하며 치료 범위를 확대하고 있다. 또 다양한 국내외 제약업계가 이 분야 표적치료제 개발에 도전장을 내밀었다.FGFR 유전적 이상은 암세포의 증식, 생존, 이동뿐만 아니라 종양 혈관 신생 및 약물 내성에 깊이 관여하는 것으로 알려져 있다. IDH1 유전자 변이는 전체 고형암 중 주로 신경교종(glioma)과 담관암에서 발현된다. 담관암 중에서는 간내 담관암에서 주로 IDH1 변이가 보고되는 것으로 알려진다.한독뿐만 아니라 국내 기업 중에선 에이치엘비가 담도암 신약 가능성을 확인 중이다.에이치엘비와 항서제약은 종양 내 신생혈관 형성에 관여하는 혈관내피세포성장인자수용체2(VEGFR2) 억제제 리보세라닙과 면역항암제 캄렐리주맙 병용요법을 통해 간암, 담도암 등 여러 고형암에서 임상적 효능을 평가하고 있다.이번 임상은 진행성 담도암 환자 28명을 대상으로 2021년 1월부터 약 2년 간 진행된 연구로 환자에 따라 리보세라닙 병용요법을 1차 또는 2차 치료제로 나눠 효능을 평가했다.임상 결과, 리보세라닙 병용요법의 전체생존율(OS)은 12.8개월, 무진행생존기간(PFS)은 6.3개월을 확인됐다. 통상 수술이 불가능한 환자의 평균 생존기간인 6~7개월 대비 2배 수준의 생존기간을 확인했다. 특히 1차 치료로 리보세라닙 병용요법을 처방받은 환자의 경우 ORR이 50.0%로 확인됐다.에이치엘비는 추가적으로 진행되는 연구자 주도 임상 데이터를 검토해 향후 파이프라인 확대에 활용하겠다는 계획이다.해외서도 담도암 신약 연구개발 꾸준중국 트랜스테라는 담도암 환자를 대상으로 임상3상 연구를 진행 중이다. 현재 국내를 비롯해 미국, 영국, 중국 등에서 임상이 진행되고 있다.티넨고티닙은 이전에 치료경험이 있는 진행성 FGFR 변이 담도암 환자를 치료하기 위한 차세대 FGFR 억제제다. 트랜스테라에 따르면 다중 키나아제 억제제인 티넨고티닙은 후천적 내성 기전을 우회하는 독특한 FGFR 결합 기전을 특징으로 한다.임상에서 티넨고티닙은 최소 1회 이상 전신 항암화학요법을 받은 이력이 있는 환자에게 효과를 나타냈다.환자들은 FGFR 돌연변이 상태 및 치료 이력에 따라 4개 군으로 분류됐다. ▲A1군(13명): FGFR2 융합을 보유하고 있으며 기존 FGFR 저해제 치료 후 질병이 진행된 환자 ▲A2군(10명): FGFR2 융합을 보유하고 있으며 기존 FGFR 저해제에 반응한 후 재발한 환자 ▲B군(12명): FGFR 비융합 변이를 가진 환자 ▲C군(13명): FGFR 변이가 없는 환자(FGFRwt)로 분류됐다.유효성 평가가 가능한 40명의 환자를 분석한 결과, A1군에서는 9.1%(1명)의 환자가 부분반응(PR)을 보였으며 종양 크기는 31.8% 감소했다. A2군에서는 37.5%(3명)의 환자가 PR을 나타냈으며, 종양 감소율은 각각 40.7%, 47.0%, 54.6%로 확인됐다. B군에서는 3명(33.3%)이 PR을 기록했으며, 종양 감소율은 36.5%, 48.6%, 60.6%였다. 반면, C군에서는 PR이 확인되지 않았다.에자이 역시 최근 FGFR2 억제제인 ‘타스피고’를 일본에서 출시하며 담도암 시장에 도전장을 내밀었다. 타스피고는 임사2상에서 30.2%(90% 신뢰구간: 20.7-41.0)로 나타나, 사전에 설정된 종양 반응 기준(15%)을 통계적으로 유의하게 초과했다.또 미국 재즈파마슈티컬스는 HER2를 타깃하는 표적치료체 ‘지히라’를 글로벌 시장에 출시할 계획이다. 재즈파마는 지난 2022년 미국 바이오회사 자임웍스로부터 자히라 개발 권리를 확보해 임상을 진행해 왔다.이 치료제는 지난해 11월 미국에서 신속승인됐으며 현재 국내를 비롯해 전 세계 시장에 진출을 노리고 있다. 이 치료제는 허가 임상인 ‘HERIZON-BTC-01’ 에서 ORR 52%와 반응지속기간(DOR) 14.9개월을 나타냈다.2025-04-03 06:20:47손형민 -
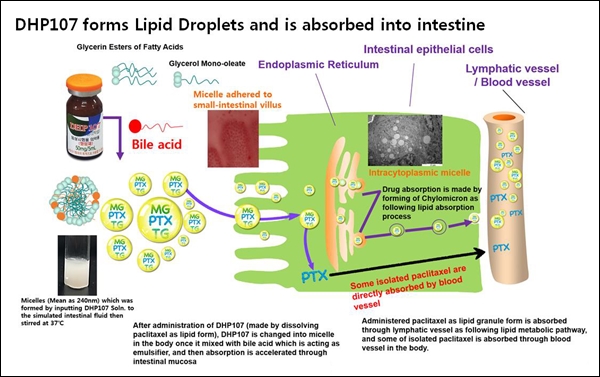 대화제약 리포락셀, 유방암 적응증 유효성 확인대화제약 경구용 항암제 리포락셀(파클리탁셀)의 작용기전 모식도. [데일리팜=노병철 기자] 대화제약 리포락셀이 최근 진행된 임상2·3상을 통해 재발·전이성 유방암에 대한 안전·유효성을 확보했다.이번 임상은 유방암을 적응증으로 재발성 또는 전이성 유방암 치료제로서 주사제 대비 리포락셀액의 유효성 및 안정성을 비교평가하기 위해 진행됐다.임상시험은 총 582명(2상 33명, 3상 549명)의 재발성 또는 전이성 유방암 환자를 대상으로 임상 2상은 국내 12개 실시기관에서 임상 3상은 국내 21개·중국 18개·헝가리 2개·세르비아 7개·불가리아 3개 등 총 51개 기관에서 다국가 임상시험을 진행했다.이번 임상을 통해 파클리탁셀 주사제 대비 PPS(프로토콜을 준수한 대상자, Per Protocol Set)군에서의 1차 유효성 평가변수인 PFS(무진행 생존 기간, Progression-Free Survial)의 중앙값은 리포락셀액에서 10.02개월, 파클리탁셀 주사제는 8.54개월로 확인했다.위험비(Hazard ratio) 95% 신뢰구간(Confidence interval)은 0.869(0.707, 1.068)였으며, 95% 신뢰구간(Confidence interval) 상한값인 1.068이 비열등성 범위인 1.33보다 낮음을 확인해 비열등성을 입증했다. 2차 유효성 평가변수인 OS(전체 생존기간), ORR(객관적 반응률), DCR(질병 통제율), TTF(치료 실패까지의 시간), QoL(삶의질 평가)에서 리포락셀액은 파클리탁셀 주사제에 비해 비열등한 경향을 확인했다.파클리탁셀 주사제 대비 리포락셀액을 비교시 안전성 측면에서 TEAEs(임상시험용 의약품 투약 후 발생한 이상사례, Treatment-Emergent Adverse Event)와 ADRs(약물이상반응, Adverse Drug Reaction)의 발생률은 두 그룹 간에 비슷했다.3등급 이상 TEAEs(임상시험용 의약품 투약 후 발생한 이상사례)와 ADRs(약물이상반응, Adverse Drug Reaction)은 리포락셀액에서 높은 비율로 발생하였으나 용량 연구를 중단을 초래할 발생률은 두 그룹 모두 매우 낮아 내약성이 있고 관리 가능한 안전성을 보였다.대화제약 관계자는 “연구 결과 리포락셀액은 신경병증 말초, 과민반응, 근골격계 및 결합 조직 장애, 주사관련 반응의 발생률이 낮아 임상적으로 관리 가능한 안전성 프로파일을 보였다”며 “리포락셀액은 주사제 대비 더 많은 임상 편의성을 제공하여 환자의 순응도를 높이고 중단 없는 항암 치료를 용이하게 하여 생존율을 향상시킬 수 있을 것으로 기대하고 있다”라고 밝혔다.대화제약은 본 임상결과를 바탕으로 상반기 한국과 중국(Haihe Biopharma가 진행)에 추가 적응증에 대한 품목허가를 신청할 계획이다.2025-02-19 09:40:36노병철
대화제약 리포락셀, 유방암 적응증 유효성 확인대화제약 경구용 항암제 리포락셀(파클리탁셀)의 작용기전 모식도. [데일리팜=노병철 기자] 대화제약 리포락셀이 최근 진행된 임상2·3상을 통해 재발·전이성 유방암에 대한 안전·유효성을 확보했다.이번 임상은 유방암을 적응증으로 재발성 또는 전이성 유방암 치료제로서 주사제 대비 리포락셀액의 유효성 및 안정성을 비교평가하기 위해 진행됐다.임상시험은 총 582명(2상 33명, 3상 549명)의 재발성 또는 전이성 유방암 환자를 대상으로 임상 2상은 국내 12개 실시기관에서 임상 3상은 국내 21개·중국 18개·헝가리 2개·세르비아 7개·불가리아 3개 등 총 51개 기관에서 다국가 임상시험을 진행했다.이번 임상을 통해 파클리탁셀 주사제 대비 PPS(프로토콜을 준수한 대상자, Per Protocol Set)군에서의 1차 유효성 평가변수인 PFS(무진행 생존 기간, Progression-Free Survial)의 중앙값은 리포락셀액에서 10.02개월, 파클리탁셀 주사제는 8.54개월로 확인했다.위험비(Hazard ratio) 95% 신뢰구간(Confidence interval)은 0.869(0.707, 1.068)였으며, 95% 신뢰구간(Confidence interval) 상한값인 1.068이 비열등성 범위인 1.33보다 낮음을 확인해 비열등성을 입증했다. 2차 유효성 평가변수인 OS(전체 생존기간), ORR(객관적 반응률), DCR(질병 통제율), TTF(치료 실패까지의 시간), QoL(삶의질 평가)에서 리포락셀액은 파클리탁셀 주사제에 비해 비열등한 경향을 확인했다.파클리탁셀 주사제 대비 리포락셀액을 비교시 안전성 측면에서 TEAEs(임상시험용 의약품 투약 후 발생한 이상사례, Treatment-Emergent Adverse Event)와 ADRs(약물이상반응, Adverse Drug Reaction)의 발생률은 두 그룹 간에 비슷했다.3등급 이상 TEAEs(임상시험용 의약품 투약 후 발생한 이상사례)와 ADRs(약물이상반응, Adverse Drug Reaction)은 리포락셀액에서 높은 비율로 발생하였으나 용량 연구를 중단을 초래할 발생률은 두 그룹 모두 매우 낮아 내약성이 있고 관리 가능한 안전성을 보였다.대화제약 관계자는 “연구 결과 리포락셀액은 신경병증 말초, 과민반응, 근골격계 및 결합 조직 장애, 주사관련 반응의 발생률이 낮아 임상적으로 관리 가능한 안전성 프로파일을 보였다”며 “리포락셀액은 주사제 대비 더 많은 임상 편의성을 제공하여 환자의 순응도를 높이고 중단 없는 항암 치료를 용이하게 하여 생존율을 향상시킬 수 있을 것으로 기대하고 있다”라고 밝혔다.대화제약은 본 임상결과를 바탕으로 상반기 한국과 중국(Haihe Biopharma가 진행)에 추가 적응증에 대한 품목허가를 신청할 계획이다.2025-02-19 09:40:36노병철 -
 SGLT2 저해제와 둘라글루타이드간 치매 예방효과 '차이 없어'[데일리팜=황병우 기자] SGLT2 저해제와 GLP-1 RA 등 제2형 당뇨병 치료제의 치매예방 효과에 관한 관심이 높아지고 있는 가운데 국내에서 두 치료제 간 상대적인 예방효과를 규명한 연구가 발표됐다.(왼쪽부터)신주영 교수, 홍빈 박사과정, 배성호 박사, 고화연 박사과정. 성균관대 약학대학 신주영 교수 연구팀(1저자 홍빈 박사과정, 공동저자 배성호 박사, 공동저자 고화연 박사과정)은 국내 보건의료 빅데이터를 활용하여 제2형 당뇨병 환자에서 SGLT2 저해제와 둘라글루타이드 치매 발생 예방에 대한 상대적인 예방효과를 규명한 연구 결과를 발표했다고 3일 밝혔다.치매는 인지 기능 저하와 기억 상실을 특징으로 하는 쇠약한 신경퇴행성 질환이다. 제2형 당뇨병은 치매의 중요한 위험 요인으로, 제2형 당뇨병 환자는 그렇지 않은 사람들에 비해 치매 발병 위험이 상당히 크다.제2형 당뇨병의 유병률이 증가하고 치매의 부담이 커지고 있어, 제2형 당뇨병 환자에서 치매 발병을 예방하거나 지연시키기 위한 효과적인 전략을 찾는 것이 시급한 실정이다.특히, 최근 SGLT2 저해제와 글루카곤 유사 펩티드-1 수용체 작용제(GLP-1 RA)라는 2가지 종류의 당뇨병 치료제가 혈당 강하 효과 외에도 심혈관계 및 신장 기능에 대한 탁월한 효과로 인해 많은 주목을 받고 있다.또 최근의 연구 결과에 따르면 SGLT2 저해제와 GLP-1 RA는 신경 보호 효과도 있을 수 있다고 밝혀졌다.연구팀에 따르면 이 두 약물 계열이 인지 기능이나 치매 위험에 미치는 영향을 비교한 연구는 소규모의 무작위 임상 시험으로, 36명의 참가자로 구성된 작은 표본 크기와 16주라는 비교적 짧은 추적 기간으로 인해 제한적이었다.이와 함께 치매 발병 위험이 높은 정신 질환 병력이 있는 환자들이 제외되었기 때문에, 실제 임상 환경에서 이 약물을 복용하는 환자들에게서 치매 위험을 정확히 반영하지 못할 가능성이 있다.따라서 제2형 당뇨병 환자에서 SGLT2 저해제와 GLP-1 RA가 인지 기능과 치매 위험에 미치는 영향은 아직 명확하게 밝혀지지 않았다.성균관대 약학과 신주영 교수 연구팀은 target trial emulation을 사용하여 실제 의료현장의 제2형 당뇨병 환자를 대상으로 SGLT2 저해제와 둘라글루타이드(국내에서 가장 많이 사용되는 GLP-1 RA)의 치매 발생을 규명하는 연구를 진행한 결과 SGLT2 억제제와 둘라글루타이드 사이의 치매 위험에는 큰 차이가 없는 것으로 확인하였다.공동연구팀은 2016년 5월 1일부터 2020년 12월 31일까지 SGLT2 저해제 또는 둘라글루타이드를 처음 처방받은 만 60세 이상의 제2형 당뇨병 환자를 대상으로 하였으며, 투여 개시 일자 이전 1년 동안의 기록으로 연령, 성별, 당뇨 중증도, 병용 약물, 동반상병, 건강검진 결과, 치매의 위험 요인을 고려하여 성향 점수를 산출하고 매칭해 최종 코호트를 구축했다.성향점수 매칭 코호트 내에서, SGLT2 저해제를 처방받은 2,076명 환자와 둘라글루타이드를 처방받은 1038명 환자가 포함되었다. 4.4년(중앙값)의 추적 기간 동안, SGLT2 저해제 그룹에서 69명, 둘라글루타이드 그룹에서 43명이 치매를 발생했다.또 SGLT2 저해제 그룹과 둘라글루타이드 그룹을 비교했을 때, 5년간의 치매 위험 차이는 0.91%(95% 신뢰구간, -2.45% - 0.63%)이었고, 위험비는 0.81(95% 신뢰구간, 0.56 & 8211; 1.16)로 확인됐다.신주영 교수는 "현재 가이드라인에서 치매 예방을 목표로 한 특정 약물 치료를 지지할 만한 결정적인 증거가 충분하지 않은 상황에서, 본 연구는 두 가지 새로운 당뇨병 치료제인 SGLT2 저해제와 GLP-1 RA의 치매 위험을 직접적으로 비교해 근거를 생성했다는 점에서 큰 의의가 있는 연구라고 생각한다"고 밝혔다.이어 연구진은 "SGLT2 저해제와 둘라글루타이드간의 치매 위험에는 큰 차이가 없는 것으로 나타났다. 그러나 이러한 결과가 최신 GLP-1 RA에 일반화될 수 있는지는 불확실하다"라며 "당뇨병 유병 기간과 헤모글로빈 A1c 수치를 포함한 잔여 교란요인들을 보다 잘 보정한 추가 연구가 필요하다"라고 말했다.한편, 성균관대 신주영 교수 연구팀의 이번 연구는 용인세브란스병원 정신건강의학과 김우정 교수, 서울대학교병원 내분비내과 조영민 교수 연구진과 함께 공동연구를 수행하였다. 본 연구는 국민건강보험공단의 맞춤형 자료를 활용하였으며, 식품의약품안전처의 지원으로 수행되었다.연구결과는 의학 분야 저명 국제 학술지인 Annals of Internal Medicine (IF: 19.6, JCR Ranking 상위 2.3%)에 8월 27일 온라인 게재되었다.2024-09-05 09:31:29황병우
SGLT2 저해제와 둘라글루타이드간 치매 예방효과 '차이 없어'[데일리팜=황병우 기자] SGLT2 저해제와 GLP-1 RA 등 제2형 당뇨병 치료제의 치매예방 효과에 관한 관심이 높아지고 있는 가운데 국내에서 두 치료제 간 상대적인 예방효과를 규명한 연구가 발표됐다.(왼쪽부터)신주영 교수, 홍빈 박사과정, 배성호 박사, 고화연 박사과정. 성균관대 약학대학 신주영 교수 연구팀(1저자 홍빈 박사과정, 공동저자 배성호 박사, 공동저자 고화연 박사과정)은 국내 보건의료 빅데이터를 활용하여 제2형 당뇨병 환자에서 SGLT2 저해제와 둘라글루타이드 치매 발생 예방에 대한 상대적인 예방효과를 규명한 연구 결과를 발표했다고 3일 밝혔다.치매는 인지 기능 저하와 기억 상실을 특징으로 하는 쇠약한 신경퇴행성 질환이다. 제2형 당뇨병은 치매의 중요한 위험 요인으로, 제2형 당뇨병 환자는 그렇지 않은 사람들에 비해 치매 발병 위험이 상당히 크다.제2형 당뇨병의 유병률이 증가하고 치매의 부담이 커지고 있어, 제2형 당뇨병 환자에서 치매 발병을 예방하거나 지연시키기 위한 효과적인 전략을 찾는 것이 시급한 실정이다.특히, 최근 SGLT2 저해제와 글루카곤 유사 펩티드-1 수용체 작용제(GLP-1 RA)라는 2가지 종류의 당뇨병 치료제가 혈당 강하 효과 외에도 심혈관계 및 신장 기능에 대한 탁월한 효과로 인해 많은 주목을 받고 있다.또 최근의 연구 결과에 따르면 SGLT2 저해제와 GLP-1 RA는 신경 보호 효과도 있을 수 있다고 밝혀졌다.연구팀에 따르면 이 두 약물 계열이 인지 기능이나 치매 위험에 미치는 영향을 비교한 연구는 소규모의 무작위 임상 시험으로, 36명의 참가자로 구성된 작은 표본 크기와 16주라는 비교적 짧은 추적 기간으로 인해 제한적이었다.이와 함께 치매 발병 위험이 높은 정신 질환 병력이 있는 환자들이 제외되었기 때문에, 실제 임상 환경에서 이 약물을 복용하는 환자들에게서 치매 위험을 정확히 반영하지 못할 가능성이 있다.따라서 제2형 당뇨병 환자에서 SGLT2 저해제와 GLP-1 RA가 인지 기능과 치매 위험에 미치는 영향은 아직 명확하게 밝혀지지 않았다.성균관대 약학과 신주영 교수 연구팀은 target trial emulation을 사용하여 실제 의료현장의 제2형 당뇨병 환자를 대상으로 SGLT2 저해제와 둘라글루타이드(국내에서 가장 많이 사용되는 GLP-1 RA)의 치매 발생을 규명하는 연구를 진행한 결과 SGLT2 억제제와 둘라글루타이드 사이의 치매 위험에는 큰 차이가 없는 것으로 확인하였다.공동연구팀은 2016년 5월 1일부터 2020년 12월 31일까지 SGLT2 저해제 또는 둘라글루타이드를 처음 처방받은 만 60세 이상의 제2형 당뇨병 환자를 대상으로 하였으며, 투여 개시 일자 이전 1년 동안의 기록으로 연령, 성별, 당뇨 중증도, 병용 약물, 동반상병, 건강검진 결과, 치매의 위험 요인을 고려하여 성향 점수를 산출하고 매칭해 최종 코호트를 구축했다.성향점수 매칭 코호트 내에서, SGLT2 저해제를 처방받은 2,076명 환자와 둘라글루타이드를 처방받은 1038명 환자가 포함되었다. 4.4년(중앙값)의 추적 기간 동안, SGLT2 저해제 그룹에서 69명, 둘라글루타이드 그룹에서 43명이 치매를 발생했다.또 SGLT2 저해제 그룹과 둘라글루타이드 그룹을 비교했을 때, 5년간의 치매 위험 차이는 0.91%(95% 신뢰구간, -2.45% - 0.63%)이었고, 위험비는 0.81(95% 신뢰구간, 0.56 & 8211; 1.16)로 확인됐다.신주영 교수는 "현재 가이드라인에서 치매 예방을 목표로 한 특정 약물 치료를 지지할 만한 결정적인 증거가 충분하지 않은 상황에서, 본 연구는 두 가지 새로운 당뇨병 치료제인 SGLT2 저해제와 GLP-1 RA의 치매 위험을 직접적으로 비교해 근거를 생성했다는 점에서 큰 의의가 있는 연구라고 생각한다"고 밝혔다.이어 연구진은 "SGLT2 저해제와 둘라글루타이드간의 치매 위험에는 큰 차이가 없는 것으로 나타났다. 그러나 이러한 결과가 최신 GLP-1 RA에 일반화될 수 있는지는 불확실하다"라며 "당뇨병 유병 기간과 헤모글로빈 A1c 수치를 포함한 잔여 교란요인들을 보다 잘 보정한 추가 연구가 필요하다"라고 말했다.한편, 성균관대 신주영 교수 연구팀의 이번 연구는 용인세브란스병원 정신건강의학과 김우정 교수, 서울대학교병원 내분비내과 조영민 교수 연구진과 함께 공동연구를 수행하였다. 본 연구는 국민건강보험공단의 맞춤형 자료를 활용하였으며, 식품의약품안전처의 지원으로 수행되었다.연구결과는 의학 분야 저명 국제 학술지인 Annals of Internal Medicine (IF: 19.6, JCR Ranking 상위 2.3%)에 8월 27일 온라인 게재되었다.2024-09-05 09:31:29황병우
오늘의 TOP 10
- 1콜린알포 점유율 회복 '꿈틀'...급여축소 부담 희석되나
- 2집으로 찾아가는 동네약사 서비스 도입...약사 91명 투입
- 3"어린이 해열제, 복약지도 이것만은 꼭"
- 4대형마트 내 창고형약국, 유통발전법으로 제어 가능할까
- 5약사채용 1위 팜리쿠르트, 약국대상 무료공고 오픈
- 6눈=루테인? 현대인의 안정피로에는 아스타잔틴
- 7[기자의 눈] 플랫폼 도매금지법, 복지부 압박 말아야
- 8시총 1조 안착했지만…리브스메드, 혹독한 코스닥 데뷔전
- 9올해 의약품 특허 등재 10% 증가...다국적사↑· 국내사↓
- 10의대증원 논의 시동..의협 "의사인력 예측 제대로 하라"
-
순위상품명횟수
-
1타이레놀정500mg(10정)30,426
-
2판콜에스내복액16,732
-
3텐텐츄정(10정)13,671
-
4까스활명수큐액12,867
-
5판피린큐액12,851















![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[위고비] 직거래 최저가](https://cdn.platpharm.co.kr/2025/12/2512020211090000013.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
