⑥ PDE3/4 저해제 '오투베어', 치료 옵션 다양성 확대
- 최병철 박사
- 2025-06-27 06:00:46
-
가
- 가
- 가
- 가
- 가
- 가
- 최병철 박사의 노벨드럭 인사이트
- 미FDA, 지난해 6월 COPD 환자 유지요법제로 승인
- 복잡한 손-호흡 조정 없이 표준 제트 네블라이저로 흡입 가능
- PR
- 잘 나가는 약국은 매달 보는 신제품 정보 ‘팜노트’
- 팜스타클럽

6편: 최초의 흡입형 PDE3/PDE4 이중 억제 COPD 치료제, 오투베어(Esifentrine)
오투베어(Ohtuvayre& 9415;, OH-too-vare 성분명 엔시펜트린 흡입 현탁액, Esifentrine& 9415;, Verona Pharma)는 최초의 흡입용 PDE3/PDE4 효소 선택적 이중 억제제로서, 2024년 6월 미국 FDA에서 '성인 만성폐쇄성폐질환(chronic obstructive pulmonary disease, COPD) 환자의 유지요법제'에 승인되었으며, 유럽에서는 아직 승인되지 않았다. 현재 이 약제와 유사한 PDE4 억제제인 '닥사스(roflumilast)'는 '중증 COPD 환자의 급성 악화 빈도를 감소'에 승인된 약제로 미국 FDA 및 국내에서 소개되어 있다.
이 약제는 기도와 폐 실질의 염증세포에서 cAMP 분해 효소인 PDE3 및 PDE4 효소를 선택적으로 억제함으로써, 기관지확장과 비스테로이드성 항염증 효과를 하나로 결합하여 높은 흡기 유속이나 복잡한 손-호흡 조정 없이 표준 제트 네블라이저를 통해 폐에 약물을 직접 전달되도록 설계되었다.
이 cAMP 경로는 COPD의 병태 생리를 조절하는 내재적 항염증 기전으로 중요하게 작용하며, 이를 조절하는 약물학적 접근은 기존의 기관지 확장제나 흡입 스테로이드 기반 치료를 보완할 수 있는 새로운 치료 전략으로 자리매김하고 있다.
오투베어의 미국 FDA 승인은 미국호흡기중환자 의학저널(American Journal of Respiratory and Critical Care Medicine)에 게재된 임상 3상 시험 ENHANCE의 결과를 포함한 광범위한 데이터를 기반으로 이뤄졌다.
ENHANCE 임상시험에서 오투바이어는 단독요법으로 투여하거나 다른 유지요법과 함께 사용했을 때 폐 기능 개선을 포함한 임상적 이점을 제공한 것으로 입증되었다. 이는 중등도에서 중증의 COPD를 가지고 있는 광범위한 그룹에서 내약성이 우수하였다.
오투바이어는 COPD 외에도 비-낭성섬유증 기관지확장증, 낭성섬유증, 천식, 기타 호흡기질환에 대한 치료제로 평가되고 있다. 또한 오투바이어와 지속성 항콜린제(LAMA)인 glycopyrrolate의 고정용량 복합제를 COPD 유지요법으로 개발 중이다.
만성폐쇄성폐질환(Chronic obstructive pulmonary disease, COPD)은 어떤 질환인가? COPD는 기류 제한이 지속적으로 나타나는 진행성 호흡기 질환으로, 기도 및 폐 실질의 만성 염증과 그에 따른 폐기능 저하가 주요 병리학적 특징이다. 임상적으로는 호흡곤란, 만성 기침, 객담 등 다양한 증상이 발현되며, 반복적인 급성 악화는 삶의 질 저하뿐 아니라 사망률 증가와도 밀접하게 연관되어 있다. 전 세계적으로 COPD는 주요 사망 원인 중 하나로 보고되고 있으며, 고령화와 흡연율 증가에 따라 그 유병률은 지속적으로 상승하고 있다.
COPD의 병태생리에는 대식세포(macrophages), 호중구(neutrophils), CD8+ T 림프구(cytotoxic T cells) 등 선천 및 후천 면역세포의 활성화가 중심적인 역할을 하며, 이들 면역세포는 다수의 염증 촉진성 사이토카인(IL-8, TNF-α 등), 프로테아제(matrix metalloproteinases), 그리고 활성산소종(reactive oxygen species)을 과도하게 분비한다. 이러한 염증 반응은 기도 리모델링, 점액 과분비, 폐포 구조의 파괴 및 폐 실질의 손상 등 병리적 변화를 유도하여 기류 제한을 지속시키는 주요 기전으로 작용한다.
이러한 만성 염증 반응을 조절하기 위한 내재적 조절 기전 중 하나로 주목받는 것이 cyclic adenosine monophosphate(cAMP) 신호 전달 경로이다. cAMP는 adenylyl cyclase에 의해 생성되는 대표적인 이차 전령(second messenger)으로, 세포 내에서 protein kinase A(PKA) 및 Epac(Exchange Protein directly Activated by cAMP) 등의 하위 효과기를 통해 다양한 생리학적 반응을 매개한다.
구체적으로, cAMP는 염증성 유전자 발현 억제, 항산화 반응 촉진, 섬모 운동 촉진, 점액 분비 감소 및 기관지 평활근의 이완 등을 유도함으로써 COPD 병태생리의 여러 측면을 동시에 조절할 수 있는 기능을 한다.
그러나 COPD 환자에서는 염증세포 내에서 phosphodiesterase-4(PDE4)의 과발현으로 인해 cAMP가 병태적으로 분해되고, 그 농도가 비정상적으로 낮아지는 현상이 관찰된다. 이러한 기전은 항염 및 기관지 보호 효과를 저해하며, 결과적으로 만성 염증을 악화시키는 데 기여한다.
Cyclic nucleotides(고리형 뉴클레오타이드)란 무엇인가? Cyclic nucleotides는 세포 내 신호전달 경로에서 이차 전령으로 작용하는 분자군으로, 다양한 생리학적 자극에 대한 세포 반응을 매개하는 데 중심적인 역할을 수행한다. 이들은 주로 ATP(adenosine triphosphate) 또는 GTP(guanosine triphosphate)로부터 유도되어 생성되며, 대표적인 형태로 cAMP(cyclic adenosine monophosphate)와 cGMP(cyclic guanosine monophosphate)가 있다.
cAMP는 adenylyl cyclase(AC)의 촉매 작용에 의해 ATP로부터 생성되며, 이는 G 단백질 연결 수용체(G protein-coupled receptor, GPCR)의 활성화에 의해 유도된다. 이는반면, cGMP는 guanylyl cyclase(GC)에 의해 GTP로부터 유도되며, 이는 나트륨이뇨펩타이드(natriuretic peptides) 또는 산화질소(nitric oxide, NO)와 같은 세포외 신호에 의해 활성화된다. 이 두 경로는 상이한 생리적 자극과 수용체를 통해 선택적으로 작용하면서 세포 특이적 반응을 조절한다(Figure 1).
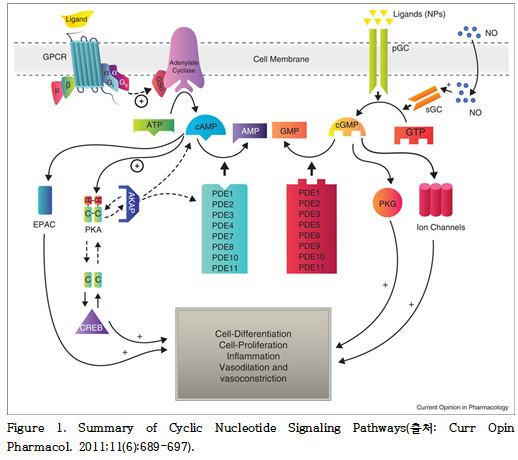
생성된 cAMP는 주로 PKA와 EPAC(exchange protein directly activated by cAMP, cAMP에 의해 직접 활성화되는 교환 단백질)을 통해 세포 기능을 조절한다. PKA는 대사 조절, 세포 분화, 증식, 생존 등 광범위한 생물학적 과정에 관여하며, EPAC은 integrin 매개 세포 부착, 세포 간 접합 형성, 분비(exocytosis), 인슐린 분비 등 PKA-비의존성 경로를 통해 다양한 세포 기능을 조절한다.
특히, 세포 내 cAMP 농도가 상승하면 cAMP-의존성 PKA가 활성화된다. PKA는 두 개의 촉매 서브유닛(C)과 두 개의 조절 서브유닛(R)으로 이루어진 이종사량체(heterotetramer)로 구성되며, 평상시에는 비활성 상태로 존재한다. 그러다 cAMP가 R 서브유닛에 결합하면 촉매 서브유닛이 유리되어 다양한 표적 단백질을 인산화한다. 이 중 대표적인 인산화 표적은 CREB(cAMP response element binding protein)으로, 이는 대사 조절 및 세포 증식에 관여하는 유전자 발현을 조절하는 전사 인자이다.
반면, 생성된 cGMP는 주로 PKG를 활성화시키며, 이는 세포 내 여러 표적 단백질을 인산화하여 평활근 수축 조절, 세포자멸사, 염증 반응, 시각 신호전달, 혈소판 응집 등 생리적 반응을 유도한다.
이러한 cyclic nucleotide의 생물학적 활성을 종료시키는 주요 기전은 phosphodiesterase (PDE)에 의해 수행된다. PDE는 cAMP 및 cGMP를 각각 5’-AMP 또는 5’-GMP의 비고리형 형태로 분해함으로써 이차 전령 신호를 효과적으로 불활성화시킨다.
cAMP 신호전달 경로는 어떤 역할을 하는가? cAMP는 1958년 Sutherland와 Rall에 의해 처음 발견된 이후, cAMP는 호르몬, 신경전달물질, 면역조절 인자 등 외부 자극에 의해 활성화되는 AC(adenyl cyclase)에 의해 ATP로부터 생성되는 고리형 뉴클레오타이드로 정의되었다.
세포는 외부 환경으로부터의 자극에 신속하고 정밀하게 반응하기 위해 다양한 신호전달 시스템을 갖추고 있으며, 이에는 cAMP를 생성하는 AC가 존재한다. AC는 세포막에 존재하는 효소로, ATP를 cAMP로 전환하는 반응을 촉매하며, 이 과정은 GPCR의 활성화에 의해 주로 조절된다.
GPCR은 세포막을 7회 통과하는 구조의 수용체로, 외부의 호르몬, 신경전달물질, 생리활성 분자 등의 리간드를 인식하여 이질삼합체 G 단백질(heterotrimeric G protein)을 활성화시킨다. 이때 GPCR은 Gs 단백과 결합하여 AC를 활성화하고, 이를 통해 세포 내 cAMP 생성을 유도한다. 반면 Gi 단백을 통해서는 AC 활성을 억제하여 cAMP 생성을 저해한다. 기도 조직에서 cAMP 농도의 증가는 평활근 이완과 염증 반응 억제를 유도하여, 천식을 포함한 폐쇄성 기도 질환의 병태생리 조절에 기여하는 것으로 알려져 있다.
아울러, PKA는 세포 내 Ca²& 8314; 농도의 감소, Ca²& 8314;에 대한 민감도 저하, MLC 비의존 경로 조절 등 다양한 기전을 통해 기관지 확장 효과를 나타낸다. 또한, cAMP는 섬모 운동(ciliary motility)을 촉진하여 점액섬모 청소(mucociliary clearance)를 향상시키며, 이는 기도 내 분비물 제거와 염증 완화에 기여한다.
이러한 이중 조절 메커니즘은 세포가 자극의 종류와 강도에 따라 cAMP 농도를 정밀하게 조절할 수 있게 하며, 하위 효과기인 PKA, EPAC 등을 통해 궁극적인 생리학적 반응으로 이어진다.
cAMP 신호전달 경로의 특이성 및 세포 내 농도는 PDE에 의해 조절되며, PDE는 cAMP를 5’-AMP로 분해하여 신호를 종료시킨다. 특히 PDE4, PDE7, PDE8은 cAMP를 선택적으로 분해하는 isoform으로, 면역세포와 염증세포에 풍부하게 발현되어 있어 염증성 질환에서 중요한 조절 인자로 작용한다. 이에 따라 PDE4 억제제인 닥사스(roflumilast)는 cAMP 농도를 증가시켜 항염증 작용을 유도한다.
따라서, cAMP 신호전달 경로는 외부 자극에 대한 세포의 신속하고 정밀한 반응을 유도하는 고차원적인 조절 기전이며, 그 구성 요소와 하위 경로를 표적으로 한 약리학적 개입은 염증성, 대사성, 심혈관성 질환을 포함한 다양한 병태에서 치료적 가능성을 제시한다.
최근 연구들은 cAMP 의존성 신호전달 경로의 복잡성과 생물학적 중요성을 더욱 강조하고 있으며, 특히 기도 평활근(airway smooth muscle, ASM) 세포에서 β₂-아드레날린 수용체(β₂-adrenergic receptor, β₂AR)와 같은 GPCR의 활성이 이러한 경로를 중심으로 작동함이 밝혀졌다.
Phosphodiesterase(PDE)는 무엇인가? PDE는 세포 내에서 cyclic nucleotide(cAMP 및 cGMP)의 3’,5’-고리형 인산 결합을 가수분해하여 각각 AMP(adenosine monophosphate) 또는 GTP(guanosine momophosphate)로 전환함으로써 이차 전령의 신호를 종료시키는 역할을 수행한다. PDE는 신호 전달의 시간적 지속성과 공간적 국소화, 그리고 신호의 강도 조절에 주요 생화학적 조절자(gatekeeper)로 기능하며, 이에 따라 다양한 생리 및 병리 현상의 미세 조절자로 작용한다.
현재까지 확인된 PDE는 총 11개 계열(PDE1& 8211;PDE11)로 구성되며, 이들은 아미노산 서열, 기질 특이성, 약물 감수성, 조절 메커니즘 등의 차이에 따라 구분된다. 각 아형(family)은 서로 다른 조직 특이성 및 세포 내 소분획(localization)을 보이며, 동일한 기질(cAMP 또는 cGMP)에 작용하더라도 그 기능적 결과는 상이할 수 있다. 예를 들어, PDE4, PDE7, PDE8은 cAMP 특이적, PDE5, PDE6, PDE9는 cGMP 특이적, PDE1, PDE2, PDE3, PDE10, PDE11은 양쪽 기질 모두에 작용할 수 있다(Table 1).
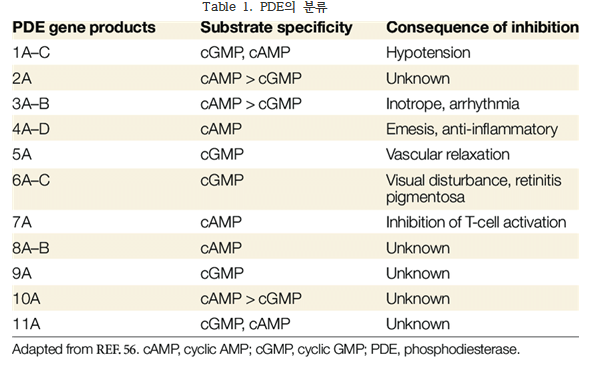
PDE의 활성 이상은 만성 염증성 질환, 심혈관 질환, 신경정신질환, 악성종양 등 다양한 질환의 병태생리와 밀접한 관련이 있으며, 특히 PDE3와 PDE4는 COPD와 같은 염증성 폐질환에서 병태생리학적 역할을 한다 .
PDE3는 상대적으로 높은 cAMP 친화도를 가지며, PDE3A와 PDE3B의 두 아형으로 구분된다. PDE3A는 폐 상피세포, 혈관 내피세포, 기도 평활근세포(airway smooth muscle, ASM), 염증세포 등에서 발현되며, 특히 혈관 평활근세포에서 주요하게 존재하며 평활근 긴장도 조절에 관여한다. 반면, PDE3B는 지방세포, 간세포, 정자세포 등 대사 활성이 높은 조직뿐만 아니라 T세포 및 대식세포에서도 발현되어, 염증 반응 조절 및 대사 경로에 영향을 미친다.
PDE4는 네 가지 유전자(PDE4A& 8211;D)와 다양한 스플라이싱 변이체로 구성되며, 호흡기계 조직을 포함한 다양한 기관에 광범위하게 분포한다. 특히 PDE4D는 인간 기도 평활근세포에서 cAMP 분해를 조절하는 주요 효소로 작용하며, PDE4 전체는 백혈구, 대식세포, 호중구 등 염증세포뿐 아니라 기도 상피세포 및 폐 신경계에도 발현되어 염증 반응의 조절자로 기능한다.
임상 및 전임상 연구에 따르면, COPD 환자, 특히 흡연자에서 PDE4 발현이 유의하게 증가되어 있음이 보고되었으며, PDE4 억제를 통해 cAMP 농도를 증가시키는 것은 염증 촉진성 사이토카인의 발현 감소, 염증세포의 조직 내 침윤 억제 등 광범위한 항염증 효과를 유도하는 것으로 나타났다. 이러한 기전을 기반으로 PDE4 억제제 닥사스(roflumilast)는 ‘기관지확장제의 부가요법제로서, 증상악화 병력이 있고, 만성기관지염을 수반한 중증의 만성폐쇄성폐질환의 유지요법제’로 승인되어 있다.
COPD에는 어떤 약제들을 사용하는가? COPD에 대한 약물 치료의 목적은 증상의 완화, 급성 악화의 예방, 신체활동 능력 향상 및 장기적인 예후 개선에 있다. 이에는 주로 흡입제에 기반하며, 기관지 확장제가 치료의 핵심이다.
기관지확장제는 호흡기 질환에서 폐쇄된 기도를 확장시켜 기류를 개선하는 약제로, 천식과 COPD와 같은 기도 폐쇄성 질환에 사용된다. 이러한 약제는 기관지 평활근(bronchial smooth muscle)의 이완을 유도하여 기도 저항을 감소시키며, 환자의 증상을 완화하고 폐기능을 향상시키는 데 기여한다.
기관지확장제는 작용 기전에 따라 크게 β2-아드레날린 수용체 작용제(β2-agonists), 항콜린제(Anticholinergics) 또는 무스카린 수용체 길항제(Muscarinic antagonists), 메틸잔틴계(Methylxanthines)가 있다.
아울러 약물의 효과 및 부작용 등을 고려하여 흡입제를 주로 사용하며, 흡입기 종류는 크게 건조분말흡입기(dry power inhaler, DPI), 정량흡입기(metered dose inhaler, MDI)로 나뉘고, 다시 MDI는 가압 정량흡입기(pressurized metered dose inhaler, pMDI)와 연무형 흡입기(soft mist inhaler, SMI)로 나뉜다.
pMDI는 다시 호흡 작동식 흡입기(breath-operated inhaler, BOI or breath-actuated inhale, BAI)와 비호흡 작동식 호흡기(Non-BOI)로 나뉘는데 호흡 작동식 흡입기는 아직 국내에 없다. 또한 분무기(nebulizer, 네불라이저)도 흡입제 치료에 속한다. 1) 베타-2 작용제(β2-agonists) β2-작용제는 기관지 평활근 세포에 발현된 β2-아드레날린 수용체에 선택적으로 결합하여 Gs 단백질을 통한 adenylyl cyclase 활성화, 이어지는 cAMP 농도 증가 및 PKA 활성화를 유도함으로써, 평활근 세포 내 칼슘 농도를 낮추고 근수축 관련 단백질들의 기능을 억제하여 기관지 확장을 유발한다. 또한 섬모운동 촉진 및 혈관 투과성 감소 등의 부수적 효과를 통해 기도 청소 기능 개선에도 기여할 수 있다.
임상적으로 β2-작용제는 작용 시간에 따라 단시간 작용제(short-acting β2-agonists, SABA)와 장시간 작용제(long-acting β2-agonists, LABA)로 구분된다.
SABA는 증상 완화를 위한 구제 치료(reliever therapy)로 사용되며, 대표적으로 살부타몰(Salbutamol)과 테르부탈린(Terbutaline)이 있다. SABA의 사용은 FEV1의 호전과 증상을 개선시킬 수 있다. SABA는 4-6시간 지속되고, LABA는 12시간 이상 지속되며, 규칙적인 LABA 사용을 하는 환자에서도 필요시 SABA 사용은 증상 완화에 도움이 될 수 있다.
반면, LABA는 하루 12시간 이상 지속되는 작용시간을 가지며 천식의 유지 치료(controller therapy) 혹은 COPD의 증상 조절을 위한 병용 요법에 사용되며, 대표적으로 살메테롤(Salmeterol)과 포르모테롤(Formoterol)이 있다. 이들 약제는 폐기능과 삶의 질을 개선시키고 호흡곤란과 급성 악화와 입원의 빈도를 감소시키지만, 사망률이나 폐기능 감소 속도에는 영향을 주지 못한다.
이 외에도 24시간 작용 지속 시간을 가진 초장시간 작용제(ultra-LABA)인 인다카테롤(Indacaterol), 올로다테롤(Olodaterol) 등이 COPD 치료에 활용되고 있다. 이들 약제는 호흡곤란과 악화위험을 감소시키고 삶의 질을 개선시킨다.
이러한 β2-작용제는 그 효과의 빠른 발현과 우수한 증상 완화 효과로 인해 널리 사용되고 있으나, 단독 사용 시 특히 천식 환자에서 기도 염증을 충분히 조절하지 못하며 오히려 기전적 내성(tachyphylaxis)이나 염증 악화의 위험을 높일 수 있다는 우려도 제기되어 왔다. 이에 따라 ICS(흡입 스테로이드)와의 병용이 원칙이며, 한 기기 내 고정용량 복합제(FDC) 형태로 투여하는 방법이 표준화되고 있다.
2) 항콜린제((Anticholinergics) 항콜린제는 기관지 평활근, 점액선, 혈관 등에 존재하는 무스카린 수용체(muscarinic receptor) 중 특히 M3 수용체에 선택적으로 작용하여, 아세틸콜린이 이 수용체에 결합하는 것을 차단함으로써 평활근 수축 및 점액 분비를 억제한다. 이로 인해 기도 저항이 감소하고 호흡 증상이 완화되며, COPD 환자의 폐기능 개선과 급성 악화 빈도 감소에 기여한다.
항콜린제는 작용 지속 시간에 따라 단시간 작용 항무스카린제(short-acting muscarinic antagonists, SAMA)와 장시간 작용 항무스카린제(long-acting muscarinic antagonists, LAMA)로 분류된다.
SAMA는 주로 단기 증상 완화에 사용되며, 대표적으로이프라트로피움(Ipratropium)와 옥시트로피움(Oxitropium)이 있다. 이들 약제는 M3 비선택적 억제로, 억제성 신경 수용체인 M2를 차단함으로써 잠재적으로 미주신경을 통해 기관지 수축을 유발시킬 수 있다.
LAMA는 하루 1회 또는 2회 흡입으로 지속적인 기도 확장을 유지할 수 있어 COPD 유지 치료의 핵심 약제로 사용된다. 대표적으로 티오트로피움(Tiotropium), 글리코피로니움(Glycopyrronium), 우메클리디늄(Umeclidinium) 등이 있다. 이들 약제는 M3 선택적 억제로, M3 무스카린성 수용체에 대한 장시간의 결합 및 M2 무스카린성 수용체와의 빠른 해리를 통해 기관지 확장제의 효과 지속 시간을 연장시킨다.
항콜린제는 β2-작용제와 병용할 경우 상호 보완적인 기전으로 기관지 확장 효과가 증대되며, 특히 COPD 환자에서는 LAMA + LABA 병용요법이 임상적으로 우월한 효과를 보인다.
항콜린제는 흡입 제형으로 투여 시 전신 흡수가 거의 없어 안전성이 높고, 주요 부작용은 구강건조, 쓴맛, 드물게 요폐 등의 국소적 반응에 국한된다. 이로 인해 장기적인 유지 요법에 적합한 약제로 간주된다.
3) 흡입스테로이드제(Inhaled corticosteroid, ICS) ICS는 합성된 글루코코르티코이드 계열 약제로, 폐로 직접 흡입되어 작용함으로써 전신 노출을 최소화하면서 강력한 항염 작용을 발휘한다. 세포 내 글루코코르티코이드 수용체(glucocorticoid receptor, GR)와 결합한 후 전사조절인자(transcriptional regulator)로 기능하여, 염증 유전자 발현을 억제하고 항염증 단백질 생성을 유도한다.
특히 NF-κB, AP-1 등 주요 염증 촉진성 전사인자의 활성을 차단함으로써 IL-4, IL-5, IL-13 등 Th2 관련 사이토카인의 생성을 억제하며, 호산구(eosinophil) 및 비만세포(mast cell)의 기도 내 침윤과 활성을 감소시킨다.
이러한 작용기전은 기관지 평활근의 수축성을 저하시켜 기도 과민 반응을 감소시키고, 상피세포의 장벽 기능 회복과 점액선의 과활성 억제를 통해 전반적인 기도 염증 조절에 기여한다.
ICS는 흡입제 형태로 국소적으로 투여되어 전신 부작용을 최소화하면서 장기간 안전하게 사용 가능하다는 점에서 ICS는 천식 치료에 있어 핵심적인 치료제로 간주된다. 이는 단독 사용뿐 아니라 LABA 또는 LAMA와의 병용 요법이 표준화되었다.
4) Phosphodiesterase-4(PDE4) 억제제 PDE4 억제제는 cAMP의 대사를 억제하여 세포내 cAMP 농도를 높이는데 이는 항 염증 효과를 나타내고 또한 호중구의 이동과 화학 주성을 억제하는 효과도 있다. 로플밀라스트(Roflumilast)는 선택적인 PDE4 억제제 중의 하나로 가래 호중구와 호산구를 감소키는 항염증 작용이 확인되어 PDE4억제제 중 COPD 치료제로 허가 받은 유일한 약제이다. 하루 한번 복용하는 경구용 약제로 기관지 확장제가 아니지만 FEV1과 삶의 질 향상효과가 있다.
따라서, 단기간 작용시간을 가지는 SABA와 SAMA는 주로 증상이 갑자기 악화될 때 사용되며, LABA와 LAMA는 유지 치료의 중심으로 사용된다.
5) 병용요법 이러한 약제들은 단독 혹은 병합 요법으로 사용되며, 특히 증상이 지속되거나 급성 악화가 반복되는 환자에서는 2제 요법(LABA + LAMA) 또는 ICS를 포함한 3제 요법(ICS + LABA + LAMA)이 권고된다.
6) PDE4 억제제 PDE4 억제제는 흡입 치료 외에도 일부 환자에서는 경구용 약제가 보조적으로 사용된다. PDE4 억제제인 로플루밀라스트(roflumilast)는 만성 기관지염 양상을 보이며 급성 악화가 잦은 중증 환자에게 효과적이다. 또한 급성 악화 시에는 경구 스테로이드 및 항생제가 단기간 사용되며, 병원성 감염의 가능성을 고려해 적절히 투여된다.
기관지 확장제는 어떤 약제인가? 기도 저항(Airway resistance)의 감소는 기도 자체의 내재적(intrinsic) 요인과 외재적(extrinsic) 요인 모두에 의해 조절되며, 그 주요 기전으로는 평활근 이완, 기관 및 세기관지 벽의 염증 감소, 기도 분비물의 감소 등이 있다.
이 중 기도 평활근의 이완은 기관지 확장을 유도하기 위한 핵심 기전으로, 이는 두 가지 주요 약리학적 접근법을 통해 달성될 수 있다. β2-아드레날린 수용체(β2-AR)를 자극하는 β2-작용제(β2-agonist)의 직접적인 작용과 무스카린 수용체를 차단하여 아세틸콜린 신호 전달을 억제하는 항콜린제(antimuscarinic)의 간접적인 작용이다(Figure 2).
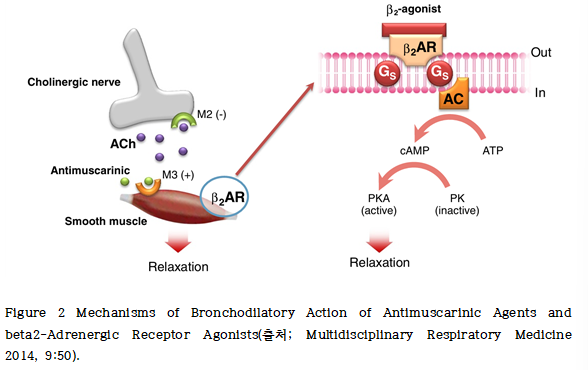
먼저, β2-작용제는 기도 평활근 세포, 특히 소기도(small airway)에 존재하는 β2-AR에 직접 결합함으로써 작용한다. 이 결합은 평활근 세포 내에서 AC(adenyl cyclase)를 활성화시켜 ATP로부터 cAMP가 생성시킨다.
생성된 cAMP는 두 가지 주요 하위 효과기를 활성화시킨다. 이때 PKA는 평활근 긴장을 조절하는 단백질들을 인산화하여 이완을 유도하고, Epac는 PKA와는 독립적으로 평활근 이완을 유도한다. 또한, cAMP는 세포 내 칼슘을 격리(sequestration)함으로써 추가적으로 수축을 억제하고 평활근 이완을 촉진한다.
다음, 항콜린제는 수축 작용을 하는 아세틸콜린(ACh)의 수용체 결합을 경쟁적으로 차단함으로써 간접적으로 평활근 이완을 유도한다. 기도 내 부교감신경 활성은 주로 M1 및 M3 무스카린 수용체를 통해 매개되며, 이들 수용체는 평활근 수축, 점액 분비, 섬모운동 증가를 유도한다. 반면, M2 수용체는 시냅스 전 말단에서 ACh의 방출을 억제하여 음성 되먹임 조절을 수행한다.
COPD에서는 특히 콜린성 기도 긴장(cholinergic bronchomotor tone)이 병태생리에 중요한 역할을 하며, 기도 수축 및 점액 과다분비를 통해 기도 폐쇄를 악화시킨다. β2-작용제는 모든 기도 수준, 특히 COPD에 관여하는 소기도의 평활근 세포 표면의 β2-AR에 결합하여 작용한다. 반면, 무스카린 수용체 길항제는 기도 평활근의 M3 수용체를 차단함으로써 수축을 방지한다.
비록 소기도에는 미주신경의 직접적인 분포가 부족하지만, COPD와 같은 질환에서는 비신경원성(non-neuronal) 아세틸콜린에 의해 무스카린 수용체가 활성화되는 것으로 알려져 있다. 따라서 항콜린제(무스카린 수용체 길항제)는 대기도와 소기도 모두에서 확장 효과를 나타낼 수 있다.
따라서, β2-작용제와 항콜린제와의 복합요법(combination therapy)은 단독요법보다 기도 전 구간에 걸쳐 더 강력한 기관지 확장 효과를 제공할 수 있으며, 각 약물에 대한 환자 간(inter-patient) 및 환자 내(intra-patient) 반응의 이질성을 극복하는 데도 도움을 줄 수 있다. 나아가, 두 기전이 결합된 병용요법은 단순한 약물 투여 방식과 함께 신체활동 내성 증가, 일상 활동 수행 능력 향상, 삶의 질 개선에도 긍정적인 영향을 미친다.
PDE 억제제에는 어떤 약제들이 있는가? PDE 억제제는 세포 내 cAMP 및 cGMP의 분해를 억제함으로써 해당 이차 전령의 농도를 증가시키고, 다양한 하위 신호경로인 PKA, PKG, EPAC, 이온 채널 등을 활성화시켜 생리적 반응을 조절한다.
이러한 작용은 단일 경로에 국한되지 않고 염증, 혈류역학, 대사, 면역 및 신경전달 등 다양한 체계에 걸쳐 조절 효과를 나타내며, 이에 따라 PDE 억제제는 다기능성 치료 플랫폼으로 진화하고 있다.
COPD에서는 PDE 억제를 통해 기도 평활근 이완 및 항염증 효과를 유도하는 치료 전략이 오래전부터 탐색되어 왔다.
대표적으로 methylxanthine 계의 테오필린(Theophylline)은 비선택적 PDE 억제제(non-selective phosphodiesterase inhibitor) 로 기관지 확장 작용 외에 횡격막 근력 강화, 기관지 섬모운동 개선과 심박출량을 증가시키는 효과가 있다. 이러한 작용으로 인해 천식 및 COPD 치료에 오랫동안 사용되었으나, 치료역이 좁고 심혈관계 및 중추신경계 부작용이 자주 동반되어 임상 활용에 제한이 있다. 따라서 기관지확장 효과가 약해 흡입 기관지확장제 약물을 사용할 수 없는 상황에서만 제한적으로 사용한다.
이에 따라 초기에 개발된 PDE4 선택적 억제제인 롤리프람(Rolipram)은 T 세포 및 대식세포에서의 cAMP 증가를 통해 염증성 사이토카인 분비를 억제하는 기전을 보였으나, 심각한 위장관계 부작용으로 인해 임상 개발이 중단되었다.
이후 개발된 로플루밀라스트(Roflumilast)는 위장관계 부작용을 줄인 개선된 PDE4 억제제로, 2010년 미국 FDA에서 “기관지확장제 병용요법으로서, 급성 악화 병력이 있고 만성 기관지염을 수반한 중증 COPD 환자의 유지 치료” 적응증으로 승인되었으며, 유럽 EMA와 국내에도 승인을 받았다.
전임상 연구에 따르면, 로플루밀라스트는 기관지 상피세포에서 글루코코르티코이드 수용체 α(GRα)의 전사활성을 증가시키고, 이는 덱사메타손(dexamethasone)의 항염 효과를 GRα 의존적으로 증강시키는 것으로 나타났다. 그러나 여전히 위장 불편감, 체중 감소 등의 부작용이 빈번히 보고되어, 국제 GOLD 가이드라인에서는 LABA, LAMA, ICS를 병용함에도 악화를 반복하는 환자에 한해 3차 치료제(third-line agent)로 제한적 사용을 권고하고 있다.
한편, PDE3 역시 평활근세포에서 발현되어 기관지 수축성 조절에 관여하는데, PDE3 억제는 기관지 이완 효과를 유도한다.
이에 따라 PDE3 및 PDE4를 동시에 억제함으로써 기관지 확장과 항염 작용을 동시에 달성하려는 전략이 제시되었다. 실제로 전임상 연구에서는 이중 억제제가 단일 억제제보다 더 우수하거나, 상가적 효과를 유도함을 입증한 바 있다.
이러한 기전을 기반으로 최근 개발된 엔시펜트린(Ensifentrine)은 PDE3와 PDE4를 모두 억제하는 이중 작용 흡입제로, 기도 평활근 이완과 염증 반응 억제를 병행하는 새로운 기전의 약제가 개발되었다.
엔시펜트린(Ensifentrine)는 어떤 약제인가? 엔시펜트린(Ensifentrine, 제품명 : 오투바이어 흡입 현탁액, Ohtuvayre& 9415;)은 PDE3/PDE4 이중 억제제로, 2024년 6월에 미국 FDA로부터 COPD 유지 치료제로 승인되었다. 이는 기관지 수축 및 염증 반응을 동시에 표적으로 삼는 새로운 치료 옵션으로, 기존의 PDE 억제제보다 내약성 및 효능 면에서 개선된 특성을 나타낸다.
엔시펜트린의 기본 구조(parent molecule)는 trequinsin으로, 이는 다른 PDE 억제제들에 비해 기도 평활근에서 지속적인 기관지 확장 효과를 나타내며, 중간 수준의 PDE3 억제력과 약한 PDE4 억제력을 가진다.
엔시펜트린은 흡입 현탁액(inhalation suspension) 제제로 Jet nebulizer를 ㅛㅏ용하는 기관지 확장제 및 항염증제이다. Jet nebulizer는 호흡기 약물 전달을 위한 대표적인 흡입 장치로, 압축 공기를 이용한 벤츄리(Venturi) 효과를 기반으로 액상 약물을 미세한 에어로졸 입자로 변환시키는 기전으로 작동한다. 이 장치는 폐 말단부위까지 약물을 직접 도달시키는 능력으로 인해 특히 COPD이나 급성 호흡곤란 환자에게 유용하며, 고령 환자, 소아, 또는 기도 협착 환자와 같이 흡입 조절이 어려운 대상군에게 효과적인 약물 전달 수단이라고 할 수 있다.
엔시펜트린의 기관지 확장과 항염증 효과는 알레르기성 기관지 수축이 유도된 기니피그 모델 연구에서 기관지 폐포 세척액 및 비강 내 염증세포 침윤을 유의하게 감소시키는 효과가 확인되었다. 또한 항원 유도로 인한 호산구 이동은 흡입형 엔시펜트린 전처리 시 80% 이상 억제되었다.
또한, 시험관 내 연구(in vitro)에서 낭성섬유증 전도 조절 단백(CFTR)을 자극하는 효과가 확인되었으며, 이는 기도의 점액섬모 청소 기능(mucociliary clearance)을 개선할 가능성을 보여주었다.
엔시트린 허가사항 중 WARNINGS AND PRECAUTIONS에서 다음과 같이 안내하고 있다. 엔시펜트린 투여를 시작하기 전에, 의료진은 우울증 및/또는 자살 생각 또는 행동의 병력이 있는 환자에게서 엔시펜트린 치료의 이점과 위험을 신중히 평가해야 한다. 환자, 보호자 및 가족에게는 불면, 불안, 우울감, 자살 충동 또는 기타 기분 변화의 발생 또는 악화 여부를 주의 깊게 관찰할 필요성이 있음을 안내하고, 이러한 변화가 나타날 경우 즉시 의료진에게 연락할 것을 권고해야 한다. 이와 같은 사건이 발생한 경우, 의료진은 엔시펜트린 치료의 지속 여부에 대해 신중히 재평가해야 한다.
엔시펜트린 치료는 정신과적 이상반응 증가와 관련이 있다. 임상시험에서 엔시펜트린를 투여받은 환자 중 자살 관련 이상반응이 보고되었으며, 그 중 자살 시도 1건 및 자살 사례 1건이 포함되었다. 또한, 통합된 24주 안전성 평가 인구집단에서 가장 흔하게 보고된 정신과적 이상반응은 다음과 같다:
불면증은 엔시펜트린 3mg 투여군 6명(0.6%), 위약군 2명(0.3%)이었고, 불안은 엔시펜트린 3mg 투여군 2명(0.2%), 위약군 1명(0.2%)이었다. 우울 관련 반응(우울증, 주요우울증, 우울 기분을 동반한 적응장애 포함)은 엔시펜트린를 투여받은 환자 4명(0.4%)에서 발생하였으며, 위약 투여군에서는 보고되지 않았다.
엔시펜트린의 약리 기전은? 엔시펜트린은 PDE3와 PDE4를 동시에 억제하는 이중 억제제로, 이러한 신호전달 경로의 조절을 통해 치료 효과를 유도하는 새로운 흡입형 저분자 약물이다. PDE3는 주로 cAMP를 가수분해하지만, cGMP도 기질로 사용할 수 있는 특성을 지니며, PDE4는 cAMP에 특이적으로 작용하는 효소이다.
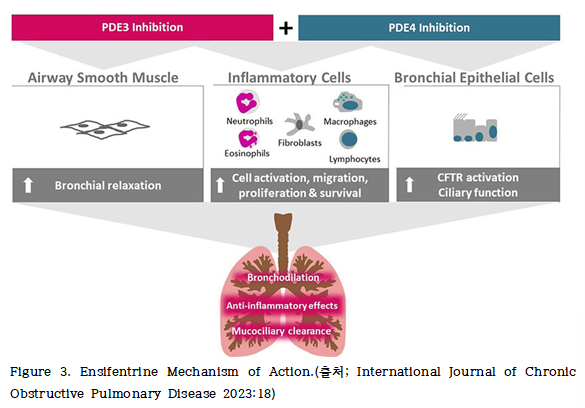
따라서 두 PDE를 동시에 억제함으로써 세포 내 cAMP 및 cGMP 농도가 모두 상승하게 되고, 이는 기도 평활근 이완, 항염작용, 점액 분비 감소 및 섬모 기능 강화 등 복합적인 생리학적 효과를 유도한다(Figure 3).
특히 PDE3와 PDE4는 기도 평활근, 염증세포, 기관지 상피세포에 널리 발현되어 있어, 이들에 대한 동시 억제는 단일 PDE 억제보다 상승적 또는 시너지 효과를 유도할 수 있다. 이러한 작용 특성은 엔시펜트린이 기관지 확장, 기도 염증 조절, 점액섬모 청소 기능(mucociliary clearance)에 걸친 통합적 치료 효과를 발휘할 수 있다.
엔시펜트린(OHTUVAYRE& 9415;)의 허가 임상은 어떠한가? 엔시펜트의 유효성은 ENHANCE-1 및 ENHANCE-2의 24주간 무작위 배정, 이중눈가림, 위약 대조, 병렬군 임상시험을 통해 평가되었다. 이 두 연구에는 중등도에서 중증의 COPD를 가진 총 1,553명의 성인 환자가 등록되었다.
ENHANCE-1에서는 763명의 환자가 등록되어 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 표준 제트 네불라이저를 통해 흡입하도록 배정되었다. 등록 시점에서 기관지 확장제 투여 후 예측 FEV1 평균은 52%(범위: 27~85%), FEV1/FVC 비율은 평균 0.52(범위: 0.22~0.71)였다. 또한, 전체 환자의 68%는 LAMA, LABA, 또는 LABA/ICS와 같은 병용 치료를 받고 있었으며, 각각 30%, 18%, 20%가 해당 약제를 사용하고 있었다.
ENHANCE-2는 총 790명의 환자를 대상으로 동일한 방식으로 설계되었으며, 5:3 비율로 OHTUVAYRE 3mg 또는 위약을 제트 네불라이저를 통해 하루 두 번 흡입하도록 배정하였다.
등록 시점의 평균 예측 FEV1은 51%(범위: 23~81%)였고, FEV1/FVC 비율은 평균 0.52(범위: 0.24~0.71)였다. 이 연구에서도 55%의 환자가 병용 치료를 받고 있었으며, LAMA, LABA , LABA/ICS와 같이 병용 치료를 받고 있었으며, 각각 33%, 7%, 15%가 해당 약제를 사용하고 있었다.
두 연구 모두에서 주요 평가변수였던 12주차 FEV₁의 시간-농도 곡선 면적(AUC& 8320;& 8211;12h)은 위약 대비 유의하게 개선되었다.
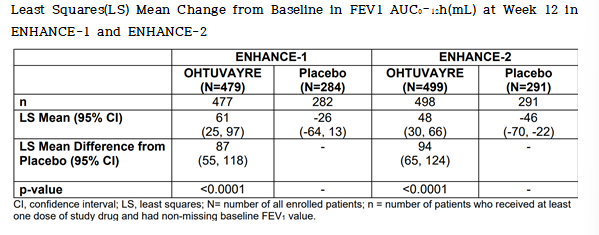
ENHANCE-1 및 ENHANCE-2 연구에서는 모든 환자를 대상으로 베이스라인 시점과 12주차에 걸쳐 12시간 동안 연속 폐기능 검사(serial spirometry)가 수행되었다. ENHANCE-1의 12주차 연속 폐기능 검사 결과는 trough FEV1은 아침 투약 직전 마지막으로 측정된 FEV1 값으로 정의되었다.
12주차 시점에서 위약 대비 평균 아침 trough FEV1의 개선치는 ENHANCE-1에서 35mL (95% 신뢰구간: 14, 68), ENHANCE-2에서는 49 mL(95% 신뢰구간: 19, 80)로 나타났으며, 이는 ENHANCE-1에서 통계적으로 유의하였으나, ENHANCE-2에서는 분석 단계(hierarchical testing) 상위 단계의 실패로 인해 통계적 유의성이 확보되지 않았다.
St. George’s 호흡기 설문지(SGRQ)를 통해 두 시험에서 시행되었으며, SGRQ 반응률은 점수가 4점 이상 개선된 경우로 정의되었다. ENHANCE-1에서 24주차 시점의 SGRQ 반응률은 OHTUVAYRE 투여군에서 58.2%, 위약군에서 45.9%로 나타났고, 이에 대한 Odds Ratio는 1.49(95% CI: 1.07, 2.07)로 통계적 유의성이 있었다.
반면, ENHANCE-2에서는 OHTUVAYRE 투여군의 반응률이 45.4%, 위약군이 50.3%였으며, Odds Ratio는 0.92(95% CI: 0.66, 1.29)로, 통계적 유의성은 나타나지 않았다.
엔시펜트린의 예상되는 쟁점은 무엇인가? 현재까지의 COPD 치료 전략은 주로 기관지 확장제 및 항염증 흡입제에 기반하였으며, 증상 완화와 급성 악화의 예방을 목표로 했다.
그러나 일부 환자에서는 기존 약물요법으로 충분한 치료 효과를 얻지 못하거나, 흡입기 사용에 대한 어려움으로 치료 순응도가 저하되는 문제가 지속적으로 제기되어 왔다.
엔시펜트린은 이러한 한계를 극복하기 위해 개발된 약제로, PDE 3와 PDE4를 동시에 억제하는 최초의 흡입형 치료제이다. PDE3 억제를 통해 기관지 평활근을 이완시켜 기관지 확장 효과를 유도하고, PDE4 억제를 통해 염증세포에서의 사이토카인 분비 및 염증 반응을 억제함으로써 항염 효과를 나타낸다. 이러한 이중 작용은 단일 기전 약물에 비해 증상 개선 및 염증 조절에 있어 시너지 효과를 기대할 수 있다.
엔시펜트린은 제트 네뷸라이저를 통해 투여되는 제형으로, 흡입기 사용이 어려운 고령 환자나 협조가 부족한 환자에게 유용한 대안이 될 수 있다. 또한 기존 유지 치료제(LABA, LAMA, ICS)와 병용 가능하며, 특히 기존 치료에 반응이 불충분한 환자에게 추가적인 임상적 혜택을 제공할 수 있다.
다만, 단시간 작용성 기관지 확장제(SABA/SAMA)에 비해 작용 발현 속도가 느리기 때문에 급성 증상 완화에는 적합하지 않으며, 휴대성과 투여 시간(약 5& 8211;7분) 측면에서도 일상 생활에서 제한점이 존재한다.
임상적으로는 두 건의 ENHANCE-1 및 ENHANCE-2 3상 무작위 위약 대조 시험을 통해 엔시펜트린의 유효성과 안전성이 평가되었다. ENHANCE-1에서는 폐기능 개선과 건강 관련 삶의 질 향상(예: SGRQ 점수)의 통계적 유의성이 입증되었으며, 탈락률도 낮아 근거 수준이 높은 연구로 간주된다. 반면 ENHANCE-2는 지역적 인구 구성의 차이 및 통계적 유의성 부족으로 인해 지원적 자료(supportive evidence)로 해석되었으며, 두 연구가 동일한 근거 수준으로 채택되지는 않았다.
현재 엔시펜트린은 미국 FDA로부터 승인을 받았으나, 유럽 EMA에서는 정식 승인을 획득하지 못한 상태이다. 이와 같은 규제 환경은 약물의 글로벌 접근성 및 보급에 있어 중요한 장애가 되고 있다.
결론적으로, 엔시펜트린은 기전적 이점을 바탕으로 기존 치료의 한계를 보완하고, 특정 환자군에서 치료 옵션의 다양성을 확대할 수 있는 약제로 평가된다. 향후 유럽 EMA 승인과 후속 임상 연구와 실제 임상에서의 사용 경험이 축적됨에 따라, 이중 PDE 억제제는 COPD 약물 치료의 새로운 전환점을 제시할 수 있을 것으로 기대해 본다.
참고문헌 1. Isaac Levy et al. “Phosphodiesterase function and endocrine cells: links to human disease and roles in tumor development and treatment” Curr Opin Pharmacol. 2011;11(6):689& 8211;697. 2. Nardini et al. “COPD: maximization of bronchodilationMultidisciplinary Respiratory Medicine” 2014, 9:50. 3. James F Donohue et al. “Ensifentrine as a Novel, Inhaled Treatment for Patients with COPD“ International Journal of Chronic Obstructive Pulmonary Disease 2023:18. 4. Rinzhin T et al. “Advancing Obstructive Airway Disease Treatment: Dual PDE3/4 Inhibition as a Therapeutic Strategy“ Cells 2025, 14, 659. 5. Nicola A. Hanania, Bartolom& 233; R. Celli, ”Phosphodiesterase Inhibition as a Therapeutic Strategy for Chronic Obstructive Pulmonary Disease: Where We Have Been and What Lies Ahead“ Chronic Obstr Pulm Dis. 2025; 12(1): 82-92. 6. COPD 진료지침 대한결핵 및 호흡기학회 2024 개정. 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등).
관련기사
-
⑤ 세계 첫 텔로머레이스 억제제 '라이텔로'...국내 도입 예상
2025-06-13 06:24
-
④ 원형탈모 치료제 '렉셀비', 세 번째 경구 JAK 억제제
2025-05-30 06:40
-
③ PNH 치료제 '피아스키', 최초의 월 1회 피하주사제
2025-05-13 18:10
- 익명 댓글
- 실명 댓글
- 댓글 0
- 최신순
- 찬성순
- 반대순
오늘의 TOP 10
- 1명인제약, 8년 연속 30% 수익률…이행명이 만든 알짜 구조
- 2경기도약 통합돌봄 교육...약사 350여명 열공
- 3강남구약, 첫 회원 스크린 골프대회…나호성·오선숙 약사 우승
- 4SK바이오팜, 미 항암 자회사에 512억 수혈…TPD 개발 지원
- 5서울시약, 전국여약사대회 앞두고 역대 여약사부회장 간담회
- 6복지부, 미국 제약사 릴리와 7500억원 국내투자 MOU
- 7공단, 빅데이터 분석센터 신규 협약기관 공모
- 8심평원, 3기 국민소통참여단 100명 선발
- 9김영진 서울시약 부회장, '올해의 서울여성상' 수상
- 10서울시약, 창고형약국 면허대여 불법 제안 급증에 강력 경고

























































![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)

![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/partner/products/3f39593e-6318-4dd9-a778-c008c868b5c8.png)
![[레비온] PDRN+EGF, 레비온RX PDRN EGF 크림](https://i.baropharm.com/products/202512/1765949426601.png)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202602/1770888420842.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)



