총 12건
-
 '고마진 원료로 실탄 확보'...에스티팜, 신약 개발 외연 확장[데일리팜=차지현 기자] 에스티팜이 신약개발 분야로 보폭을 넓히고 있다. 올리고뉴클레오타이드 원료의약품(CDMO) 사업을 통해 벌어들인 안정적인 수익을 바탕으로 메신저 리보핵산(mRNA)과 유전자 편집 치료제 등 차세대 RNA 치료제 시장 공략에 속도를 내는 분위기다.13일 바이오 업계에 따르면 에스티팜은 최근 전염병예방혁신연합(CEPI)이 추진하는 중증열성혈소판감소증후군(SFTS) mRNA 백신 개발 프로젝트의 핵심 제조·기술 파트너로 선정됐다.이번 연구는 인공지능(AI)·구조기반 설계를 활용해 항원 후보물질을 도출하고 면역원성과 안전성을 검증하는 장기 연구다. 오는 2030년까지 CEPI의 지원을 받아 수행될 예정이다. 질병관리청 국립보건연구원과 국제백신연구소(IVI), 서울대학교가 공동으로 참여한다.백신 후보물질은 질병관리청과 서울대학교가 항원을 설계하고 에스티팜은 mRNA 원료 설계와 생산을 담당한다. 구체적으로 에스티팜은 자체 mRNA 5’ 캡핑 기술(SmartCap)과 지질나노입자(LNP) 전달 기술(STLNP), 글로벌 표준의 GMP 제조 역량을 제공한다.SFTS는 국내 비롯한 중국·일본·대만 등 동아시아에서 주로 발생하는 참진드기 매개 감염병이다. 고열과 혈소판 감소, 신부전 등을 일으켜 고령 환자에게서는 치명률이 높은 질환이다. 바이러스 면역 회피 특성 탓에 아직 상용화된 백신이 없는 상황으로 mRNA 백신은 항원 구조를 정밀하게 구현해 효과적인 면역 반응을 유도할 수 있을 것이라는 게 회사 측 기대다.에스티팜은 올해 들어 mRNA와 차세대 RNA 치료제 분야에서 존재감을 본격적으로 드러내고 있다. 회사는 올해 TIDES USA 2025와 CRISPR MEDiCiNE 2025 등 RNA·유전자 치료제 분야를 대표하는 국제 학회에 연이어 참가하며 적극적인 대외 행보에 나섰다. 해당 학회에서 에스티팜은 mRNA 관련 자체 플랫폼을 소개하고 gRNA 등 mRNA 플랫폼 응용 범위를 유전자치료제 영역까지 확장하겠다는 중장기 전략과 비전을 제시했다.가시적인 성과도 나오고 있다. 에스티팜은 올해 1분기와 2분기 각각 mRNA 부문 매출 6억원, 7억원을 기록하며 관련 사업에서 첫 실적을 창출했다. 3분기에는 mRNA 부문과 관련 초기 R&D 프로젝트에서 14억원의 매출을 올렸다. LNP 지질 중간체 공급과 mRNA 목록제품, 자체개발 캡핑 시약 CDMO를 통해 매출이 발생했다.에스티팜 mRNA CDMO 플랫폼 개요 (자료: 에스티팜)동아쏘시오그룹 계열사 에스티팜은 올리고와 저분자 화학합성 신약 원료의약품 위탁개발생산(CDMO)을 주력으로 영위하는 업체다. 당초 제네릭 원료의약품(API) 생산 업체로 출발했으나 이후 고성장·고부가가치 올리고 원료 생산 중심으로 사업 구조를 고도화해 왔다. 최근에는 mRNA와 유전자 편집 치료제 등 차세대 RNA 치료제 분야로 사업 영역 확장을 꾀하는 모습이다.에스티팜은 2020년 mRNA 사업에 처음 뛰어들었다. 코로나19 팬데믹을 계기로 mRNA 기술의 상업적 가능성이 부각되자 같은 해 8월 반월캠퍼스에 비임상 실험용 mRNA 생산 설비 증설에 착수하며 관련 사업을 본격화했다. 이후 단계적으로 투자를 확대해 상업화 수준 mRNA 원액 생산 설비를 완공하며 생산 인프라를 갖췄다.에스티팜은 2020년 8월 반월캠퍼스 내 비임상 실험용 규모 증설을 시작으로 2021년 5월 추가 증설을 완료했고 2023년 8월 연간 3000만~1억 도즈 상당 상업화 규모 mRNA 백신 원액을 생산할 수 있는 설비를 완공했다. mRNA 분자를 안정화하는 핵심기술을 독자화하고 mRNA 약물 전달의 핵심기술인 LNP를 공동개발하는 등 핵심 플랫폼 기술도 내재화했다.나아가 에스티팜은 신약개발 영역으로도 보폭을 넓히는 중이다. 단순 mRNA 원료 위탁생산에 그치지 않고 자체 원천기술을 바탕으로 백신·치료제 개발 과정에 직접 참여하는 전략으로 방향을 전환한 것이다.회사는 mRNA 기반 코로나19 백신 후보물질 'STP2104' 개발에 나섰다. STP2104는 코로나19 바이러스의 스파이크 단백질 정보를 담은 mRNA에 T세포 면역을 강화하는 요소를 추가해, 항체와 세포 면역을 동시에 유도하는 백신이다. 에스티팜은 STP2104 임상 1상에서 글로벌 mRNA 백신과 동등 이상의 중화항체 역가와 항체양전율을 확인했다. 다만 전략적 판단에 따라 임상 1상 이후 추가 개발은 중단한 상태다.회사는 미국 자회사를 통해 mRNA 기반 혁신 신약 파이프라인을 강화하는 데 힘을 쏟고 있다. 에스티팜은 2021년 4, 미국 샌디에이고에 mRNA와 CAR-NKT 플랫폼 기술을 이용한 신약개발 바이오텍 레바티오 테라퓨틱스를 설립했다. 또 같은 해 8월 미국 애틀랜타에 mRNA 신약개발 바이오텍 버나젠을 설립했다.현재 버나젠은 현재 10여 개의 항바이러스 질환 mRNA 백신 파이프라인을 보유 중이다. 특히 2023년 3월에는 미국질병청(CDC)와 하트랜드바이러스 mRNA 백신 공동연구개발 업무협약(MOU)을 체결하고 7월 본계약을 완료했다. 백신 개발에 에스티팜의 SmartCap과 STLNP 플랫폼 기술을 적용하는 게 골자다. 레바티오의 경우 작년 말 청산했으나 CAR-NKT, cirRNA 등 핵심 플랫폼 기술 IP와 신약 파이프라인은 모두 에스티팜에게 이전돼 관련 연구를 지속하고 있다.이 같은 신사업 확장 동력은 기존 CDMO 사업에서 창출되는 안정적인 현금흐름에서 나온다. 올 3분기 에스티팜 영업이익은 147억원으로 전년 동기 대비 141.6% 급증했다. 같은 기간 매출액은 819억원으로 전년보다 32.7% 늘었다. 고마진 올리고핵산 CDMO 비중 확대와 상업화 프로젝트 증가가 맞물린 결과다. 매출 구성을 보면 올리고 CDMO 매출이 686억원으로 전체 매출의 84%를 차지했고 이 가운데 상업화 단계 프로젝트가 절반 이상인 54%를 차지해 수익성 개선을 이끌었다.2025-12-13 06:00:53차지현 기자
'고마진 원료로 실탄 확보'...에스티팜, 신약 개발 외연 확장[데일리팜=차지현 기자] 에스티팜이 신약개발 분야로 보폭을 넓히고 있다. 올리고뉴클레오타이드 원료의약품(CDMO) 사업을 통해 벌어들인 안정적인 수익을 바탕으로 메신저 리보핵산(mRNA)과 유전자 편집 치료제 등 차세대 RNA 치료제 시장 공략에 속도를 내는 분위기다.13일 바이오 업계에 따르면 에스티팜은 최근 전염병예방혁신연합(CEPI)이 추진하는 중증열성혈소판감소증후군(SFTS) mRNA 백신 개발 프로젝트의 핵심 제조·기술 파트너로 선정됐다.이번 연구는 인공지능(AI)·구조기반 설계를 활용해 항원 후보물질을 도출하고 면역원성과 안전성을 검증하는 장기 연구다. 오는 2030년까지 CEPI의 지원을 받아 수행될 예정이다. 질병관리청 국립보건연구원과 국제백신연구소(IVI), 서울대학교가 공동으로 참여한다.백신 후보물질은 질병관리청과 서울대학교가 항원을 설계하고 에스티팜은 mRNA 원료 설계와 생산을 담당한다. 구체적으로 에스티팜은 자체 mRNA 5’ 캡핑 기술(SmartCap)과 지질나노입자(LNP) 전달 기술(STLNP), 글로벌 표준의 GMP 제조 역량을 제공한다.SFTS는 국내 비롯한 중국·일본·대만 등 동아시아에서 주로 발생하는 참진드기 매개 감염병이다. 고열과 혈소판 감소, 신부전 등을 일으켜 고령 환자에게서는 치명률이 높은 질환이다. 바이러스 면역 회피 특성 탓에 아직 상용화된 백신이 없는 상황으로 mRNA 백신은 항원 구조를 정밀하게 구현해 효과적인 면역 반응을 유도할 수 있을 것이라는 게 회사 측 기대다.에스티팜은 올해 들어 mRNA와 차세대 RNA 치료제 분야에서 존재감을 본격적으로 드러내고 있다. 회사는 올해 TIDES USA 2025와 CRISPR MEDiCiNE 2025 등 RNA·유전자 치료제 분야를 대표하는 국제 학회에 연이어 참가하며 적극적인 대외 행보에 나섰다. 해당 학회에서 에스티팜은 mRNA 관련 자체 플랫폼을 소개하고 gRNA 등 mRNA 플랫폼 응용 범위를 유전자치료제 영역까지 확장하겠다는 중장기 전략과 비전을 제시했다.가시적인 성과도 나오고 있다. 에스티팜은 올해 1분기와 2분기 각각 mRNA 부문 매출 6억원, 7억원을 기록하며 관련 사업에서 첫 실적을 창출했다. 3분기에는 mRNA 부문과 관련 초기 R&D 프로젝트에서 14억원의 매출을 올렸다. LNP 지질 중간체 공급과 mRNA 목록제품, 자체개발 캡핑 시약 CDMO를 통해 매출이 발생했다.에스티팜 mRNA CDMO 플랫폼 개요 (자료: 에스티팜)동아쏘시오그룹 계열사 에스티팜은 올리고와 저분자 화학합성 신약 원료의약품 위탁개발생산(CDMO)을 주력으로 영위하는 업체다. 당초 제네릭 원료의약품(API) 생산 업체로 출발했으나 이후 고성장·고부가가치 올리고 원료 생산 중심으로 사업 구조를 고도화해 왔다. 최근에는 mRNA와 유전자 편집 치료제 등 차세대 RNA 치료제 분야로 사업 영역 확장을 꾀하는 모습이다.에스티팜은 2020년 mRNA 사업에 처음 뛰어들었다. 코로나19 팬데믹을 계기로 mRNA 기술의 상업적 가능성이 부각되자 같은 해 8월 반월캠퍼스에 비임상 실험용 mRNA 생산 설비 증설에 착수하며 관련 사업을 본격화했다. 이후 단계적으로 투자를 확대해 상업화 수준 mRNA 원액 생산 설비를 완공하며 생산 인프라를 갖췄다.에스티팜은 2020년 8월 반월캠퍼스 내 비임상 실험용 규모 증설을 시작으로 2021년 5월 추가 증설을 완료했고 2023년 8월 연간 3000만~1억 도즈 상당 상업화 규모 mRNA 백신 원액을 생산할 수 있는 설비를 완공했다. mRNA 분자를 안정화하는 핵심기술을 독자화하고 mRNA 약물 전달의 핵심기술인 LNP를 공동개발하는 등 핵심 플랫폼 기술도 내재화했다.나아가 에스티팜은 신약개발 영역으로도 보폭을 넓히는 중이다. 단순 mRNA 원료 위탁생산에 그치지 않고 자체 원천기술을 바탕으로 백신·치료제 개발 과정에 직접 참여하는 전략으로 방향을 전환한 것이다.회사는 mRNA 기반 코로나19 백신 후보물질 'STP2104' 개발에 나섰다. STP2104는 코로나19 바이러스의 스파이크 단백질 정보를 담은 mRNA에 T세포 면역을 강화하는 요소를 추가해, 항체와 세포 면역을 동시에 유도하는 백신이다. 에스티팜은 STP2104 임상 1상에서 글로벌 mRNA 백신과 동등 이상의 중화항체 역가와 항체양전율을 확인했다. 다만 전략적 판단에 따라 임상 1상 이후 추가 개발은 중단한 상태다.회사는 미국 자회사를 통해 mRNA 기반 혁신 신약 파이프라인을 강화하는 데 힘을 쏟고 있다. 에스티팜은 2021년 4, 미국 샌디에이고에 mRNA와 CAR-NKT 플랫폼 기술을 이용한 신약개발 바이오텍 레바티오 테라퓨틱스를 설립했다. 또 같은 해 8월 미국 애틀랜타에 mRNA 신약개발 바이오텍 버나젠을 설립했다.현재 버나젠은 현재 10여 개의 항바이러스 질환 mRNA 백신 파이프라인을 보유 중이다. 특히 2023년 3월에는 미국질병청(CDC)와 하트랜드바이러스 mRNA 백신 공동연구개발 업무협약(MOU)을 체결하고 7월 본계약을 완료했다. 백신 개발에 에스티팜의 SmartCap과 STLNP 플랫폼 기술을 적용하는 게 골자다. 레바티오의 경우 작년 말 청산했으나 CAR-NKT, cirRNA 등 핵심 플랫폼 기술 IP와 신약 파이프라인은 모두 에스티팜에게 이전돼 관련 연구를 지속하고 있다.이 같은 신사업 확장 동력은 기존 CDMO 사업에서 창출되는 안정적인 현금흐름에서 나온다. 올 3분기 에스티팜 영업이익은 147억원으로 전년 동기 대비 141.6% 급증했다. 같은 기간 매출액은 819억원으로 전년보다 32.7% 늘었다. 고마진 올리고핵산 CDMO 비중 확대와 상업화 프로젝트 증가가 맞물린 결과다. 매출 구성을 보면 올리고 CDMO 매출이 686억원으로 전체 매출의 84%를 차지했고 이 가운데 상업화 단계 프로젝트가 절반 이상인 54%를 차지해 수익성 개선을 이끌었다.2025-12-13 06:00:53차지현 기자 -
 동아ST·그래디언트, 신약개발 공동연구 업무협약[데일리팜=노병철 기자] 동아에스티(대표이사 사장 정재훈)는 지난 21일 동아에스티 용인 연구단지에서 그래디언트 바이오컨버전스(대표이사 이진근)와 AI기반 오가노이드 및 유전체 분석을 활용한 신약개발 초기 단계 공동연구 업무협약을 체결했다고 22일 밝혔다.이번 협약은 양사의 기술력과 연구 역량을 결합해 예측 한계, 높은 비용, 장기 개발 기간 등 기존 신약개발의 구조적 문제를 극복하고 난치성 질환 치료제 개발을 앞당기기 위해 마련됐다.협약에 따라 양사는 ▲AI 기반 오가노이드 및 유전체 빅데이터 분석을 통한 신규 타깃 발굴 및 신약개발 ▲PDO(Patient-Derived Organoid,환자 유래 오가노이드)를 활용한 다양한 암종의 약물 반응 분석 및 정밀의료 기반 약물 스크리닝 ▲hiPSC(human induced Pluripotent Stem Cell, 역분화 줄기세포) 기반 뇌 오가노이드를 활용한 알츠하이머병, 타우병증 등 난치성 뇌질환 후보물질 유효성 검증을 위해 협력한다.그래디언트 바이오컨버전스는 임직원의 약 80% 이상이 연구진으로 구성된 기업으로 약1,000 종의 PDO와 유전체 정보(NGS) 데이터 기반의 오가노이드 뱅킹 시스템을 보유하고 있다. 독자적인 AI 플랫폼과 오가노이드 및 크리스퍼 유전자 가위(CRISPR-Cas9) 기술을 통해 신규 항암 타깃을 발굴하며, iPSC(induced Pluripotent Stem Cell, 유도만능줄기세포) 유래 오가노이드 구축 및 약물 스크리닝 서비스 등의 핵심 플랫폼을 보유한 오가노이드 기반 타깃 발굴 전문 기업이다.그래디언트 바이오컨버전스 이진근 대표는 “그래디언트 바이오컨버전스의 오가노이드 플랫폼과 동아에스티의 신약개발 역량이 만나, 신약개발 초기 단계의 정밀성과 효율성을 크게 높일 수 있을 것“이라며 “양사의 기술력과 자원을 결합해 신약개발을 더욱 신속하고 효과적으로 이끌어가겠다”고 말했다.동아에스티 김미경 연구본부장은 “양사가 보유한 기술력과 연구 역량이 결합되면 독자적인 약물 타깃 발굴과 효과적인 후보물질 선정이 가능해질 것이다”며 “그래디언트 바이오컨버전스와 긴밀히 협력해 혁신적인 연구 성과를 창출하고 글로벌 신약개발 경쟁력을 강화해 나가겠다”고 말했다.2025-08-22 09:44:08노병철
동아ST·그래디언트, 신약개발 공동연구 업무협약[데일리팜=노병철 기자] 동아에스티(대표이사 사장 정재훈)는 지난 21일 동아에스티 용인 연구단지에서 그래디언트 바이오컨버전스(대표이사 이진근)와 AI기반 오가노이드 및 유전체 분석을 활용한 신약개발 초기 단계 공동연구 업무협약을 체결했다고 22일 밝혔다.이번 협약은 양사의 기술력과 연구 역량을 결합해 예측 한계, 높은 비용, 장기 개발 기간 등 기존 신약개발의 구조적 문제를 극복하고 난치성 질환 치료제 개발을 앞당기기 위해 마련됐다.협약에 따라 양사는 ▲AI 기반 오가노이드 및 유전체 빅데이터 분석을 통한 신규 타깃 발굴 및 신약개발 ▲PDO(Patient-Derived Organoid,환자 유래 오가노이드)를 활용한 다양한 암종의 약물 반응 분석 및 정밀의료 기반 약물 스크리닝 ▲hiPSC(human induced Pluripotent Stem Cell, 역분화 줄기세포) 기반 뇌 오가노이드를 활용한 알츠하이머병, 타우병증 등 난치성 뇌질환 후보물질 유효성 검증을 위해 협력한다.그래디언트 바이오컨버전스는 임직원의 약 80% 이상이 연구진으로 구성된 기업으로 약1,000 종의 PDO와 유전체 정보(NGS) 데이터 기반의 오가노이드 뱅킹 시스템을 보유하고 있다. 독자적인 AI 플랫폼과 오가노이드 및 크리스퍼 유전자 가위(CRISPR-Cas9) 기술을 통해 신규 항암 타깃을 발굴하며, iPSC(induced Pluripotent Stem Cell, 유도만능줄기세포) 유래 오가노이드 구축 및 약물 스크리닝 서비스 등의 핵심 플랫폼을 보유한 오가노이드 기반 타깃 발굴 전문 기업이다.그래디언트 바이오컨버전스 이진근 대표는 “그래디언트 바이오컨버전스의 오가노이드 플랫폼과 동아에스티의 신약개발 역량이 만나, 신약개발 초기 단계의 정밀성과 효율성을 크게 높일 수 있을 것“이라며 “양사의 기술력과 자원을 결합해 신약개발을 더욱 신속하고 효과적으로 이끌어가겠다”고 말했다.동아에스티 김미경 연구본부장은 “양사가 보유한 기술력과 연구 역량이 결합되면 독자적인 약물 타깃 발굴과 효과적인 후보물질 선정이 가능해질 것이다”며 “그래디언트 바이오컨버전스와 긴밀히 협력해 혁신적인 연구 성과를 창출하고 글로벌 신약개발 경쟁력을 강화해 나가겠다”고 말했다.2025-08-22 09:44:08노병철 -
 글로벌제약, 스몰딜 잇단 성사…희귀질환 신약 러브콜[데일리팜=손형민 기자] 올해 상반기 글로벌 제약업계의 인수합병(M&A)은 희귀질환 분야에 초점이 맞춰졌다. 주요 글로벌제약사들은 M&A를 통해 중추신경질환(CNS), 세포치료제, 알츠하이머병 치료제, 심혈관계 치료제 등 다양한 희귀질환 파이프라인을 확보했다.CAR-T·조현병 치료제 등 희귀질환 영역에 집중27일 관련 업계에 따르면 GSK, 존슨앤드존슨, 사노피, 노바티스, 릴리, 사노피 등 주요 글로벌 제약사들이 올해 상반기 M&A를 통해 추가 파이프라인 확보에 나섰다.GSK는 올해 첫 딜을 성사시켰다. 이 회사는 지난 1월 열린 JP모건헬스케어 컨퍼런스를 통해 위장암 치료제를 개발하고 있는 미국 생명공학 회사 IDRx를 11억 5000만달러(약 1조7000억원)에 인수했다. 선급금은 10억 달러다.이번 거래로 GSK는 IDRx의 표적항암제 후보물질 ‘IDRX-42’을 확보했다. IDRX-42는 위장관기질종양에서 80% 비율로 발현되는 KIT 유전자 변이를 타깃한다. IDRX-42는 기존 표적치료제와 달리 임상적으로 유의미한 KIT 돌연변이의 전체 스펙트럼을 억제할 수 있는 잠재력을 갖고 있다는 평가를 받고 있다.GSK는 면역항암제 ‘젬퍼리’의 적응증 확대, B7-H3 표적 항체약물접합체(ADC) 임상 등에 IDRX-42 병용요법 가능성을 확인한다.존슨앤드존슨도 지난 1월 미국 바이오제약기업 인트라-셀룰러를 인수하며 146억달러(약21조 5000억원)를 지출했다. 이 회사는 이번 인수로 미국에서 승인된 조현병, 양극성 장애 치료제 '캐플리타'를 파이프라인에 추가했다.캐플리타는 세로토닌 5-HT2A 수용체 점유율이 높고 도파민 D2 수용체 점유율은 낮다는 특징을 갖고 있다. 존슨앤드존슨은 캐플리타의 연간 매출액이 50억 달러 이상을 기록할 것으로 내다봤다.아스트라제네카는 지난 3월 벨기에 생명공학사 에소바이오텍을 인수했다. 계약 규모는 최대 10억 달러다. 이번 인수로 아스트라제네카는 생체내(in vivo) 기반 키메릭항원수용체 T세포(CAR-T) 치료제 분야에 분격 뛰어들었다. 이 회사는 지난 2023년 세포치료제 개발사 그라셀 바이오테크를 인수한 바 있다.에소바이오텍은 렌티바이러스 기반 유전자 전달 기술을 활용해, 환자 체내의 T세포에 직접 유전자를 삽입하는 기술을 보유하고 있다. ‘ENaBL(Engineered NanoBody Lentiviral)’로 명명된 이 플랫폼은 정맥주사 한 번만으로 체내 CAR-T 세포를 유도할 수 있다. 심혈관계 질환 치료제 등 순환기 영역도 집중최근에는 항암제뿐만 아니라 심혈관계 질환 치료제에서도 집중하는 글로벌제약사들이 늘어나고 있다.지난 2월 노바티스는 심혈관질환 치료제 개발사 안토스 테라퓨틱스를 31억 달러에 인수했다. 이번 인수는 항응고제 분야에서의 경쟁력 강화를 목표한 노바티스의 전략적 결정이다.안토스의 핵심 파이프라인은 후천성 혈전증 예방 신약후보물질 아벨라시맙으로, 기존 항응고제 대비 출혈 위험을 현저히 줄일 수 있는 기전으로 주목받고 있다.아벨라시맙은 XIIa 인자 억제제 계열의 신규 작용제로, 정맥혈전색전증(VTE) 예방을 포함해 심방세동 환자 대상 적응증 확보를 목표하고 있다. 현재 아벨리시맙은 임상 3상에 진입해 있으며, 기존 항응고제 대비 출혈 안전성 측면에서 유리한 데이터가 일부 확보된 상태다.또 노바티스는 5월 레귤러스 테라퓨틱스를 17억 달러에 인수하며 신장질환 RNA 치료제도 확보했다.레귤러스는 마이크로RNA(miRNA) 조절 플랫폼을 기반으로 다양한 신장질환 치료제를 개발하고 있다. 특히 주목받는 신약후보물질은 RGLS8429다. 이 신약후보물질은 miR-21을 표적해 염증과 섬유화를 억제함으로써 신장 기능 저하를 방지하는 작용기전을 갖고 있다. RGLS8429는 현재 알포트증후군 환자 대상 임상 2상에 진입한 상태로, 초기 데이터에서 신장기능 개선을 유의미하게 입증했다는 평가를 받고 있다.노바티스는 이번 인수를 통해 기존의 신장·심혈관 치료제 포트폴리오에 RNA 기반 혁신 치료제를 접목해 중장기적으로 항섬유화 치료제 시장의 주도권을 노린다는 전략이다사노피는 TREM2 항체를 주목하고 있다. 사노피는 지난달 비질 뉴로사이언스(Vigil Neuroscience)를 인수했다. 계약 규모는 총 4억7000만 달러(약 6400억원)다. 이번 인수로 사노피는 TREM2 항체 활성화에 관여하는 소분자 제제 ‘VG-3927’을 확보했다.TREM2는 수지상세포 표면에 발현돼 면역 반응을 조절하는 중요한 분자다. 특히 항원 제시, 면역 활성화, 뇌 기능 유지 등 다양한 생물학적 과정에 관여하며, 신경 질환 및 염증 질환 연구에서 중요한 표적으로 간주된다.특히 기존 항체들이 혈중 가용 STREM2(soluble TREM2)에 비특이적으로 결합해 효과가 제한됐던 것과 달리 VG-3927은 세포막 상 수용체에만 작용해 미세아교세포 기능 활성화를 극대화할 수 있다는 강점이 있다. 사노피는 올해 3분기 중 VG-3927의 임상 2상을 착수할 계획이다.일라이릴리는 버브 테라퓨틱스를 인수에 13억 달러를 지출하며 차세대 유전자 편집 기반 심혈관 치료제 개발에 착수했다.버브 테라퓨틱스는 크리스퍼(CRISPR) 유전자 편집 기술을 기반으로 심혈관질환의 근본 원인을 차단하는 접근법을 개발 중이며, 주요 파이프라인은 고콜레스테롤혈증 치료용 유전자 편집 신약후보물질 'VERVE-101'이다.VERVE-101은 PCSK9 유전자를 영구적으로 불활성화시켜, 단 1회 투여만으로도 지속적인 LDL 콜레스테롤 수치를 낮추는 효과를 목표로 한다. 현재 미국과 영국에서 이상지질혈증 및 유전성 고콜레스테롤혈증 환자 대상 임상 1/2상이 진행 중이며, 중간 분석에서 지속적이고 유의미한 LDL 감소 효과가 보고된 바 있다.릴리는 이번 인수를 통해 CRISPR 기술을 활용한 심혈관질환 치료 영역에 조기 진입하는 동시에, 기존 GLP-1 계열 대사질환 치료제와 적응증 연계 시너지를 창출할 것으로 기대하고 있다.2025-06-27 12:00:19손형민
글로벌제약, 스몰딜 잇단 성사…희귀질환 신약 러브콜[데일리팜=손형민 기자] 올해 상반기 글로벌 제약업계의 인수합병(M&A)은 희귀질환 분야에 초점이 맞춰졌다. 주요 글로벌제약사들은 M&A를 통해 중추신경질환(CNS), 세포치료제, 알츠하이머병 치료제, 심혈관계 치료제 등 다양한 희귀질환 파이프라인을 확보했다.CAR-T·조현병 치료제 등 희귀질환 영역에 집중27일 관련 업계에 따르면 GSK, 존슨앤드존슨, 사노피, 노바티스, 릴리, 사노피 등 주요 글로벌 제약사들이 올해 상반기 M&A를 통해 추가 파이프라인 확보에 나섰다.GSK는 올해 첫 딜을 성사시켰다. 이 회사는 지난 1월 열린 JP모건헬스케어 컨퍼런스를 통해 위장암 치료제를 개발하고 있는 미국 생명공학 회사 IDRx를 11억 5000만달러(약 1조7000억원)에 인수했다. 선급금은 10억 달러다.이번 거래로 GSK는 IDRx의 표적항암제 후보물질 ‘IDRX-42’을 확보했다. IDRX-42는 위장관기질종양에서 80% 비율로 발현되는 KIT 유전자 변이를 타깃한다. IDRX-42는 기존 표적치료제와 달리 임상적으로 유의미한 KIT 돌연변이의 전체 스펙트럼을 억제할 수 있는 잠재력을 갖고 있다는 평가를 받고 있다.GSK는 면역항암제 ‘젬퍼리’의 적응증 확대, B7-H3 표적 항체약물접합체(ADC) 임상 등에 IDRX-42 병용요법 가능성을 확인한다.존슨앤드존슨도 지난 1월 미국 바이오제약기업 인트라-셀룰러를 인수하며 146억달러(약21조 5000억원)를 지출했다. 이 회사는 이번 인수로 미국에서 승인된 조현병, 양극성 장애 치료제 '캐플리타'를 파이프라인에 추가했다.캐플리타는 세로토닌 5-HT2A 수용체 점유율이 높고 도파민 D2 수용체 점유율은 낮다는 특징을 갖고 있다. 존슨앤드존슨은 캐플리타의 연간 매출액이 50억 달러 이상을 기록할 것으로 내다봤다.아스트라제네카는 지난 3월 벨기에 생명공학사 에소바이오텍을 인수했다. 계약 규모는 최대 10억 달러다. 이번 인수로 아스트라제네카는 생체내(in vivo) 기반 키메릭항원수용체 T세포(CAR-T) 치료제 분야에 분격 뛰어들었다. 이 회사는 지난 2023년 세포치료제 개발사 그라셀 바이오테크를 인수한 바 있다.에소바이오텍은 렌티바이러스 기반 유전자 전달 기술을 활용해, 환자 체내의 T세포에 직접 유전자를 삽입하는 기술을 보유하고 있다. ‘ENaBL(Engineered NanoBody Lentiviral)’로 명명된 이 플랫폼은 정맥주사 한 번만으로 체내 CAR-T 세포를 유도할 수 있다. 심혈관계 질환 치료제 등 순환기 영역도 집중최근에는 항암제뿐만 아니라 심혈관계 질환 치료제에서도 집중하는 글로벌제약사들이 늘어나고 있다.지난 2월 노바티스는 심혈관질환 치료제 개발사 안토스 테라퓨틱스를 31억 달러에 인수했다. 이번 인수는 항응고제 분야에서의 경쟁력 강화를 목표한 노바티스의 전략적 결정이다.안토스의 핵심 파이프라인은 후천성 혈전증 예방 신약후보물질 아벨라시맙으로, 기존 항응고제 대비 출혈 위험을 현저히 줄일 수 있는 기전으로 주목받고 있다.아벨라시맙은 XIIa 인자 억제제 계열의 신규 작용제로, 정맥혈전색전증(VTE) 예방을 포함해 심방세동 환자 대상 적응증 확보를 목표하고 있다. 현재 아벨리시맙은 임상 3상에 진입해 있으며, 기존 항응고제 대비 출혈 안전성 측면에서 유리한 데이터가 일부 확보된 상태다.또 노바티스는 5월 레귤러스 테라퓨틱스를 17억 달러에 인수하며 신장질환 RNA 치료제도 확보했다.레귤러스는 마이크로RNA(miRNA) 조절 플랫폼을 기반으로 다양한 신장질환 치료제를 개발하고 있다. 특히 주목받는 신약후보물질은 RGLS8429다. 이 신약후보물질은 miR-21을 표적해 염증과 섬유화를 억제함으로써 신장 기능 저하를 방지하는 작용기전을 갖고 있다. RGLS8429는 현재 알포트증후군 환자 대상 임상 2상에 진입한 상태로, 초기 데이터에서 신장기능 개선을 유의미하게 입증했다는 평가를 받고 있다.노바티스는 이번 인수를 통해 기존의 신장·심혈관 치료제 포트폴리오에 RNA 기반 혁신 치료제를 접목해 중장기적으로 항섬유화 치료제 시장의 주도권을 노린다는 전략이다사노피는 TREM2 항체를 주목하고 있다. 사노피는 지난달 비질 뉴로사이언스(Vigil Neuroscience)를 인수했다. 계약 규모는 총 4억7000만 달러(약 6400억원)다. 이번 인수로 사노피는 TREM2 항체 활성화에 관여하는 소분자 제제 ‘VG-3927’을 확보했다.TREM2는 수지상세포 표면에 발현돼 면역 반응을 조절하는 중요한 분자다. 특히 항원 제시, 면역 활성화, 뇌 기능 유지 등 다양한 생물학적 과정에 관여하며, 신경 질환 및 염증 질환 연구에서 중요한 표적으로 간주된다.특히 기존 항체들이 혈중 가용 STREM2(soluble TREM2)에 비특이적으로 결합해 효과가 제한됐던 것과 달리 VG-3927은 세포막 상 수용체에만 작용해 미세아교세포 기능 활성화를 극대화할 수 있다는 강점이 있다. 사노피는 올해 3분기 중 VG-3927의 임상 2상을 착수할 계획이다.일라이릴리는 버브 테라퓨틱스를 인수에 13억 달러를 지출하며 차세대 유전자 편집 기반 심혈관 치료제 개발에 착수했다.버브 테라퓨틱스는 크리스퍼(CRISPR) 유전자 편집 기술을 기반으로 심혈관질환의 근본 원인을 차단하는 접근법을 개발 중이며, 주요 파이프라인은 고콜레스테롤혈증 치료용 유전자 편집 신약후보물질 'VERVE-101'이다.VERVE-101은 PCSK9 유전자를 영구적으로 불활성화시켜, 단 1회 투여만으로도 지속적인 LDL 콜레스테롤 수치를 낮추는 효과를 목표로 한다. 현재 미국과 영국에서 이상지질혈증 및 유전성 고콜레스테롤혈증 환자 대상 임상 1/2상이 진행 중이며, 중간 분석에서 지속적이고 유의미한 LDL 감소 효과가 보고된 바 있다.릴리는 이번 인수를 통해 CRISPR 기술을 활용한 심혈관질환 치료 영역에 조기 진입하는 동시에, 기존 GLP-1 계열 대사질환 치료제와 적응증 연계 시너지를 창출할 것으로 기대하고 있다.2025-06-27 12:00:19손형민 -
 세계 첫 텔로머레이스 억제제 '라이텔로'...국내 도입 예상5편: First-in-class 텔로머레이스 억제제, 골수이형성증후군 치료제 '라이텔로(Imetelstat)' 라이텔로(RyteloⓇ, 성분명: 이메텔스타트, Imetelstat, Geron)는 세계 최초의 올리고뉴클레오타이드 텔로머레이스 억제제(Oligonucleotide telomerase inhibitor)로 2024년 6월 미국 FDA와 2025년 3월 유럽 EMA에서 '적혈구 자극제(ESA)에 반응하지 않거나 효과가 소실되었거나 투여가 불가능한, 수혈 의존성 빈혈이 있으며 8주 동안 적어도 4단위 이상의 적혈구 수혈이 필요한 저위험에서 중간 1단계 위험군의 성인 골수이형성증후군(low-to intermediate-1 risk myelodysplastic syndromes, MDS) 환자 치료'에 승인되었다.대부분의 암세포 및 암 전구세포(cancer progenitor cells)는 높은 텔로머레이스 활성과 텔로미어 유지 능력을 통해 세포가 정상적인 복제 제한 없이 무한히 분열할 수 있는 능력(세포 불사성, cellular immortality)을 가지게 되므로, 텔로머레이스는 암 치료의 유망한 표적 중 하나가 된다이러한 기전에 기반하여 개발된 이메텔스타트는 텔로머레이스를 표적으로 하는 13개 염기 서열의 올리고뉴클레오타이드로, 인간 텔로머레이스 RNA(human telomerase RNA, hTR)의 주형(template) 영역에 선택적으로 결합하여 텔로머레이스 활성을 경쟁적으로 억제함으로써 암세포를 사멸한다.이메텔스타트의 약동학(PK), 약력학(PD), 용량-반응 관계(dose-response relationship), 유효성 및 안전성은 고형암 및 혈액암을 포함한 다양한 종양 모델에서 in vitro, in vivo, 그리고 임상시험을 통해 평가되었다. 특히, 저위험 골수형성이상증후군(LR-MDS) 및 골수증식성 종양을 포함한 혈액질환을 대상으로 한 연구가 집중적으로 수행되었다.핵심 3상 임상시험인 IMerge 연구에 따르면, 이메텔스타트 투여군은 위약군 대비 8주 및 24주 이상에서 적혈구 수혈 비의존성(red blood cell-transfusion independence, RBC-TI)에 도달한 환자의 비율이 통계적으로 유의하게 높았으며, 주요 이상반응으로는 일시적이며 조절 가능한 호중구감소증(neutropenia) 및 혈소판감소증(thrombocytopenia)이 관찰되어, 전반적으로 관리 가능한 안전성 프로파일을 보였다.저위험에서 중간 1단계 위험군의 성인 골수이형성증후군(Low-to intermediate-1 risk myelodysplastic syndromes, MDS)은 무엇인가?골수이형성증후군(MDS)은 혈액 생성 줄기세포의 클론성 이상으로 인해 발생하는 혈액 종양 질환군으로, 골수 내 이형성(dysplasia)과 비효율적인 조혈(hematopoiesis)을 특징으로 한다. 이 질환은 빈혈, 백혈구 감소증, 혈소판 감소증 등의 다양한 혈구감소증(cytopenia)이 나타날 수 있다.일부 MDS 환자는 급성 골수성 백혈병(AML)으로 진행되기도 하여, 임상 경과를 더욱 복잡하게 만든다. MDS 환자의 예후는 매우 다양하며, 염색체 이상 및 혈구감소증의 중증도와 같은 요인에 따라 영향을 받는다. 따라서, MDS 환자의 임상 경과와 치료 반응은 매우 다양하므로, 정확한 예후 분류는 치료 전략 수립 및 예후 예측에 있어 필수적이다.가장 널리 사용되는 예후 평가 시스템은 1997년 제시된 국제 예후 점수 시스템( International Prognostic Scoring System, IPSS)이며, 골수 내 아세포(blast) 비율, 세포유전학적 이상(cytogenetics), 혈구감소증의 수 등 세 가지 지표를 기반으로 환자를 위험(Low), 중간-1위험(Intermediate-1), 중간-2위험(Intermediate-2), 고위험(High)의 네 군으로 분류한다.이 중 저위험에서 중간-1위험군(low-to intermediate-1 risk)은 IPSS 점수 기준으로 0~1.0점에 해당하며, 비교적 안정된 임상 경과를 보이고, 적혈구 자극제(ESA)나 보존적 치료 등의 저강도 요법이 우선적으로 고려된다.2012년에는 기존 IPSS의 한계를 보완하기 위해 개정된 국제 예후 점수 시스템(IPSS-R)이 제안되었다. IPSS-R은 세포유전학적 이상을 5단계로 세분화하고, 골수 아세포 비율, 혈색소 농도, 혈소판 수, 절대 호중구 수 등 보다 정량적인 지표를 반영함으로써 환자를 매우 저위험(very low), 저위험(low), 중간위험(intermediate), 고위험(high), 매우 고위험(very high)의 5단계로 분류한다. 이 중 IPSS-R의 저위험 및 중간위험군은 대체로 기존 IPSS의 저위험 및 중간-1위험군과 대응된다.저위험~중간-1위험군 MDS 환자는 일반적으로 생존 기간이 길고, 급성 골수성 백혈병(AML)으로의 진행 위험이 낮은 편이나, 수혈 의존성 빈혈, 증상성 혈구감소증, 분자 유전학적 이상 유무에 따라 치료 방법의 세분화가 필요하다. 최근에는 유전자 변이 기반의 위험도 분류가 병용되며, 보다 정밀한 예후 예측과 치료 맞춤화에 기여하고 있다.이러한 MDS는 텔로미어(telomere) 단축과 관련된 조혈 줄기세포 기능 저하와 병적 클론의 형성을 특징으로 하며, 일부 클론은 텔로머레이스(telomerase)를 재활성화하여 불사성(immortality)을 획득하고 질환의 진행에 관여한다. 텔로머레이스는 이러한 병태생리적 역할로 인해 MDS에서 유망한 치료 표적이 된다.텔로미어(Telomere)는 어떤 물질인가? 2009년 노벨 생리의학상은 엘리자베스 블랙번(Elizabeth Blackburn), 캐럴 그라이더(Carol Greider), 잭 쇼스택(Jack Szostak)에게 수여되었다. 이들은 염색체 말단에 위치한 특수한 반복 서열 구조인 텔로미어(telomere)와 그 유지에 관여하는 효소인 텔로머레이스(telomerase)를 규명함으로써, 세포 분열 과정에서 유전 정보가 어떻게 안정적으로 보존되는지를 설명하는 데 기여하였다.노벨위원회는 "이들 세 명의 연구는 염색체가 세포 분열 과정 중 퇴화를 방지하고, 완전하게 복제될 수 있는지를 둘러싼 오랜 생물학적 의문에 대한 해답을 제공하였다"고 평가하였다.텔로미어에는 세포의 염색체 말단에 반복적인 DNA 서열이 존재하며, 이는 유전물질의 손상을 방지하고 염색체의 구조적 안정성을 유지하는 역할을 수행한다. 그러나 체세포는 분열을 반복할수록 텔로미어 길이(telomere length)가 '모래시계'처럼 점진적으로 짧아지며, 일정 임계점에 도달하면 세포는 증식을 멈추고 세포 노화(senescence)나 세포자멸사사(apoptosis)를 유도하게 된다(Figure 1).이때 텔로머레이스는 텔로미어의 말단을 연장할 수 있는 효소로 세포의 수명을 연장시키고, 이론적으로는 세포의 불사성(immortality)를 유도할 가능성을 지닌다. 이러한 텔로미어는 생물체의 노화 과정과 직접적으로 연관되어 있고, 또한 대부분의 암세포는 텔로머레이스의 활성을 통해 텔로미어 길이를 유지하거나 연장함으로써 무한 증식 능력을 가지게 된다. 즉, 텔로미어 단축은 세포 노화를 유도하는 반면, 텔로미어 보존은 암세포의 지속적 증식을 가능하게 한다. 따라서, 텔로미어 기능의 조절은 노화 억제 혹은 암 치료를 위한 잠재적 전략으로 제시되고 있다.텔로머레이스(Telomerase)란 무엇인가? 텔로머레이스(Telomerase)는 염색체 말단에 있는 3' 말단 돌출부(3' overhang)에 반복적인 염기서열을 추가하는 기능을 가진 리보핵단백질 복합체(ribonucleoprotein complex)로, 역전사효소(reverse transcriptase) 활성을 갖는다. 3' 말단 돌출부는 이중가닥 DNA 말단에서 한 가닥이 다른 가닥보다 더 길어 돌출된 형태로, 텔로미어 구조에서 텔로머레이스가 인식하고 작용하는 주요 부위이다.텔로머레이스는 자체의 RNA 구성요소인 TERC(telomerase RNA component)를 주형(template)으로 삼아, TERT(telomerase reverse transcriptase)의 역전사 효소 활성을 통해 반복적인 TTAGGG 염기서열을 합성함으로써 염색체 말단의 텔로미어를 연장한다(Figure 2). 인간의 경우, 텔로머레이스는 인간 텔로머레이스 역전사효소(human telomerase reverse transcriptase, hTERT) 유전자에 의해 암호화되는 촉매 소단위(catalytic subunit)와 인간 텔로머레이스 RNA(human telomerase RNA, hTR) 유전자 산물인 RNA 주형(template)을 중심으로 구성된 복합체이다. 여기에 dyskerin, NHP2, NOP10, GAR1 등 다양한 보조 단백질들이 결합하여, 효소 복합체의 구조적 안정성과 기능적 활성을 조절한다.텔로머레이스를 ‘자동차’ 전체에 비유한다면, TERT는 실제로 DNA를 합성하는 역할을 수행하는 ‘엔진’에 해당하며, hTR(또는 TERC)는 어떤 염기서열을 합성할지를 지시하는 ‘설계도’에 해당하는 RNA 주형으로 볼 수 있다.인체 내 약 120여 종의 세포 중 대부분은 텔로미어를 합성하는 효소인 텔로머레이스의 활성을 갖지 않으며, 이로 인해 세포는 분열이 반복될수록 텔로미어가 점진적으로 단축되고, 결국 복제에 따른 세포 노화(replicative senescence)에 도달하게 된다. 반면, 일부 높은 분열 능력을 가진 조직의 세포들은 예외적으로 텔로머레이스 활성을 유지한다.이러한 세포에는 모낭(hair follicle), 구강 편평상피(squamous epithelium), 피부 표피의 기저층(basal layer of epidermis), 제2형 폐포상피세포(type 2 alveolar epithelial cells), 간세포(hepatocytes), 장의 장선(intestinal crypts), 정원세포(spermatogonia) 등이 있다. 이들 세포에서 텔로머레이스 활성이 결여될 경우, 조직의 항상성 유지 및 생식 기능에 중대한 장애가 초래된다.특히, 정자 형성에 관여하는 정원세포(spermatogonia)에서 텔로머레이스 활성이 결여되면, 정자의 텔로미어 길이가 충분히 유지되지 못하고 단축된 상태로 전달된다. 이로 인해 형성된 배아는 텔로미어 단축에 기인한 세포 노화가 조기에 시작되며, 조기 노화(progeria)와 유사한 양상을 보일 수 있다. 실제로 이는 복제 양 돌리(Dolly) 사례에서 관찰된 바 있으며, 단축된 텔로미어가 수명 감소와 밀접하게 연관됨을 시사한다.이는 일반적인 체세포에서는 텔로머레이스 활성이 매우 낮은 수준으로 유지하지만, 생식세포와 줄기세포에서는 해당 효소가 구성효소(constitutive enzyme)로서 지속적으로 발현된다. 구성효소는 소화효소와 같이 항상 일정 수준으로 활성화되어 있는 효소이다.이에 반해 유도효소(inducible enzyme)는 특정 자극(예: 약물, 독성물질 등)에 의해 후천적으로 유도되는 효소이다. 이러한 분류 기준에 따라 텔로머레이스는 생식세포 및 줄기세포에서 구성효소로 기능하며, 암세포에서는 구성효소 및 유도효소적 특성을 보이는 이중적 성격을 가진다고 볼 수 있다.줄기세포 중에서도 배아줄기세포(embryonic stem cells) 및 유도만능줄기세포(induced pluripotent stem cells)는 고도로 안정된 텔로머레이스 활성을 보이며, 이로 인해 세포 분열에 따른 텔로미어의 단축이 거의 발생하지 않고, 복제에 따른 세포 노화에도 이르지 않는다.반면, 중간엽줄기세포(mesenchymal stem cells), 신경줄기세포(neural stem cells), 조혈모세포(hematopoietic stem cells) 등 성체 유래 줄기세포에서는 텔로머레이스 활성이 상대적으로 낮으며, 이로 인해 제한적인 텔로미어 단축이 관찰된다.TERT(Telomerase reverse transcriptase)란 무엇인가? 대부분의 체세포는 약 60~80회의 분열(population doublings) 이후 텔로미어가 임계 길이에 도달하게 되며, 이 시점에서 이중가닥 DNA 절단(double-strand break) 신호가 유도되어 복제에 따른 노화로 전환된다.이러한 현상은 체세포 내에서 텔로머레이스 활성이 거의 존재하지 않기 때문에 발생하는데, 이는 텔로머레이스의 RNA 구성 요소인 TERC(hTR)가 존재하더라도, 촉매 활성을 담당하는 TERT 유전자의 전사가 억제되어 있기 때문이다. 따라서, TERT 발현의 억제는 체세포에서 텔로머레이스 활성이 결핍되는 주요 원인이며, 텔로미어 단축의 분자적 기전으로 작용한다.뿐만 아니라, TERT는 단순한 텔로미어 연장 기능 외에도 텔로미어 말단의 캡핑(capping)과 전체 구조 유지에도 중요한 역할을 한다. 이는 다양한 암종의 약 80~90%에서는 TERT 발현이 재활성화되어 텔로머레이스 활성이 증가되어 있으며, 암세포의 불사화와 밀접하게 연관되어 있다.결과적으로, TERT 발현은 텔로미어 연장과 세포 노화 회피를 통해 암세포 특성이 획득되는 초기 단계에서 결정적인 분자 표지자로 작용한다. 이러한 TERT 발현 유도는 다양한 내•외부 요인 중 유전자 불안정성과 돌연변이가 가장 대표적인 기전으로 제시되고 있다.암의 발생 과정에서 텔로미어 길이의 보존이 빈번히 동반되며, 이는 주로 인간 텔로머레이스 역전사효소(hTERT)의 발현 증가에 따른 텔로머레이스 활성의 재개로 설명된다. 따라서 TERT의 발현 조절 기전은 텔로머레이스 기반 항암 치료법의 핵심 표적으로 주목받고 있으며, 암세포 특이적 바이오마커로서의 임상적 활용 가능성 또한 높다.텔로머레이스와 암과의 관계는 어떠한가? 텔로머레이스의 비정상적인 재활성화는 암세포에서 흔히 관찰되는데, 이는 텔로미어 단축으로 유도되는 세포자멸사를 회피하고 무한 증식 능력을 획득하는 데 핵심적인 기전으로 작용한다. 실제로, 전체 고형암 및 혈액암의 약 90% 이상에서 텔로머레이스 활성이 현저히 증가되어 있음이 관찰된다.여러 암 조직 생검에서 텔로머레이스 활성의 증가가 종양의 병기 및 악성도와 유의한 상관관계를 보이는 반면, 대부분의 정상 성인 조직에서는 텔로머레이스 활성이 거의 검출되지 않으며, 일부 조혈모세포나 면역세포에서만 일시적으로 나타나는 것으로 알려져 있다.이는 암세포 및 암전구세포에서 공통적으로 관찰되는 높은 수준의 텔로머레이스 발현과 텔로미어 유지 현상을 억제하여 암세포의 증식을 제한하는 치료 방법이 된다.특히, RNA 기반 치료법은 텔로머레이스의 RNA 구성요소인 hTR 또는 hTERT mRNA를 표적으로 하여 효소 활성을 간접적으로 억제하는 방식으로 주목받고 있다. 이 중 안티센스 올리고뉴클레오타이드(antisense oligonucleotides, ASO) 및 RNA 간섭(small interfering RNA, siRNA) 기술은 텔로머레이스 기능을 선택적으로 차단할 수 있는 새로운 접근법이다.대표적 예로는 이멜스타트(Imetelstat)가 있으며, 이는 인간 텔로머레이스 RNA(hTR)의 주형 영역에 상보적으로 결합하는 리간드 결합형 ASO로 설계되어, 텔로미어 연장 과정을 억제함으로써 암세포의 증식 억제를 유도한다. 이와 같은 RNA 기반 접근은 텔로머레이스 억제를 통한 항암 치료의 새로운 패러다임을 제시하며, 표적 치료제 개발에 있어 중요한 진전을 이끌고 있다.텔로머레이스 억제를 통한 항암 치료 전략은? 텔로머레이스를 표적으로 한 항암제 개발은 다양한 작용기전을 바탕으로 다방면에서 진행되고 있으며, 크게 RNA 기반 억제제, 전사 억제 화합물, G-사중나선 안정화제, 그리고 면역치료 백신 전략으로 구분할 수 있다.1. RNA 기반 억제제 가장 활발히 연구되고 있는 접근은 안티센스 올리고뉴클레오타이드(ASO) 또는 RNA 간섭(siRNA) 기술을 활용하여 텔로머레이스 RNA 구성요소(hTR 또는 TERC)를 표적으로 하는 전략이다. 이들 억제제는 텔로머레이스 복합체 내의 RNA 주형에 상보적으로 결합함으로써 효소 활성을 억제하거나, RNase H 의존적 분해를 유도하여 텔로머레이스 기능을 근본적으로 차단한다.대표적 약제인 이멜스타트(Imetelstat)는 티오포스포라마이드(thio-phosphoramidate) 변형을 적용한 ASO로, hTR의 템플릿 영역에 결합하여 텔로미어 연장을 저해한다.2. hTERT 전사 억제 저분자 화합물 이 저분자 화합물은 텔로머레이스의 촉매 소단위인 hTERT 유전자의 전사를 직접 억제하는 방식으로, 프로모터 영역 조절 또는 후성유전학적 메커니즘을 통해 유전자 발현 자체를 낮춘다. 일부 저분자 화합물은 hTERT 단백질에 직접 결합하여 효소 활성을 차단한다. 식물 유래 플라보노이드(예: genistein)가 TERT 전사를 억제하는 기능이 보고된 바 있으나 낮은 선택성과 잠재적인 세포독성으로 인해 임상 적용에는 제한이 있다.3. G-사중나선(G-quadruplex) 안정화제 이 안정화제는 텔로미어 말단에서 형성되는 G-사중나선 구조를 안정화시켜 텔로머레이스의 접근을 물리적으로 차단하는 방식이다. 해당 구조는 G-rich 반복 서열에서 자연적으로 형성되며, 일부 저분자 화합물은 이 구조에 특이적으로 결합하여 G-quadruplex 형태의 유지 및 안정화를 유도한다.이 방법은 효소가 아닌 기질을 표적으로 한다는 점에서 기존 억제제와 구별되며, 비교적 빠른 약효 발현이 가능하다. 그러나 G-rich 서열이 텔로미어 외에도 다양한 유전자의 조절부위에 존재하기 때문에, 표적 특이성 확보가 주요 과제로 남아 있다.4. 텔로머레이스를 항원으로 활용한 면역치료 텔로머레이스를 면역계의 표적으로 활용하는 전략도 개발되고 있다. 이는 hTERT 유래 펩타이드를 기반으로 하는 항암 백신을 통해, 텔로머레이스를 발현하는 종양세포를 면역세포가 인식하고 제거하도록 유도한다. 비소세포폐암(NSCLC), 췌장암 등 다양한 고형암에서 임상시험이 진행되고 있으며, 면역기억 반응을 통한 재발 억제 효과가 기대된다. 다만, 환자의 HLA 유형 및 종양미세환경(TME)에 따라 치료 반응의 편차가 존재하여, 정밀한 환자 선별 전략이 병행되어야 한다.이와 같이 텔로머레이스 억제 전략은 암세포 특이성이 높고 장기적인 종양 억제 효과를 유도할 수 있다는 점에서 유망한 접근이다. 그러나 기전상 텔로미어 길이의 점진적 단축을 필요로 하므로, 치료 효과 발현까지 수 주에서 수 개월이 소요되는 경향이 있다. 또한, 일부 암에서는 텔로머레이스 비의존적인 대체적 길이 조절(ALT, alternative lengthening of telomeres) 경로가 활성화되어 있어 단독요법으로는 제한적일 수 있다.이러한 한계를 극복하기 위해, 최근에는 DNA 손상 유도제, 면역관문억제제(PD-1/PD-L1 억제제), PARP 억제제 등과의 병용요법이 시도되고 있다. 또한 텔로머레이스 발현 수준, 텔로미어 길이 상태, ALT 경로 활성 여부 등을 고려한 환자 맞춤형 정밀의학적 접근이 병행됨으로써, 텔로머레이스 억제제의 임상적 유용성은 점차 확대되고 있다.뉴클레오타이드(Nucleotide)와 합성 올리고뉴클레오타이드의 차이는? 뉴클레오타이드는 모든 생명체에 보편적으로 존재하는 저분자 유기 화합물로, DNA와 RNA와 같은 핵산의 기본 단위이며 에너지 전달(ATP, GTP), 세포 신호전달(cAMP, cGMP), 효소 보조인자(NAD⁺, FAD) 등의 생리적 기능에 필수적인 역할을 수행한다. 이러한 분자는 세포 내에서 de novo 합성 경로 또는 재활용 경로(salvage pathway)를 통해 지속적으로 생성되며, 생명 유지에 핵심적인 역할을 한다.이에 반해, 올리고뉴클레오타이드는 일반적으로 몇 개에서 수십 개의 뉴클레오타이드가 공유결합으로 연결된 짧은 핵산 서열로, 인공적으로 합성된 생체분자이다. 자연적으로는 microRNA나 small nuclear RNA와 같은 일부 예외적인 경우를 제외하면 생체 내에서 잘 합성되지 않으며, 주로 화학적으로 합성되어 특정 유전 서열의 인식이나 분자 기능의 조절을 목적으로 활용된다.합성 올리고뉴클레오타이드는 분자생물학, 진단, 치료, 유전자 조작 등 다양한 분야에서 핵심 도구로 활용되고 있으며, 기능, 표적, 화학적 변형에 따라 , 다음과 같이 분류된다.첫째, 기능적 측면에서 ▲ mRNA 또는 pre-mRNA에 결합하여 유전자 발현을 억제하거나 RNA 스플라이싱을 조절하는 안티센스 올리고뉴클레오타이드(antisense oligonucleotide, ASO), ▲ RNA 간섭(RNAi)을 유도하여 표적 mRNA의 분해를 유도하는 소간섭 RNA(siRNA) 또는 마이크로 RNA(miRNA) 유사체, ▲ 고특이적으로 단백질에 결합하여 기능을 저해하거나 조절하는 압타머(aptamer), ▲ CRISPR 시스템에서 유전자 편집을 유도하는 가이드 RNA(guide RNA, gRNA), ▲ 전사인자와 결합하여 표적 유전자 조절을 간섭하는 디코이(decoy), ▲ PCR, qPCR, 유전자 탐지 등 핵산 분석 기술에 사용하는 프라이머(primer) / 프로브(probe) 등으로 분류된다.둘째, 표적 및 작용기전에 따라 ▲ DNA, ▲ mRNA, ▲ pre-mRNA, 또는 단백질 등 다양한 분자에 작용할 수 있으며, 그 기전은 전사 억제, 번역 차단, RNA 스플라이싱 조절, 단백질-핵산 상호작용 차단 등으로 확장된다.셋째, 화학 구조적 변형 측면에서 천연형(natural-type) 외에도 약물 안정성 및 효율성을 개선하기 위한 다양한 화학적 변형이 도입된다. 대표적으로 ▲ 인산기 산소를 황으로 치환하여 핵산분해효소 내성 증가를 위한 phosphorothioate(PS), ▲ 리보스의 2′ 위치에 화학기 추가로 결합력과 안정성 증가를 위한 2′-O-methyl RNA 및 2′-fluoro RNA, ▲ 리보스 고정을 통해 고결합 친화성 및 특이성 확보한 locked nucleic acid(LNA), ▲ 간세포 타깃팅 또는 세포 내 전달력 향상을 위한 GalNAc 또는 지질을 접합시킨 conjugated oligonucleotide 등이 있으며, 이는 체내 안정성, 표적 결합력, 약물 전달 효율성을 향상시키는 데 기여한다.요약하면, 뉴클레오타이드는 생명체 내에서 합성되는 주요 생리활성 분자인 반면, 올리고뉴클레오타이드는 외부에서 합성되어 생체 내 특정 유전자나 분자 기전을 정교하게 조절하기 위한 인공 핵산 서열이라는 점에서, 양자는 생성 방식과 생리적 존재 양상에서 본질적으로 다르다. 그럼에도 불구하고, 올리고뉴클레오타이드는 자연계 핵산의 기능을 모방하거나 확장함으로써 차세대 핵산 기반 치료제 및 진단 기술의 핵심 플랫폼으로 부상하고 있다.ASO(Antisense Oligonucleotide, 안티센스 올리고뉴클레오타이드)란? ASO는 mRNA를 표적으로 설계된 짧은 합성 단일가닥 DNA 분자로, 특정 mRNA 서열과 상보적으로 결합함으로써 유전자 발현을 억제하거나 조절하는 기능을 수행한다(Figure. 3).ASO는 비교적 간단한 화학 구조를 기반으로 하면서도, 전사체의 분해 유도, RNA 스플라이싱 (splicing) 조절, 번역 억제 등 다양한 작용기전을 통해 유전 정보의 흐름을 정교하게 제어할 수 있는 장점을 가진다.ASO의 작용기전은 화학적 변형 방식과 결합 표적에 따라 다양하게 구분된다. 대표적으로 RNase H 매개 분해는 ASO가 표적 mRNA와 이중가닥을 형성한 후, 세포 내 RNase H 효소에 의해 해당 mRNA가 분해되어 단백질 생성을 원천적으로 차단하는 기전이다.또한, 스플라이싱 조절용 ASO는 pre-mRNA의 엑손/인트론 경계부에 결합하여, 엑손 스키핑(skipping) 또는 보존을 유도함으로써 단백질의 구조와 기능을 변형시킬 수 있다. 이 외에도 번역 개시 억제, mRNA 안정성 저해 등 다양한 방식으로 작용이 가능하다.이러한 특성을 바탕으로, ASO는 기존 소분자 화합물이나 단백질 기반 치료제와 달리 기능 상실(loss-of-function) 혹은 기능 획득(gain-of-function) 유전자 돌연변이 모두를 정교하게 조절할 수 있다.그러나 ASO 치료제는 면역반응 유발, 비표적 결합(off-target effect), 체내 약물 전달 효율 등의 한계를 지니고 있으며, 이를 극복하기 위해 phosphorothioate 치환, 2′-O-methyl 및 LNA 변형, GalNAc 결합을 통한 간세포 표적화, 지질 나노입자 기반 전달체 등 다양한 기술적 발전이 이루어지고 있다.이러한 발전은 ASO의 치료적 효능을 향상시키는 데 핵심적인 기여를 하고 있으며, ASO 기반 핵산 치료제가 차세대 정밀의학 기반의 분자표적 치료제로 자리매김할 수 있는 가능성을 높이고 있다.텔로머레이스 표적 올리고뉴클레오타이드(Telomerase-targeted oligonucleotide, TTO)란? TTO는 표적 핵산 서열에 상보적으로 결합하는 구조를 가지면서도, 기존의 ASO와는 본질적으로 다른 작용기전을 가진다. 즉 일반적인 ASO는 mRNA의 분해(RNase H 의존적 경로) 또는 스플라이싱 조절을 통해 단백질 생성을 억제하지만, TTO는 hTR의 템플릿 서열에 직접 결합함으로써 텔로머레이스 효소 복합체의 활성 부위를 차단한다. 이는 효소의 기질 인식 및 촉매 반응 자체를 방해하는 비정형(non-canonical) ASO로 분류된다.이러한 TTO는 효소 작용 자체의 차단을 통해 효소 기능 차단(enzyme activity inhibition)이라는 새로운 패러다임을 제공한다. 특히 텔로머레이스 활성이 높은 암세포에서 선택적으로 작용함으로써, 정상세포에 대한 영향을 최소화하면서 암 특이적 억제 효과를 유도할 수 있다.대표적인 TTO로는 이메텔스타트(Imetelstat)가 있으며, 이는 hTR의 템플릿 영역에 상보적으로 결합하는 티오인산화(thio-phosphoramidate) 올리고뉴클레오타이드로 설계되었다.이메텔스타트는 어떤 약제인가? 이메텔스타트(Imetelstat, 제품명: 라이텔로 정맥주사, Rytelo®)는 텔로머레이스를 직접 표적으로 하는 최초의 올리고뉴클레오타이드 기반 치료제로, 2024년 미국 FDA로부터 승인받은 이후 골수이형성증후군(MDS) 치료 영역에서 새로운 치료 축으로 부상하고 있다. 이 약제의 승인 적응증은 "8주간 4단위 이상의 적혈구 수혈이 필요한 수혈 의존성 빈혈을 가진 저위험~중간-1 위험군 MDS 성인 환자 중, 적혈구생성자극제(ESA)에 반응하지 않거나 반응이 소실되었거나, 투여가 불가능한 경우"이다.이메텔스타트는 기존의 ASO와는 구별되는 비정형 ASO로 분류되며, 비정상적인 텔로머레이스 활성을 보이는 악성 조혈모세포(HSCs) 및 전구세포(HPCs)를 선택적으로 억제함으로써 병적 클론의 제거와 정상 조혈 기능의 회복을 유도하는 질환 수정형(disease-modifying) 치료 제이다.분자 구조적으로, 이메텔스타트는 13개의 뉴클레오타이드로 구성된 단일가닥 DNA 서열이며, 티오인산화(thio-phosphoramidate) 변형을 통해 핵산분해효소(nuclease) 저항성, 수용성, 대사적 안정성 등의 약물학적 특성이 향상되었다. 또한 5′ 말단에 팔미토일기(palmitoyl group)가 결합되어 소수성을 증가시켜 세포막 투과성 및 세포 내 유지성을 강화하며, 별도의 형질전환 과정 없이도 세포 내 작용이 가능하도록 설계되었다.전임상 연구에서는 이메텔스타트의 약물 노출과 텔로머레이스 억제 간의 명확한 약력학적 상관성이 확인되었고, 텔로머레이스 활성을 50% 이상 억제하는 수준의 약리 효과가 임상적으로 확보 가능한 범위 내에 있음이 입증되었다. 또한, 골수증식성 질환 모델(예: 본태성 혈소판증, 골수섬유증, 급성 골수성 백혈병 등)에서는 시험관 내(in vitro) 및 생체 내(in vivo) 실험 모두에서 강력한 항종양 활성을 나타냈다.특히 저위험 MDS 환자에서 이메텔스타트는 텔로미어 단축, hTERT 과발현, 분화 억제 등으로 특징지어지는 병적 조혈모세포 및 전구세포를 선택적으로 제거함으로써, 정상 조혈의 회복과 함께 적혈구 수혈 비의존 기간(RBC-TI)의 연장, 혈색소 수치의 향상, 염색체 이상 클론 및 돌연변이 부담의 감소를 유도하였다.아울러, 이메텔스타트는 면역회피 특성을 가진 악성 클론에서도 항암 활성을 유지함으로써, 기존 면역항암제 또는 세포독성 항암제에 비해 임상적 적용 가능성이 높다. 현재 진행 중인 다수의 임상시험 결과에 따라, MDS뿐 아니라 골수섬유증(myelofibrosis), 기타 혈액암 영역으로의 적응증 확장 가능성도 제시되고 있다.이메텔스타트의 약리 기전은? 이메텔스타트는 TERT-targeting telomerase complex inhibtor 또는 RNA-template targeting telomerase inhibitor로, 인간 텔로머라제의 RNA 구성 요소(hTR)의 주형 영역에 상보적으로 결합하여 텔로머레이스 복합체의 활성 부위에서 기질 결합 및 연장을 직접 차단한다. 즉 hTR의 주형 서열(3′-CAAUCCCAAUC-5′)에 상보적인 염기서열(5′-palmitate-TAGGGTTAGACAA-NH₂-3′)이 결합함으로써, 텔로머레이스 효소의 활성을 억제하여 텔로미어 말단에 반복 서열을 추가하는 기능을 경쟁적으로 차단한다. 이로 인해 암세포 내에서의 텔로미어 길이가 점진적으로 짧아지며, 결국 세포 노화 또는 세포자멸사를 유도하게 된다(Figure 4). 골수이형성증후군(MDS) 및 악성 줄기세포 및 전구세포에서 텔로머레이스 활성 및 인간 텔로머레이스 역전사효소(hTERT) RNA 발현이 증가한 것으로 보고되었다. 이에 여러 연구에서 이메텔스타트 치료가 텔로미어 길이 감소, 악성 줄기세포 및 전구세포의 증식 감소, 그리고 세포자멸사를 유도함으로써 세포 증식 억제 및 수명 단축 효과를 나타낸 것으로 보고되었다.또한, 이 약제는 텔로머레이스의 촉매 소단위인 hTERT의 발현을 억제함으로써 효소 활성을 이중적으로 저해하는데, 이 hTERT는 텔로머레이스 활성을 조절하는 주요 속도 제한 인자(rate-limiting component)로 알려져 있다.이러한 이멜스타트의 작용 기전은 항원-항체 반응이나 면역세포 활성화를 기반으로 하는 기존 면역항암제와는 달리, 종양 세포의 분열 및 생존을 유지하는 내재적 기전인 텔로머레이스 의존성을 직접 차단한다는 점에서 근본적인 차별성을 갖는다.이멜스타트(RYTELOⓇ) 3상 임상은 어떻게 진행되었나? 이메텔스타트의 임상적 유효성은 IMerge 3상 연구를 통해 입증되었다. 본 연구는 무작위배정, 이중눈가림, 위약대조, 다기관 임상시험으로 설계되었으며, 저위험 또는 중간-1위험군 골수이형성증후군(MDS) 환자 중 수혈 의존성을 보이는 성인 178명을 대상으로 시행되었다. 환자 등록 기준은 무작위배정 16주 전의 8주간 기간 동안 적어도 4단위 이상의 적혈구 수혈 필요 이력이 있는 경우로 정의되었다.등록 환자들은 모두 적혈구생성자극제(ESA)에 반응이 없었거나 반응이 소실되었거나, ESA 투여가 적절하지 않다고 판단된 경우였다. 주요 포함 기준에는 절대 호중구 수치 ≥ 1.5 × 10⁹/L, 혈소판 수 ≥ 75 × 10⁹/L이 포함되었으며, del(5q) 염색체 이상 보유자, 레날리도마이드(Lenalidomide) 또는 아자시티딘(Azacitidine)과 데시타빈(Decitabine) 같은 저메틸화제(hypomethylating agents, HMA) 치료 이력이 있는 환자는 제외되었다.무작위배정은 2:1 비율로 수행되어, RYTELO 7.1 mg/kg 정맥주사군(n=118) 또는 위약군(n=60)에 배정되었으며, 28일 주기(cycle)로 반복 투여되었다. 치료는 질병 진행, 용인할 수 없는 독성, 또는 환자의 자의적 중단 시점까지 지속되었다. 무작위배정은 기존 RBC 수혈 부담 및 IPSS 위험군 등급을 기준으로 계층화되었다. 모든 환자에게는 필요 시 적혈구 수혈을 포함한 지지요법(supportive care)이 병행 제공되었다.평가 기간은 RYTELO 투여군에서 중앙 추적기간 19.5개월(범위: 1.4–36.2개월), 위약군에서 17.5개월(범위: 0.7–34.3개월)이었으며, 주요 유효성 평가 변수는 적혈구 수혈 독립(RBC transfusion independence, RBC-TI) 달성 비율이었다. 이는 무작위배정 이후부터 차기 항암 치료 개시 전까지의 기간 중 연속된 8주(≥56일) 또는 연속된 24주(≥168일) 동안 적혈구 수혈이 전혀 이루어지지 않은 경우로 정의되었다.그 결과, 8주 이상 RBC-TI 도달률은 RYTELO 군에서 39.8%(95% CI: 30.9–49.3)로, 위약군의 15.0%(95% CI: 7.1–26.6) 대비 통계적으로 유의하게 높았다(p < 0.001). 또한 24주 이상 RBC-TI 도달률 역시 RYTELO 군에서 28.0% (95% CI: 20.1–37.0)로, 위약군 3.3% (95% CI: 0.4–11.5)와 비교하여 유의한 차이를 보였다(p < 0.001). 이러한 결과는 RYTELO가 ESA 불응 또는 부적합 환자군에서 수혈 의존성을 유의하게 줄이고, 적혈구계 조혈 회복을 유도할 수 있는 잠재력을 입증하는 것으로 해석된다.안전성 측면은 RYTELO 군에서 위약군 대비 ≥10% 이상, ≥5% 차이를 보인 주요 이상반응은 혈소판 감소, 백혈구 감소, 호중구 감소, AST/ALT/ALP 상승, 피로, 부분 트롬보플라스틴 시간 연장, 관절/근육통, COVID-19 감염, 두통 등이었다.따라서, RYTELO는 저위험 MDS 환자에서 임상적으로 의미 있는 수혈 독립 향상을 유도하였으며, 전반적으로 관리 가능한 안전성 프로파일을 보였다. 권장 투여 용량은 7.1 mg/kg이며, 4주마다 2시간에 걸쳐 정맥 투여한다. 이멜스타트의 앞으로의 예상은? 골수이형성증후군(MDS)은 조혈모세포의 분화 및 성숙에 결함이 생겨 비정상적 조혈과 말초 혈구감소증을 유발하는 이질적인 클론성 조혈장애이다. 특히 저위험군 MDS 환자에서는 만성적인 적혈구 수혈 의존성 빈혈이 주요 임상 양상으로 나타나며, 삶의 질 저하 및 철분 과부하에 의한 이차적 장기 손상이 주요 합병증으로 작용한다.현재까지 이들 환자에서 사용 가능한 치료제로는 적혈구생성자극제(ESA) 및 저메틸화제(HMA) 등이 있으나, 반응률의 한계와 장기 치료 효과에 대한 의문이 지속적으로 제기되고 있다.텔로머레이스는 텔로미어 길이를 유지하여 세포의 분열 한계를 극복하게 하는 핵심 효소로, 대부분의 암세포 및 악성 조혈모세포에서 비정상적으로 활성이 증가되어 있는 것이 특징이다. 이러한 활성을 선택적으로 억제함으로써 병적 조혈세포의 증식을 제한하고 정상 조혈을 회복시키는 접근은 질환의 근본 기전을 타겟으로 하는 질환 수정형(disease-modifying) 치료전략으로 주목받고 있다.이메텔스타트(Imetelstat)는 인간 텔로머레이스 복합체(hTERT/hTR)에 직접 결합하여 활성을 경쟁적으로 억제하는 first-in-class 올리고뉴클레오타이드 기반 치료제로, 텔로미어 유지 능력을 상실하게 하여 세포 자멸사 및 증식 억제를 유도한다. 특히 병적 조혈모세포(HSCs/HPCs)와 백혈병 줄기세포(LSCs)에 선택적으로 작용하며, 정상 조혈세포에 대한 영향은 제한적으로 보고되고 있다.IMerge 3상 임상시험에서 이메텔스타트는 ESA에 반응하지 않거나 부적합한 저위험~중간-1 위험군 MDS 환자를 대상으로 통계적으로 유의한 적혈구 수혈 독립 효과를 입증하였다. 8주 이상 수혈 독립률(RBC-TI)은 이메텔스타트군에서 39.8%, 위약군에서 15.0%로 나타났으며, 24주 이상 수혈 독립률도 각각 17.8%와 1.6%로 유의한 차이를 보였다. 이는 기존 치료옵션에 반응하지 않는 환자 집단에 있어 새로운 치료 패러다임을 제시한 근거로 평가된다.다만, 현재 이메텔스타트는 저위험 MDS + ESA 실패 + 수혈 의존성 빈혈이라는 제한된 적응증으로 승인되어 있으며, TP53 돌연변이나 고위험군 MDS는 제외 대상에 해당된다. 또한 치료 효과 발현까지 수 주에서 수개월이 소요되며, 호중구감소증(72%) 및 혈소판감소증(65%) 등 고빈도의 혈액학적 이상반응이 동반될 수 있다는 점은 임상적 고려가 필요하다.그럼에도 불구하고, 텔로머레이스라는 근원적 분자 표적을 겨냥한 이메텔스타트는 기존 화학요법 및 면역조절제와는 차별화된 기전을 통해 조혈계 악성질환에 있어 정밀의학적 치료 전략으로서의 가능성을 보여주고 있다. 이미 미국 및 유럽에서 승인된 약제로서, 향후 국내 도입과 더불어 적응증 확대, 병용요법, 고위험 환자군에서의 임상적 검토가 필요할 것으로 예상한다.참고문헌 1. Alexander Vaiserman, Dmytro Krasnienkov “Telomere Length as a Marker of Biological Age: State-of-the-Art, Open Issues, and Future Perspectives” Front. Genet. 11:630186(2021). 2. Virginia Boccardi “Aging, Cancer, and Inflammation: The Telomerase Connection” J. Mol. Sci. 2024, 25(15), 8542. 3. Virginia Boccardi, and Luigi Marano “Aging, Cancer, and Inflammation: The Telomerase Connection” Int. J. Mol. Sci. 2024, 25, 8542. 4. Zachary Schrank, Nabiha Khan, Chike Osude, Sanjana Singh et al. “Oligonucleotides Targeting Telomeres and Telomerase in Cancer” Molecules 2018, 23, 2267. 5. Ashley L. Lennoxm, Fei Huang, Melissa Kelly Behrs, Mario González-Sales et al. “Imetelstat, a novel, first-in-class telomerase inhibitor:Mechanism of action” Clin Transl Sci. 2024;17:e70076 6. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-06-13 06:24:02최병철 박사
세계 첫 텔로머레이스 억제제 '라이텔로'...국내 도입 예상5편: First-in-class 텔로머레이스 억제제, 골수이형성증후군 치료제 '라이텔로(Imetelstat)' 라이텔로(RyteloⓇ, 성분명: 이메텔스타트, Imetelstat, Geron)는 세계 최초의 올리고뉴클레오타이드 텔로머레이스 억제제(Oligonucleotide telomerase inhibitor)로 2024년 6월 미국 FDA와 2025년 3월 유럽 EMA에서 '적혈구 자극제(ESA)에 반응하지 않거나 효과가 소실되었거나 투여가 불가능한, 수혈 의존성 빈혈이 있으며 8주 동안 적어도 4단위 이상의 적혈구 수혈이 필요한 저위험에서 중간 1단계 위험군의 성인 골수이형성증후군(low-to intermediate-1 risk myelodysplastic syndromes, MDS) 환자 치료'에 승인되었다.대부분의 암세포 및 암 전구세포(cancer progenitor cells)는 높은 텔로머레이스 활성과 텔로미어 유지 능력을 통해 세포가 정상적인 복제 제한 없이 무한히 분열할 수 있는 능력(세포 불사성, cellular immortality)을 가지게 되므로, 텔로머레이스는 암 치료의 유망한 표적 중 하나가 된다이러한 기전에 기반하여 개발된 이메텔스타트는 텔로머레이스를 표적으로 하는 13개 염기 서열의 올리고뉴클레오타이드로, 인간 텔로머레이스 RNA(human telomerase RNA, hTR)의 주형(template) 영역에 선택적으로 결합하여 텔로머레이스 활성을 경쟁적으로 억제함으로써 암세포를 사멸한다.이메텔스타트의 약동학(PK), 약력학(PD), 용량-반응 관계(dose-response relationship), 유효성 및 안전성은 고형암 및 혈액암을 포함한 다양한 종양 모델에서 in vitro, in vivo, 그리고 임상시험을 통해 평가되었다. 특히, 저위험 골수형성이상증후군(LR-MDS) 및 골수증식성 종양을 포함한 혈액질환을 대상으로 한 연구가 집중적으로 수행되었다.핵심 3상 임상시험인 IMerge 연구에 따르면, 이메텔스타트 투여군은 위약군 대비 8주 및 24주 이상에서 적혈구 수혈 비의존성(red blood cell-transfusion independence, RBC-TI)에 도달한 환자의 비율이 통계적으로 유의하게 높았으며, 주요 이상반응으로는 일시적이며 조절 가능한 호중구감소증(neutropenia) 및 혈소판감소증(thrombocytopenia)이 관찰되어, 전반적으로 관리 가능한 안전성 프로파일을 보였다.저위험에서 중간 1단계 위험군의 성인 골수이형성증후군(Low-to intermediate-1 risk myelodysplastic syndromes, MDS)은 무엇인가?골수이형성증후군(MDS)은 혈액 생성 줄기세포의 클론성 이상으로 인해 발생하는 혈액 종양 질환군으로, 골수 내 이형성(dysplasia)과 비효율적인 조혈(hematopoiesis)을 특징으로 한다. 이 질환은 빈혈, 백혈구 감소증, 혈소판 감소증 등의 다양한 혈구감소증(cytopenia)이 나타날 수 있다.일부 MDS 환자는 급성 골수성 백혈병(AML)으로 진행되기도 하여, 임상 경과를 더욱 복잡하게 만든다. MDS 환자의 예후는 매우 다양하며, 염색체 이상 및 혈구감소증의 중증도와 같은 요인에 따라 영향을 받는다. 따라서, MDS 환자의 임상 경과와 치료 반응은 매우 다양하므로, 정확한 예후 분류는 치료 전략 수립 및 예후 예측에 있어 필수적이다.가장 널리 사용되는 예후 평가 시스템은 1997년 제시된 국제 예후 점수 시스템( International Prognostic Scoring System, IPSS)이며, 골수 내 아세포(blast) 비율, 세포유전학적 이상(cytogenetics), 혈구감소증의 수 등 세 가지 지표를 기반으로 환자를 위험(Low), 중간-1위험(Intermediate-1), 중간-2위험(Intermediate-2), 고위험(High)의 네 군으로 분류한다.이 중 저위험에서 중간-1위험군(low-to intermediate-1 risk)은 IPSS 점수 기준으로 0~1.0점에 해당하며, 비교적 안정된 임상 경과를 보이고, 적혈구 자극제(ESA)나 보존적 치료 등의 저강도 요법이 우선적으로 고려된다.2012년에는 기존 IPSS의 한계를 보완하기 위해 개정된 국제 예후 점수 시스템(IPSS-R)이 제안되었다. IPSS-R은 세포유전학적 이상을 5단계로 세분화하고, 골수 아세포 비율, 혈색소 농도, 혈소판 수, 절대 호중구 수 등 보다 정량적인 지표를 반영함으로써 환자를 매우 저위험(very low), 저위험(low), 중간위험(intermediate), 고위험(high), 매우 고위험(very high)의 5단계로 분류한다. 이 중 IPSS-R의 저위험 및 중간위험군은 대체로 기존 IPSS의 저위험 및 중간-1위험군과 대응된다.저위험~중간-1위험군 MDS 환자는 일반적으로 생존 기간이 길고, 급성 골수성 백혈병(AML)으로의 진행 위험이 낮은 편이나, 수혈 의존성 빈혈, 증상성 혈구감소증, 분자 유전학적 이상 유무에 따라 치료 방법의 세분화가 필요하다. 최근에는 유전자 변이 기반의 위험도 분류가 병용되며, 보다 정밀한 예후 예측과 치료 맞춤화에 기여하고 있다.이러한 MDS는 텔로미어(telomere) 단축과 관련된 조혈 줄기세포 기능 저하와 병적 클론의 형성을 특징으로 하며, 일부 클론은 텔로머레이스(telomerase)를 재활성화하여 불사성(immortality)을 획득하고 질환의 진행에 관여한다. 텔로머레이스는 이러한 병태생리적 역할로 인해 MDS에서 유망한 치료 표적이 된다.텔로미어(Telomere)는 어떤 물질인가? 2009년 노벨 생리의학상은 엘리자베스 블랙번(Elizabeth Blackburn), 캐럴 그라이더(Carol Greider), 잭 쇼스택(Jack Szostak)에게 수여되었다. 이들은 염색체 말단에 위치한 특수한 반복 서열 구조인 텔로미어(telomere)와 그 유지에 관여하는 효소인 텔로머레이스(telomerase)를 규명함으로써, 세포 분열 과정에서 유전 정보가 어떻게 안정적으로 보존되는지를 설명하는 데 기여하였다.노벨위원회는 "이들 세 명의 연구는 염색체가 세포 분열 과정 중 퇴화를 방지하고, 완전하게 복제될 수 있는지를 둘러싼 오랜 생물학적 의문에 대한 해답을 제공하였다"고 평가하였다.텔로미어에는 세포의 염색체 말단에 반복적인 DNA 서열이 존재하며, 이는 유전물질의 손상을 방지하고 염색체의 구조적 안정성을 유지하는 역할을 수행한다. 그러나 체세포는 분열을 반복할수록 텔로미어 길이(telomere length)가 '모래시계'처럼 점진적으로 짧아지며, 일정 임계점에 도달하면 세포는 증식을 멈추고 세포 노화(senescence)나 세포자멸사사(apoptosis)를 유도하게 된다(Figure 1).이때 텔로머레이스는 텔로미어의 말단을 연장할 수 있는 효소로 세포의 수명을 연장시키고, 이론적으로는 세포의 불사성(immortality)를 유도할 가능성을 지닌다. 이러한 텔로미어는 생물체의 노화 과정과 직접적으로 연관되어 있고, 또한 대부분의 암세포는 텔로머레이스의 활성을 통해 텔로미어 길이를 유지하거나 연장함으로써 무한 증식 능력을 가지게 된다. 즉, 텔로미어 단축은 세포 노화를 유도하는 반면, 텔로미어 보존은 암세포의 지속적 증식을 가능하게 한다. 따라서, 텔로미어 기능의 조절은 노화 억제 혹은 암 치료를 위한 잠재적 전략으로 제시되고 있다.텔로머레이스(Telomerase)란 무엇인가? 텔로머레이스(Telomerase)는 염색체 말단에 있는 3' 말단 돌출부(3' overhang)에 반복적인 염기서열을 추가하는 기능을 가진 리보핵단백질 복합체(ribonucleoprotein complex)로, 역전사효소(reverse transcriptase) 활성을 갖는다. 3' 말단 돌출부는 이중가닥 DNA 말단에서 한 가닥이 다른 가닥보다 더 길어 돌출된 형태로, 텔로미어 구조에서 텔로머레이스가 인식하고 작용하는 주요 부위이다.텔로머레이스는 자체의 RNA 구성요소인 TERC(telomerase RNA component)를 주형(template)으로 삼아, TERT(telomerase reverse transcriptase)의 역전사 효소 활성을 통해 반복적인 TTAGGG 염기서열을 합성함으로써 염색체 말단의 텔로미어를 연장한다(Figure 2). 인간의 경우, 텔로머레이스는 인간 텔로머레이스 역전사효소(human telomerase reverse transcriptase, hTERT) 유전자에 의해 암호화되는 촉매 소단위(catalytic subunit)와 인간 텔로머레이스 RNA(human telomerase RNA, hTR) 유전자 산물인 RNA 주형(template)을 중심으로 구성된 복합체이다. 여기에 dyskerin, NHP2, NOP10, GAR1 등 다양한 보조 단백질들이 결합하여, 효소 복합체의 구조적 안정성과 기능적 활성을 조절한다.텔로머레이스를 ‘자동차’ 전체에 비유한다면, TERT는 실제로 DNA를 합성하는 역할을 수행하는 ‘엔진’에 해당하며, hTR(또는 TERC)는 어떤 염기서열을 합성할지를 지시하는 ‘설계도’에 해당하는 RNA 주형으로 볼 수 있다.인체 내 약 120여 종의 세포 중 대부분은 텔로미어를 합성하는 효소인 텔로머레이스의 활성을 갖지 않으며, 이로 인해 세포는 분열이 반복될수록 텔로미어가 점진적으로 단축되고, 결국 복제에 따른 세포 노화(replicative senescence)에 도달하게 된다. 반면, 일부 높은 분열 능력을 가진 조직의 세포들은 예외적으로 텔로머레이스 활성을 유지한다.이러한 세포에는 모낭(hair follicle), 구강 편평상피(squamous epithelium), 피부 표피의 기저층(basal layer of epidermis), 제2형 폐포상피세포(type 2 alveolar epithelial cells), 간세포(hepatocytes), 장의 장선(intestinal crypts), 정원세포(spermatogonia) 등이 있다. 이들 세포에서 텔로머레이스 활성이 결여될 경우, 조직의 항상성 유지 및 생식 기능에 중대한 장애가 초래된다.특히, 정자 형성에 관여하는 정원세포(spermatogonia)에서 텔로머레이스 활성이 결여되면, 정자의 텔로미어 길이가 충분히 유지되지 못하고 단축된 상태로 전달된다. 이로 인해 형성된 배아는 텔로미어 단축에 기인한 세포 노화가 조기에 시작되며, 조기 노화(progeria)와 유사한 양상을 보일 수 있다. 실제로 이는 복제 양 돌리(Dolly) 사례에서 관찰된 바 있으며, 단축된 텔로미어가 수명 감소와 밀접하게 연관됨을 시사한다.이는 일반적인 체세포에서는 텔로머레이스 활성이 매우 낮은 수준으로 유지하지만, 생식세포와 줄기세포에서는 해당 효소가 구성효소(constitutive enzyme)로서 지속적으로 발현된다. 구성효소는 소화효소와 같이 항상 일정 수준으로 활성화되어 있는 효소이다.이에 반해 유도효소(inducible enzyme)는 특정 자극(예: 약물, 독성물질 등)에 의해 후천적으로 유도되는 효소이다. 이러한 분류 기준에 따라 텔로머레이스는 생식세포 및 줄기세포에서 구성효소로 기능하며, 암세포에서는 구성효소 및 유도효소적 특성을 보이는 이중적 성격을 가진다고 볼 수 있다.줄기세포 중에서도 배아줄기세포(embryonic stem cells) 및 유도만능줄기세포(induced pluripotent stem cells)는 고도로 안정된 텔로머레이스 활성을 보이며, 이로 인해 세포 분열에 따른 텔로미어의 단축이 거의 발생하지 않고, 복제에 따른 세포 노화에도 이르지 않는다.반면, 중간엽줄기세포(mesenchymal stem cells), 신경줄기세포(neural stem cells), 조혈모세포(hematopoietic stem cells) 등 성체 유래 줄기세포에서는 텔로머레이스 활성이 상대적으로 낮으며, 이로 인해 제한적인 텔로미어 단축이 관찰된다.TERT(Telomerase reverse transcriptase)란 무엇인가? 대부분의 체세포는 약 60~80회의 분열(population doublings) 이후 텔로미어가 임계 길이에 도달하게 되며, 이 시점에서 이중가닥 DNA 절단(double-strand break) 신호가 유도되어 복제에 따른 노화로 전환된다.이러한 현상은 체세포 내에서 텔로머레이스 활성이 거의 존재하지 않기 때문에 발생하는데, 이는 텔로머레이스의 RNA 구성 요소인 TERC(hTR)가 존재하더라도, 촉매 활성을 담당하는 TERT 유전자의 전사가 억제되어 있기 때문이다. 따라서, TERT 발현의 억제는 체세포에서 텔로머레이스 활성이 결핍되는 주요 원인이며, 텔로미어 단축의 분자적 기전으로 작용한다.뿐만 아니라, TERT는 단순한 텔로미어 연장 기능 외에도 텔로미어 말단의 캡핑(capping)과 전체 구조 유지에도 중요한 역할을 한다. 이는 다양한 암종의 약 80~90%에서는 TERT 발현이 재활성화되어 텔로머레이스 활성이 증가되어 있으며, 암세포의 불사화와 밀접하게 연관되어 있다.결과적으로, TERT 발현은 텔로미어 연장과 세포 노화 회피를 통해 암세포 특성이 획득되는 초기 단계에서 결정적인 분자 표지자로 작용한다. 이러한 TERT 발현 유도는 다양한 내•외부 요인 중 유전자 불안정성과 돌연변이가 가장 대표적인 기전으로 제시되고 있다.암의 발생 과정에서 텔로미어 길이의 보존이 빈번히 동반되며, 이는 주로 인간 텔로머레이스 역전사효소(hTERT)의 발현 증가에 따른 텔로머레이스 활성의 재개로 설명된다. 따라서 TERT의 발현 조절 기전은 텔로머레이스 기반 항암 치료법의 핵심 표적으로 주목받고 있으며, 암세포 특이적 바이오마커로서의 임상적 활용 가능성 또한 높다.텔로머레이스와 암과의 관계는 어떠한가? 텔로머레이스의 비정상적인 재활성화는 암세포에서 흔히 관찰되는데, 이는 텔로미어 단축으로 유도되는 세포자멸사를 회피하고 무한 증식 능력을 획득하는 데 핵심적인 기전으로 작용한다. 실제로, 전체 고형암 및 혈액암의 약 90% 이상에서 텔로머레이스 활성이 현저히 증가되어 있음이 관찰된다.여러 암 조직 생검에서 텔로머레이스 활성의 증가가 종양의 병기 및 악성도와 유의한 상관관계를 보이는 반면, 대부분의 정상 성인 조직에서는 텔로머레이스 활성이 거의 검출되지 않으며, 일부 조혈모세포나 면역세포에서만 일시적으로 나타나는 것으로 알려져 있다.이는 암세포 및 암전구세포에서 공통적으로 관찰되는 높은 수준의 텔로머레이스 발현과 텔로미어 유지 현상을 억제하여 암세포의 증식을 제한하는 치료 방법이 된다.특히, RNA 기반 치료법은 텔로머레이스의 RNA 구성요소인 hTR 또는 hTERT mRNA를 표적으로 하여 효소 활성을 간접적으로 억제하는 방식으로 주목받고 있다. 이 중 안티센스 올리고뉴클레오타이드(antisense oligonucleotides, ASO) 및 RNA 간섭(small interfering RNA, siRNA) 기술은 텔로머레이스 기능을 선택적으로 차단할 수 있는 새로운 접근법이다.대표적 예로는 이멜스타트(Imetelstat)가 있으며, 이는 인간 텔로머레이스 RNA(hTR)의 주형 영역에 상보적으로 결합하는 리간드 결합형 ASO로 설계되어, 텔로미어 연장 과정을 억제함으로써 암세포의 증식 억제를 유도한다. 이와 같은 RNA 기반 접근은 텔로머레이스 억제를 통한 항암 치료의 새로운 패러다임을 제시하며, 표적 치료제 개발에 있어 중요한 진전을 이끌고 있다.텔로머레이스 억제를 통한 항암 치료 전략은? 텔로머레이스를 표적으로 한 항암제 개발은 다양한 작용기전을 바탕으로 다방면에서 진행되고 있으며, 크게 RNA 기반 억제제, 전사 억제 화합물, G-사중나선 안정화제, 그리고 면역치료 백신 전략으로 구분할 수 있다.1. RNA 기반 억제제 가장 활발히 연구되고 있는 접근은 안티센스 올리고뉴클레오타이드(ASO) 또는 RNA 간섭(siRNA) 기술을 활용하여 텔로머레이스 RNA 구성요소(hTR 또는 TERC)를 표적으로 하는 전략이다. 이들 억제제는 텔로머레이스 복합체 내의 RNA 주형에 상보적으로 결합함으로써 효소 활성을 억제하거나, RNase H 의존적 분해를 유도하여 텔로머레이스 기능을 근본적으로 차단한다.대표적 약제인 이멜스타트(Imetelstat)는 티오포스포라마이드(thio-phosphoramidate) 변형을 적용한 ASO로, hTR의 템플릿 영역에 결합하여 텔로미어 연장을 저해한다.2. hTERT 전사 억제 저분자 화합물 이 저분자 화합물은 텔로머레이스의 촉매 소단위인 hTERT 유전자의 전사를 직접 억제하는 방식으로, 프로모터 영역 조절 또는 후성유전학적 메커니즘을 통해 유전자 발현 자체를 낮춘다. 일부 저분자 화합물은 hTERT 단백질에 직접 결합하여 효소 활성을 차단한다. 식물 유래 플라보노이드(예: genistein)가 TERT 전사를 억제하는 기능이 보고된 바 있으나 낮은 선택성과 잠재적인 세포독성으로 인해 임상 적용에는 제한이 있다.3. G-사중나선(G-quadruplex) 안정화제 이 안정화제는 텔로미어 말단에서 형성되는 G-사중나선 구조를 안정화시켜 텔로머레이스의 접근을 물리적으로 차단하는 방식이다. 해당 구조는 G-rich 반복 서열에서 자연적으로 형성되며, 일부 저분자 화합물은 이 구조에 특이적으로 결합하여 G-quadruplex 형태의 유지 및 안정화를 유도한다.이 방법은 효소가 아닌 기질을 표적으로 한다는 점에서 기존 억제제와 구별되며, 비교적 빠른 약효 발현이 가능하다. 그러나 G-rich 서열이 텔로미어 외에도 다양한 유전자의 조절부위에 존재하기 때문에, 표적 특이성 확보가 주요 과제로 남아 있다.4. 텔로머레이스를 항원으로 활용한 면역치료 텔로머레이스를 면역계의 표적으로 활용하는 전략도 개발되고 있다. 이는 hTERT 유래 펩타이드를 기반으로 하는 항암 백신을 통해, 텔로머레이스를 발현하는 종양세포를 면역세포가 인식하고 제거하도록 유도한다. 비소세포폐암(NSCLC), 췌장암 등 다양한 고형암에서 임상시험이 진행되고 있으며, 면역기억 반응을 통한 재발 억제 효과가 기대된다. 다만, 환자의 HLA 유형 및 종양미세환경(TME)에 따라 치료 반응의 편차가 존재하여, 정밀한 환자 선별 전략이 병행되어야 한다.이와 같이 텔로머레이스 억제 전략은 암세포 특이성이 높고 장기적인 종양 억제 효과를 유도할 수 있다는 점에서 유망한 접근이다. 그러나 기전상 텔로미어 길이의 점진적 단축을 필요로 하므로, 치료 효과 발현까지 수 주에서 수 개월이 소요되는 경향이 있다. 또한, 일부 암에서는 텔로머레이스 비의존적인 대체적 길이 조절(ALT, alternative lengthening of telomeres) 경로가 활성화되어 있어 단독요법으로는 제한적일 수 있다.이러한 한계를 극복하기 위해, 최근에는 DNA 손상 유도제, 면역관문억제제(PD-1/PD-L1 억제제), PARP 억제제 등과의 병용요법이 시도되고 있다. 또한 텔로머레이스 발현 수준, 텔로미어 길이 상태, ALT 경로 활성 여부 등을 고려한 환자 맞춤형 정밀의학적 접근이 병행됨으로써, 텔로머레이스 억제제의 임상적 유용성은 점차 확대되고 있다.뉴클레오타이드(Nucleotide)와 합성 올리고뉴클레오타이드의 차이는? 뉴클레오타이드는 모든 생명체에 보편적으로 존재하는 저분자 유기 화합물로, DNA와 RNA와 같은 핵산의 기본 단위이며 에너지 전달(ATP, GTP), 세포 신호전달(cAMP, cGMP), 효소 보조인자(NAD⁺, FAD) 등의 생리적 기능에 필수적인 역할을 수행한다. 이러한 분자는 세포 내에서 de novo 합성 경로 또는 재활용 경로(salvage pathway)를 통해 지속적으로 생성되며, 생명 유지에 핵심적인 역할을 한다.이에 반해, 올리고뉴클레오타이드는 일반적으로 몇 개에서 수십 개의 뉴클레오타이드가 공유결합으로 연결된 짧은 핵산 서열로, 인공적으로 합성된 생체분자이다. 자연적으로는 microRNA나 small nuclear RNA와 같은 일부 예외적인 경우를 제외하면 생체 내에서 잘 합성되지 않으며, 주로 화학적으로 합성되어 특정 유전 서열의 인식이나 분자 기능의 조절을 목적으로 활용된다.합성 올리고뉴클레오타이드는 분자생물학, 진단, 치료, 유전자 조작 등 다양한 분야에서 핵심 도구로 활용되고 있으며, 기능, 표적, 화학적 변형에 따라 , 다음과 같이 분류된다.첫째, 기능적 측면에서 ▲ mRNA 또는 pre-mRNA에 결합하여 유전자 발현을 억제하거나 RNA 스플라이싱을 조절하는 안티센스 올리고뉴클레오타이드(antisense oligonucleotide, ASO), ▲ RNA 간섭(RNAi)을 유도하여 표적 mRNA의 분해를 유도하는 소간섭 RNA(siRNA) 또는 마이크로 RNA(miRNA) 유사체, ▲ 고특이적으로 단백질에 결합하여 기능을 저해하거나 조절하는 압타머(aptamer), ▲ CRISPR 시스템에서 유전자 편집을 유도하는 가이드 RNA(guide RNA, gRNA), ▲ 전사인자와 결합하여 표적 유전자 조절을 간섭하는 디코이(decoy), ▲ PCR, qPCR, 유전자 탐지 등 핵산 분석 기술에 사용하는 프라이머(primer) / 프로브(probe) 등으로 분류된다.둘째, 표적 및 작용기전에 따라 ▲ DNA, ▲ mRNA, ▲ pre-mRNA, 또는 단백질 등 다양한 분자에 작용할 수 있으며, 그 기전은 전사 억제, 번역 차단, RNA 스플라이싱 조절, 단백질-핵산 상호작용 차단 등으로 확장된다.셋째, 화학 구조적 변형 측면에서 천연형(natural-type) 외에도 약물 안정성 및 효율성을 개선하기 위한 다양한 화학적 변형이 도입된다. 대표적으로 ▲ 인산기 산소를 황으로 치환하여 핵산분해효소 내성 증가를 위한 phosphorothioate(PS), ▲ 리보스의 2′ 위치에 화학기 추가로 결합력과 안정성 증가를 위한 2′-O-methyl RNA 및 2′-fluoro RNA, ▲ 리보스 고정을 통해 고결합 친화성 및 특이성 확보한 locked nucleic acid(LNA), ▲ 간세포 타깃팅 또는 세포 내 전달력 향상을 위한 GalNAc 또는 지질을 접합시킨 conjugated oligonucleotide 등이 있으며, 이는 체내 안정성, 표적 결합력, 약물 전달 효율성을 향상시키는 데 기여한다.요약하면, 뉴클레오타이드는 생명체 내에서 합성되는 주요 생리활성 분자인 반면, 올리고뉴클레오타이드는 외부에서 합성되어 생체 내 특정 유전자나 분자 기전을 정교하게 조절하기 위한 인공 핵산 서열이라는 점에서, 양자는 생성 방식과 생리적 존재 양상에서 본질적으로 다르다. 그럼에도 불구하고, 올리고뉴클레오타이드는 자연계 핵산의 기능을 모방하거나 확장함으로써 차세대 핵산 기반 치료제 및 진단 기술의 핵심 플랫폼으로 부상하고 있다.ASO(Antisense Oligonucleotide, 안티센스 올리고뉴클레오타이드)란? ASO는 mRNA를 표적으로 설계된 짧은 합성 단일가닥 DNA 분자로, 특정 mRNA 서열과 상보적으로 결합함으로써 유전자 발현을 억제하거나 조절하는 기능을 수행한다(Figure. 3).ASO는 비교적 간단한 화학 구조를 기반으로 하면서도, 전사체의 분해 유도, RNA 스플라이싱 (splicing) 조절, 번역 억제 등 다양한 작용기전을 통해 유전 정보의 흐름을 정교하게 제어할 수 있는 장점을 가진다.ASO의 작용기전은 화학적 변형 방식과 결합 표적에 따라 다양하게 구분된다. 대표적으로 RNase H 매개 분해는 ASO가 표적 mRNA와 이중가닥을 형성한 후, 세포 내 RNase H 효소에 의해 해당 mRNA가 분해되어 단백질 생성을 원천적으로 차단하는 기전이다.또한, 스플라이싱 조절용 ASO는 pre-mRNA의 엑손/인트론 경계부에 결합하여, 엑손 스키핑(skipping) 또는 보존을 유도함으로써 단백질의 구조와 기능을 변형시킬 수 있다. 이 외에도 번역 개시 억제, mRNA 안정성 저해 등 다양한 방식으로 작용이 가능하다.이러한 특성을 바탕으로, ASO는 기존 소분자 화합물이나 단백질 기반 치료제와 달리 기능 상실(loss-of-function) 혹은 기능 획득(gain-of-function) 유전자 돌연변이 모두를 정교하게 조절할 수 있다.그러나 ASO 치료제는 면역반응 유발, 비표적 결합(off-target effect), 체내 약물 전달 효율 등의 한계를 지니고 있으며, 이를 극복하기 위해 phosphorothioate 치환, 2′-O-methyl 및 LNA 변형, GalNAc 결합을 통한 간세포 표적화, 지질 나노입자 기반 전달체 등 다양한 기술적 발전이 이루어지고 있다.이러한 발전은 ASO의 치료적 효능을 향상시키는 데 핵심적인 기여를 하고 있으며, ASO 기반 핵산 치료제가 차세대 정밀의학 기반의 분자표적 치료제로 자리매김할 수 있는 가능성을 높이고 있다.텔로머레이스 표적 올리고뉴클레오타이드(Telomerase-targeted oligonucleotide, TTO)란? TTO는 표적 핵산 서열에 상보적으로 결합하는 구조를 가지면서도, 기존의 ASO와는 본질적으로 다른 작용기전을 가진다. 즉 일반적인 ASO는 mRNA의 분해(RNase H 의존적 경로) 또는 스플라이싱 조절을 통해 단백질 생성을 억제하지만, TTO는 hTR의 템플릿 서열에 직접 결합함으로써 텔로머레이스 효소 복합체의 활성 부위를 차단한다. 이는 효소의 기질 인식 및 촉매 반응 자체를 방해하는 비정형(non-canonical) ASO로 분류된다.이러한 TTO는 효소 작용 자체의 차단을 통해 효소 기능 차단(enzyme activity inhibition)이라는 새로운 패러다임을 제공한다. 특히 텔로머레이스 활성이 높은 암세포에서 선택적으로 작용함으로써, 정상세포에 대한 영향을 최소화하면서 암 특이적 억제 효과를 유도할 수 있다.대표적인 TTO로는 이메텔스타트(Imetelstat)가 있으며, 이는 hTR의 템플릿 영역에 상보적으로 결합하는 티오인산화(thio-phosphoramidate) 올리고뉴클레오타이드로 설계되었다.이메텔스타트는 어떤 약제인가? 이메텔스타트(Imetelstat, 제품명: 라이텔로 정맥주사, Rytelo®)는 텔로머레이스를 직접 표적으로 하는 최초의 올리고뉴클레오타이드 기반 치료제로, 2024년 미국 FDA로부터 승인받은 이후 골수이형성증후군(MDS) 치료 영역에서 새로운 치료 축으로 부상하고 있다. 이 약제의 승인 적응증은 "8주간 4단위 이상의 적혈구 수혈이 필요한 수혈 의존성 빈혈을 가진 저위험~중간-1 위험군 MDS 성인 환자 중, 적혈구생성자극제(ESA)에 반응하지 않거나 반응이 소실되었거나, 투여가 불가능한 경우"이다.이메텔스타트는 기존의 ASO와는 구별되는 비정형 ASO로 분류되며, 비정상적인 텔로머레이스 활성을 보이는 악성 조혈모세포(HSCs) 및 전구세포(HPCs)를 선택적으로 억제함으로써 병적 클론의 제거와 정상 조혈 기능의 회복을 유도하는 질환 수정형(disease-modifying) 치료 제이다.분자 구조적으로, 이메텔스타트는 13개의 뉴클레오타이드로 구성된 단일가닥 DNA 서열이며, 티오인산화(thio-phosphoramidate) 변형을 통해 핵산분해효소(nuclease) 저항성, 수용성, 대사적 안정성 등의 약물학적 특성이 향상되었다. 또한 5′ 말단에 팔미토일기(palmitoyl group)가 결합되어 소수성을 증가시켜 세포막 투과성 및 세포 내 유지성을 강화하며, 별도의 형질전환 과정 없이도 세포 내 작용이 가능하도록 설계되었다.전임상 연구에서는 이메텔스타트의 약물 노출과 텔로머레이스 억제 간의 명확한 약력학적 상관성이 확인되었고, 텔로머레이스 활성을 50% 이상 억제하는 수준의 약리 효과가 임상적으로 확보 가능한 범위 내에 있음이 입증되었다. 또한, 골수증식성 질환 모델(예: 본태성 혈소판증, 골수섬유증, 급성 골수성 백혈병 등)에서는 시험관 내(in vitro) 및 생체 내(in vivo) 실험 모두에서 강력한 항종양 활성을 나타냈다.특히 저위험 MDS 환자에서 이메텔스타트는 텔로미어 단축, hTERT 과발현, 분화 억제 등으로 특징지어지는 병적 조혈모세포 및 전구세포를 선택적으로 제거함으로써, 정상 조혈의 회복과 함께 적혈구 수혈 비의존 기간(RBC-TI)의 연장, 혈색소 수치의 향상, 염색체 이상 클론 및 돌연변이 부담의 감소를 유도하였다.아울러, 이메텔스타트는 면역회피 특성을 가진 악성 클론에서도 항암 활성을 유지함으로써, 기존 면역항암제 또는 세포독성 항암제에 비해 임상적 적용 가능성이 높다. 현재 진행 중인 다수의 임상시험 결과에 따라, MDS뿐 아니라 골수섬유증(myelofibrosis), 기타 혈액암 영역으로의 적응증 확장 가능성도 제시되고 있다.이메텔스타트의 약리 기전은? 이메텔스타트는 TERT-targeting telomerase complex inhibtor 또는 RNA-template targeting telomerase inhibitor로, 인간 텔로머라제의 RNA 구성 요소(hTR)의 주형 영역에 상보적으로 결합하여 텔로머레이스 복합체의 활성 부위에서 기질 결합 및 연장을 직접 차단한다. 즉 hTR의 주형 서열(3′-CAAUCCCAAUC-5′)에 상보적인 염기서열(5′-palmitate-TAGGGTTAGACAA-NH₂-3′)이 결합함으로써, 텔로머레이스 효소의 활성을 억제하여 텔로미어 말단에 반복 서열을 추가하는 기능을 경쟁적으로 차단한다. 이로 인해 암세포 내에서의 텔로미어 길이가 점진적으로 짧아지며, 결국 세포 노화 또는 세포자멸사를 유도하게 된다(Figure 4). 골수이형성증후군(MDS) 및 악성 줄기세포 및 전구세포에서 텔로머레이스 활성 및 인간 텔로머레이스 역전사효소(hTERT) RNA 발현이 증가한 것으로 보고되었다. 이에 여러 연구에서 이메텔스타트 치료가 텔로미어 길이 감소, 악성 줄기세포 및 전구세포의 증식 감소, 그리고 세포자멸사를 유도함으로써 세포 증식 억제 및 수명 단축 효과를 나타낸 것으로 보고되었다.또한, 이 약제는 텔로머레이스의 촉매 소단위인 hTERT의 발현을 억제함으로써 효소 활성을 이중적으로 저해하는데, 이 hTERT는 텔로머레이스 활성을 조절하는 주요 속도 제한 인자(rate-limiting component)로 알려져 있다.이러한 이멜스타트의 작용 기전은 항원-항체 반응이나 면역세포 활성화를 기반으로 하는 기존 면역항암제와는 달리, 종양 세포의 분열 및 생존을 유지하는 내재적 기전인 텔로머레이스 의존성을 직접 차단한다는 점에서 근본적인 차별성을 갖는다.이멜스타트(RYTELOⓇ) 3상 임상은 어떻게 진행되었나? 이메텔스타트의 임상적 유효성은 IMerge 3상 연구를 통해 입증되었다. 본 연구는 무작위배정, 이중눈가림, 위약대조, 다기관 임상시험으로 설계되었으며, 저위험 또는 중간-1위험군 골수이형성증후군(MDS) 환자 중 수혈 의존성을 보이는 성인 178명을 대상으로 시행되었다. 환자 등록 기준은 무작위배정 16주 전의 8주간 기간 동안 적어도 4단위 이상의 적혈구 수혈 필요 이력이 있는 경우로 정의되었다.등록 환자들은 모두 적혈구생성자극제(ESA)에 반응이 없었거나 반응이 소실되었거나, ESA 투여가 적절하지 않다고 판단된 경우였다. 주요 포함 기준에는 절대 호중구 수치 ≥ 1.5 × 10⁹/L, 혈소판 수 ≥ 75 × 10⁹/L이 포함되었으며, del(5q) 염색체 이상 보유자, 레날리도마이드(Lenalidomide) 또는 아자시티딘(Azacitidine)과 데시타빈(Decitabine) 같은 저메틸화제(hypomethylating agents, HMA) 치료 이력이 있는 환자는 제외되었다.무작위배정은 2:1 비율로 수행되어, RYTELO 7.1 mg/kg 정맥주사군(n=118) 또는 위약군(n=60)에 배정되었으며, 28일 주기(cycle)로 반복 투여되었다. 치료는 질병 진행, 용인할 수 없는 독성, 또는 환자의 자의적 중단 시점까지 지속되었다. 무작위배정은 기존 RBC 수혈 부담 및 IPSS 위험군 등급을 기준으로 계층화되었다. 모든 환자에게는 필요 시 적혈구 수혈을 포함한 지지요법(supportive care)이 병행 제공되었다.평가 기간은 RYTELO 투여군에서 중앙 추적기간 19.5개월(범위: 1.4–36.2개월), 위약군에서 17.5개월(범위: 0.7–34.3개월)이었으며, 주요 유효성 평가 변수는 적혈구 수혈 독립(RBC transfusion independence, RBC-TI) 달성 비율이었다. 이는 무작위배정 이후부터 차기 항암 치료 개시 전까지의 기간 중 연속된 8주(≥56일) 또는 연속된 24주(≥168일) 동안 적혈구 수혈이 전혀 이루어지지 않은 경우로 정의되었다.그 결과, 8주 이상 RBC-TI 도달률은 RYTELO 군에서 39.8%(95% CI: 30.9–49.3)로, 위약군의 15.0%(95% CI: 7.1–26.6) 대비 통계적으로 유의하게 높았다(p < 0.001). 또한 24주 이상 RBC-TI 도달률 역시 RYTELO 군에서 28.0% (95% CI: 20.1–37.0)로, 위약군 3.3% (95% CI: 0.4–11.5)와 비교하여 유의한 차이를 보였다(p < 0.001). 이러한 결과는 RYTELO가 ESA 불응 또는 부적합 환자군에서 수혈 의존성을 유의하게 줄이고, 적혈구계 조혈 회복을 유도할 수 있는 잠재력을 입증하는 것으로 해석된다.안전성 측면은 RYTELO 군에서 위약군 대비 ≥10% 이상, ≥5% 차이를 보인 주요 이상반응은 혈소판 감소, 백혈구 감소, 호중구 감소, AST/ALT/ALP 상승, 피로, 부분 트롬보플라스틴 시간 연장, 관절/근육통, COVID-19 감염, 두통 등이었다.따라서, RYTELO는 저위험 MDS 환자에서 임상적으로 의미 있는 수혈 독립 향상을 유도하였으며, 전반적으로 관리 가능한 안전성 프로파일을 보였다. 권장 투여 용량은 7.1 mg/kg이며, 4주마다 2시간에 걸쳐 정맥 투여한다. 이멜스타트의 앞으로의 예상은? 골수이형성증후군(MDS)은 조혈모세포의 분화 및 성숙에 결함이 생겨 비정상적 조혈과 말초 혈구감소증을 유발하는 이질적인 클론성 조혈장애이다. 특히 저위험군 MDS 환자에서는 만성적인 적혈구 수혈 의존성 빈혈이 주요 임상 양상으로 나타나며, 삶의 질 저하 및 철분 과부하에 의한 이차적 장기 손상이 주요 합병증으로 작용한다.현재까지 이들 환자에서 사용 가능한 치료제로는 적혈구생성자극제(ESA) 및 저메틸화제(HMA) 등이 있으나, 반응률의 한계와 장기 치료 효과에 대한 의문이 지속적으로 제기되고 있다.텔로머레이스는 텔로미어 길이를 유지하여 세포의 분열 한계를 극복하게 하는 핵심 효소로, 대부분의 암세포 및 악성 조혈모세포에서 비정상적으로 활성이 증가되어 있는 것이 특징이다. 이러한 활성을 선택적으로 억제함으로써 병적 조혈세포의 증식을 제한하고 정상 조혈을 회복시키는 접근은 질환의 근본 기전을 타겟으로 하는 질환 수정형(disease-modifying) 치료전략으로 주목받고 있다.이메텔스타트(Imetelstat)는 인간 텔로머레이스 복합체(hTERT/hTR)에 직접 결합하여 활성을 경쟁적으로 억제하는 first-in-class 올리고뉴클레오타이드 기반 치료제로, 텔로미어 유지 능력을 상실하게 하여 세포 자멸사 및 증식 억제를 유도한다. 특히 병적 조혈모세포(HSCs/HPCs)와 백혈병 줄기세포(LSCs)에 선택적으로 작용하며, 정상 조혈세포에 대한 영향은 제한적으로 보고되고 있다.IMerge 3상 임상시험에서 이메텔스타트는 ESA에 반응하지 않거나 부적합한 저위험~중간-1 위험군 MDS 환자를 대상으로 통계적으로 유의한 적혈구 수혈 독립 효과를 입증하였다. 8주 이상 수혈 독립률(RBC-TI)은 이메텔스타트군에서 39.8%, 위약군에서 15.0%로 나타났으며, 24주 이상 수혈 독립률도 각각 17.8%와 1.6%로 유의한 차이를 보였다. 이는 기존 치료옵션에 반응하지 않는 환자 집단에 있어 새로운 치료 패러다임을 제시한 근거로 평가된다.다만, 현재 이메텔스타트는 저위험 MDS + ESA 실패 + 수혈 의존성 빈혈이라는 제한된 적응증으로 승인되어 있으며, TP53 돌연변이나 고위험군 MDS는 제외 대상에 해당된다. 또한 치료 효과 발현까지 수 주에서 수개월이 소요되며, 호중구감소증(72%) 및 혈소판감소증(65%) 등 고빈도의 혈액학적 이상반응이 동반될 수 있다는 점은 임상적 고려가 필요하다.그럼에도 불구하고, 텔로머레이스라는 근원적 분자 표적을 겨냥한 이메텔스타트는 기존 화학요법 및 면역조절제와는 차별화된 기전을 통해 조혈계 악성질환에 있어 정밀의학적 치료 전략으로서의 가능성을 보여주고 있다. 이미 미국 및 유럽에서 승인된 약제로서, 향후 국내 도입과 더불어 적응증 확대, 병용요법, 고위험 환자군에서의 임상적 검토가 필요할 것으로 예상한다.참고문헌 1. Alexander Vaiserman, Dmytro Krasnienkov “Telomere Length as a Marker of Biological Age: State-of-the-Art, Open Issues, and Future Perspectives” Front. Genet. 11:630186(2021). 2. Virginia Boccardi “Aging, Cancer, and Inflammation: The Telomerase Connection” J. Mol. Sci. 2024, 25(15), 8542. 3. Virginia Boccardi, and Luigi Marano “Aging, Cancer, and Inflammation: The Telomerase Connection” Int. J. Mol. Sci. 2024, 25, 8542. 4. Zachary Schrank, Nabiha Khan, Chike Osude, Sanjana Singh et al. “Oligonucleotides Targeting Telomeres and Telomerase in Cancer” Molecules 2018, 23, 2267. 5. Ashley L. Lennoxm, Fei Huang, Melissa Kelly Behrs, Mario González-Sales et al. “Imetelstat, a novel, first-in-class telomerase inhibitor:Mechanism of action” Clin Transl Sci. 2024;17:e70076 6. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-06-13 06:24:02최병철 박사 -
 AI부터 유전자가위까지…제약, 액체생검 플랫폼 확보 분주[데일리팜=손형민 기자] 국내 제약바이오업계가 암을 조기진단할 수 있는 액체생검 기술 확보에 분주하다. 액체생검은 혈액이나 체액, 소변 등으로 암 진단이 가능해 직접 종양을 떼어내는 조직검사 대비 빠르고 간편하며, 환자의 생체 조직이 없는 경우에도 활용될 수 있다. GC지놈, 랩지노믹스 등이 인공지능(AI)과 유전자편집 기술을 통해 이 시장에 도전장을 내밀었다.12일 관련 업계에 따르면 GC지놈은 최근 AI 기반 액체생검 데이터를 활용한 폐암 검출 알고리즘에 관한 연구 결과를 국제학술지 ‘캔써리서치’에 게재했다.GC지놈은 2013년 출범한 임상유전체 분석 전문 업체다. 녹십자가 유전자 분석과 질병유전자 발굴 사업을 위해 약 20억원을 출자해 설립했다. 환자의 유전자 정보를 분석해 질병 정보를 제공하는 사업을 영위한다. 질병 진단과 예측은 물론 이를 통해 맞춤형 치료까지 지원하겠다는 목표다. 삼성서울병원 교수 출신 기창석 대표가 2018년부터 회사를 이끌고 있다.GC지놈은 혈액에서 세포유리 DNA를 분석해 폐암을 검출하는 알고리즘을 개발했다. '유전자 단편 말단 및 크기(FEMS)’ 기술과 딥러닝 알고리즘을 활용해 폐암 조기 검출의 정확도를 높인 게 특징이다. FEMS 기술은 폐암 조기 발견에서 민감도 91.0%를 기록하며 기존 유전체 분석 기술보다 성과를 나타냈다.연구진은 한국인 2777명의 데이터를 사용해 모델을 구축한 후 한국인 검증 코호트(1247명)와 백인 검증 코호트(100명)에서 성능을 평가했다.연구 결과, 한국인 검증 집단에서 95.5%의 민감도와 83.8%의 특이도를, 백인 검증 집단에서는 94.0%의 민감도와 84.0%의 특이도를 기록했다. 1~2기 초기 폐암 환자에서도 91.1%의 민감도를 보여 조기 암 진단 성과를 나타냈다.GC지놈은 지난 2023년 9월 아이캔서치를 출시했다. 아이캔서치는 GC지놈이 개발한 AI 기반 액체생검 진단 플랫폼이다.아이캔서치는 AI 알고리즘을 활용해 혈관 속을 떠다니는 세포유리 DNA(cfDNA) 중 순환 종양 DNA(ctDNA)를 추출해 차세대 염기서열 분석법(NGS)으로 암 존재 가능성을 조기에 확인할 수 있다. 암세포에서 유래된 cfDNA는 세포에서 혈액으로 방출된 DNA로 자가유래 세포의 특징을 고스란히 지니고 있다.아이캔서치는 총 5000여 명(암 환자 1300여 명, 일반인 3700여 명)의 샘플 분석을 통해 검사 정확도를 입증했다. 아이캔서치가 진단할 수 있는 암종은 폐암, 간암, 대장암, 담도암, 식도암, 난소암 등 총 6가지 암종이다. 허가 연구에서 1기암 진단 민감도는 81.1%를 기록하고 있는 것으로 알려진다.유전자가위로 암 조기진단 시대 열리나진씨커의 '크리스핀셋'진씨커는 액체생검에 크리스퍼(CRISPR) 유전자 가위 기술을 적용한 액체생검 제품 '크리스핀셋 하모니'를 보유하고 있다. 유전자 가위는 유전자를 편집하기 위해 DNA 특정 부위를 인식해 절단하는 분자생물학적 도구다.유전체 교정 도구에는 CRISPR/Cas-9, 징크핑거뉴클라아제, 탈렌 등이 있다. 그중 CRISPR/Cas-9은 3세대 유전자 가위 기술로 분류된다. CRISPR/Cas-9의 작용 원리는 상보적 염기서열을 지닌 RNA와 Cas-9 복합체를 핵 내로 넣어 상보적 DNA에 결합한 후 Cas-9이 DNA를 두 가닥으로 자르는 방식이다.진씨커에 따르면 이 회사의 유전자 가위 기술을 이용하면 정상 유전자에서 유래된 cfDNA만 겨냥해 절단한다. 종양 크기가 1㎤인 극초기 암환자는 ctDNA 비율이 0.022%에 불과하지만 기존 액체생검은 ctDNA가 0.1% 미만일 때는 검진이 불가능하다.진씨커의 유전자 가위 기술은 정상 유전자에서 유래된 cfDNA만 겨냥해 절단하고 이후 증폭과정을 거치면 절단된 유전자는 증폭하지 못한다. 대신 혈액 속 유전자 가운데 ctDNA 비율이 최대 100배까지 증가하는 것으로 나타났다.진씨커는 고대안암병원과 손잡고 건강검진 시장에 진출했다. 고대안암병원 건강검진센터를 통해 대표적인 암종 11가지(간암, 갑상선암, 난소암, 담도암, 대장암, 방광암, 유방암, 위암, 자궁경부암, 췌장암, 폐암)의 위험도를 예측해 안내하고, 각 진료과 전문의를 통해 추가 정밀검사를 안내하는 형태다.액체생검 상용화는 성공…한계도 여전암환자의 조직 추출은 항암제 내성이 생긴 이후에는 점차 어려워진다. 첫 조직검사 시 대개 90% 이상의 확률로 조직 추출이 가능하지만 항암제 내성 환자에서 재조직검사를 시행할 때 점차 그 확률이 떨어진다. 액체생검의 가장 큰 강점은 기존 조직검사와 달리 비침습성 검사 요법이라는 것이다.이에 액체생검이 조직검사를 대체할 수 있는 후보로 거론되고 있지만 아직까지는 일부 암에만 적용 가능하고 100%에 근접하는 정확도를 보여주지는 못해 추가 검사가 필요한 상황이다. 다만 암의 조기 진단과 예측 측면에서는 유용한 도구로 활용될 수 있다. 이에 주요 액체생검 진단 바이오기업들은 조기 암 진단 시장을 노리고 있다.싸이토젠과 아이엠비디엑스는 액체생검 분야에서 활발한 활동을 전개하고 있다.싸이토젠은 혈액 내 순환종양세포(CTC)를 기반으로 한 액체생검 플랫폼을 개발했다. 이 회사는 2023년 11월 미국 국립보건원(NIH) 산하 로젠버그 연구소에 해당 플랫폼을 추가로 공급했다. 이는 작년 미국국립암연구소(NCI)에 이어 두 번째 공급이다.싸이토젠은 일본 시장 진출에도 박차를 가하고 있다. 2023년 내에 일본 현지법인을 설립하고 도쿄에 액체생검 분석센터를 구축할 계획이다. 이는 미국에 이은 두 번째 해외 거점으로, 일본 내 제약사 및 연구기관과의 협력을 강화해 현지 고객들의 요구에 신속하게 대응할 수 있을 것으로 싸이토젠은 기대하고 있다.아이엠비디엑스는 지난해 11월 다중 암 조기진단 플랫폼인 '캔서파인드'를 출시하며 액체생검 시장에 본격적으로 진입했다. 캔서파인드는 한 번의 혈액 검사로 대장암, 위암, 간암 등 8가지 암종을 동시에 검사할 수 있는 제품이다. 현재 국내 10개 상급종합병원에서 상용화됐다.아이엠비디엑스는 향후 캔서파인드 적용 암종을 20종으로 확대하고 검사 비용을 기존 100만원에서 30만원으로 낮추겠다는 계획이다.2025-04-12 06:20:49손형민
AI부터 유전자가위까지…제약, 액체생검 플랫폼 확보 분주[데일리팜=손형민 기자] 국내 제약바이오업계가 암을 조기진단할 수 있는 액체생검 기술 확보에 분주하다. 액체생검은 혈액이나 체액, 소변 등으로 암 진단이 가능해 직접 종양을 떼어내는 조직검사 대비 빠르고 간편하며, 환자의 생체 조직이 없는 경우에도 활용될 수 있다. GC지놈, 랩지노믹스 등이 인공지능(AI)과 유전자편집 기술을 통해 이 시장에 도전장을 내밀었다.12일 관련 업계에 따르면 GC지놈은 최근 AI 기반 액체생검 데이터를 활용한 폐암 검출 알고리즘에 관한 연구 결과를 국제학술지 ‘캔써리서치’에 게재했다.GC지놈은 2013년 출범한 임상유전체 분석 전문 업체다. 녹십자가 유전자 분석과 질병유전자 발굴 사업을 위해 약 20억원을 출자해 설립했다. 환자의 유전자 정보를 분석해 질병 정보를 제공하는 사업을 영위한다. 질병 진단과 예측은 물론 이를 통해 맞춤형 치료까지 지원하겠다는 목표다. 삼성서울병원 교수 출신 기창석 대표가 2018년부터 회사를 이끌고 있다.GC지놈은 혈액에서 세포유리 DNA를 분석해 폐암을 검출하는 알고리즘을 개발했다. '유전자 단편 말단 및 크기(FEMS)’ 기술과 딥러닝 알고리즘을 활용해 폐암 조기 검출의 정확도를 높인 게 특징이다. FEMS 기술은 폐암 조기 발견에서 민감도 91.0%를 기록하며 기존 유전체 분석 기술보다 성과를 나타냈다.연구진은 한국인 2777명의 데이터를 사용해 모델을 구축한 후 한국인 검증 코호트(1247명)와 백인 검증 코호트(100명)에서 성능을 평가했다.연구 결과, 한국인 검증 집단에서 95.5%의 민감도와 83.8%의 특이도를, 백인 검증 집단에서는 94.0%의 민감도와 84.0%의 특이도를 기록했다. 1~2기 초기 폐암 환자에서도 91.1%의 민감도를 보여 조기 암 진단 성과를 나타냈다.GC지놈은 지난 2023년 9월 아이캔서치를 출시했다. 아이캔서치는 GC지놈이 개발한 AI 기반 액체생검 진단 플랫폼이다.아이캔서치는 AI 알고리즘을 활용해 혈관 속을 떠다니는 세포유리 DNA(cfDNA) 중 순환 종양 DNA(ctDNA)를 추출해 차세대 염기서열 분석법(NGS)으로 암 존재 가능성을 조기에 확인할 수 있다. 암세포에서 유래된 cfDNA는 세포에서 혈액으로 방출된 DNA로 자가유래 세포의 특징을 고스란히 지니고 있다.아이캔서치는 총 5000여 명(암 환자 1300여 명, 일반인 3700여 명)의 샘플 분석을 통해 검사 정확도를 입증했다. 아이캔서치가 진단할 수 있는 암종은 폐암, 간암, 대장암, 담도암, 식도암, 난소암 등 총 6가지 암종이다. 허가 연구에서 1기암 진단 민감도는 81.1%를 기록하고 있는 것으로 알려진다.유전자가위로 암 조기진단 시대 열리나진씨커의 '크리스핀셋'진씨커는 액체생검에 크리스퍼(CRISPR) 유전자 가위 기술을 적용한 액체생검 제품 '크리스핀셋 하모니'를 보유하고 있다. 유전자 가위는 유전자를 편집하기 위해 DNA 특정 부위를 인식해 절단하는 분자생물학적 도구다.유전체 교정 도구에는 CRISPR/Cas-9, 징크핑거뉴클라아제, 탈렌 등이 있다. 그중 CRISPR/Cas-9은 3세대 유전자 가위 기술로 분류된다. CRISPR/Cas-9의 작용 원리는 상보적 염기서열을 지닌 RNA와 Cas-9 복합체를 핵 내로 넣어 상보적 DNA에 결합한 후 Cas-9이 DNA를 두 가닥으로 자르는 방식이다.진씨커에 따르면 이 회사의 유전자 가위 기술을 이용하면 정상 유전자에서 유래된 cfDNA만 겨냥해 절단한다. 종양 크기가 1㎤인 극초기 암환자는 ctDNA 비율이 0.022%에 불과하지만 기존 액체생검은 ctDNA가 0.1% 미만일 때는 검진이 불가능하다.진씨커의 유전자 가위 기술은 정상 유전자에서 유래된 cfDNA만 겨냥해 절단하고 이후 증폭과정을 거치면 절단된 유전자는 증폭하지 못한다. 대신 혈액 속 유전자 가운데 ctDNA 비율이 최대 100배까지 증가하는 것으로 나타났다.진씨커는 고대안암병원과 손잡고 건강검진 시장에 진출했다. 고대안암병원 건강검진센터를 통해 대표적인 암종 11가지(간암, 갑상선암, 난소암, 담도암, 대장암, 방광암, 유방암, 위암, 자궁경부암, 췌장암, 폐암)의 위험도를 예측해 안내하고, 각 진료과 전문의를 통해 추가 정밀검사를 안내하는 형태다.액체생검 상용화는 성공…한계도 여전암환자의 조직 추출은 항암제 내성이 생긴 이후에는 점차 어려워진다. 첫 조직검사 시 대개 90% 이상의 확률로 조직 추출이 가능하지만 항암제 내성 환자에서 재조직검사를 시행할 때 점차 그 확률이 떨어진다. 액체생검의 가장 큰 강점은 기존 조직검사와 달리 비침습성 검사 요법이라는 것이다.이에 액체생검이 조직검사를 대체할 수 있는 후보로 거론되고 있지만 아직까지는 일부 암에만 적용 가능하고 100%에 근접하는 정확도를 보여주지는 못해 추가 검사가 필요한 상황이다. 다만 암의 조기 진단과 예측 측면에서는 유용한 도구로 활용될 수 있다. 이에 주요 액체생검 진단 바이오기업들은 조기 암 진단 시장을 노리고 있다.싸이토젠과 아이엠비디엑스는 액체생검 분야에서 활발한 활동을 전개하고 있다.싸이토젠은 혈액 내 순환종양세포(CTC)를 기반으로 한 액체생검 플랫폼을 개발했다. 이 회사는 2023년 11월 미국 국립보건원(NIH) 산하 로젠버그 연구소에 해당 플랫폼을 추가로 공급했다. 이는 작년 미국국립암연구소(NCI)에 이어 두 번째 공급이다.싸이토젠은 일본 시장 진출에도 박차를 가하고 있다. 2023년 내에 일본 현지법인을 설립하고 도쿄에 액체생검 분석센터를 구축할 계획이다. 이는 미국에 이은 두 번째 해외 거점으로, 일본 내 제약사 및 연구기관과의 협력을 강화해 현지 고객들의 요구에 신속하게 대응할 수 있을 것으로 싸이토젠은 기대하고 있다.아이엠비디엑스는 지난해 11월 다중 암 조기진단 플랫폼인 '캔서파인드'를 출시하며 액체생검 시장에 본격적으로 진입했다. 캔서파인드는 한 번의 혈액 검사로 대장암, 위암, 간암 등 8가지 암종을 동시에 검사할 수 있는 제품이다. 현재 국내 10개 상급종합병원에서 상용화됐다.아이엠비디엑스는 향후 캔서파인드 적용 암종을 20종으로 확대하고 검사 비용을 기존 100만원에서 30만원으로 낮추겠다는 계획이다.2025-04-12 06:20:49손형민 -
 "남일 같지 않네"...미국 바이오기업 폐업·헐값 매각 속출[데일리팜=차지현 기자] 최근 문을 닫거나 헐값에 매각되는 미국 바이오텍이 증가하고 있다. 세계적으로 투자 심리가 위축된 상황 속 연구개발(R&D) 비용과 운영비 부담을 견디지 못한 기업의 시장 퇴출이 이어지는 분위기다.27일 바이오 업계에 따르면 크리스퍼(CRISPR) 유전자 편집 기술 전문 업체 스포트라이트테라퓨틱스가 최근 문을 닫았다. 2018년 설립된 스포트라이트테라퓨틱스는 특정 세포만 선택적으로 유전자 편집을 해 치료 정확성과 효율성을 높이는 데 주력했다. 면역항암제, 안과 질환 등 다양한 치료 분야 파이프라인을 개발해 왔다.그러나 전임상에서 기대에 못 미치는 결과를 얻으면서 추가 자금 조달에 어려움을 겪었다. 하지만 전임상 마우스 실험 모델에서 망막 세포의 유전자 편집 성공률이 7%에 불과했고 미니피그 대상 모델에서는 1% 미만으로 나타났다. 스포트라이트테라퓨틱스는 작년 여름부터 직원을 해고하는 등 긴축 경영에 돌입했다.코진 테라퓨틱스 구조조정 관련 공지(자료: 코진 테라퓨틱스 공식 SNS) 미국 보스턴 소재 코진 테라퓨틱스도 폐쇄를 결정했다. 코진 테라퓨틱스는 지난 13일 자사 공식 사회관계망서비스(SNS)를 통해 "작년 새로운 리더십 팀 구성 이후 암과 자가면역 질환을 대상으로 한 최초의 소분자 페로프토시스 치료제 개발에 있어 놀라운 진전을 이뤘다"면서도 "이 프로그램의 임상을 진행하기 위한 충분한 자금을 확보하지 못해 향후 구조조정 절차에 들어갈 예정"이라고 했다.코진 테라퓨틱스는 세포 대사 상태와 약물 반응성 간 상관관계를 연구해 새 치료법을 개발하는 바이오텍이다. 2019년에 설립한 뒤 2021년 시리즈 A 라운드를 통해 6000만 달러를 모집했다. 하지만 이후 후속 투자 유치에 실패하면서 재정난이 심화했다.암 생명공학 업체 비락타 테라퓨틱스도 모든 직원을 해고하면서 영업을 종료했다. 미국 증권거래위원회(SEC)에 따르면 이 회사는 지난 3일 이사회를 열고 회사 운영을 중단하기로 의결했다. 비락타 테라퓨틱스는 직원 전체를 해고하는 등 청산 작업에 10만 달러의 일회성 비용이 발생할 것으로 전망했다.미국 캘리포니아에 본사를 둔 비락타 테라퓨틱스는 1998년 설립됐다. 작년 파이프라인 우선순위를 재조정하는 과정에서 인력의 23%를 감축했다. 비락타 테라퓨틱스는 당시 고형 종양 프로그램을 일시 중단하고 말초 T세포 림프종(PTCL) 치료제 개발에 집중하기로 결정했다.작년 하반기 추가 구조조정을 진행하면서 인력의 42%를 해고했다. 이후 자금조달에 난항을 겪으면서 림프종 파이프라인 임상 중단을 선언했다. 이달 초 최고경영자(CEO) 마크 로테라가 사임한 데 이어 최고재무책임자(CFO), 최고의료책임자(CMO) 등 고위급 임원이 줄줄이 퇴임하면서 폐업을 공식화했다. 지난 4일 나스닥에서 상장 폐지됐다.미국 샌디에이고에 위치한 벨리아 테라퓨틱스도 지난달 운영 중단을 발표했다. 2021년 설립 이후 4년 만에 문을 닫기로 결정했다. 만족스럽지 않은 임상 결과, 투자 유치 실패 등이 복합적으로 작용한 결과로 풀이된다. 이로써 올해 들어서만 미국 바이오텍 3곳이 영업을 중단했다.재정난으로 인해 헐값에 회사를 매각하는 사례도 속속 나오고 있다. 미국 블루버드바이오는 최근 글로벌 투자 업체 칼라일과 미국 사모펀드 SK캐피탈에 인수되는 내용의 최종 계약을 체결했다. 계약에 따라 블루버드바이오 주주는 1주당 3달러를 현금으로 받는다. 제품 포트폴리오의 실적 달성에 따른 조건부 가치권(CVR)을 추가로 받는 조건도 달렸다. CVR을 포함한 총 거래 규모는 최대 1400억원 수준이다. 거래 완료 이후 블루버드바이오는 비상장기업으로 전환된다.블루버드바이오는 유전자 치료제 개발 전문 업체다. 1992년 설립한 제네틱스파마슈티컬즈가 전신으로 2010년 사명을 바꾼 뒤 2013년 나스닥에 상장했다. 베타 지중해 빈혈(TDT)과 겸상적혈구병(SCD) 등 혁신 유전자 치료제를 개발하며 시장의 크게 받았다. 유전자 치료제 분야 선두 기업으로 자리매김하면서 2018년 시가총액이 120억 달러를 돌파하기도 했다. 그러나 이후 상업성 실패 등으로 기업가치가 지속 떨어졌다. 현지시각 24일 종가 기준 블루버드바이오 주가는 4.05 달러, 시가총액은 3938만 달러다. 미국 23앤드미(23andMe)도 현지 시각 21일 SEC 공시를 통해 창업자 앤 보이치키 CEO가 상장폐지를 추진한다고 밝혔다. 보이치키 CEO와 미국 투자 업체 뉴마운틴캐피탈은 1주당 2.53달러, 총 7470만 달러에 보이치키 CEO가 보유하고 있지 않은 나머지 23앤드미 주식 전량을 매입할 계획이다. 다만 이는 이사회 승인 절차를 거쳐야 한다.2006년 설립된 23앤드미는 유전자 검사와 연구를 전문으로 하는 미국 바이오텍이다. 소비자가 직접 유전자 검사를 받을 수 있는 DTC(Direct-to-Consumer) 유전자 검사 서비스를 제공한다. 2021년 특수목적 인수기업(SPAC) 방식으로 나스닥에 상장했으나 최근 경영난과 주가 하락으로 생존 위기에 직면했다. 2023년 직원 25%를 감축하면서 구조조정에 돌입한 데 이어 작년 말 신약개발 사업부를 완전히 접었다.코로나19 팬데믹 시기 급성장했던 바이오텍이 자금 조달에 어려움을 겪으면서 회사를 청산하는 기업이 증가하고 있다는 분석이다. 글로벌 회계법인 언스트앤영(EY) 조사 결과 2023년 미국과 유럽의 바이오벤처 자금 조달액은 184억 달러로, 팬데믹 이전 5년 평균인 475억 달러 대비 60% 이상 감소했다.EY가 분석한 바이오텍 생존 지수를 보면, 2023년 약 31%의 기업이 향후 1년 이상 운영 유지를 위한 현금이 부족한 것으로 조사됐다. 미국과 유럽의 상장 바이오 업체의 2023년 매출은 1919억 달러로 전년보다10.7% 감소했다. 상장을 추진하는 바이오텍도 같은 기간 5% 감소했고 고용은 1.5% 줄어들었다.2025-02-27 12:04:24차지현
"남일 같지 않네"...미국 바이오기업 폐업·헐값 매각 속출[데일리팜=차지현 기자] 최근 문을 닫거나 헐값에 매각되는 미국 바이오텍이 증가하고 있다. 세계적으로 투자 심리가 위축된 상황 속 연구개발(R&D) 비용과 운영비 부담을 견디지 못한 기업의 시장 퇴출이 이어지는 분위기다.27일 바이오 업계에 따르면 크리스퍼(CRISPR) 유전자 편집 기술 전문 업체 스포트라이트테라퓨틱스가 최근 문을 닫았다. 2018년 설립된 스포트라이트테라퓨틱스는 특정 세포만 선택적으로 유전자 편집을 해 치료 정확성과 효율성을 높이는 데 주력했다. 면역항암제, 안과 질환 등 다양한 치료 분야 파이프라인을 개발해 왔다.그러나 전임상에서 기대에 못 미치는 결과를 얻으면서 추가 자금 조달에 어려움을 겪었다. 하지만 전임상 마우스 실험 모델에서 망막 세포의 유전자 편집 성공률이 7%에 불과했고 미니피그 대상 모델에서는 1% 미만으로 나타났다. 스포트라이트테라퓨틱스는 작년 여름부터 직원을 해고하는 등 긴축 경영에 돌입했다.코진 테라퓨틱스 구조조정 관련 공지(자료: 코진 테라퓨틱스 공식 SNS) 미국 보스턴 소재 코진 테라퓨틱스도 폐쇄를 결정했다. 코진 테라퓨틱스는 지난 13일 자사 공식 사회관계망서비스(SNS)를 통해 "작년 새로운 리더십 팀 구성 이후 암과 자가면역 질환을 대상으로 한 최초의 소분자 페로프토시스 치료제 개발에 있어 놀라운 진전을 이뤘다"면서도 "이 프로그램의 임상을 진행하기 위한 충분한 자금을 확보하지 못해 향후 구조조정 절차에 들어갈 예정"이라고 했다.코진 테라퓨틱스는 세포 대사 상태와 약물 반응성 간 상관관계를 연구해 새 치료법을 개발하는 바이오텍이다. 2019년에 설립한 뒤 2021년 시리즈 A 라운드를 통해 6000만 달러를 모집했다. 하지만 이후 후속 투자 유치에 실패하면서 재정난이 심화했다.암 생명공학 업체 비락타 테라퓨틱스도 모든 직원을 해고하면서 영업을 종료했다. 미국 증권거래위원회(SEC)에 따르면 이 회사는 지난 3일 이사회를 열고 회사 운영을 중단하기로 의결했다. 비락타 테라퓨틱스는 직원 전체를 해고하는 등 청산 작업에 10만 달러의 일회성 비용이 발생할 것으로 전망했다.미국 캘리포니아에 본사를 둔 비락타 테라퓨틱스는 1998년 설립됐다. 작년 파이프라인 우선순위를 재조정하는 과정에서 인력의 23%를 감축했다. 비락타 테라퓨틱스는 당시 고형 종양 프로그램을 일시 중단하고 말초 T세포 림프종(PTCL) 치료제 개발에 집중하기로 결정했다.작년 하반기 추가 구조조정을 진행하면서 인력의 42%를 해고했다. 이후 자금조달에 난항을 겪으면서 림프종 파이프라인 임상 중단을 선언했다. 이달 초 최고경영자(CEO) 마크 로테라가 사임한 데 이어 최고재무책임자(CFO), 최고의료책임자(CMO) 등 고위급 임원이 줄줄이 퇴임하면서 폐업을 공식화했다. 지난 4일 나스닥에서 상장 폐지됐다.미국 샌디에이고에 위치한 벨리아 테라퓨틱스도 지난달 운영 중단을 발표했다. 2021년 설립 이후 4년 만에 문을 닫기로 결정했다. 만족스럽지 않은 임상 결과, 투자 유치 실패 등이 복합적으로 작용한 결과로 풀이된다. 이로써 올해 들어서만 미국 바이오텍 3곳이 영업을 중단했다.재정난으로 인해 헐값에 회사를 매각하는 사례도 속속 나오고 있다. 미국 블루버드바이오는 최근 글로벌 투자 업체 칼라일과 미국 사모펀드 SK캐피탈에 인수되는 내용의 최종 계약을 체결했다. 계약에 따라 블루버드바이오 주주는 1주당 3달러를 현금으로 받는다. 제품 포트폴리오의 실적 달성에 따른 조건부 가치권(CVR)을 추가로 받는 조건도 달렸다. CVR을 포함한 총 거래 규모는 최대 1400억원 수준이다. 거래 완료 이후 블루버드바이오는 비상장기업으로 전환된다.블루버드바이오는 유전자 치료제 개발 전문 업체다. 1992년 설립한 제네틱스파마슈티컬즈가 전신으로 2010년 사명을 바꾼 뒤 2013년 나스닥에 상장했다. 베타 지중해 빈혈(TDT)과 겸상적혈구병(SCD) 등 혁신 유전자 치료제를 개발하며 시장의 크게 받았다. 유전자 치료제 분야 선두 기업으로 자리매김하면서 2018년 시가총액이 120억 달러를 돌파하기도 했다. 그러나 이후 상업성 실패 등으로 기업가치가 지속 떨어졌다. 현지시각 24일 종가 기준 블루버드바이오 주가는 4.05 달러, 시가총액은 3938만 달러다. 미국 23앤드미(23andMe)도 현지 시각 21일 SEC 공시를 통해 창업자 앤 보이치키 CEO가 상장폐지를 추진한다고 밝혔다. 보이치키 CEO와 미국 투자 업체 뉴마운틴캐피탈은 1주당 2.53달러, 총 7470만 달러에 보이치키 CEO가 보유하고 있지 않은 나머지 23앤드미 주식 전량을 매입할 계획이다. 다만 이는 이사회 승인 절차를 거쳐야 한다.2006년 설립된 23앤드미는 유전자 검사와 연구를 전문으로 하는 미국 바이오텍이다. 소비자가 직접 유전자 검사를 받을 수 있는 DTC(Direct-to-Consumer) 유전자 검사 서비스를 제공한다. 2021년 특수목적 인수기업(SPAC) 방식으로 나스닥에 상장했으나 최근 경영난과 주가 하락으로 생존 위기에 직면했다. 2023년 직원 25%를 감축하면서 구조조정에 돌입한 데 이어 작년 말 신약개발 사업부를 완전히 접었다.코로나19 팬데믹 시기 급성장했던 바이오텍이 자금 조달에 어려움을 겪으면서 회사를 청산하는 기업이 증가하고 있다는 분석이다. 글로벌 회계법인 언스트앤영(EY) 조사 결과 2023년 미국과 유럽의 바이오벤처 자금 조달액은 184억 달러로, 팬데믹 이전 5년 평균인 475억 달러 대비 60% 이상 감소했다.EY가 분석한 바이오텍 생존 지수를 보면, 2023년 약 31%의 기업이 향후 1년 이상 운영 유지를 위한 현금이 부족한 것으로 조사됐다. 미국과 유럽의 상장 바이오 업체의 2023년 매출은 1919억 달러로 전년보다10.7% 감소했다. 상장을 추진하는 바이오텍도 같은 기간 5% 감소했고 고용은 1.5% 줄어들었다.2025-02-27 12:04:24차지현 -
 유전자가위 신약 등장…국내 제약업계도 개발 본격화[데일리팜=손형민 기자] 국내 제약업계가 잇따라 공동연구 계약을 체결하며 유전자 가위를 활용한 유전자치료제 개발에 적극적인 움직임을 보이고 있다. 최근 엑사셀, 리프제니아 등 유전자치료제들이 해외에 상용화되면서 국내 유전자 편집 기술 보유 기업들도 분주하게 신약 개발에 나서고 있는 모습이다.28일 관련 업계에 따르면 툴젠은 최근 오가노이드사이언스와 유전자 가위 'CRISPR-Cas9' 특허 기술이전 계약을 체결했다. 오가노이드사이언스는 CRISPR-Cas9 기술을 활용해 암, 유전 질환, 면역 질환 등에 적용 가능한 오가노이드 기반 질병 모델을 개발하겠다는 계획이다.유전자 가위는 유전자를 편집하기 위해 DNA 특정 부위를 인식해 절단하는 분자생물학적 도구다.유전체 교정 도구에는 CRISPR/Cas-9, 징크핑거뉴클라아제, 탈렌 등이 있다. 그중 CRISPR/Cas-9은 3세대 유전자 가위 기술로 분류된다. CRISPR/Cas-9의 작용 원리는 상보적 염기서열을 지닌 RNA와 Cas-9 복합체를 핵 내로 넣어 상보적 DNA에 결합한 후 Cas-9이 DNA를 두 가닥으로 자르는 방식이다.툴젠과 오가노이드사이언스는 이달 유전자 가위를 활용한 신약 공동연구 계약을 체결했다. 툴젠은 유전자 가위를 활용해 희귀질환인 샤르코-마리-투스병 1A형(CMT1A) 치료제인 'TGT-001'을 개발하고 있다. CMT는 유전성 말초신경질환으로 근위축, 근력약화, 감각소실, 보행장애 및 무반사 등의 증상을 보인다. 전체 CMT 환자의 약 40%가 PMP22 유전자의 중복에 기인하는 CMT1A형 질환으로 아직 근본적인 치료법이 없다.지난 6월 툴젠이 공개한 연구에 따르면 유전자전달체를 활용해 다양한 CMT1A 동물모델에 적용한 결과, TGT-001은 말초신경에서 유의미한 유전자편집과 PMP22 유전자 발현 감소를 확인했다. 또 행동학적, 전기생리학적 지표를 통해 유효성을 입증했다.툴젠은 CRISPR-Cas9 유전자 가위 원천특허를 보유한 유일한 국내 기업으로 주요 10개 국가에 총 29건의 특허가 등록돼 있다. 툴젠은 CRISPR-Cas9 유전자가위의 Cas9을 단백질 형태로 세포에 도입하는 방법에 대한 유럽 특허 등록에도 성공했다.진코어는 최근 삼양홀딩스와 유전자치료제 공동연구 계약을 체결했다.이번 공동연구 계약은 삼양홀딩스의 유전자 전달 기술 플랫폼 ‘SENS’와 진코어의 유전자 편집 기술 ‘TaRGET’을 결합해 새로운 유전자치료제를 개발하기 위한 목적으로 체결됐다.SENS는 핵산 기반 치료제, 유전자 교정 약물 등을 간·폐·비장 등 다양한 조직의 특정 세포에 선택적으로 전달할 수 있는 약물 전달 플랫폼이다. 삼양홀딩스는 유전자 편집 기술과 유전자 전달체 융합기술의 타당성을 검증한 후에 진코어와 유전자치료제 공동개발을 진행할 계획이다.진코어는 초소형 유전자가위 기술인 TaRGET 플랫폼을 보유하고 있다. TaRGET은 CRISPR-Cas9과 비교해 유전자 편집 효소의 크기가 작아 아데노관련바이러스(AAV)로 전달이 가능해 생체 내(in vivo) 유전자치료제 개발에 유용한 기술이다. 이 회사는 신경세포의 기능 저하와 관련된 원인 유전자를 교정하는 치료제 개발 계획을 갖고 있다.동아에스티는 일레븐 테라퓨틱스와 공동연구 계약을 체결하고 RNA 기반 유전자치료제 개발에 나선다. 동아에스티는 일레븐 테라퓨틱스가 보유한 ‘테라' 플랫폼 기술을 활용해 섬유증 질환을 타깃으로 RNA 치료제 발굴을 위한 공동연구를 진행할 계획이다.테라 플랫폼은 RNA 화학적 변형에 대한 구조-활성 관계(SAR)를 인공지능/머신러닝 기술을 이용해 높은 처리량으로 해독하는 기술로 최적의 xRNA 약물 발굴에 활용되고 있다.동아에스티는 차세대 주력 분야 중 하나로 유전자 치료제를 선정했으며, 기존 강점 분야인 합성신약 분야에서 유전자치료제 분야로 연구개발 역량을 확장하기 위한 시도를 지속하고 있다.이와 관련 동아쏘시오홀딩스 자회사 에스티팜은 유전자 편집 기술에 활용되는 sgRNA(single-guide RNA) 공정 기술을 개발하겠다는 계획이다.유전자치료제 개발을 위해서는 100mer 이상의 고순도 sgRNA의 생산이 필요한데 기존 올리고 원료보다 생산 기술이 어려운 것으로 알려져 있다. 이에 에스티팜은 지난 5월 100mer 이상의 sgRNA 공정을 만든 결과와 주요 지표에 대해 공개하며 본격적으로 RNA 플랫폼을 구축하겠다는 목표다.엑사셀·리프제니아 상용화…유전자 가위 활용한 신약 가능성 확인최근 해외에서 유전자 가위를 활용한 신약이 본격 상용화되면서 관련 기술에 대해 이목이 집중되고 있다.미국 식품의약국(FDA)은 지난해 12월 미국 바이오기업 버텍스 파마슈티컬스와 스위스 크리스퍼 테라퓨틱스가 개발한 유전자 편집 치료제 엑사셀(영국 허가명 가스케비)을 승인했다. 또 같은 날 미국 블루버드바이오의 유전자 편집 치료제인 리프제니아를 허가했다.유전자 편집 기술을 활용한 두 치료제는 이번 허가를 통해 12세 이상 중증 겸상적혈구증후군 환자를 대상으로 미국 내에서 사용할 수 있다.겸상적혈구증후군은 유전병 중 하나로 헤모글로빈 유전자 변이로 인해 적혈구의 모양이 낫이나 초승달 모양으로 변하는 질병이다. 현재는 조혈모세포 이식이 유일한 치료 방법이지만 유전자 편집 기술을 활용한 치료제가 승인된 만큼 환자 치료옵션이 다양해질 것이라는 분석이다.최근에는 체내에 직접 주입하는 생체 내 방식의 유전자치료제도 임상3상에 진입했다.미국 인텔리아와 리제네론은 최근 국내를 비롯해 다국가 임상3상을 승인받고 심근병증을 동반한 트랜스티레틴 아밀로이드증 환자를 대상으로 유전자 가위를 활용한 신약 'NTLA-2001'의 효능과 안전성을 확인한다. NTLA-2001은 지질나노입자(LNP)를 이용해 크리스퍼 가위 기술을 전달하는 기전을 갖고 있다.현재까지 공개된 임상 결과에 따르면, 트랜스티레틴 아밀로이드성 다발신경병증과 아밀로이드증 환자에서 NTLA-2001군은 최대 94%의 비정상적인 트랜스티레틴(TTR) 유전자의 감소 효과를 보였다. 이 같은 효과는 6개월 이상 장기 추적결과에서도 지속됐다.2024-10-28 12:00:43손형민
유전자가위 신약 등장…국내 제약업계도 개발 본격화[데일리팜=손형민 기자] 국내 제약업계가 잇따라 공동연구 계약을 체결하며 유전자 가위를 활용한 유전자치료제 개발에 적극적인 움직임을 보이고 있다. 최근 엑사셀, 리프제니아 등 유전자치료제들이 해외에 상용화되면서 국내 유전자 편집 기술 보유 기업들도 분주하게 신약 개발에 나서고 있는 모습이다.28일 관련 업계에 따르면 툴젠은 최근 오가노이드사이언스와 유전자 가위 'CRISPR-Cas9' 특허 기술이전 계약을 체결했다. 오가노이드사이언스는 CRISPR-Cas9 기술을 활용해 암, 유전 질환, 면역 질환 등에 적용 가능한 오가노이드 기반 질병 모델을 개발하겠다는 계획이다.유전자 가위는 유전자를 편집하기 위해 DNA 특정 부위를 인식해 절단하는 분자생물학적 도구다.유전체 교정 도구에는 CRISPR/Cas-9, 징크핑거뉴클라아제, 탈렌 등이 있다. 그중 CRISPR/Cas-9은 3세대 유전자 가위 기술로 분류된다. CRISPR/Cas-9의 작용 원리는 상보적 염기서열을 지닌 RNA와 Cas-9 복합체를 핵 내로 넣어 상보적 DNA에 결합한 후 Cas-9이 DNA를 두 가닥으로 자르는 방식이다.툴젠과 오가노이드사이언스는 이달 유전자 가위를 활용한 신약 공동연구 계약을 체결했다. 툴젠은 유전자 가위를 활용해 희귀질환인 샤르코-마리-투스병 1A형(CMT1A) 치료제인 'TGT-001'을 개발하고 있다. CMT는 유전성 말초신경질환으로 근위축, 근력약화, 감각소실, 보행장애 및 무반사 등의 증상을 보인다. 전체 CMT 환자의 약 40%가 PMP22 유전자의 중복에 기인하는 CMT1A형 질환으로 아직 근본적인 치료법이 없다.지난 6월 툴젠이 공개한 연구에 따르면 유전자전달체를 활용해 다양한 CMT1A 동물모델에 적용한 결과, TGT-001은 말초신경에서 유의미한 유전자편집과 PMP22 유전자 발현 감소를 확인했다. 또 행동학적, 전기생리학적 지표를 통해 유효성을 입증했다.툴젠은 CRISPR-Cas9 유전자 가위 원천특허를 보유한 유일한 국내 기업으로 주요 10개 국가에 총 29건의 특허가 등록돼 있다. 툴젠은 CRISPR-Cas9 유전자가위의 Cas9을 단백질 형태로 세포에 도입하는 방법에 대한 유럽 특허 등록에도 성공했다.진코어는 최근 삼양홀딩스와 유전자치료제 공동연구 계약을 체결했다.이번 공동연구 계약은 삼양홀딩스의 유전자 전달 기술 플랫폼 ‘SENS’와 진코어의 유전자 편집 기술 ‘TaRGET’을 결합해 새로운 유전자치료제를 개발하기 위한 목적으로 체결됐다.SENS는 핵산 기반 치료제, 유전자 교정 약물 등을 간·폐·비장 등 다양한 조직의 특정 세포에 선택적으로 전달할 수 있는 약물 전달 플랫폼이다. 삼양홀딩스는 유전자 편집 기술과 유전자 전달체 융합기술의 타당성을 검증한 후에 진코어와 유전자치료제 공동개발을 진행할 계획이다.진코어는 초소형 유전자가위 기술인 TaRGET 플랫폼을 보유하고 있다. TaRGET은 CRISPR-Cas9과 비교해 유전자 편집 효소의 크기가 작아 아데노관련바이러스(AAV)로 전달이 가능해 생체 내(in vivo) 유전자치료제 개발에 유용한 기술이다. 이 회사는 신경세포의 기능 저하와 관련된 원인 유전자를 교정하는 치료제 개발 계획을 갖고 있다.동아에스티는 일레븐 테라퓨틱스와 공동연구 계약을 체결하고 RNA 기반 유전자치료제 개발에 나선다. 동아에스티는 일레븐 테라퓨틱스가 보유한 ‘테라' 플랫폼 기술을 활용해 섬유증 질환을 타깃으로 RNA 치료제 발굴을 위한 공동연구를 진행할 계획이다.테라 플랫폼은 RNA 화학적 변형에 대한 구조-활성 관계(SAR)를 인공지능/머신러닝 기술을 이용해 높은 처리량으로 해독하는 기술로 최적의 xRNA 약물 발굴에 활용되고 있다.동아에스티는 차세대 주력 분야 중 하나로 유전자 치료제를 선정했으며, 기존 강점 분야인 합성신약 분야에서 유전자치료제 분야로 연구개발 역량을 확장하기 위한 시도를 지속하고 있다.이와 관련 동아쏘시오홀딩스 자회사 에스티팜은 유전자 편집 기술에 활용되는 sgRNA(single-guide RNA) 공정 기술을 개발하겠다는 계획이다.유전자치료제 개발을 위해서는 100mer 이상의 고순도 sgRNA의 생산이 필요한데 기존 올리고 원료보다 생산 기술이 어려운 것으로 알려져 있다. 이에 에스티팜은 지난 5월 100mer 이상의 sgRNA 공정을 만든 결과와 주요 지표에 대해 공개하며 본격적으로 RNA 플랫폼을 구축하겠다는 목표다.엑사셀·리프제니아 상용화…유전자 가위 활용한 신약 가능성 확인최근 해외에서 유전자 가위를 활용한 신약이 본격 상용화되면서 관련 기술에 대해 이목이 집중되고 있다.미국 식품의약국(FDA)은 지난해 12월 미국 바이오기업 버텍스 파마슈티컬스와 스위스 크리스퍼 테라퓨틱스가 개발한 유전자 편집 치료제 엑사셀(영국 허가명 가스케비)을 승인했다. 또 같은 날 미국 블루버드바이오의 유전자 편집 치료제인 리프제니아를 허가했다.유전자 편집 기술을 활용한 두 치료제는 이번 허가를 통해 12세 이상 중증 겸상적혈구증후군 환자를 대상으로 미국 내에서 사용할 수 있다.겸상적혈구증후군은 유전병 중 하나로 헤모글로빈 유전자 변이로 인해 적혈구의 모양이 낫이나 초승달 모양으로 변하는 질병이다. 현재는 조혈모세포 이식이 유일한 치료 방법이지만 유전자 편집 기술을 활용한 치료제가 승인된 만큼 환자 치료옵션이 다양해질 것이라는 분석이다.최근에는 체내에 직접 주입하는 생체 내 방식의 유전자치료제도 임상3상에 진입했다.미국 인텔리아와 리제네론은 최근 국내를 비롯해 다국가 임상3상을 승인받고 심근병증을 동반한 트랜스티레틴 아밀로이드증 환자를 대상으로 유전자 가위를 활용한 신약 'NTLA-2001'의 효능과 안전성을 확인한다. NTLA-2001은 지질나노입자(LNP)를 이용해 크리스퍼 가위 기술을 전달하는 기전을 갖고 있다.현재까지 공개된 임상 결과에 따르면, 트랜스티레틴 아밀로이드성 다발신경병증과 아밀로이드증 환자에서 NTLA-2001군은 최대 94%의 비정상적인 트랜스티레틴(TTR) 유전자의 감소 효과를 보였다. 이 같은 효과는 6개월 이상 장기 추적결과에서도 지속됐다.2024-10-28 12:00:43손형민 -
 체내 직접 주입 유전자 가위 치료제, 국내 3상 승인[데일리팜=이혜경 기자] 체내에 직접 주입하는 인비보(in vivo) 방식의 유전자 가위 치료제가 국내에서 임상 3상에 들어간다.식품의약품안전처는 23일 심근병증을 동반한 트랜스티레틴 아밀로이드증(Transthyretin Amyloidosis with Cardiomyopathy, ATTR-CM)을 앓고 있는 참가자를 대상으로 'NTLA-2001'의 유효성과 안전성을 평가하기 위한 3상 임상을 승인했다.미국 인텔리아 테라퓨틱스의 신약후보 물질인 'NTLA-2001'은 유전자 편집을 진행할 'Cas9 mRNA'와 타겟 유전자로 안내할 'guide RNA'를 LNP (Lipid Nano Particle, 지질나노입자)에 담아 정맥 주사를 통해 간 세포 내에 전달함으로써 간 내의 타겟 유전자를 제거하는 작용을 한다.LNP는 기본적으로 혈중 ApoE와 결합해 간 세포 표면의 ApoE 수용체를 통해 주로 간 내에 유입되지만, 지나친 축적으로 인한 독성문제가 존재했다.하지만 NTLA-2001은 지질구조에 에스테르 링크를 연결해 생분해성을 강화, 동물임상에서 기존 LNP 대비 1/4 수준의 반감기를 달성했다.NTLA-2001은 유전성 트랜스티레틴 아밀로이드증(hATTR) 치료제로 글로벌 1상에서 긍정적인 결과를 확보했으며,최초의 Crispr 기반 치료제로 first-in-class 의약품을 목표로 하고 있다.인텔리아는 체네 직접 주입 방식의 'in vivo' 파이프라인 뿐 아니라 체외에서 유전자 조작을 거친 세포를 주입해 면역 항암 및 자가면역 질환을 치료하는 'ex vivo' 파이프라인도 보유하고 있다. ex vivo 파이프라인으로는 현재 1/2상이 진행 중인 경상적혈구질환 치료제 'OTQ923'과 급성골수성백혈병 (AML) 치료제 'NTLA-5001'이 있다.ATTR은 트랜스티레틴 유전자의 돌연변이로 인해 간에서 잘못 잡힌 트랜스티레틴 단백질이 생성돼 각종 신경 손상과 심장근육의 이상을 일으키는 질환이다.전 세계 5만여명의 환자가 존재하는 것으로 알려졌으며, 증상 발현 이후 기대수명이 평균 2~15년으로 완치제에 대한 관심이 있을 수 밖에 없다.한편 미국 리제네론은 지난 2016년 4월 인텔리아와 크리스퍼 유전자 편집 기술을 통한 차세대 유전자 치료제를 공동 개발하기 위한 협력 계약을 체결했다.계약에 따라 인텔리아는 7500만 달러(한화 약 1046억원)의 선지급을 받았으며, 향후 실적에 따른 성과금도 추가 지급 받을 수 있다. 리제네론은 지난 2020년 1억 달러(한화 약 1395억원) 규모의 추가 라이선스 계약을 통해 'NTLA-2001'을 상업화할 수 있는 권리도 확보했다.현재 미FDA 승인을 받은 ATTR 치료제는 화이자의 '빈다켈(타파미디스 메글루민)'과 '빈다맥스(타파미디스)', 앨나일람의 '온파트로(파티시란)'와 '앰부트라(부트리시란)', 아이오니스의 '테그세디(이노테르센) 등이 있다.2024-10-24 10:20:07이혜경
체내 직접 주입 유전자 가위 치료제, 국내 3상 승인[데일리팜=이혜경 기자] 체내에 직접 주입하는 인비보(in vivo) 방식의 유전자 가위 치료제가 국내에서 임상 3상에 들어간다.식품의약품안전처는 23일 심근병증을 동반한 트랜스티레틴 아밀로이드증(Transthyretin Amyloidosis with Cardiomyopathy, ATTR-CM)을 앓고 있는 참가자를 대상으로 'NTLA-2001'의 유효성과 안전성을 평가하기 위한 3상 임상을 승인했다.미국 인텔리아 테라퓨틱스의 신약후보 물질인 'NTLA-2001'은 유전자 편집을 진행할 'Cas9 mRNA'와 타겟 유전자로 안내할 'guide RNA'를 LNP (Lipid Nano Particle, 지질나노입자)에 담아 정맥 주사를 통해 간 세포 내에 전달함으로써 간 내의 타겟 유전자를 제거하는 작용을 한다.LNP는 기본적으로 혈중 ApoE와 결합해 간 세포 표면의 ApoE 수용체를 통해 주로 간 내에 유입되지만, 지나친 축적으로 인한 독성문제가 존재했다.하지만 NTLA-2001은 지질구조에 에스테르 링크를 연결해 생분해성을 강화, 동물임상에서 기존 LNP 대비 1/4 수준의 반감기를 달성했다.NTLA-2001은 유전성 트랜스티레틴 아밀로이드증(hATTR) 치료제로 글로벌 1상에서 긍정적인 결과를 확보했으며,최초의 Crispr 기반 치료제로 first-in-class 의약품을 목표로 하고 있다.인텔리아는 체네 직접 주입 방식의 'in vivo' 파이프라인 뿐 아니라 체외에서 유전자 조작을 거친 세포를 주입해 면역 항암 및 자가면역 질환을 치료하는 'ex vivo' 파이프라인도 보유하고 있다. ex vivo 파이프라인으로는 현재 1/2상이 진행 중인 경상적혈구질환 치료제 'OTQ923'과 급성골수성백혈병 (AML) 치료제 'NTLA-5001'이 있다.ATTR은 트랜스티레틴 유전자의 돌연변이로 인해 간에서 잘못 잡힌 트랜스티레틴 단백질이 생성돼 각종 신경 손상과 심장근육의 이상을 일으키는 질환이다.전 세계 5만여명의 환자가 존재하는 것으로 알려졌으며, 증상 발현 이후 기대수명이 평균 2~15년으로 완치제에 대한 관심이 있을 수 밖에 없다.한편 미국 리제네론은 지난 2016년 4월 인텔리아와 크리스퍼 유전자 편집 기술을 통한 차세대 유전자 치료제를 공동 개발하기 위한 협력 계약을 체결했다.계약에 따라 인텔리아는 7500만 달러(한화 약 1046억원)의 선지급을 받았으며, 향후 실적에 따른 성과금도 추가 지급 받을 수 있다. 리제네론은 지난 2020년 1억 달러(한화 약 1395억원) 규모의 추가 라이선스 계약을 통해 'NTLA-2001'을 상업화할 수 있는 권리도 확보했다.현재 미FDA 승인을 받은 ATTR 치료제는 화이자의 '빈다켈(타파미디스 메글루민)'과 '빈다맥스(타파미디스)', 앨나일람의 '온파트로(파티시란)'와 '앰부트라(부트리시란)', 아이오니스의 '테그세디(이노테르센) 등이 있다.2024-10-24 10:20:07이혜경 -
 오가노이드사이언스-툴젠, 유전자가위 라이선스 계약왼쪽부터 툴젠 김정화 부장, 이병화 대표, 오가노이드사이언스 유종만 대표, 이경진 상무. [데일리팜=노병철 기자] 오가노이드사이언스(대표 유종만)는 지난 16일 툴젠(대표 이병화)과 CRISPR-Cas9 특허 라이선스-인 계약을 체결했다고 17일 밝혔다.CRISPR-Cas9 유전자가위 기술은 생명체의 특정 유전자 서열을 정밀하게 교정 및 개선하는 혁신적인 기술로, 암과 난치성 질환 치료제 개발뿐만 아니라, 전염병 저항성 동물 품종 개발, 농작물 신품종 개발 등에 폭넓게 활용 가능하다.세계적으로 CRISPR-Cas9 기술을 활용한 연구개발이 활발히 진행 중으로, 연구를 위한 CRISPR-Cas9 유전자가위 제품 수요도 지속적인 증가 추세에 있다.툴젠은 국내에서 CRISPR-Cas9 유전자 가위 원천특허를 보유한 유일한 기업으로, 주요 10개 국가에 총 29건이 등록되어 있다. 이를 기반으로 몬산토, 써모피셔 등에 총 20건의 기술이전계약을 체결한 바 있다.이번 툴젠과의 협력으로 오가노이드사이언스는 CRISPR-Cas9기술을 활용해 암, 유전 질환, 면역 질환 등 연구에 적용 가능한 오가노이드 기반 질병 모델을 개발할 예정이다.오가노이드 기술은 CRISPR-Cas9 기술을 접목했을 때, 유전자 교정을 통해 더 정교하고 관련성 높은 질병 모델을 만들 수 있다. 이를 통해 신약 개발과 맞춤형 치료제 연구에 중요한 역할을 할 것으로 기대된다.오가노이드사이언스 이경진 상무는 “유전자가위 기술과 오가노이드의 만남은 유전자 질병 연구의 새 지평을 열 것”이라며, “오가노이드에 CRISPR-Cas9 기술 적용을 통해 글로벌 경쟁력을 확보하고, 시너지 효과로 새로운 산업을 창출하는 리더 기업으로 성장할 것”이라고 전했다.이번 협력을 통해 툴젠과 오가노이드사이언스는 바이오 의학 분야 진일보는 물론, CRISPR-Cas9 기반 연구 수요 증가에 따른 과학과 산업 분야 응용 최전선에서 중요한 돌파구를 마련할 것으로 기대하고 있다.특히, 오가노이드사이언스는 이번 협약으로 글로벌 협력사인 독일 람다 바이오로직스(Lambda Biologics GmbH)를 통해 더욱 활발한 사업 확장을 도모할 예정이다.2024-10-17 09:50:59노병철
오가노이드사이언스-툴젠, 유전자가위 라이선스 계약왼쪽부터 툴젠 김정화 부장, 이병화 대표, 오가노이드사이언스 유종만 대표, 이경진 상무. [데일리팜=노병철 기자] 오가노이드사이언스(대표 유종만)는 지난 16일 툴젠(대표 이병화)과 CRISPR-Cas9 특허 라이선스-인 계약을 체결했다고 17일 밝혔다.CRISPR-Cas9 유전자가위 기술은 생명체의 특정 유전자 서열을 정밀하게 교정 및 개선하는 혁신적인 기술로, 암과 난치성 질환 치료제 개발뿐만 아니라, 전염병 저항성 동물 품종 개발, 농작물 신품종 개발 등에 폭넓게 활용 가능하다.세계적으로 CRISPR-Cas9 기술을 활용한 연구개발이 활발히 진행 중으로, 연구를 위한 CRISPR-Cas9 유전자가위 제품 수요도 지속적인 증가 추세에 있다.툴젠은 국내에서 CRISPR-Cas9 유전자 가위 원천특허를 보유한 유일한 기업으로, 주요 10개 국가에 총 29건이 등록되어 있다. 이를 기반으로 몬산토, 써모피셔 등에 총 20건의 기술이전계약을 체결한 바 있다.이번 툴젠과의 협력으로 오가노이드사이언스는 CRISPR-Cas9기술을 활용해 암, 유전 질환, 면역 질환 등 연구에 적용 가능한 오가노이드 기반 질병 모델을 개발할 예정이다.오가노이드 기술은 CRISPR-Cas9 기술을 접목했을 때, 유전자 교정을 통해 더 정교하고 관련성 높은 질병 모델을 만들 수 있다. 이를 통해 신약 개발과 맞춤형 치료제 연구에 중요한 역할을 할 것으로 기대된다.오가노이드사이언스 이경진 상무는 “유전자가위 기술과 오가노이드의 만남은 유전자 질병 연구의 새 지평을 열 것”이라며, “오가노이드에 CRISPR-Cas9 기술 적용을 통해 글로벌 경쟁력을 확보하고, 시너지 효과로 새로운 산업을 창출하는 리더 기업으로 성장할 것”이라고 전했다.이번 협력을 통해 툴젠과 오가노이드사이언스는 바이오 의학 분야 진일보는 물론, CRISPR-Cas9 기반 연구 수요 증가에 따른 과학과 산업 분야 응용 최전선에서 중요한 돌파구를 마련할 것으로 기대하고 있다.특히, 오가노이드사이언스는 이번 협약으로 글로벌 협력사인 독일 람다 바이오로직스(Lambda Biologics GmbH)를 통해 더욱 활발한 사업 확장을 도모할 예정이다.2024-10-17 09:50:59노병철 -
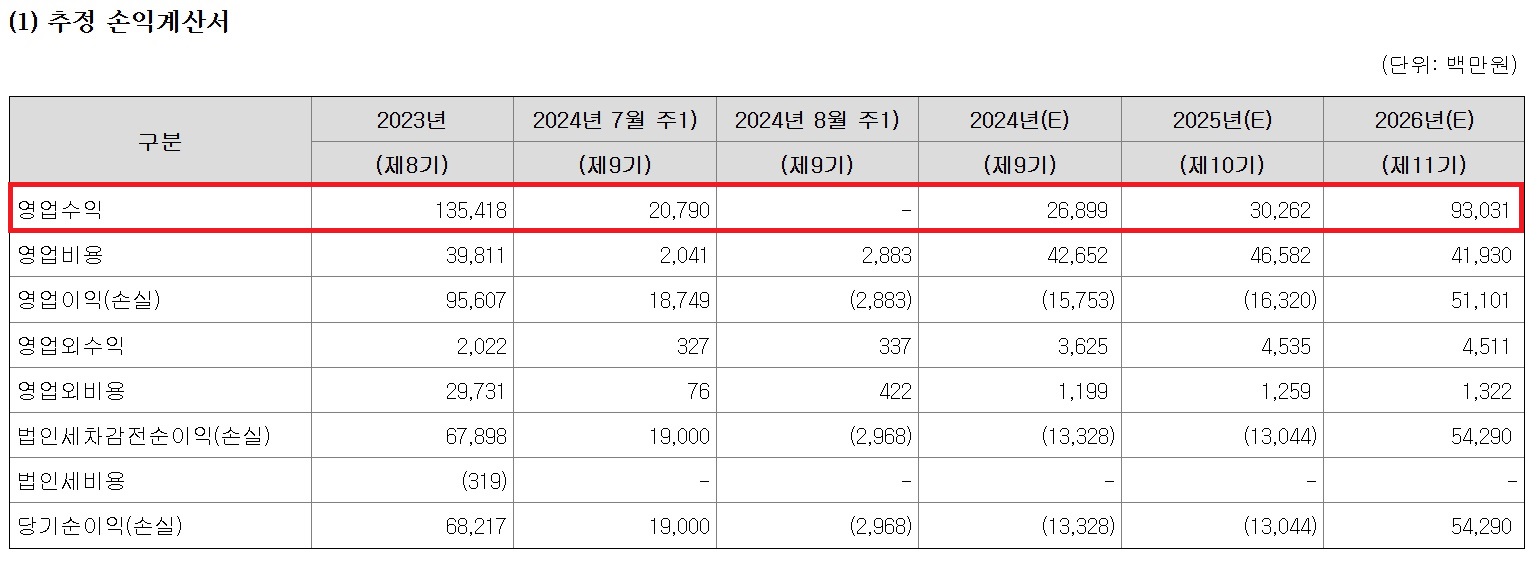 IPO 앞둔 바이오벤처의 흑자 예고…현실은 적자 투성[데일리팜=이석준 기자] IPO(기업공개)를 앞둔 바이오벤처들이 상장 후 빠르게 흑자전환하거나 수백억원 매출 달성을 예고하고 있다. 핵심 물질(파이프라인)의 기술이전, 품목허가 등 성과를 통해서다.다만 앞서 상장한 바이오벤처 대다수가 성과를 내지 못해 여전히 적자인 경우가 많아 선별이 필요하다는 지적이 나온다.오름테라퓨틱은 2026년 매출을 930억원으로 추정했다. 최근 주목받는 바이오벤처는 오름테라퓨틱과 셀비온이다. 양사 모두 상장 후 유의미한 실적을 자신하고 있다. 다만 추정 실적 접근 방식은 기술이전 유무로 차이가 있다는 분석이다.11월 상장 예정인 오름테라퓨틱은 하반기 상장 대어로 꼽힌다. 이유는 몇 안되는 실체 있는 바이오벤처여서다. 오름테라퓨틱은 앞서 두 건의 기술이전 성사 경험이 있다.회사 주요 파이프라인은 이중 정밀 표적단백질분해(TPD²) 플랫폼 기술로 도출한 급성 골수성 백혈병 신약 후보물질 'ORM-6151', HER2 표적 유방암 치료제 후보물질 'ORM-5029', 소세포암 및 신경내분비종양 후보물질 'ORM-1023' 등이다.오름테라퓨틱은 글로벌제약사 BMS에 ORM-6151를 최대 계약규모 1억8000만 달러(약 2428억원)로 기술 수출했다. 세계 최초 '크리스퍼 캐스나인'(CRISPR/Cas9) 유전자 편집 치료제 '카스게비'를 개발한 버텍스에는 TPD² 플랫폼을 기술 이전했다.회사는 상장 2년 뒤인 2026년 매출 930억원을 달성할 것이라고 전망했다. 930억원 중 600억원 이상은 기존 계약(단계별 마일스톤)이 책임지고 나머지는 새로운 계약을 통해 들어올 것이라고 추정했다.업계 관계자는 "오름테라퓨틱이 하반기 상장 대어로 꼽히는 이유는 기술이전 경험이다. 불확실한 기술이전 기대감을 바탕으로 추정 실적을 내는 벤처와는 다르다. 지난해도 매출액 1354억원, 영업이익 956억원, 당기순이익 682억원을 기록했다. 2026년 추정 실적에도 앞선 기술이전 수익이 반영됐다"고 평가했다.셀비온은 주력 물질의 2027년 최대 매출액을 1022억원으로 추산했다. 이와 반대로 10월 상장하는 셀비온은 불확실성이 존재한다는 진단이다.셀비온은 주력 파이프라인 전립선암치료 방사선의약품 'Lu-177-DGUL'의 2027년 최대 매출액을 1022억원으로 추산했다. Lu-177-DGUL의 내년 10월 국내 출시를 기반으로 추정한 수치다. 2023년 전체 매출(15억원)과는 약 68배 차이다.다만 Lu-177-DGUL 추정 실적에 리스크가 존재한다는 의견이 나온다.기본적으로 품목허가 및 보험등재 위험도 도사린다. 셀비온은 2025년 3월까지 Lu-177-DGUL 2상 모든 환자 투약을 완료할 계획이다. 이후 2025년 3분기내 임상시험 보고서를 완료하고 식약처 허가와 보험급여를 연계하는 허가평가연계심사제도를 통해 2025년내 출시를 목표로 하고 있다. 종합하면 모든게 계획대로 이뤄졌을 때 내년 출시가 가능하다는 소리다.출시해도 경쟁약물이 기다리고 있다. 노바티스 '플루빅토'는 이미 허가를 받아 미국과 유럽에서 매출을 올리고 있다. 국내서도 5월 허가를 받았다. 일라이 릴리 또한 유사 적응증을 목표로 임상 3상을 진행 중이다. 국내는 퓨쳐켐이 셀비온과 같은 타겟의 PSMA 약물을 개발중이다. 일라이 릴리의 PSMA-I&T는 미국에서 NDA 심사 중이다.상장 바이오벤처 현실은상장을 앞둔 바이오벤처가 빠른 시일내에 영업이익 흑자 또는 매출 수백억원을 예고하고 있지만 현실은 녹록치 않다. 오름테라퓨틱, 에이비엘바이오, 리가켐바이오 등을 제외하면 돈 버는 바이오벤처는 손에 꼽을 정도이기 때문이다.일례로 티움바이오는 상장 후 5년 연속 순손실을 냈다. 누적 규모는 1000억원을 넘긴다. 티움바이오는 2019년말 코스닥 상장을 앞두고 2022년부터 순이익이 가능할 것으로 전망했다. 2023년에는 541억원 순이익을 점쳤다. 다만 현실은 적자지속이다.영업수익(매출액)도 마찬가지다. 2023년 815억원을 전망했지만 실제는 49억원에 그쳤다. 불확실성이 큰 기술료 수익에 의존하는 매출 구조 한계로 지적된다. 올 반기도 매출 42억원, 영업손실 91억원을 기록중이다.업계 관계자는 "바이오벤처의 경우 상장 직전에는 임상 단계에 따른 기술수출과 마일스톤을 가정한 실적 전망치를 내놓는다. 다만 임상의 경우 변수가 많아 계획대로 진행되는 경우는 많지 않다. 임상 변수를 고려하더라도 상장 전 내놓은 전망치와 실제와의 괴리가 큰 것은 사실이다. 대부분 상장 바이오벤처의 현실"이라고 진단했다.2024-10-11 06:00:01이석준
IPO 앞둔 바이오벤처의 흑자 예고…현실은 적자 투성[데일리팜=이석준 기자] IPO(기업공개)를 앞둔 바이오벤처들이 상장 후 빠르게 흑자전환하거나 수백억원 매출 달성을 예고하고 있다. 핵심 물질(파이프라인)의 기술이전, 품목허가 등 성과를 통해서다.다만 앞서 상장한 바이오벤처 대다수가 성과를 내지 못해 여전히 적자인 경우가 많아 선별이 필요하다는 지적이 나온다.오름테라퓨틱은 2026년 매출을 930억원으로 추정했다. 최근 주목받는 바이오벤처는 오름테라퓨틱과 셀비온이다. 양사 모두 상장 후 유의미한 실적을 자신하고 있다. 다만 추정 실적 접근 방식은 기술이전 유무로 차이가 있다는 분석이다.11월 상장 예정인 오름테라퓨틱은 하반기 상장 대어로 꼽힌다. 이유는 몇 안되는 실체 있는 바이오벤처여서다. 오름테라퓨틱은 앞서 두 건의 기술이전 성사 경험이 있다.회사 주요 파이프라인은 이중 정밀 표적단백질분해(TPD²) 플랫폼 기술로 도출한 급성 골수성 백혈병 신약 후보물질 'ORM-6151', HER2 표적 유방암 치료제 후보물질 'ORM-5029', 소세포암 및 신경내분비종양 후보물질 'ORM-1023' 등이다.오름테라퓨틱은 글로벌제약사 BMS에 ORM-6151를 최대 계약규모 1억8000만 달러(약 2428억원)로 기술 수출했다. 세계 최초 '크리스퍼 캐스나인'(CRISPR/Cas9) 유전자 편집 치료제 '카스게비'를 개발한 버텍스에는 TPD² 플랫폼을 기술 이전했다.회사는 상장 2년 뒤인 2026년 매출 930억원을 달성할 것이라고 전망했다. 930억원 중 600억원 이상은 기존 계약(단계별 마일스톤)이 책임지고 나머지는 새로운 계약을 통해 들어올 것이라고 추정했다.업계 관계자는 "오름테라퓨틱이 하반기 상장 대어로 꼽히는 이유는 기술이전 경험이다. 불확실한 기술이전 기대감을 바탕으로 추정 실적을 내는 벤처와는 다르다. 지난해도 매출액 1354억원, 영업이익 956억원, 당기순이익 682억원을 기록했다. 2026년 추정 실적에도 앞선 기술이전 수익이 반영됐다"고 평가했다.셀비온은 주력 물질의 2027년 최대 매출액을 1022억원으로 추산했다. 이와 반대로 10월 상장하는 셀비온은 불확실성이 존재한다는 진단이다.셀비온은 주력 파이프라인 전립선암치료 방사선의약품 'Lu-177-DGUL'의 2027년 최대 매출액을 1022억원으로 추산했다. Lu-177-DGUL의 내년 10월 국내 출시를 기반으로 추정한 수치다. 2023년 전체 매출(15억원)과는 약 68배 차이다.다만 Lu-177-DGUL 추정 실적에 리스크가 존재한다는 의견이 나온다.기본적으로 품목허가 및 보험등재 위험도 도사린다. 셀비온은 2025년 3월까지 Lu-177-DGUL 2상 모든 환자 투약을 완료할 계획이다. 이후 2025년 3분기내 임상시험 보고서를 완료하고 식약처 허가와 보험급여를 연계하는 허가평가연계심사제도를 통해 2025년내 출시를 목표로 하고 있다. 종합하면 모든게 계획대로 이뤄졌을 때 내년 출시가 가능하다는 소리다.출시해도 경쟁약물이 기다리고 있다. 노바티스 '플루빅토'는 이미 허가를 받아 미국과 유럽에서 매출을 올리고 있다. 국내서도 5월 허가를 받았다. 일라이 릴리 또한 유사 적응증을 목표로 임상 3상을 진행 중이다. 국내는 퓨쳐켐이 셀비온과 같은 타겟의 PSMA 약물을 개발중이다. 일라이 릴리의 PSMA-I&T는 미국에서 NDA 심사 중이다.상장 바이오벤처 현실은상장을 앞둔 바이오벤처가 빠른 시일내에 영업이익 흑자 또는 매출 수백억원을 예고하고 있지만 현실은 녹록치 않다. 오름테라퓨틱, 에이비엘바이오, 리가켐바이오 등을 제외하면 돈 버는 바이오벤처는 손에 꼽을 정도이기 때문이다.일례로 티움바이오는 상장 후 5년 연속 순손실을 냈다. 누적 규모는 1000억원을 넘긴다. 티움바이오는 2019년말 코스닥 상장을 앞두고 2022년부터 순이익이 가능할 것으로 전망했다. 2023년에는 541억원 순이익을 점쳤다. 다만 현실은 적자지속이다.영업수익(매출액)도 마찬가지다. 2023년 815억원을 전망했지만 실제는 49억원에 그쳤다. 불확실성이 큰 기술료 수익에 의존하는 매출 구조 한계로 지적된다. 올 반기도 매출 42억원, 영업손실 91억원을 기록중이다.업계 관계자는 "바이오벤처의 경우 상장 직전에는 임상 단계에 따른 기술수출과 마일스톤을 가정한 실적 전망치를 내놓는다. 다만 임상의 경우 변수가 많아 계획대로 진행되는 경우는 많지 않다. 임상 변수를 고려하더라도 상장 전 내놓은 전망치와 실제와의 괴리가 큰 것은 사실이다. 대부분 상장 바이오벤처의 현실"이라고 진단했다.2024-10-11 06:00:01이석준 -
 R&D·CDMO 경쟁력 과시…K-바이오, 국제무대 성과[데일리팜=손형민 기자] 국내 주요 제약바이오기업들이 글로벌 파트너링 행사인 바이오USA 2024에 참여해 자사 경쟁력을 소개했다. 이달 5일부터 4일간 미국 샌디에이고서 개최된 바이오USA 2024에는 50여 개 국내사들이 참여해 파트너십 확대와 함께 글로벌 기술수출에 대한 논의를 진행했다.삼성바이오로직스는 새로운 플랫폼을 공개하며 생산성이 향상된 고농도 배양방식까지 역량을 확장하겠다는 의지를 표명했다. 롯데바이오로직스와 에스티팜, 프레스티지바이오는 위탁개발생산(CDMO) 역량을 알리는 것과 동시에 계약 수주를 위한 파트너링 미팅을 진행했다.신약개발 부문에서도 성과를 보였다. 박셀바이오는 임상2상을 진행 중인 간세포암 신약후보물질의 긍정적인 결과를 소개했으며 지놈앤컴퍼니는 항체약물접합체(ADC) 기술이전 계약 소식을 알리며 경쟁력을 확인했다.중국 빠진 바이오USA…K-바이오 관심도 집중9일 관련 업계에 따르면 바이오USA에 부스를 마련한 국내 기업은 47개사로 지난해보다 6곳 늘었다. 바이오USA는 전 세계 2만 명 이상의 제약바이오 업계 관계자들이 모이는 세계 최대 제약바이오 분야 행사다.지난해와 마찬가지로 올해도 국내 CDMO 기업들에게 이목이 집중됐다. 특히 올해는 미국의 생물보안법안 발의로 인해 중국 최대 위탁개발생산 CDMO 업체 우시바이오로직스가 참여하지 않았던 만큼 국내 기업들에게 이목이 더욱 집중됐다.미국은 최근 중국 바이오기업들과 거래를 제한하는 생물보안법을 추진하고 있다. 이에 스위스 론자, 일본 후지필름 등 글로벌 CDMO 기업뿐만 아니라 국내 기업들에게도 기회가 더 커질 것이라는 분석이 나오고 있다.바이오 USA 2024 한국관 전경 (사진=한국바이오협회) 삼성바이오로직스는 새로운 위탁개발(CDO) 플랫폼인 에스-텐시파이(S-Tensify)를 출시하며 CDO 경쟁력 강화에 나섰다. 에스-텐시파이는 첨단 배양기술을 적용해 고농도 바이오 의약품 개발을 지원하는 플랫폼이다.에스-텐시파이에 적용된 엔 마이너스 원 퍼퓨전 기술을 통해 최종세포배양 직전 단계의 접종세포농도를 평균 30배까지 높여 최종세포배양단계(N)에 접종 시 생산성을 크게 높일 수 있다는 게 삼성바이오로직스의 설명이다.에스티팜은 유전자 편집 가위 기술에 사용되는 CRISPR/Casx CDMO에 본격 뛰어들었다. 유전자 가위는 DNA 특정 부위를 인식해 절단하는 분자생물학적 도구로 징크, 핑거뉴클라아제, 탈렌, CRISPR 등이 활용된다. CRISPR/Casx는 DNA 서열을 정밀하게 편집해 유전자를 제거하거나 추가 또는 변경할 수 있는 기술이다.유전자 가위를 활용한 신약은 난치성 질환을 알고 있는 환자들에게 새로운 치료옵션이 될 수 있다. 미국 식품의약국(FDA)은 미국 바이오기업 버텍스 파마슈티컬스와 스위스 크리스퍼 테라퓨틱스가 개발한 유전자 편집 치료제 엑사셀(영국 허가명 가스케비)을 지난해 12월 허가한 바 있다.에스티팜은 게놈을 정밀하게 타깃하는 RNA인 sgRNA 공정 개발에 공을 들이고 있다. 에스티팜에 따르면 치료제 개발을 위해서는 100mer 이상의 고순도 sgRNA의 생산이 필요한데 기존의 ASO나 siRNA 올리고 원료보다 생산 기술이 어려운 것으로 알려진다.프레스티지바이오로직스는 이번 행사에서 미국 생물보안법 통과 임박에 따른 새로운 CDMO 사업 기회 요인에 대해 설명했다. 이 회사에 따르면 최근까지 30여 곳의 기업이 미팅을 요청하고 6건의 제안을 받았다.프레스티지바이오로직스는 현재 가격 경쟁력과 싱글유즈 방식의 품질을 모두 기대할 수 있는 회사는 자사라는 점을 강조했다.신약개발 경쟁력도 알린 K-바이오CDMO 수주 외에도 신약개발 부문에서도 국내 제약바이오업계의 역량이 소개됐다.박셀바이오는 이번 바이오 USA 2024에서 간세포암 치료제 ‘Vax-NK/HCC’ 임상2a상 결과를 발표했다. 이번 임상은 박셀바이오는 기존 치료법에 반응이 없는 진행성 간세포암 환자 16명을 대상으로 Vax-NK/HCC+HAIC(간동맥주입화학요법) 병용요법의 유효성을 평가한 결과다.임상 결과, Vax-NK/HCC와+HAIC 병용요법은 객관적반응률(ORR) 68.8%, 무진행 생존기간(PFS) 16.8개월을 기록했다.지놈앤컴퍼니는 ADC 후보물질의 경쟁력을 확인했다. 이 회사는 이달 초 스위스 디바이오팜에 ADC 후보물질 GENA-111의 기술이전 계약을 체결한 바 있다. 계약 규모는 선급금 약 69억원을 포함해 최대 5864억원 규모다.GENA-111은 CD239를 표적으로 하는 신규 기전 ADC 후보물질이다. CD239는 정상세포 대비 암세포에서 높게 발현되는 것으로 알려지는데 현재까지 해당 타깃으로 상용화된 ADC는 없다.지놈앤컴퍼니는 GENA-111의 부인암 등에 타깃을 고려하고 있으며 어떤 페이로드를 썼을 때 가장 효과적인지 파악한 뒤 최종 타깃 적응증을 결정할 것이라는 뜻을 밝혔다.브릿지바이오는 특발성폐섬유증 신약후보물질에 대한 개발 방향성을 소개했다. 현재 임상2상 중인 BBT-877은 신규 표적 단백질인 오토택신을 선택적으로 저해하는 혁신 신약후보물질이다. 오토택신은 세포내 수용체와 결합해 경화증, 종양화 등 병리기전에 관여하는 단백질로 알려진다.브릿지바이오 기업발표 현장(사진=브릿지바이오). 지난달 브릿지바이오는 독립적인 자료 모니터링 위원회(IDMC)에 임상 지속 권고를 받았다. 임상 대상자 75명의 유효성과 안전성 데이터를 검토한 결과, 약물의 안전성이나 효과에 대한 우려사항은 없었다.한국제약바이오협회 역시 한국보건산업진흥원, 한국바이오의약품협회 등 7개 유관단체와 함께 공동홍보관을 운영하며 국내 제약바이오기업들을 지원사격했다.엄승인 협회 전무는 “미국시장은 궁극적으로 진출해야하는 가장 큰 시장”이라며 “우리 기업이 다양한 제품과 기술들로 신속하게 미국 시장에 진입할 수 있도록 글로벌 지원 사업을 강화해 나갈 것”이라고 말했다.또 협회는 한국·미국·일본·인도·EU 등 5개국 민관으로 구성된 바이오제약 연합 출범회의에 참석해 제약바이오분야의 공급망 강화 필요성에 공감하고 적극 협력하기로 했다.한국제약바이오협회는 4~5일 바이오USA 행사장에서 기업 IR 세션을 개최했다(사진=한국제약바이오협회).2024-06-10 06:20:48손형민
R&D·CDMO 경쟁력 과시…K-바이오, 국제무대 성과[데일리팜=손형민 기자] 국내 주요 제약바이오기업들이 글로벌 파트너링 행사인 바이오USA 2024에 참여해 자사 경쟁력을 소개했다. 이달 5일부터 4일간 미국 샌디에이고서 개최된 바이오USA 2024에는 50여 개 국내사들이 참여해 파트너십 확대와 함께 글로벌 기술수출에 대한 논의를 진행했다.삼성바이오로직스는 새로운 플랫폼을 공개하며 생산성이 향상된 고농도 배양방식까지 역량을 확장하겠다는 의지를 표명했다. 롯데바이오로직스와 에스티팜, 프레스티지바이오는 위탁개발생산(CDMO) 역량을 알리는 것과 동시에 계약 수주를 위한 파트너링 미팅을 진행했다.신약개발 부문에서도 성과를 보였다. 박셀바이오는 임상2상을 진행 중인 간세포암 신약후보물질의 긍정적인 결과를 소개했으며 지놈앤컴퍼니는 항체약물접합체(ADC) 기술이전 계약 소식을 알리며 경쟁력을 확인했다.중국 빠진 바이오USA…K-바이오 관심도 집중9일 관련 업계에 따르면 바이오USA에 부스를 마련한 국내 기업은 47개사로 지난해보다 6곳 늘었다. 바이오USA는 전 세계 2만 명 이상의 제약바이오 업계 관계자들이 모이는 세계 최대 제약바이오 분야 행사다.지난해와 마찬가지로 올해도 국내 CDMO 기업들에게 이목이 집중됐다. 특히 올해는 미국의 생물보안법안 발의로 인해 중국 최대 위탁개발생산 CDMO 업체 우시바이오로직스가 참여하지 않았던 만큼 국내 기업들에게 이목이 더욱 집중됐다.미국은 최근 중국 바이오기업들과 거래를 제한하는 생물보안법을 추진하고 있다. 이에 스위스 론자, 일본 후지필름 등 글로벌 CDMO 기업뿐만 아니라 국내 기업들에게도 기회가 더 커질 것이라는 분석이 나오고 있다.바이오 USA 2024 한국관 전경 (사진=한국바이오협회) 삼성바이오로직스는 새로운 위탁개발(CDO) 플랫폼인 에스-텐시파이(S-Tensify)를 출시하며 CDO 경쟁력 강화에 나섰다. 에스-텐시파이는 첨단 배양기술을 적용해 고농도 바이오 의약품 개발을 지원하는 플랫폼이다.에스-텐시파이에 적용된 엔 마이너스 원 퍼퓨전 기술을 통해 최종세포배양 직전 단계의 접종세포농도를 평균 30배까지 높여 최종세포배양단계(N)에 접종 시 생산성을 크게 높일 수 있다는 게 삼성바이오로직스의 설명이다.에스티팜은 유전자 편집 가위 기술에 사용되는 CRISPR/Casx CDMO에 본격 뛰어들었다. 유전자 가위는 DNA 특정 부위를 인식해 절단하는 분자생물학적 도구로 징크, 핑거뉴클라아제, 탈렌, CRISPR 등이 활용된다. CRISPR/Casx는 DNA 서열을 정밀하게 편집해 유전자를 제거하거나 추가 또는 변경할 수 있는 기술이다.유전자 가위를 활용한 신약은 난치성 질환을 알고 있는 환자들에게 새로운 치료옵션이 될 수 있다. 미국 식품의약국(FDA)은 미국 바이오기업 버텍스 파마슈티컬스와 스위스 크리스퍼 테라퓨틱스가 개발한 유전자 편집 치료제 엑사셀(영국 허가명 가스케비)을 지난해 12월 허가한 바 있다.에스티팜은 게놈을 정밀하게 타깃하는 RNA인 sgRNA 공정 개발에 공을 들이고 있다. 에스티팜에 따르면 치료제 개발을 위해서는 100mer 이상의 고순도 sgRNA의 생산이 필요한데 기존의 ASO나 siRNA 올리고 원료보다 생산 기술이 어려운 것으로 알려진다.프레스티지바이오로직스는 이번 행사에서 미국 생물보안법 통과 임박에 따른 새로운 CDMO 사업 기회 요인에 대해 설명했다. 이 회사에 따르면 최근까지 30여 곳의 기업이 미팅을 요청하고 6건의 제안을 받았다.프레스티지바이오로직스는 현재 가격 경쟁력과 싱글유즈 방식의 품질을 모두 기대할 수 있는 회사는 자사라는 점을 강조했다.신약개발 경쟁력도 알린 K-바이오CDMO 수주 외에도 신약개발 부문에서도 국내 제약바이오업계의 역량이 소개됐다.박셀바이오는 이번 바이오 USA 2024에서 간세포암 치료제 ‘Vax-NK/HCC’ 임상2a상 결과를 발표했다. 이번 임상은 박셀바이오는 기존 치료법에 반응이 없는 진행성 간세포암 환자 16명을 대상으로 Vax-NK/HCC+HAIC(간동맥주입화학요법) 병용요법의 유효성을 평가한 결과다.임상 결과, Vax-NK/HCC와+HAIC 병용요법은 객관적반응률(ORR) 68.8%, 무진행 생존기간(PFS) 16.8개월을 기록했다.지놈앤컴퍼니는 ADC 후보물질의 경쟁력을 확인했다. 이 회사는 이달 초 스위스 디바이오팜에 ADC 후보물질 GENA-111의 기술이전 계약을 체결한 바 있다. 계약 규모는 선급금 약 69억원을 포함해 최대 5864억원 규모다.GENA-111은 CD239를 표적으로 하는 신규 기전 ADC 후보물질이다. CD239는 정상세포 대비 암세포에서 높게 발현되는 것으로 알려지는데 현재까지 해당 타깃으로 상용화된 ADC는 없다.지놈앤컴퍼니는 GENA-111의 부인암 등에 타깃을 고려하고 있으며 어떤 페이로드를 썼을 때 가장 효과적인지 파악한 뒤 최종 타깃 적응증을 결정할 것이라는 뜻을 밝혔다.브릿지바이오는 특발성폐섬유증 신약후보물질에 대한 개발 방향성을 소개했다. 현재 임상2상 중인 BBT-877은 신규 표적 단백질인 오토택신을 선택적으로 저해하는 혁신 신약후보물질이다. 오토택신은 세포내 수용체와 결합해 경화증, 종양화 등 병리기전에 관여하는 단백질로 알려진다.브릿지바이오 기업발표 현장(사진=브릿지바이오). 지난달 브릿지바이오는 독립적인 자료 모니터링 위원회(IDMC)에 임상 지속 권고를 받았다. 임상 대상자 75명의 유효성과 안전성 데이터를 검토한 결과, 약물의 안전성이나 효과에 대한 우려사항은 없었다.한국제약바이오협회 역시 한국보건산업진흥원, 한국바이오의약품협회 등 7개 유관단체와 함께 공동홍보관을 운영하며 국내 제약바이오기업들을 지원사격했다.엄승인 협회 전무는 “미국시장은 궁극적으로 진출해야하는 가장 큰 시장”이라며 “우리 기업이 다양한 제품과 기술들로 신속하게 미국 시장에 진입할 수 있도록 글로벌 지원 사업을 강화해 나갈 것”이라고 말했다.또 협회는 한국·미국·일본·인도·EU 등 5개국 민관으로 구성된 바이오제약 연합 출범회의에 참석해 제약바이오분야의 공급망 강화 필요성에 공감하고 적극 협력하기로 했다.한국제약바이오협회는 4~5일 바이오USA 행사장에서 기업 IR 세션을 개최했다(사진=한국제약바이오협회).2024-06-10 06:20:48손형민 -
 CAR-T치료제 신장암 가능성 확인…후발주자도 잰걸음[데일리팜=손형민 기자] 신규 기전을 앞세운 CAR-T 치료제가 고형암에서 성과가 나타나고 있다. 그간 CAR-T는 혈액암 분야에서 큰 성공을 거뒀지만 고형암에서는 이렇다 할 성과를 보이지는 못했다. 이에 개발사들은 유전자가위, 신규 단백질을 타깃하는 차별화된 상용화 전략을 구사하고 있다.9일 관련 업계에 따르면 스위스 크리스퍼 테라퓨틱스가 개발 중인 CTX130이 진행성 신세포암 환자를 대상으로 진행한 임상 1상에서 반응률을 확인했다. 이 치료제는 신장암에서 과발현되는 CD70을 타깃하는 키메릭항원수용체 T세포(CAR-T) 치료제다.CAR-T 치료제는 환자의 T세포에 CAR을 발현시키는 유전정보를 조합해 만든 면역세포치료 항암제다. 이처럼 CAR-T는 T세포 수용체를 변형시키기 때문에 암 조직내의 섬유아세포 등 종양미세환경이 T세포의 접근을 방해하고 표적항원의 발견이 어려워 고형암 적응증을 확보하지 못했다.크리스퍼는 3세대 유전자 가위인 CRISPR/Cas-9 기술을 보유하고 있다. 이에 크리스퍼는 유전자 가위 기술을 통해 CTX130에 동종 세포를 투여하는데 성공했다.COBALT-RCC 명명된 임상1상 연구는 최소 한 가지 이상의 체크포인트 또는 티로신 키나아제 억제제를 신세포암 환자 16명을 대상으로 진행됐다. 환자 평균 연령 중앙값은 63세로 남성 비율은 87.5%에 달했다.임상은 환자들에게 CTX130의 다양한 용량을 투여하고 반응을 관찰하는 방식으로 진행됐다.임상 결과, 신세포암 환자 16명 중 75%에서 안정병변(SD)를 보였다. 환자 1명에게서는 완전반응(CR)이 확인됐다. 환자 81%는 질병 조절에 성공했다.안전성 측면에서 이상반응은 세포 관련 신경독성 증후군(ICANS)의 사례가 관찰되지 않았고 2등급 이상의 사이토카인 방출 증후군에 대한 보고는 없었다.크리스퍼는 CTX130뿐만 아니라 T 세포의 내구성을 향상시키기 위해 편집된 차세대 CAR-T 치료제인 CTX131의 임상1/2상도 진행 중이다.아스텔라스, 고형암 CAR-T 개발 참전…국내기업도 임상 진행후발주자들 역시 고형암 CAR-T 개발에 적극 뛰어들고 있다.아스텔라스는 최근 회사인 자이포스를 통해 포세이다와 CAR-T 세포 치료제 후보물질을 개발 협력 계약을 체결했다. 자이포스는 항원 표적 플랫폼 MicAbody를 보유하고 있다.이를 통해 자이포스는 포세이다의 동종유래 CAR-T 플랫폼과 결합해 고형암 적응증을 타깃하겠다는 계획이다.HK이노엔은 자체적으로 T세포에 면역관문인자 ‘HLA-G’의 활동을 억제하는 항체를 발현시킨 CAR-T 치료제를 개발하는 중이다. HLA-G는 우리 몸에서 면역반응에 관여하는 면역관문 인자다. HLA-G는 특정 암세포에 과다하게 발현돼 면역체계를 망가뜨린다. HK이노엔의 CAR-T 치료제는 국가신약개발 지원 과제 선정됐으며 본 임상 진입을 목표하고 있다.박셀바이오는 ‘VaxCAR2301’을 개발 중이다. VaxCAR2301은 PD-L1과 EphA2를 동시에 타깃하는 새로운 CAR-T 치료제 후보물질이다.전임상에서 VaxCAR2301는 CD8 양성 전문살상 세포에서 CAR 발현율이 78%에 달했다. 이는 아벨루맙 CAR-T 58%, 아테졸리주맙 CAR-T 45%보다 유의미하게 높은 것으로 확인됐다. 또 VaxCAR2301 투여 시 종양 크기가 통제됐고, 실험 관찰 종료 시까지 빠른 체중 회복과 연장된 생존 기간을 보였다.이외에도 GC셀, 앱클론, 큐로셀 등 다양한 기업들이 고형암 CAR-T 개발 가능성을 확인 중이다.2024-05-09 12:00:00손형민
CAR-T치료제 신장암 가능성 확인…후발주자도 잰걸음[데일리팜=손형민 기자] 신규 기전을 앞세운 CAR-T 치료제가 고형암에서 성과가 나타나고 있다. 그간 CAR-T는 혈액암 분야에서 큰 성공을 거뒀지만 고형암에서는 이렇다 할 성과를 보이지는 못했다. 이에 개발사들은 유전자가위, 신규 단백질을 타깃하는 차별화된 상용화 전략을 구사하고 있다.9일 관련 업계에 따르면 스위스 크리스퍼 테라퓨틱스가 개발 중인 CTX130이 진행성 신세포암 환자를 대상으로 진행한 임상 1상에서 반응률을 확인했다. 이 치료제는 신장암에서 과발현되는 CD70을 타깃하는 키메릭항원수용체 T세포(CAR-T) 치료제다.CAR-T 치료제는 환자의 T세포에 CAR을 발현시키는 유전정보를 조합해 만든 면역세포치료 항암제다. 이처럼 CAR-T는 T세포 수용체를 변형시키기 때문에 암 조직내의 섬유아세포 등 종양미세환경이 T세포의 접근을 방해하고 표적항원의 발견이 어려워 고형암 적응증을 확보하지 못했다.크리스퍼는 3세대 유전자 가위인 CRISPR/Cas-9 기술을 보유하고 있다. 이에 크리스퍼는 유전자 가위 기술을 통해 CTX130에 동종 세포를 투여하는데 성공했다.COBALT-RCC 명명된 임상1상 연구는 최소 한 가지 이상의 체크포인트 또는 티로신 키나아제 억제제를 신세포암 환자 16명을 대상으로 진행됐다. 환자 평균 연령 중앙값은 63세로 남성 비율은 87.5%에 달했다.임상은 환자들에게 CTX130의 다양한 용량을 투여하고 반응을 관찰하는 방식으로 진행됐다.임상 결과, 신세포암 환자 16명 중 75%에서 안정병변(SD)를 보였다. 환자 1명에게서는 완전반응(CR)이 확인됐다. 환자 81%는 질병 조절에 성공했다.안전성 측면에서 이상반응은 세포 관련 신경독성 증후군(ICANS)의 사례가 관찰되지 않았고 2등급 이상의 사이토카인 방출 증후군에 대한 보고는 없었다.크리스퍼는 CTX130뿐만 아니라 T 세포의 내구성을 향상시키기 위해 편집된 차세대 CAR-T 치료제인 CTX131의 임상1/2상도 진행 중이다.아스텔라스, 고형암 CAR-T 개발 참전…국내기업도 임상 진행후발주자들 역시 고형암 CAR-T 개발에 적극 뛰어들고 있다.아스텔라스는 최근 회사인 자이포스를 통해 포세이다와 CAR-T 세포 치료제 후보물질을 개발 협력 계약을 체결했다. 자이포스는 항원 표적 플랫폼 MicAbody를 보유하고 있다.이를 통해 자이포스는 포세이다의 동종유래 CAR-T 플랫폼과 결합해 고형암 적응증을 타깃하겠다는 계획이다.HK이노엔은 자체적으로 T세포에 면역관문인자 ‘HLA-G’의 활동을 억제하는 항체를 발현시킨 CAR-T 치료제를 개발하는 중이다. HLA-G는 우리 몸에서 면역반응에 관여하는 면역관문 인자다. HLA-G는 특정 암세포에 과다하게 발현돼 면역체계를 망가뜨린다. HK이노엔의 CAR-T 치료제는 국가신약개발 지원 과제 선정됐으며 본 임상 진입을 목표하고 있다.박셀바이오는 ‘VaxCAR2301’을 개발 중이다. VaxCAR2301은 PD-L1과 EphA2를 동시에 타깃하는 새로운 CAR-T 치료제 후보물질이다.전임상에서 VaxCAR2301는 CD8 양성 전문살상 세포에서 CAR 발현율이 78%에 달했다. 이는 아벨루맙 CAR-T 58%, 아테졸리주맙 CAR-T 45%보다 유의미하게 높은 것으로 확인됐다. 또 VaxCAR2301 투여 시 종양 크기가 통제됐고, 실험 관찰 종료 시까지 빠른 체중 회복과 연장된 생존 기간을 보였다.이외에도 GC셀, 앱클론, 큐로셀 등 다양한 기업들이 고형암 CAR-T 개발 가능성을 확인 중이다.2024-05-09 12:00:00손형민
오늘의 TOP 10
- 1끝나지 않은 퇴출 위기...'국민 위염약'의 험난한 생존기
- 2신풍제약, 비용개선 가속화...의원급 CSO 준비
- 3제약업계 "약가제도 개편 시행 유예..전면 재검토해야"
- 4직듀오·엘리델 등 대형 품목 판매처 변동에 반품·정산 우려
- 5고덱스 판박이 애엽, 재논의 결정에 약가인하도 보류
- 6내년부터 동네의원 주도 '한국형 주치의' 시범사업 개시
- 7"일본·한국 약사면허 동시에"...조기입시에 일본약대 관심↑
- 8대용량 수액제 한해 무균시험 대신 다른 품질기준 적용
- 9"약가제도 개편, 산업계 체질 바꿀 유예기간 필요"
- 10새로운 심근병증 치료제 가세…캄지오스와 경쟁 본격화
-
순위상품명횟수
-
1타이레놀정500mg(10정)30,426
-
2판콜에스내복액16,732
-
3텐텐츄정(10정)13,671
-
4까스활명수큐액12,867
-
5판피린큐액12,851













![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[위고비] 직거래 최저가](https://cdn.platpharm.co.kr/2025/12/2512020211090000013.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
