총 49건
-
 HLB제약, R&D 투자 성과 본격화…5개 품목 생동성 성공HLB제약이 연구개발(R&D) 투자가 실질적인 성과로 구체화되고 있다. 의약품 개발 역량이 고도화되고 있다는 평가다. 회사는 올해 경구용 항응고제 ‘에독사반(Edoxaban)’의 퍼스트 제네릭(최초 복제약)을 포함해 총 5개 제네릭 의약품에 대해 생물학적 동등성(이하 생동성) 판정을 획득했다.대상 약물은 이상지질혈증 치료제 '피타바스타틴(Pitavastatin)+에제티미브(Ezetimibe) 복합제', 비스테로이드성 항염증제 '펠루비프로펜(Pelubiprofen)', 알레르기성 비염 치료제 '프란루카스트(Pranlukast)', 천식·알레르기비염 치료제 '몬테루카스트(Montelukast)' 등이다.해당 5개 약물 성분의 합산 시장은 5000억원 규모다. 생동성 입증을 기반으로 시장 진입 및 점유율 확대에 나설 방침이다.HLB제약은 수탁 생산을 통해 축적한 생산 기술과 품질 관리 역량을 기반으로 의약품 개발 분야로 사업을 확장하며 제네릭 개발 경쟁력을 지속적으로 고도화하고 있다.현재 전립선암 치료제 ‘엔잘루타마이드(Enzalutamide)’ 제네릭의 품목 허가를 추진 중으로, 이를 기점으로 항암제 제네릭 라인업을 확장하고 종합병원 대상 시장 공략을 본격화할 계획이다.HLB제약은 한 단계 더 나아가 제네릭 개발을 통해 축적한 연구개발 역량을 기반으로 자체 개량신약 개발로 영역을 확대하고, 제품 경쟁력 강화를 본격화할 방침이다.또한 자체 제네릭과 개량신약 생산을 위한 향남 GMP 공장 건립을 추진 중이며, 2026년 착공을 목표로 하고 있다. 이를 통해 원가 경쟁력과 품질 통제력을 동시에 확보함으로써 수익성과 시장 신뢰도가 한층 제고될 것으로 기대된다.박재형 HLB제약 대표이사는 "그동안 추진해온 의약품 개발 투자가 실질적인 성과로 가시화되고 있다. 제네릭 개발 경쟁력을 고도화하고, 항암제 제네릭과 개량신약으로 이어지는 단계적 성장을 통해 제품 경쟁력을 지속적으로 강화해 나가겠다"고 말했다.2025-11-28 14:28:04이석준 기자
HLB제약, R&D 투자 성과 본격화…5개 품목 생동성 성공HLB제약이 연구개발(R&D) 투자가 실질적인 성과로 구체화되고 있다. 의약품 개발 역량이 고도화되고 있다는 평가다. 회사는 올해 경구용 항응고제 ‘에독사반(Edoxaban)’의 퍼스트 제네릭(최초 복제약)을 포함해 총 5개 제네릭 의약품에 대해 생물학적 동등성(이하 생동성) 판정을 획득했다.대상 약물은 이상지질혈증 치료제 '피타바스타틴(Pitavastatin)+에제티미브(Ezetimibe) 복합제', 비스테로이드성 항염증제 '펠루비프로펜(Pelubiprofen)', 알레르기성 비염 치료제 '프란루카스트(Pranlukast)', 천식·알레르기비염 치료제 '몬테루카스트(Montelukast)' 등이다.해당 5개 약물 성분의 합산 시장은 5000억원 규모다. 생동성 입증을 기반으로 시장 진입 및 점유율 확대에 나설 방침이다.HLB제약은 수탁 생산을 통해 축적한 생산 기술과 품질 관리 역량을 기반으로 의약품 개발 분야로 사업을 확장하며 제네릭 개발 경쟁력을 지속적으로 고도화하고 있다.현재 전립선암 치료제 ‘엔잘루타마이드(Enzalutamide)’ 제네릭의 품목 허가를 추진 중으로, 이를 기점으로 항암제 제네릭 라인업을 확장하고 종합병원 대상 시장 공략을 본격화할 계획이다.HLB제약은 한 단계 더 나아가 제네릭 개발을 통해 축적한 연구개발 역량을 기반으로 자체 개량신약 개발로 영역을 확대하고, 제품 경쟁력 강화를 본격화할 방침이다.또한 자체 제네릭과 개량신약 생산을 위한 향남 GMP 공장 건립을 추진 중이며, 2026년 착공을 목표로 하고 있다. 이를 통해 원가 경쟁력과 품질 통제력을 동시에 확보함으로써 수익성과 시장 신뢰도가 한층 제고될 것으로 기대된다.박재형 HLB제약 대표이사는 "그동안 추진해온 의약품 개발 투자가 실질적인 성과로 가시화되고 있다. 제네릭 개발 경쟁력을 고도화하고, 항암제 제네릭과 개량신약으로 이어지는 단계적 성장을 통해 제품 경쟁력을 지속적으로 강화해 나가겠다"고 말했다.2025-11-28 14:28:04이석준 기자 -
 세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'큐피틀리아(Qfitlia, 성분명 피투시란, Fitusiran, 사노피)는 GalXC 기술 플랫폼을 기반으로 개발된 항트롬빈(antithrombin)을 표적으로 하는 소간섭 리보핵산(small interfering RNA, siRNA) 치료제다.이 약제는 2024년 유럽의약청(EMA) 에서, 이어 올해 3월 미국 식품의약국(FDA) 에서 제VIII인자 또는 제IX인자 억제인자(inhibitor)의 유무와 관계없이, 12세 이상 성인 및 소아 혈우병 A 또는 B 환자에서 출혈 에피소드의 발생을 예방하거나 빈도를 감소시키기 위한 정기적 예방요법(routine prophylaxis)에 ‘두 달에 한번 피하주사’로 승인되었다. 국내에서는 올해 5월 희귀의약품(Orphan drug) 으로 지정되었다.혈우병(hemophilia)은 X염색체 연관 열성 유전질환으로, 제Ⅷ인자(FVIII) 또는 제Ⅸ인자(FIX) 의 결핍으로 인해 혈액응고 연쇄반응(coagulation cascade) 이 정상적으로 진행되지 못하며, 그 결과 트롬빈(thrombin) 생성 부족으로 지혈(hemostasis) 이 저하된다. 이러한 병태생리적 이상은 반복적인 출혈, 특히 관절 출혈을 초래하여 만성 관절병증(chronic arthropathy) 및 삶의 질 저하로 이어진다.기존의 표준 치료는 응고인자제제(clotting factor concentrate, CFC) 의 정맥 내 투여를 통한 인자 보충요법(replacement therapy) 이었다. 그러나 이 방식은 정맥 투여의 불편성, 반복적 투여 부담, 그리고 항체(억제인자, inhibitor) 형성으로 인한 치료 저항성이라는 한계를 지닌다.이에 따라 최근에는 비(非)응고인자 기반 치료(non-factor therapy) 의 개발이 활발히 이루어지고 있으며, 그중에서도 RNA 간섭(RNA interference, RNAi) 기술을 이용한 피투시란(Fitusiran) 은 새로운 치료 옵션으로 주목 받고 있다.피투시란은 간세포 내에서 항트롬빈(antithrombin, AT) 합성을 억제하도록 설계된 siRNA 기반 치료제로, 내인성 응고 조절 인자의 발현을 조절함으로써 응고 균형(hemostatic balance) 을 회복시키는 새로운 접근법을 제시한다.피투시란의 승인은 다국가, 무작위배정, 대조, 3상 임상시험들로 구성된 ATLAS 임상 프로그램의 결과를 근거로 하였다.이 프로그램에는 ATLAS-A/B, ATLAS-INH, 그리고 ATLAS-PPX 연구가 포함되며, 각각 혈우병 A 또는 B 환자 중 인자 억제인자의 유무, 그리고 기존 예방요법(prophylaxis) 사용 여부에 따라 구분되었다.ATLAS-A/B 연구는 억제인자가 없는(non-inhibitor) 혈우병 A 또는 B 환자를 대상으로, ATLAS-INH 연구는 억제인자가 존재하는(inhibitor-positive) 환자를 대상으로 수행되었다. ATLAS-PPX 연구는 기존 예방요법을 받고 있던 환자에서 피투시란으로 전환했을 때의 출혈률 변화를 평가하였다.이들 연구에서 피투시란은 월 1회 피하주사(subcutaneous injection) 투여만으로도 연간 출혈률(annualized bleeding rate, ABR)을 기존 치료 대비 약 90% 이상 유의하게 감소시켰으며, 절반 이상의 환자에서 무출혈(ABR = 0)이 관찰되었다. 또한 억제인자 유무와 관계없이 일관된 출혈 억제 효과가 확인되었다.혈우병이란 무엇인가?혈우병(hemophilia)은 그리스어 ‘hemo(피)’와 ‘philia(사랑하다)’에서 유래한 용어로, 1828년 Sch& 246;nlein에 의해 H& 228;mophilie라 명명됐다. 19세기 말 유럽 왕실 내 근친혼으로 인해 영국, 스페인, 독일, 러시아 등 여러 나라에서 다수의 환자가 발생하면서 ‘왕실병(The Royal Disease)’이라는 별칭을 얻었다.혈우병은 혈액응고인자의 결핍으로 인해 발생하는 대표적인 선천성 출혈성 질환이다. 제VIII응고인자(FVIII)의 결핍은 혈우병 A로, 전체 환자의 약 80~85%를 차지하며 ‘고전적 혈우병(classic hemophilia)’이라 불린다. 제IX응고인자(FIX)의 결핍은 혈우병 B로 약 15%를 차지하며, 최초 환자의 이름을 따 ‘크리스마스병(Christmas disease)’으로도 알려져 있다. 제XI응고인자(FXI)의 결핍은 혈우병 C로 상대적으로 드물게 발생한다.혈우병 A와 B는 X 염색체 열성 유전 양식을 가지므로 주로 남성에서 발병하며, 여성은 보인자로 존재하거나 드물게 태아기에 사망하기도 한다. 반면 혈우병 C는 4번 염색체 이상에 기인하므로 성별에 관계없이 발생할 수 있으며, 일부 환자에서는 가족력 없이 자연 발생적 유전자 변이에 의해 발현되기도 한다.혈우병과 유사한 질환으로는 폰빌레브란트병(von Willebrand disease, vWD)이 있다. 이는 응고인자 VIII과 결합하는 폰빌레브란트인자(vWF)의 결핍으로 인해 혈우병과 유사한 임상 양상을 보인다.이외에도 프로트롬빈(II), 피브리노겐(I), V, VII, X, XII, XIII 응고인자의 결핍으로 인한 선천성 응고장애가 보고되어 있으나, 이러한 질환들은 혈우병의 범주에는 포함되지 않는다.혈액응고 과정은 어떻게 일어나는가?혈액응고는 인체의 항상성을 유지하기 위한 필수적인 생리적 방어기전으로, 외상이나 혈관 손상 시 과도한 출혈을 방지하는 역할을 한다. 이 과정은 혈관수축, 혈소판 기능, 그리고 혈액응고인자의 연속적인 활성화로 이루어지는 응고 연쇄(cascade)로 설명되며, 궁극적으로 안정적인 피브린 혈전(fibrin clot)을 형성한다.혈액응고인자(Coagulation factors)는 주로 간에서 합성되는 단백질로, 로마 숫자로 표기된 I번부터 XIII번까지의 인자가 알려져 있다. 이들은 각각 특정 효소 활성 또는 보조인자로 작용하면서 정교하고 단계적인 반응을 매개한다. 주요 응고인자로는 피브리노겐(Factor I), 프로트롬빈(Factor II), 그리고 프로트롬빈 복합체를 구성하는 V, VII, IX, X, XI, XII 인자, 마지막으로 XIII 인자 등이 있다. 응고 연쇄는 크게 내인성 경로(intrinsic pathway), 외인성 경로(extrinsic pathway), 그리고 두 경로가 합류하는 공통 경로(common pathway)로 구성된다.내인성 경로는 Factor XII의 활성화를 시작으로 XI, IX, VIII 인자가 순차적으로 활성화되며, 외인성 경로는 조직인자(tissue factor, TF)와 Factor VII의 상호작용을 통해 개시된다.두 경로는 Factor X의 활성화 단계에서 공통 경로로 수렴하며, 활성화된 Factor X는 Factor V와 결합하여 프로트롬비나제(prothrombinase) 복합체를 형성한다. 이 복합체는 프로트롬빈(Factor II)을 트롬빈(thrombin)으로 전환시키고, 생성된 트롬빈은 피브리노겐(Factor I)을 불용성 피브린(fibrin)으로 전환시켜 최종적으로 혈전을 완성한다.또한 트롬빈은 Factor V, VIII, XI 등을 다시 활성화시키는 양성 되먹임(positive feedback) 작용을 통해 응고 반응을 증폭시키며, Factor XIII을 활성화시켜 피브린 가교결합(fibrin cross-linking)을 형성함으로써 혈전의 안정성을 더욱 높인다.이러한 정교한 연쇄 반응은 항응고 단백질(antithrombin, protein C/S system 등)과 섬유소 용해(fibrinolysis) 기전 간의 정밀한 균형 속에서 조절된다. 이 균형이 깨질 경우 출혈성 질환이나 혈전성 질환으로 이어질 수 있다.항트롬빈(Antithrombin, AT, heparin cofactor I)은 어떤 물질인가?항트롬빈(AT)은 혈액응고 조절에서 가장 중요한 내인성 항응고인자로, 전체 생리적 응고 억제 작용의 약 70~80%를 담당하는 핵심 단백질이다. AT는 혈장에 존재하는 세린 단백질분해효소 억제제(serpin) 계열의 당단백질로, 주된 표적은 트롬빈(thrombin)이지만, Factor Xa, IXa, XIa, XIIa 및 칼리크레인(kallikrein) 등 다양한 혈액응고인자를 동시에 억제함으로써 응고 연쇄(cascade) 전반의 균형 유지에 기여한다.The Coagulation Cascade(출처: Ann Pharmacother . 2016 Sep;50(9):758-67). AT는 트롬빈의 활성 중심부에 위치한 세린(serine) 잔기와 1:1 비율로 결합하여 불활성 복합체를 형성함으로써 트롬빈 활성을 차단한다. 이를 통해 소규모 응고 반응이나 불필요한 혈전 형성을 신속히 억제하며, 정상적인 생리 상태에서 과도한 혈액응고를 방지하는 핵심 역할을 수행한다.그러나 대규모 혈관 손상이나 파종성 혈관내응고(Disseminated intravascular coagulation, DIC)와 같이 트롬빈 생성이 폭발적으로 증가하는 상황에서는 AT의 억제 능력이 상대적으로 부족해져, 생리적 항응고 메커니즘만으로는 병적 혈전 형성을 완전히 제어하기 어렵다.AT의 항응고 활성이 가장 강력하게 발휘되는 조건은 헤파린(heparin)의 존재 하에서이다. 헤파린은 AT에 결합하여 구조적 변화를 유도하고, AT와 트롬빈 및 Factor Xa 간의 결합 친화도를 수백 배 이상 증폭시킨다.이로 인해 헤파린은 AT의 촉매제(cofactor) 역할을 하며, 임상적으로 항응고 효과를 발휘하는 주요 기전이 바로 AT 매개 억제 반응이다. 이러한 이유로 AT 결핍 환자에서는 헤파린의 항응고 효과가 현저히 감소하며, 이는 선천성 또는 후천성 AT 결핍에서 혈전성 질환 발생 위험이 증가하는 중요한 근거가 된다.AT는 간에서 합성되며 혈중 농도는 약 0.15mg/mL로 유지되고, 정상 활성도는 80~120% 범위 내에 있다. 선천성 AT 결핍은 드문 질환이지만 정맥혈전증과 폐색전증 발생의 중요한 위험 요인으로 알려져 있으며, 후천성 결핍은 간질환, 신증후군, DIC, 항응고제 치료 등 다양한 상황에서 관찰된다. AT 농도의 감소는 항응고 균형을 무너뜨려 과도한 혈전 형성을 유발하므로, 임상적으로 AT 농축제제 보충 또는 헤파린·직접 트롬빈 억제제와 같은 항응고 요법을 병행하는 치료 전략이 고려된다.이처럼 AT는 단순한 혈액응고인자 억제 단백질을 넘어, 혈액응고와 항응고, 그리고 섬유소 용해(fibrinolysis) 시스템 사이의 미세한 균형을 유지하는 핵심 조절인자로서, 혈전성 질환의 병태생리 이해와 새로운 항응고 치료제 개발에 있어 중요한 연구 대상이 되고 있다.혈우병 A 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor Replacement Therapy) 혈우병 A의 전통적인 치료는 부족한 제Ⅷ인자(FVIII)를 직접 보충하는 방식이다. 초기에는 혈액 유래 FVIII 제제가 사용되었으나, 감염 위험 등 안전성 문제가 제기되면서 현재는 재조합 FVIII(rFVIII)이 표준으로 자리잡았다. 또한 최근에는 반감기를 연장한 FVIII 제제들이 개발되어 투여 빈도를 줄이고 환자 순응도를 높이는 데 기여하고 있다.1) 표준 반감기(Standard half-life, SHL) FVIII 제제 표준 반감기 제제는 혈액 유래 FVIII와 재조합 FVIII로 나눌 수 있다. 혈액 유래 제제는 감염 위험 관리가 필요하지만 여전히 일부에서 사용되고 있으며, 재조합 FVIII로 애드베이트(Advate& 9415;, 코지네이트 에프에스(Kogenate FS& 9415;) 등은 안전성 측면에서 더 선호된다.2) 반감기 연장형(Extended half-life, EHL) FVIII 제제 반감기 연장형 제제는 투여 간격을 늘리기 위해 Fc-fusion(엘록테이트, Eloctate& 9415;), PEGylation(애디노베이트, Adynovate& 9415;, 지비, Jivi& 9415;) 등 다양한 기술이 적용되었다. 이러한 약제들은 환자의 주사 횟수를 줄여 장기적인 치료 순응도를 개선하는 장점이 있다.3) VWF-independent EHL(VWF 비의존성 반감기 연장형) FVIII 제제 VWF 비의존성 반감기 연장형 제제인 알투비오(Altuviiio& 9415;)는 주 1회 주사로 FVIII 활성을 더 오래 유지할 수 있도록 설계된 최신형 지속형 치료제(high sustained factor, HSF)로 2023년 미 FDA에서 승인되었고 국내에서는 진행중이다,2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 A 환자의 약 20~30%는 치료 과정에서 FVIII에 대한 억제항체를 형성하게 되며, 이 경우 기존의 FVIII 보충요법은 효과가 제한적이다. 억제인자 환자의 치료에는 크게 두 가지 접근법이 있다.첫째, 우회제제(bypassing agents, BPA)를 사용하는 방법이다. 활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBA& 9415;)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSeven& 9415;)는 응고경로를 우회적으로 활성화하여 지혈 효과를 발휘하지만, 지혈 반응의 변동성과 혈전 위험이라는 한계가 존재한다.둘째, 에미시주맙(Emicizumab, Hemlibra& 9415;)는 FIXa와 FX를 연결하여 FVIII의 기능을 모방하는 이중특이성 항체로, 억제인자 환자뿐 아니라 비(非)억제인자 환자에서도 예방요법으로 사용 가능하다. 피하 주사로 1주~4주 간격 투여가 가능하여 투여 편의성이 획기적으로 개선되었다.3. 대체 인자제제(Replacement therapy) 재조합 돼지 유래 FVIII(r-pFVIII)인 오비주르(Obizur®, Susoctocog alfa)는 2014년 미 FDA, 2015년 EMA 그리고 2023년 국내에서 ‘성인 후천성 혈우병 A(Acquired Haemophilia A, AHA) 환자의 출혈 에피소드 치료’에 승인되었다. 후천성 혈우병 A는 선천성 혈우병과 다르게, 정상 혈액응고인자 VIII(FVIII) 수준을 가지고 있지만, 이에 대해 자가면역 항체(중화 항체)가 생겨 혈액 응고 기능이 저해되어 출혈 위험이 커지는 인구 100만 명당 약 1명꼴로 발생하는 초희귀 자가면역 응고질환이다.4. 비응고인자 기반 치료(Non-factor Therapy) 최근 혈우병 A 치료에서 가장 주목받는 변화는 FVIII를 직접 보충하지 않고, 다른 경로를 통해 응고 균형을 회복하는 비응고인자 기반 치료이다. 대표적인 약제가 에미시주맙(Emicizumab, Hemlibra& 9415;)으로, FIXa와 FX을 연결하여 FVIII의 보조인자 기능을 모방하는 이중특이성 항체이다. 피하 주사로 주 1회, 격주, 또는 4주 간격 투여가 가능해 환자의 치료 편의성이 획기적으로 개선되었다.이외에도 피투시란(Fitusiran)과 콘시주맙(Concizumab, Alhemo®)가 있다. 피투시란은 RNA 간섭(RNAi) 기술을 이용하여 간세포에서 항트롬빈 합성을 억제함으로써 응고 활성을 높인다. 월 1회 피하 주사가 가능하지만, 혈전 및 간독성 발생 위험으로 인해 항트롬빈 활성(15& 8211;35%)을 유지하는 개별화 용량조절(AT-DR)이 필요하다. 콘시주맙은 조직인자경로억제인자(TFPI)를 차단하여 내인성 응고를 촉진하는 약제이다.5. 유전자 치료(Gene Therapy) 혈우병 A에서 유전자 치료는 단회 정맥투여를 통해 간세포에 FVIII 유전자를 도입하여 장기간 발현을 유도하는 새로운 전략이다. 대표적인 약제가 록타비안(Roctavian& 9415;, Valoctocogene roxaparvovec)으로, AAV5 벡터를 이용해 개발되었으며 2022년 유럽, 2023년 미국 FDA의 승인을 받았다.단일 투여로 FVIII 발현을 장기간 유지할 수 있어 치료 패러다임의 변화를 예고했으나, 발현 지속 기간의 불확실성, 간효소 상승, 재투여 불가 등의 문제점이 여전히 남아 있다.혈우병 B 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor IX Replacement Therapy) 혈우병 B의 가장 기본적인 치료는 부족한 제Ⅸ인자(FIX)를 직접 보충하는 방식이다. 과거에는 혈액 유래 제제가 널리 사용되었으나, 감염 위험 문제로 현재는 재조합 FIX(rFIX) 제제가 주로 사용된다. 여기에 더해 반감기를 연장한 제제들이 개발되면서 투여 간격이 길어지고 환자의 치료 순응도가 크게 향상되었다.1) 표준 반감기(Standard half-life, SHL) FIX 제제 표준 반감기 FIX 제제는 투여 후 약 18~24시간의 반감기를 가지며, 주 2~3회 정맥 주사가 필요하다. 혈액 유래 FIX 제제는 여전히 일부에서 사용되지만, 바이러스 감염에 대한 안전성 우려가 있었다. 이를 보완하기 위해 개발된 재조합 FIX 제제인 베네픽스(BeneFIX& 9415;, Nonacog alfa)는 안전성이 확보되어 현재 임상에서 가장 널리 사용되고 있다.2) 반감기 연장(Extended half-life, EHL) FIX 제제 반감기 연장 제제는 기존 표준 제제보다 3~5배 긴 반감기를 가지며, 1~2주 간격으로 투여가 가능하다. 이들 약제에는 Fc-fusion 단백을 이용한 알프로릭스(Alprolix(& 9415;, Eftrenonacog alfa), albumin-fusion 기술이 적용된 아이델비온(Idelvion& 9415; Albutrepenonacog alfa) 등이 포함된다. 이러한 제제들은 주사 횟수를 줄여 환자의 삶의 질과 치료 순응도를 높이는 중요한 진보로 평가된다.2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 B 환자에서 억제인자 발생은 상대적으로 드물지만, 일단 형성되면 치료가 매우 어렵다. 억제인자가 형성된 경우 기존 FIX 제제의 효과가 소실되므로 우회제제(bypassing agents)가 사용된다.활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBA& 9415;)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSeven& 9415;)가 대표적이다. 그러나 혈우병 A와 달리 에미시주맙은 FVIII 기능을 모방하는 기전이기 때문에 혈우병 B 환자에게는 효과가 없다. 따라서 억제인자 환자의 치료는 여전히 제한적이며, 새로운 치료 전략이 필요한 영역이다.3. 비응고인자 기반 치료(Non-factor Therapy) 혈우병 B에서도 비응고인자 기반 치료가 적용될 수 있다. 이들 약제는 특정 응고인자를 보충하지 않고 응고 균형 자체를 조절하는 기전을 갖는다. 대표적으로 RNA 간섭 기반의 피투시란(Fitusiran)은 간세포에서 항트롬빈 합성을 억제하여 응고 활성을 증가시키며, 혈우병 A와 B 모두에 승인되었다.또한 항 TFPI 항체인 콘시주맙(Concizumab, Alhemo®) 역시 혈우병 A와 B 모두에 적용 가능하며, 내인성 응고경로를 촉진하여 출혈을 억제한다. 이처럼 비응고인자 기반 치료는 억제인자 보유 여부와 관계없이 사용할 수 있는 장점이 있어, 혈우병 B 환자에서도 중요한 치료 대안으로 부상하고 있다.4. 유전자 치료(Gene Therapy) 혈우병 B는 유전자 치료 분야에서 가장 먼저 성과를 낸 질환 중 하나이다. FIX 유전자의 크기가 FVIII보다 작아 AAV 벡터 전달이 용이하기 때문에, 임상개발이 상대적으로 앞서 진행되었다.대표적인 약제는 헴제닉스(Hemgenix& 9415;, Etranacogene dezaparvovec)으로, 2022년 미국 FDA와 2023년 유럽 EMA에서 세계 최초로 혈우병 유전자 치료제로 승인되었다. 단회 정맥투여만으로 간세포에서 FIX 발현이 장기간 유지될 수 있으며, 환자의 치료 부담을 획기적으로 줄일 수 있다. 그러나 여전히 발현 지속 기간의 변동성, 간효소 상승, 재투여 불가 등의 문제점이 존재하며, 고가의 치료비용 역시 중요한 사회적 논의 대상이 되고 있다.피투시란은 어떤 약제인가?피투시란은 안티트롬빈(AT) mRNA를 절단·분해하여 AT 발현을 억제함으로써 혈중 AT 농도를 감소시키는 기전을 가진다. siRNA 치료제는 RNAi 과정을 활용하는 대표적인 플랫폼으로, 표적 mRNA를 인식하고 분해하도록 설계된 합성 RNA 이중가닥 구조를 기반으로 한다. 이 과정은 특정 단백질의 번역을 저해하여 표적 단백질의 합성을 효과적으로 억제한다.피투시란은 화학적으로 안정화된 이중가닥 siRNA로 설계되어 뉴클레아제에 의한 분해나 Toll-like receptor(TLR)3, TLR7 등 선천면역 수용체의 인식을 회피한다. 특히 리보뉴클레오티드의 2′-데옥시-2′-플루오로 치환, 2′-O-메틸 치환, 인산 골격의 선택적 변형이 적용되어 높은 안정성과 생체 내 지속성을 확보하였다.이 siRNA는 삼중 안테나(tri-antenna) 형태의 N-아세틸갈락토사민(GalNAc) 잔기와 결합되어 있으며, 간세포 표면의 아실글리코프로테인 수용체(asialoglycoprotein receptor, ASGPR)를 통해 효율적으로 간세포 내로 전달된다. 세포 내로 흡수된 후 산성 환경에서 siRNA는 ASGPR로부터 해리되고, 엔도솜을 탈출하여 세포질 내 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 탑재된다.RISC는 siRNA의 안티센스(antisense) 가닥을 선택적으로 유지하고, 이를 이용해 표적 유전자인 SERPINC1 mRNA를 서열 특이적으로 절단·분해함으로써 AT 발현을 억제한다. 이 과정의 결과로 혈중 AT 농도가 감소하며, 그에 따라 트롬빈 생성이 증가하여 혈우병 환자의 응고능이 향상된다.RISC 내 안티센스 가닥은 세포 내에서 수 주간 안정적으로 존재하면서 반복적으로 전사체 절단을 매개하므로, 세포당 수백 개 수준의 siRNA 분자만으로도 강력하고 지속적인 knockdown 효과를 낸다. 이러한 특성 덕분에 피투시란은 임상시험에서 한 달에 한 번의 피하 투여만으로도 충분한 약효를 유지할 수 있는 장점을 보인다.Antithrombin Knockdown by Fitusiran(출처: Molecular Therapy Vol. 28 No 3 April 2020).피투시란의 약리 기전은?피투시란은 간에서 합성되는 AT(antithrombin) mRNA를 표적하는 siRNA로 개발된 약제로, 항트롬빈 발현을 효율적으로 억제함으로써 체내의 친응고 상태를 강화하는 새로운 치료 전략이다.즉, AT 억제 작용을 통해 내인성 및 외인성 경로 모두에서 Factor Xa와 트롬빈의 활성을 증가시켜 응고 연쇄의 효율성을 회복시키며, 그 결과 FVIII 또는 FIX 결핍이 있는 혈우병 환자에서도 출혈 위험을 효과적으로 감소시킨다.The Role of Thrombin and Antithrombin in Hemostasis, and the Mechanism of Action of Fitusiran(출처: Res Pract Thromb Haemost. 2023;7:e100179).피투시란은 혈우병 A 또는 B 환자의 출혈 예방을 위해 2개월에 한 번 피하 주사로 투여된다. 초기 권장 용량은 50mg이며, 이후 항트롬빈 활성도를 모니터링하여 용량과 투여 간격을 조정한다. 목표 AT 활성도는 15~35% 사이로 유지하는 것이 바람직하다.AT 활성도가 15% 미만으로 떨어질 경우 용량을 줄이고, 35% 이상으로 증가하면 용량을 늘릴 수 있다. 예를 들어, 50mg을 2개월 간격으로 투여하던 환자의 AT 활성도가 35%를 초과할 경우, 동일 용량을 매월 투여하도록 변경할 수 있다.약동학 연구에서 피투시란은 혈장에서 비교적 짧은 반감기(약 3~5시간)를 보였으나, 모든 임상시험 용량군에서 투여 중단 후에도 수개월간 AT 감소 효과가 지속되었다. 평균 AT 회복 속도는 한 달에 약 10~15% 수준이었으며, 이 기간 동안 트롬빈 생성은 억제되고 출혈 사건 발생 위험은 증가하는 경향을 보였다.투여 중단 후 약 5개월 시점에서 중앙값 AT 수치는 약 60% 이상으로 회복되었다. 약력학적 분석 결과, AT 억제 효과는 첫 투여 후 약 15~28일 사이에 나타났으며, 개인 간 AT 감소 정도에는 차이가 있으나 개인 내에서는 일정하게 유지되어 지속적인 지혈 보호 효과를 제공하는 것으로 확인되었다.피투시란은 또한 비인자(non-factor) 치료제 중 유일하게 특정 역전제(reversal agent)를 보유한 약제로, 이는 재조합 또는 혈장 유래 항트롬빈 제제 형태로 제공된다. 이러한 역전제는 돌파성 출혈 시 다른 지혈제와 병용할 경우 혈전증 위험을 조절할 수 있다는 점에서 임상적으로 중요한 의미를 갖는다.한편, 혈중 AT 감소가 표준 응고 검사에 직접적인 영향을 미치지 않는다는 점은, CFC(concentrated factor concentrate) 또는 BPA(bypassing agent)를 사용하는 상황이나 수술 시 지혈 상태 및 인자 수치를 보다 용이하게 모니터링할 수 있음을 시사한다.피투시란(QFITLIA)의 허가임상은 어떠한가?성인 및 12세 이상의 소아 환자에서 억제인자(inhibitors)의 존재 여부와 관계없이 혈우병 A 또는 B를 가진 환자에서 QFITLIA의 유효성과 안전성은 두 건의 임상시험에서 입증되었다.-억제인자가 있는 혈우병 A 또는 B: ATLAS-INH -억제인자가 없는 혈우병 A 또는 B: ATLAS-A/B위의 본 임상시험에 참여한 환자들은 장기 연장 연구인 ATLAS-OLE로 이월되었다.임상시험 ATLAS-INH 및 ATLAS-A/B에서는 QFITLIA 80mg 고정 월 1회 용량을 시험하였다. 그러나 이 용량에서 혈전성 사건(thrombotic events)이 발생하여, ATLAS-OLE에서는 항트롬빈(AT) 활성 15& 8211;35%를 목표로 하는 QFITLIA AT-DR 용법이 도입되었다.AT-DR 용법은 ATLAS-INH 및 ATLAS-A/B 연구가 거의 완료될 시점에 도입되었으므로, QFITLIA AT-DR 치료의 유효성은 장기 연장 연구 ATLAS-OLE에서 얻어진 AT-DR 치료 데이터를 ATLAS-INH 및 ATLAS-A/B 연구의 대조(control) 데이터와 비교하여 평가되었다.유효성 분석은 본 임상시험들의 무작위 배정(randomization)을 보존하면서, 부모 연구(parent studies)에서의 의도한 치료(intent-to-treat, ITT) 원칙에 따라 수행되었다.[ATLAS-INH] ATLAS-INH은 혈우병 A 또는 B 환자 중 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체를 가진 성인 및 소아 남성 환자(≥12세) 57명을 대상으로 실시된 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 이들은 모두 과거에 출혈 시 우회제제(BPAs)를 필요에 따라(episodic, on-demand) 투여받은 병력이 있었다.대상 환자들은 2:1 비율로 무작위 배정되어, 월 1회 80mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=38)과, 돌발 출혈(breakthrough bleeding) 발생 시 BPA를 필요에 따라 투여받은 군(N=19)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg 용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다. 현재 50mg과 20mg이 허가되어 있다.[ATLAS A/B] ATLAS A/B는 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체가 없는 혈우병 A 또는 B 환자를 대상으로 한 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 대상자는 모두 성인 및 소아 남성(≥12세)으로, 과거에 출혈 시 응고인자제제(CFC)를 필요에 따라(on-demand, episodic) 투여받은 병력이 있었다.대상 환자 120명은 2:1 비율로 무작위 배정되어, 월 1회 80 mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=80)과, 돌발 출혈 발생 시 CFC를 필요에 따라 투여받은 군(N=40)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다.[ATLAS-OLE] 총 227명의 환자가 두 임상시험(ATLAS-INH 및 ATLAS-A/B)과, CFC 또는 BPA 예방요법을 받던 환자를 대상으로 한 교차 임상시험 ATLAS-PPX에서 이월되어 ATLAS-OLE 연구에서 QFITLIA 치료를 받았다. 이 다기관 공개 연장 임상시험은 FVIII 또는 FIX 억제항체 유무와 관계없이, 12세 이상의 성인 및 소아 남성 혈우병 A 또는 B 환자에서 QFITLIA의 장기적인 안전성과 유효성을 평가하였다.대상자는 초기에는 월 1회 80mg QFITLIA 피하 주사를 투여받았으나, 연구가 개정되어 AT-DR(항트롬빈 활성 15& 8211;35% 목표) 용법의 유효성과 안전성을 평가하도록 설계가 변경되었다. 이후 총 213명의 환자가 AT-DR로 전환되었다.AT-DR에서는 시작 용량이 50mg 격월(2개월 간격) 투여였으며, INNOVANCE Antithrombin 분석법을 이용해 측정한 AT 활성 수치에 따라 개별적으로 용량을 조정하였다. 용량은 50mg 월 1회 또는 80mg 월 1회로 증량하거나, 20mg 격월 또는 20mg 월 1회로 감량할 수 있었다.AT 활성 수치가 최저 용량에서도2025-10-23 23:25:17최병철 박사
세계 첫 항체 무관 혈우병 A·B 치료제 '피투시란'큐피틀리아(Qfitlia, 성분명 피투시란, Fitusiran, 사노피)는 GalXC 기술 플랫폼을 기반으로 개발된 항트롬빈(antithrombin)을 표적으로 하는 소간섭 리보핵산(small interfering RNA, siRNA) 치료제다.이 약제는 2024년 유럽의약청(EMA) 에서, 이어 올해 3월 미국 식품의약국(FDA) 에서 제VIII인자 또는 제IX인자 억제인자(inhibitor)의 유무와 관계없이, 12세 이상 성인 및 소아 혈우병 A 또는 B 환자에서 출혈 에피소드의 발생을 예방하거나 빈도를 감소시키기 위한 정기적 예방요법(routine prophylaxis)에 ‘두 달에 한번 피하주사’로 승인되었다. 국내에서는 올해 5월 희귀의약품(Orphan drug) 으로 지정되었다.혈우병(hemophilia)은 X염색체 연관 열성 유전질환으로, 제Ⅷ인자(FVIII) 또는 제Ⅸ인자(FIX) 의 결핍으로 인해 혈액응고 연쇄반응(coagulation cascade) 이 정상적으로 진행되지 못하며, 그 결과 트롬빈(thrombin) 생성 부족으로 지혈(hemostasis) 이 저하된다. 이러한 병태생리적 이상은 반복적인 출혈, 특히 관절 출혈을 초래하여 만성 관절병증(chronic arthropathy) 및 삶의 질 저하로 이어진다.기존의 표준 치료는 응고인자제제(clotting factor concentrate, CFC) 의 정맥 내 투여를 통한 인자 보충요법(replacement therapy) 이었다. 그러나 이 방식은 정맥 투여의 불편성, 반복적 투여 부담, 그리고 항체(억제인자, inhibitor) 형성으로 인한 치료 저항성이라는 한계를 지닌다.이에 따라 최근에는 비(非)응고인자 기반 치료(non-factor therapy) 의 개발이 활발히 이루어지고 있으며, 그중에서도 RNA 간섭(RNA interference, RNAi) 기술을 이용한 피투시란(Fitusiran) 은 새로운 치료 옵션으로 주목 받고 있다.피투시란은 간세포 내에서 항트롬빈(antithrombin, AT) 합성을 억제하도록 설계된 siRNA 기반 치료제로, 내인성 응고 조절 인자의 발현을 조절함으로써 응고 균형(hemostatic balance) 을 회복시키는 새로운 접근법을 제시한다.피투시란의 승인은 다국가, 무작위배정, 대조, 3상 임상시험들로 구성된 ATLAS 임상 프로그램의 결과를 근거로 하였다.이 프로그램에는 ATLAS-A/B, ATLAS-INH, 그리고 ATLAS-PPX 연구가 포함되며, 각각 혈우병 A 또는 B 환자 중 인자 억제인자의 유무, 그리고 기존 예방요법(prophylaxis) 사용 여부에 따라 구분되었다.ATLAS-A/B 연구는 억제인자가 없는(non-inhibitor) 혈우병 A 또는 B 환자를 대상으로, ATLAS-INH 연구는 억제인자가 존재하는(inhibitor-positive) 환자를 대상으로 수행되었다. ATLAS-PPX 연구는 기존 예방요법을 받고 있던 환자에서 피투시란으로 전환했을 때의 출혈률 변화를 평가하였다.이들 연구에서 피투시란은 월 1회 피하주사(subcutaneous injection) 투여만으로도 연간 출혈률(annualized bleeding rate, ABR)을 기존 치료 대비 약 90% 이상 유의하게 감소시켰으며, 절반 이상의 환자에서 무출혈(ABR = 0)이 관찰되었다. 또한 억제인자 유무와 관계없이 일관된 출혈 억제 효과가 확인되었다.혈우병이란 무엇인가?혈우병(hemophilia)은 그리스어 ‘hemo(피)’와 ‘philia(사랑하다)’에서 유래한 용어로, 1828년 Sch& 246;nlein에 의해 H& 228;mophilie라 명명됐다. 19세기 말 유럽 왕실 내 근친혼으로 인해 영국, 스페인, 독일, 러시아 등 여러 나라에서 다수의 환자가 발생하면서 ‘왕실병(The Royal Disease)’이라는 별칭을 얻었다.혈우병은 혈액응고인자의 결핍으로 인해 발생하는 대표적인 선천성 출혈성 질환이다. 제VIII응고인자(FVIII)의 결핍은 혈우병 A로, 전체 환자의 약 80~85%를 차지하며 ‘고전적 혈우병(classic hemophilia)’이라 불린다. 제IX응고인자(FIX)의 결핍은 혈우병 B로 약 15%를 차지하며, 최초 환자의 이름을 따 ‘크리스마스병(Christmas disease)’으로도 알려져 있다. 제XI응고인자(FXI)의 결핍은 혈우병 C로 상대적으로 드물게 발생한다.혈우병 A와 B는 X 염색체 열성 유전 양식을 가지므로 주로 남성에서 발병하며, 여성은 보인자로 존재하거나 드물게 태아기에 사망하기도 한다. 반면 혈우병 C는 4번 염색체 이상에 기인하므로 성별에 관계없이 발생할 수 있으며, 일부 환자에서는 가족력 없이 자연 발생적 유전자 변이에 의해 발현되기도 한다.혈우병과 유사한 질환으로는 폰빌레브란트병(von Willebrand disease, vWD)이 있다. 이는 응고인자 VIII과 결합하는 폰빌레브란트인자(vWF)의 결핍으로 인해 혈우병과 유사한 임상 양상을 보인다.이외에도 프로트롬빈(II), 피브리노겐(I), V, VII, X, XII, XIII 응고인자의 결핍으로 인한 선천성 응고장애가 보고되어 있으나, 이러한 질환들은 혈우병의 범주에는 포함되지 않는다.혈액응고 과정은 어떻게 일어나는가?혈액응고는 인체의 항상성을 유지하기 위한 필수적인 생리적 방어기전으로, 외상이나 혈관 손상 시 과도한 출혈을 방지하는 역할을 한다. 이 과정은 혈관수축, 혈소판 기능, 그리고 혈액응고인자의 연속적인 활성화로 이루어지는 응고 연쇄(cascade)로 설명되며, 궁극적으로 안정적인 피브린 혈전(fibrin clot)을 형성한다.혈액응고인자(Coagulation factors)는 주로 간에서 합성되는 단백질로, 로마 숫자로 표기된 I번부터 XIII번까지의 인자가 알려져 있다. 이들은 각각 특정 효소 활성 또는 보조인자로 작용하면서 정교하고 단계적인 반응을 매개한다. 주요 응고인자로는 피브리노겐(Factor I), 프로트롬빈(Factor II), 그리고 프로트롬빈 복합체를 구성하는 V, VII, IX, X, XI, XII 인자, 마지막으로 XIII 인자 등이 있다. 응고 연쇄는 크게 내인성 경로(intrinsic pathway), 외인성 경로(extrinsic pathway), 그리고 두 경로가 합류하는 공통 경로(common pathway)로 구성된다.내인성 경로는 Factor XII의 활성화를 시작으로 XI, IX, VIII 인자가 순차적으로 활성화되며, 외인성 경로는 조직인자(tissue factor, TF)와 Factor VII의 상호작용을 통해 개시된다.두 경로는 Factor X의 활성화 단계에서 공통 경로로 수렴하며, 활성화된 Factor X는 Factor V와 결합하여 프로트롬비나제(prothrombinase) 복합체를 형성한다. 이 복합체는 프로트롬빈(Factor II)을 트롬빈(thrombin)으로 전환시키고, 생성된 트롬빈은 피브리노겐(Factor I)을 불용성 피브린(fibrin)으로 전환시켜 최종적으로 혈전을 완성한다.또한 트롬빈은 Factor V, VIII, XI 등을 다시 활성화시키는 양성 되먹임(positive feedback) 작용을 통해 응고 반응을 증폭시키며, Factor XIII을 활성화시켜 피브린 가교결합(fibrin cross-linking)을 형성함으로써 혈전의 안정성을 더욱 높인다.이러한 정교한 연쇄 반응은 항응고 단백질(antithrombin, protein C/S system 등)과 섬유소 용해(fibrinolysis) 기전 간의 정밀한 균형 속에서 조절된다. 이 균형이 깨질 경우 출혈성 질환이나 혈전성 질환으로 이어질 수 있다.항트롬빈(Antithrombin, AT, heparin cofactor I)은 어떤 물질인가?항트롬빈(AT)은 혈액응고 조절에서 가장 중요한 내인성 항응고인자로, 전체 생리적 응고 억제 작용의 약 70~80%를 담당하는 핵심 단백질이다. AT는 혈장에 존재하는 세린 단백질분해효소 억제제(serpin) 계열의 당단백질로, 주된 표적은 트롬빈(thrombin)이지만, Factor Xa, IXa, XIa, XIIa 및 칼리크레인(kallikrein) 등 다양한 혈액응고인자를 동시에 억제함으로써 응고 연쇄(cascade) 전반의 균형 유지에 기여한다.The Coagulation Cascade(출처: Ann Pharmacother . 2016 Sep;50(9):758-67). AT는 트롬빈의 활성 중심부에 위치한 세린(serine) 잔기와 1:1 비율로 결합하여 불활성 복합체를 형성함으로써 트롬빈 활성을 차단한다. 이를 통해 소규모 응고 반응이나 불필요한 혈전 형성을 신속히 억제하며, 정상적인 생리 상태에서 과도한 혈액응고를 방지하는 핵심 역할을 수행한다.그러나 대규모 혈관 손상이나 파종성 혈관내응고(Disseminated intravascular coagulation, DIC)와 같이 트롬빈 생성이 폭발적으로 증가하는 상황에서는 AT의 억제 능력이 상대적으로 부족해져, 생리적 항응고 메커니즘만으로는 병적 혈전 형성을 완전히 제어하기 어렵다.AT의 항응고 활성이 가장 강력하게 발휘되는 조건은 헤파린(heparin)의 존재 하에서이다. 헤파린은 AT에 결합하여 구조적 변화를 유도하고, AT와 트롬빈 및 Factor Xa 간의 결합 친화도를 수백 배 이상 증폭시킨다.이로 인해 헤파린은 AT의 촉매제(cofactor) 역할을 하며, 임상적으로 항응고 효과를 발휘하는 주요 기전이 바로 AT 매개 억제 반응이다. 이러한 이유로 AT 결핍 환자에서는 헤파린의 항응고 효과가 현저히 감소하며, 이는 선천성 또는 후천성 AT 결핍에서 혈전성 질환 발생 위험이 증가하는 중요한 근거가 된다.AT는 간에서 합성되며 혈중 농도는 약 0.15mg/mL로 유지되고, 정상 활성도는 80~120% 범위 내에 있다. 선천성 AT 결핍은 드문 질환이지만 정맥혈전증과 폐색전증 발생의 중요한 위험 요인으로 알려져 있으며, 후천성 결핍은 간질환, 신증후군, DIC, 항응고제 치료 등 다양한 상황에서 관찰된다. AT 농도의 감소는 항응고 균형을 무너뜨려 과도한 혈전 형성을 유발하므로, 임상적으로 AT 농축제제 보충 또는 헤파린·직접 트롬빈 억제제와 같은 항응고 요법을 병행하는 치료 전략이 고려된다.이처럼 AT는 단순한 혈액응고인자 억제 단백질을 넘어, 혈액응고와 항응고, 그리고 섬유소 용해(fibrinolysis) 시스템 사이의 미세한 균형을 유지하는 핵심 조절인자로서, 혈전성 질환의 병태생리 이해와 새로운 항응고 치료제 개발에 있어 중요한 연구 대상이 되고 있다.혈우병 A 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor Replacement Therapy) 혈우병 A의 전통적인 치료는 부족한 제Ⅷ인자(FVIII)를 직접 보충하는 방식이다. 초기에는 혈액 유래 FVIII 제제가 사용되었으나, 감염 위험 등 안전성 문제가 제기되면서 현재는 재조합 FVIII(rFVIII)이 표준으로 자리잡았다. 또한 최근에는 반감기를 연장한 FVIII 제제들이 개발되어 투여 빈도를 줄이고 환자 순응도를 높이는 데 기여하고 있다.1) 표준 반감기(Standard half-life, SHL) FVIII 제제 표준 반감기 제제는 혈액 유래 FVIII와 재조합 FVIII로 나눌 수 있다. 혈액 유래 제제는 감염 위험 관리가 필요하지만 여전히 일부에서 사용되고 있으며, 재조합 FVIII로 애드베이트(Advate& 9415;, 코지네이트 에프에스(Kogenate FS& 9415;) 등은 안전성 측면에서 더 선호된다.2) 반감기 연장형(Extended half-life, EHL) FVIII 제제 반감기 연장형 제제는 투여 간격을 늘리기 위해 Fc-fusion(엘록테이트, Eloctate& 9415;), PEGylation(애디노베이트, Adynovate& 9415;, 지비, Jivi& 9415;) 등 다양한 기술이 적용되었다. 이러한 약제들은 환자의 주사 횟수를 줄여 장기적인 치료 순응도를 개선하는 장점이 있다.3) VWF-independent EHL(VWF 비의존성 반감기 연장형) FVIII 제제 VWF 비의존성 반감기 연장형 제제인 알투비오(Altuviiio& 9415;)는 주 1회 주사로 FVIII 활성을 더 오래 유지할 수 있도록 설계된 최신형 지속형 치료제(high sustained factor, HSF)로 2023년 미 FDA에서 승인되었고 국내에서는 진행중이다,2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 A 환자의 약 20~30%는 치료 과정에서 FVIII에 대한 억제항체를 형성하게 되며, 이 경우 기존의 FVIII 보충요법은 효과가 제한적이다. 억제인자 환자의 치료에는 크게 두 가지 접근법이 있다.첫째, 우회제제(bypassing agents, BPA)를 사용하는 방법이다. 활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBA& 9415;)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSeven& 9415;)는 응고경로를 우회적으로 활성화하여 지혈 효과를 발휘하지만, 지혈 반응의 변동성과 혈전 위험이라는 한계가 존재한다.둘째, 에미시주맙(Emicizumab, Hemlibra& 9415;)는 FIXa와 FX를 연결하여 FVIII의 기능을 모방하는 이중특이성 항체로, 억제인자 환자뿐 아니라 비(非)억제인자 환자에서도 예방요법으로 사용 가능하다. 피하 주사로 1주~4주 간격 투여가 가능하여 투여 편의성이 획기적으로 개선되었다.3. 대체 인자제제(Replacement therapy) 재조합 돼지 유래 FVIII(r-pFVIII)인 오비주르(Obizur®, Susoctocog alfa)는 2014년 미 FDA, 2015년 EMA 그리고 2023년 국내에서 ‘성인 후천성 혈우병 A(Acquired Haemophilia A, AHA) 환자의 출혈 에피소드 치료’에 승인되었다. 후천성 혈우병 A는 선천성 혈우병과 다르게, 정상 혈액응고인자 VIII(FVIII) 수준을 가지고 있지만, 이에 대해 자가면역 항체(중화 항체)가 생겨 혈액 응고 기능이 저해되어 출혈 위험이 커지는 인구 100만 명당 약 1명꼴로 발생하는 초희귀 자가면역 응고질환이다.4. 비응고인자 기반 치료(Non-factor Therapy) 최근 혈우병 A 치료에서 가장 주목받는 변화는 FVIII를 직접 보충하지 않고, 다른 경로를 통해 응고 균형을 회복하는 비응고인자 기반 치료이다. 대표적인 약제가 에미시주맙(Emicizumab, Hemlibra& 9415;)으로, FIXa와 FX을 연결하여 FVIII의 보조인자 기능을 모방하는 이중특이성 항체이다. 피하 주사로 주 1회, 격주, 또는 4주 간격 투여가 가능해 환자의 치료 편의성이 획기적으로 개선되었다.이외에도 피투시란(Fitusiran)과 콘시주맙(Concizumab, Alhemo®)가 있다. 피투시란은 RNA 간섭(RNAi) 기술을 이용하여 간세포에서 항트롬빈 합성을 억제함으로써 응고 활성을 높인다. 월 1회 피하 주사가 가능하지만, 혈전 및 간독성 발생 위험으로 인해 항트롬빈 활성(15& 8211;35%)을 유지하는 개별화 용량조절(AT-DR)이 필요하다. 콘시주맙은 조직인자경로억제인자(TFPI)를 차단하여 내인성 응고를 촉진하는 약제이다.5. 유전자 치료(Gene Therapy) 혈우병 A에서 유전자 치료는 단회 정맥투여를 통해 간세포에 FVIII 유전자를 도입하여 장기간 발현을 유도하는 새로운 전략이다. 대표적인 약제가 록타비안(Roctavian& 9415;, Valoctocogene roxaparvovec)으로, AAV5 벡터를 이용해 개발되었으며 2022년 유럽, 2023년 미국 FDA의 승인을 받았다.단일 투여로 FVIII 발현을 장기간 유지할 수 있어 치료 패러다임의 변화를 예고했으나, 발현 지속 기간의 불확실성, 간효소 상승, 재투여 불가 등의 문제점이 여전히 남아 있다.혈우병 B 치료제에는 어떤 약제가 있는가?1. 응고인자 보충요법(Factor IX Replacement Therapy) 혈우병 B의 가장 기본적인 치료는 부족한 제Ⅸ인자(FIX)를 직접 보충하는 방식이다. 과거에는 혈액 유래 제제가 널리 사용되었으나, 감염 위험 문제로 현재는 재조합 FIX(rFIX) 제제가 주로 사용된다. 여기에 더해 반감기를 연장한 제제들이 개발되면서 투여 간격이 길어지고 환자의 치료 순응도가 크게 향상되었다.1) 표준 반감기(Standard half-life, SHL) FIX 제제 표준 반감기 FIX 제제는 투여 후 약 18~24시간의 반감기를 가지며, 주 2~3회 정맥 주사가 필요하다. 혈액 유래 FIX 제제는 여전히 일부에서 사용되지만, 바이러스 감염에 대한 안전성 우려가 있었다. 이를 보완하기 위해 개발된 재조합 FIX 제제인 베네픽스(BeneFIX& 9415;, Nonacog alfa)는 안전성이 확보되어 현재 임상에서 가장 널리 사용되고 있다.2) 반감기 연장(Extended half-life, EHL) FIX 제제 반감기 연장 제제는 기존 표준 제제보다 3~5배 긴 반감기를 가지며, 1~2주 간격으로 투여가 가능하다. 이들 약제에는 Fc-fusion 단백을 이용한 알프로릭스(Alprolix(& 9415;, Eftrenonacog alfa), albumin-fusion 기술이 적용된 아이델비온(Idelvion& 9415; Albutrepenonacog alfa) 등이 포함된다. 이러한 제제들은 주사 횟수를 줄여 환자의 삶의 질과 치료 순응도를 높이는 중요한 진보로 평가된다.2. 억제인자 환자 치료(Treatment for Patients with Inhibitors) 혈우병 B 환자에서 억제인자 발생은 상대적으로 드물지만, 일단 형성되면 치료가 매우 어렵다. 억제인자가 형성된 경우 기존 FIX 제제의 효과가 소실되므로 우회제제(bypassing agents)가 사용된다.활성화 프로트롬빈 복합체(aPCC, 훼이바, FEIBA& 9415;)와 재조합 활성 VIIa(rFVIIa, 노보세븐, NovoSeven& 9415;)가 대표적이다. 그러나 혈우병 A와 달리 에미시주맙은 FVIII 기능을 모방하는 기전이기 때문에 혈우병 B 환자에게는 효과가 없다. 따라서 억제인자 환자의 치료는 여전히 제한적이며, 새로운 치료 전략이 필요한 영역이다.3. 비응고인자 기반 치료(Non-factor Therapy) 혈우병 B에서도 비응고인자 기반 치료가 적용될 수 있다. 이들 약제는 특정 응고인자를 보충하지 않고 응고 균형 자체를 조절하는 기전을 갖는다. 대표적으로 RNA 간섭 기반의 피투시란(Fitusiran)은 간세포에서 항트롬빈 합성을 억제하여 응고 활성을 증가시키며, 혈우병 A와 B 모두에 승인되었다.또한 항 TFPI 항체인 콘시주맙(Concizumab, Alhemo®) 역시 혈우병 A와 B 모두에 적용 가능하며, 내인성 응고경로를 촉진하여 출혈을 억제한다. 이처럼 비응고인자 기반 치료는 억제인자 보유 여부와 관계없이 사용할 수 있는 장점이 있어, 혈우병 B 환자에서도 중요한 치료 대안으로 부상하고 있다.4. 유전자 치료(Gene Therapy) 혈우병 B는 유전자 치료 분야에서 가장 먼저 성과를 낸 질환 중 하나이다. FIX 유전자의 크기가 FVIII보다 작아 AAV 벡터 전달이 용이하기 때문에, 임상개발이 상대적으로 앞서 진행되었다.대표적인 약제는 헴제닉스(Hemgenix& 9415;, Etranacogene dezaparvovec)으로, 2022년 미국 FDA와 2023년 유럽 EMA에서 세계 최초로 혈우병 유전자 치료제로 승인되었다. 단회 정맥투여만으로 간세포에서 FIX 발현이 장기간 유지될 수 있으며, 환자의 치료 부담을 획기적으로 줄일 수 있다. 그러나 여전히 발현 지속 기간의 변동성, 간효소 상승, 재투여 불가 등의 문제점이 존재하며, 고가의 치료비용 역시 중요한 사회적 논의 대상이 되고 있다.피투시란은 어떤 약제인가?피투시란은 안티트롬빈(AT) mRNA를 절단·분해하여 AT 발현을 억제함으로써 혈중 AT 농도를 감소시키는 기전을 가진다. siRNA 치료제는 RNAi 과정을 활용하는 대표적인 플랫폼으로, 표적 mRNA를 인식하고 분해하도록 설계된 합성 RNA 이중가닥 구조를 기반으로 한다. 이 과정은 특정 단백질의 번역을 저해하여 표적 단백질의 합성을 효과적으로 억제한다.피투시란은 화학적으로 안정화된 이중가닥 siRNA로 설계되어 뉴클레아제에 의한 분해나 Toll-like receptor(TLR)3, TLR7 등 선천면역 수용체의 인식을 회피한다. 특히 리보뉴클레오티드의 2′-데옥시-2′-플루오로 치환, 2′-O-메틸 치환, 인산 골격의 선택적 변형이 적용되어 높은 안정성과 생체 내 지속성을 확보하였다.이 siRNA는 삼중 안테나(tri-antenna) 형태의 N-아세틸갈락토사민(GalNAc) 잔기와 결합되어 있으며, 간세포 표면의 아실글리코프로테인 수용체(asialoglycoprotein receptor, ASGPR)를 통해 효율적으로 간세포 내로 전달된다. 세포 내로 흡수된 후 산성 환경에서 siRNA는 ASGPR로부터 해리되고, 엔도솜을 탈출하여 세포질 내 RNA 유도 침묵 복합체(RNA-induced silencing complex, RISC)에 탑재된다.RISC는 siRNA의 안티센스(antisense) 가닥을 선택적으로 유지하고, 이를 이용해 표적 유전자인 SERPINC1 mRNA를 서열 특이적으로 절단·분해함으로써 AT 발현을 억제한다. 이 과정의 결과로 혈중 AT 농도가 감소하며, 그에 따라 트롬빈 생성이 증가하여 혈우병 환자의 응고능이 향상된다.RISC 내 안티센스 가닥은 세포 내에서 수 주간 안정적으로 존재하면서 반복적으로 전사체 절단을 매개하므로, 세포당 수백 개 수준의 siRNA 분자만으로도 강력하고 지속적인 knockdown 효과를 낸다. 이러한 특성 덕분에 피투시란은 임상시험에서 한 달에 한 번의 피하 투여만으로도 충분한 약효를 유지할 수 있는 장점을 보인다.Antithrombin Knockdown by Fitusiran(출처: Molecular Therapy Vol. 28 No 3 April 2020).피투시란의 약리 기전은?피투시란은 간에서 합성되는 AT(antithrombin) mRNA를 표적하는 siRNA로 개발된 약제로, 항트롬빈 발현을 효율적으로 억제함으로써 체내의 친응고 상태를 강화하는 새로운 치료 전략이다.즉, AT 억제 작용을 통해 내인성 및 외인성 경로 모두에서 Factor Xa와 트롬빈의 활성을 증가시켜 응고 연쇄의 효율성을 회복시키며, 그 결과 FVIII 또는 FIX 결핍이 있는 혈우병 환자에서도 출혈 위험을 효과적으로 감소시킨다.The Role of Thrombin and Antithrombin in Hemostasis, and the Mechanism of Action of Fitusiran(출처: Res Pract Thromb Haemost. 2023;7:e100179).피투시란은 혈우병 A 또는 B 환자의 출혈 예방을 위해 2개월에 한 번 피하 주사로 투여된다. 초기 권장 용량은 50mg이며, 이후 항트롬빈 활성도를 모니터링하여 용량과 투여 간격을 조정한다. 목표 AT 활성도는 15~35% 사이로 유지하는 것이 바람직하다.AT 활성도가 15% 미만으로 떨어질 경우 용량을 줄이고, 35% 이상으로 증가하면 용량을 늘릴 수 있다. 예를 들어, 50mg을 2개월 간격으로 투여하던 환자의 AT 활성도가 35%를 초과할 경우, 동일 용량을 매월 투여하도록 변경할 수 있다.약동학 연구에서 피투시란은 혈장에서 비교적 짧은 반감기(약 3~5시간)를 보였으나, 모든 임상시험 용량군에서 투여 중단 후에도 수개월간 AT 감소 효과가 지속되었다. 평균 AT 회복 속도는 한 달에 약 10~15% 수준이었으며, 이 기간 동안 트롬빈 생성은 억제되고 출혈 사건 발생 위험은 증가하는 경향을 보였다.투여 중단 후 약 5개월 시점에서 중앙값 AT 수치는 약 60% 이상으로 회복되었다. 약력학적 분석 결과, AT 억제 효과는 첫 투여 후 약 15~28일 사이에 나타났으며, 개인 간 AT 감소 정도에는 차이가 있으나 개인 내에서는 일정하게 유지되어 지속적인 지혈 보호 효과를 제공하는 것으로 확인되었다.피투시란은 또한 비인자(non-factor) 치료제 중 유일하게 특정 역전제(reversal agent)를 보유한 약제로, 이는 재조합 또는 혈장 유래 항트롬빈 제제 형태로 제공된다. 이러한 역전제는 돌파성 출혈 시 다른 지혈제와 병용할 경우 혈전증 위험을 조절할 수 있다는 점에서 임상적으로 중요한 의미를 갖는다.한편, 혈중 AT 감소가 표준 응고 검사에 직접적인 영향을 미치지 않는다는 점은, CFC(concentrated factor concentrate) 또는 BPA(bypassing agent)를 사용하는 상황이나 수술 시 지혈 상태 및 인자 수치를 보다 용이하게 모니터링할 수 있음을 시사한다.피투시란(QFITLIA)의 허가임상은 어떠한가?성인 및 12세 이상의 소아 환자에서 억제인자(inhibitors)의 존재 여부와 관계없이 혈우병 A 또는 B를 가진 환자에서 QFITLIA의 유효성과 안전성은 두 건의 임상시험에서 입증되었다.-억제인자가 있는 혈우병 A 또는 B: ATLAS-INH -억제인자가 없는 혈우병 A 또는 B: ATLAS-A/B위의 본 임상시험에 참여한 환자들은 장기 연장 연구인 ATLAS-OLE로 이월되었다.임상시험 ATLAS-INH 및 ATLAS-A/B에서는 QFITLIA 80mg 고정 월 1회 용량을 시험하였다. 그러나 이 용량에서 혈전성 사건(thrombotic events)이 발생하여, ATLAS-OLE에서는 항트롬빈(AT) 활성 15& 8211;35%를 목표로 하는 QFITLIA AT-DR 용법이 도입되었다.AT-DR 용법은 ATLAS-INH 및 ATLAS-A/B 연구가 거의 완료될 시점에 도입되었으므로, QFITLIA AT-DR 치료의 유효성은 장기 연장 연구 ATLAS-OLE에서 얻어진 AT-DR 치료 데이터를 ATLAS-INH 및 ATLAS-A/B 연구의 대조(control) 데이터와 비교하여 평가되었다.유효성 분석은 본 임상시험들의 무작위 배정(randomization)을 보존하면서, 부모 연구(parent studies)에서의 의도한 치료(intent-to-treat, ITT) 원칙에 따라 수행되었다.[ATLAS-INH] ATLAS-INH은 혈우병 A 또는 B 환자 중 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체를 가진 성인 및 소아 남성 환자(≥12세) 57명을 대상으로 실시된 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 이들은 모두 과거에 출혈 시 우회제제(BPAs)를 필요에 따라(episodic, on-demand) 투여받은 병력이 있었다.대상 환자들은 2:1 비율로 무작위 배정되어, 월 1회 80mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=38)과, 돌발 출혈(breakthrough bleeding) 발생 시 BPA를 필요에 따라 투여받은 군(N=19)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg 용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다. 현재 50mg과 20mg이 허가되어 있다.[ATLAS A/B] ATLAS A/B는 FVIII(제8인자) 또는 FIX(제9인자)에 대한 억제항체가 없는 혈우병 A 또는 B 환자를 대상으로 한 다기관, 무작위배정, 공개(open-label) 임상시험이었다. 대상자는 모두 성인 및 소아 남성(≥12세)으로, 과거에 출혈 시 응고인자제제(CFC)를 필요에 따라(on-demand, episodic) 투여받은 병력이 있었다.대상 환자 120명은 2:1 비율로 무작위 배정되어, 월 1회 80 mg 고정 용량의 QFITLIA 피하 주사(SC)를 예방요법(prophylaxis)으로 투여받은 군(N=80)과, 돌발 출혈 발생 시 CFC를 필요에 따라 투여받은 군(N=40)으로 나뉘어 9개월간 치료를 받았다.그러나 QFITLIA 80mg용량은 심각한 혈전성 사건(thrombotic events), 담낭 질환(담낭절제술 필요 포함), 간독성(hepatotoxicity) 위험 증가로 인해 승인되지 않았다.[ATLAS-OLE] 총 227명의 환자가 두 임상시험(ATLAS-INH 및 ATLAS-A/B)과, CFC 또는 BPA 예방요법을 받던 환자를 대상으로 한 교차 임상시험 ATLAS-PPX에서 이월되어 ATLAS-OLE 연구에서 QFITLIA 치료를 받았다. 이 다기관 공개 연장 임상시험은 FVIII 또는 FIX 억제항체 유무와 관계없이, 12세 이상의 성인 및 소아 남성 혈우병 A 또는 B 환자에서 QFITLIA의 장기적인 안전성과 유효성을 평가하였다.대상자는 초기에는 월 1회 80mg QFITLIA 피하 주사를 투여받았으나, 연구가 개정되어 AT-DR(항트롬빈 활성 15& 8211;35% 목표) 용법의 유효성과 안전성을 평가하도록 설계가 변경되었다. 이후 총 213명의 환자가 AT-DR로 전환되었다.AT-DR에서는 시작 용량이 50mg 격월(2개월 간격) 투여였으며, INNOVANCE Antithrombin 분석법을 이용해 측정한 AT 활성 수치에 따라 개별적으로 용량을 조정하였다. 용량은 50mg 월 1회 또는 80mg 월 1회로 증량하거나, 20mg 격월 또는 20mg 월 1회로 감량할 수 있었다.AT 활성 수치가 최저 용량에서도2025-10-23 23:25:17최병철 박사 -
 DOAC 제네릭 점유율, 엘리퀴스 13%, 자렐토 49%[데일리팜=김진구 기자] 직접작용 경구용 항응고제(DOAC, Direct Oral Anti-Coagulant) 시장에서 ‘엘리퀴스(아픽사반)’ 제네릭이 재진입 1년 만에 점유율을 13%로 확대했다. 시장에서 철수하기 직전의 처방실적 점유율과 비교하면 절반 수준에 그친다.반면 ‘자렐토(리바록사반)’ 제네릭은 점유율을 49% 수준까지 끌어올리며 오리지널 추월을 눈앞에 두고 있다. 엘리퀴스 제네릭이 시장에서 철수한 사이 발매된 자렐토 제네릭으로 무게 중심이 옮겨가면서 시장 침투에 어려움을 겪고 있다는 분석이 나온다.엘리퀴스 제네릭 재진입 1년…점유율 13% 수준20일 의약품 시장조사기관 유비스트에 따르면 지난 3분기 엘리퀴스 제네릭은 19억원의 합산 처방실적을 기록했다. 아픽사반 성분 DOAC 치료제 시장에서의 점유율은 13% 수준이다.엘리퀴스 제네릭은 작년 4분기 DOAC 시장에 재진입했다. 당초 엘리퀴스 제네릭은 2019년 6월 발매된 바 있다. 당시 제네릭사들은 특허 소송 1·2심 승소 판결을 근거로 제품을 발매했다.그러나 2021년 4월 대법원이 1·2심을 뒤집고 오리지널사인 BMS의 손을 들어주는 판결을 내리면서 상황이 반전됐다. 제네릭은 즉각 시장에서 철수했다. 이후 작년 9월 엘리퀴스 물질특허 만료 전까지 3년 반 동안 제네릭 공백이 생겼다. 시장에 복귀한 이후로는 침투 속도가 더디다는 분석이다. 엘리퀴스 제네릭은 철수 직전인 2021년 1분기 37억원의 처방실적을 기록한 바 있다. 또한 당시 아픽사반 성분 DOAC 치료제 시장에서의 점유율은 24% 수준이었다.철수 직전과 비교하면 처방실적은 절반 수준이고, 점유율은 10%p 넘는 차이를 보인다. 시장 복귀 이후 점진적으로 처방실적을 늘리고는 있지만, 기대에 미치지 못한다는 평가가 나온다.엘리퀴스 제네릭 자리 비운 사이…자렐토 제네릭 점유율 껑충엘리퀴스 제네릭이 3년 넘게 자리를 비운 사이 자렐토 제네릭으로 무게 중심이 이동했다는 분석이 나온다.자렐토 제네릭은 2021년 2분기 최초 발매됐다. 대법원이 엘리퀴스 특허분쟁에서 원심을 뒤집고 오리지널사의 손을 들어준 시기와 일치한다. 자렐토 물질특허는 그해 10월 만료됐으나, 5개 업체는 시장 선진입을 강행했다.자렐토 물질특허가 만료된 2021년 4분기 이후로 자렐토 제네릭은 본격적으로 처방실적과 점유율을 확대하기 시작했다. 2023년 1분기엔 처방실적 37억원의 처방실적을 기록하며 리바록사반 성분 DOAC 치료제 시장에서의 점유율을 30% 이상으로 확대했다.올해 3분기엔 처방실적이 72억원으로 더욱 증가했다. 리바록사반 시장에서의 점유율은 49% 수준으로 끌어올렸다. 제약업계에선 조만간 오리지널의 점유율을 추월할 것이란 전망이 나온다. 결과적으로 엘리퀴스 제네릭과 자렐토 제네릭의 처지가 뒤바뀐 상황이다. 엘리퀴스 제네릭이 대법원의 역전 판결로 시장에서 철수하자, 제네릭사들은 자렐토 제네릭에 마케팅을 집중하면서 처방실적과 점유율 확대로 이어졌다는 분석이다.뒤바뀐 처지에…엘리퀴스 제네릭 판매 중단·자렐토 제네릭 판매 집중실제 몇몇 업체는 엘리퀴스 물질특허 만료에도 제네릭을 발매하지 않고 있다.유한양행은 대법원 판결 이전 엘리퀴스 제네릭인 ‘유한아픽사반’을 판매하며 누적 25억원 이상의 처방실적을 올렸지만, 공백 발생 이후론 제품을 판매하지 않고 있다. 대신 유한양행은 자렐토 제네릭인 ‘유한리바록사반’의 판매에 집중, 누적 33억원의 처방실적을 냈다.한미약품도 과거 ‘아픽스반’이란 이름의 엘리퀴스 제네릭을 판매했으나, 현재는 이 제품 대신 자렐토 제네릭인 ‘리록스반’의 판매에 집중하고 있다. 리록스반의 올해 3분기 처방실적은 22억원으로, 자렐토 제네릭 가운데 가장 높은 처방실적을 기록했다.종근당과 삼진제약은 엘리퀴스 제네릭과 자렐토 제네릭을 동시에 판매하고 있다. 다만 두 회사의 경우도 자렐토 제네릭의 처방실적이 2배가량 높은 상황이다.종근당의 엘리퀴스 제네릭 ‘리퀴시아’의 올해 3분기 처방액은 6억원이다. 자렐토 제네릭인 ‘리록시아’는 이보다 2배 많은 12억원의 처방실적을 냈다. 삼진제약의 경우 엘리퀴스 제네릭 ‘엘사반’은 7억원, 자렐토 제네릭 ‘리복사반’은 12억원을 각각 기록했다.직접작용 경구용 항응고제 시장 분석2025-10-20 12:00:50김진구
DOAC 제네릭 점유율, 엘리퀴스 13%, 자렐토 49%[데일리팜=김진구 기자] 직접작용 경구용 항응고제(DOAC, Direct Oral Anti-Coagulant) 시장에서 ‘엘리퀴스(아픽사반)’ 제네릭이 재진입 1년 만에 점유율을 13%로 확대했다. 시장에서 철수하기 직전의 처방실적 점유율과 비교하면 절반 수준에 그친다.반면 ‘자렐토(리바록사반)’ 제네릭은 점유율을 49% 수준까지 끌어올리며 오리지널 추월을 눈앞에 두고 있다. 엘리퀴스 제네릭이 시장에서 철수한 사이 발매된 자렐토 제네릭으로 무게 중심이 옮겨가면서 시장 침투에 어려움을 겪고 있다는 분석이 나온다.엘리퀴스 제네릭 재진입 1년…점유율 13% 수준20일 의약품 시장조사기관 유비스트에 따르면 지난 3분기 엘리퀴스 제네릭은 19억원의 합산 처방실적을 기록했다. 아픽사반 성분 DOAC 치료제 시장에서의 점유율은 13% 수준이다.엘리퀴스 제네릭은 작년 4분기 DOAC 시장에 재진입했다. 당초 엘리퀴스 제네릭은 2019년 6월 발매된 바 있다. 당시 제네릭사들은 특허 소송 1·2심 승소 판결을 근거로 제품을 발매했다.그러나 2021년 4월 대법원이 1·2심을 뒤집고 오리지널사인 BMS의 손을 들어주는 판결을 내리면서 상황이 반전됐다. 제네릭은 즉각 시장에서 철수했다. 이후 작년 9월 엘리퀴스 물질특허 만료 전까지 3년 반 동안 제네릭 공백이 생겼다. 시장에 복귀한 이후로는 침투 속도가 더디다는 분석이다. 엘리퀴스 제네릭은 철수 직전인 2021년 1분기 37억원의 처방실적을 기록한 바 있다. 또한 당시 아픽사반 성분 DOAC 치료제 시장에서의 점유율은 24% 수준이었다.철수 직전과 비교하면 처방실적은 절반 수준이고, 점유율은 10%p 넘는 차이를 보인다. 시장 복귀 이후 점진적으로 처방실적을 늘리고는 있지만, 기대에 미치지 못한다는 평가가 나온다.엘리퀴스 제네릭 자리 비운 사이…자렐토 제네릭 점유율 껑충엘리퀴스 제네릭이 3년 넘게 자리를 비운 사이 자렐토 제네릭으로 무게 중심이 이동했다는 분석이 나온다.자렐토 제네릭은 2021년 2분기 최초 발매됐다. 대법원이 엘리퀴스 특허분쟁에서 원심을 뒤집고 오리지널사의 손을 들어준 시기와 일치한다. 자렐토 물질특허는 그해 10월 만료됐으나, 5개 업체는 시장 선진입을 강행했다.자렐토 물질특허가 만료된 2021년 4분기 이후로 자렐토 제네릭은 본격적으로 처방실적과 점유율을 확대하기 시작했다. 2023년 1분기엔 처방실적 37억원의 처방실적을 기록하며 리바록사반 성분 DOAC 치료제 시장에서의 점유율을 30% 이상으로 확대했다.올해 3분기엔 처방실적이 72억원으로 더욱 증가했다. 리바록사반 시장에서의 점유율은 49% 수준으로 끌어올렸다. 제약업계에선 조만간 오리지널의 점유율을 추월할 것이란 전망이 나온다. 결과적으로 엘리퀴스 제네릭과 자렐토 제네릭의 처지가 뒤바뀐 상황이다. 엘리퀴스 제네릭이 대법원의 역전 판결로 시장에서 철수하자, 제네릭사들은 자렐토 제네릭에 마케팅을 집중하면서 처방실적과 점유율 확대로 이어졌다는 분석이다.뒤바뀐 처지에…엘리퀴스 제네릭 판매 중단·자렐토 제네릭 판매 집중실제 몇몇 업체는 엘리퀴스 물질특허 만료에도 제네릭을 발매하지 않고 있다.유한양행은 대법원 판결 이전 엘리퀴스 제네릭인 ‘유한아픽사반’을 판매하며 누적 25억원 이상의 처방실적을 올렸지만, 공백 발생 이후론 제품을 판매하지 않고 있다. 대신 유한양행은 자렐토 제네릭인 ‘유한리바록사반’의 판매에 집중, 누적 33억원의 처방실적을 냈다.한미약품도 과거 ‘아픽스반’이란 이름의 엘리퀴스 제네릭을 판매했으나, 현재는 이 제품 대신 자렐토 제네릭인 ‘리록스반’의 판매에 집중하고 있다. 리록스반의 올해 3분기 처방실적은 22억원으로, 자렐토 제네릭 가운데 가장 높은 처방실적을 기록했다.종근당과 삼진제약은 엘리퀴스 제네릭과 자렐토 제네릭을 동시에 판매하고 있다. 다만 두 회사의 경우도 자렐토 제네릭의 처방실적이 2배가량 높은 상황이다.종근당의 엘리퀴스 제네릭 ‘리퀴시아’의 올해 3분기 처방액은 6억원이다. 자렐토 제네릭인 ‘리록시아’는 이보다 2배 많은 12억원의 처방실적을 냈다. 삼진제약의 경우 엘리퀴스 제네릭 ‘엘사반’은 7억원, 자렐토 제네릭 ‘리복사반’은 12억원을 각각 기록했다.직접작용 경구용 항응고제 시장 분석2025-10-20 12:00:50김진구 -
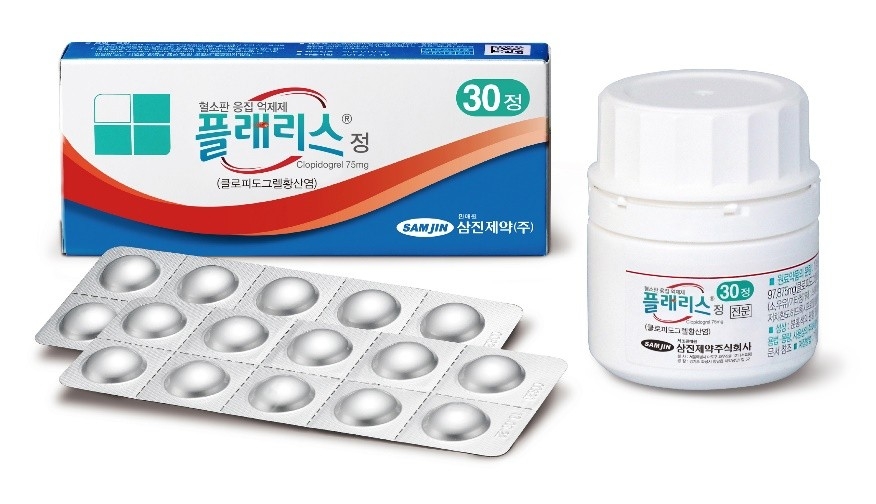 삼진제약, 항혈전제 '플래리스' 필리핀 수출 본격화[데일리팜=이석준 기자] 삼진제약은 항혈전제 ‘플래리스 정’의 필리핀 수출이 본격화되고 있다고 13일 밝혔다.삼진제약 대표 브랜드 ‘플래리스 정’은 ‘클로피도그렐 황산수소염(Clopidogrel Bisulfate)’제제다. 심혈관, 뇌혈관, 말초동맥질환 치료에 ‘단독요법’ 혹은 ‘병용요법’으로 처방된다. ‘Drug Eluting Stent(DES) 시술 환자’에게도 사용 가능하다. 국내 대부분 상급종합병원에 공급되고 있다.삼진제약은 ‘플래리스 정’을 주력 전문의약품으로 키우기 위해 2007년 출시 이후 전사적인 연구개발에 집중했다.2009년 국내 최초로 ‘구상입자형 클로피도그렐 황산수소염’ 원료를 자체 합성하는 데 성공했다(클로피도그렐 황산수소염의 구형입자, 이를 포함하는 약학적 조성물 및 이의 제조방법 : 등록특허 10-1324862). 이후 식약처로부터 제조 및 합성 허가를 획득했다.해당 기술은 난이도가 높다. 이에 이같은 합성기술을 보유한 회사는 세계적으로도 소수에 불과하다. 국내에서 대량의 상업용으로 생산 중에 있는 곳은 삼진제약이 유일하다.삼진제약은 ‘플래리스 정’ 외에도 필리핀 시장에서의 제품 다각화를 위해 새롭게 출시한 항응고제 ‘엘사반 정’, 항암제 ‘페트라 정’ 등의 추가 수출을 논의 중이다. ‘엘사반 정’의 경우 올해 아제르바이잔 수출 허가를 완료하고 수출을 개시하는 등 해외시장 공략에 본격적으로 나서고 있다.김상진 삼진제약 사장은 “항혈전제 ‘플래리스 정’의 필리핀 진출은 삼진제약의 미래 글로벌 도약을 위한 중요한 성과다. 글로벌 네트워크 확장을 통해 해외시장 진출 다각화에 박차를 가할 것”이라고 밝혔다.2025-10-13 16:32:50이석준
삼진제약, 항혈전제 '플래리스' 필리핀 수출 본격화[데일리팜=이석준 기자] 삼진제약은 항혈전제 ‘플래리스 정’의 필리핀 수출이 본격화되고 있다고 13일 밝혔다.삼진제약 대표 브랜드 ‘플래리스 정’은 ‘클로피도그렐 황산수소염(Clopidogrel Bisulfate)’제제다. 심혈관, 뇌혈관, 말초동맥질환 치료에 ‘단독요법’ 혹은 ‘병용요법’으로 처방된다. ‘Drug Eluting Stent(DES) 시술 환자’에게도 사용 가능하다. 국내 대부분 상급종합병원에 공급되고 있다.삼진제약은 ‘플래리스 정’을 주력 전문의약품으로 키우기 위해 2007년 출시 이후 전사적인 연구개발에 집중했다.2009년 국내 최초로 ‘구상입자형 클로피도그렐 황산수소염’ 원료를 자체 합성하는 데 성공했다(클로피도그렐 황산수소염의 구형입자, 이를 포함하는 약학적 조성물 및 이의 제조방법 : 등록특허 10-1324862). 이후 식약처로부터 제조 및 합성 허가를 획득했다.해당 기술은 난이도가 높다. 이에 이같은 합성기술을 보유한 회사는 세계적으로도 소수에 불과하다. 국내에서 대량의 상업용으로 생산 중에 있는 곳은 삼진제약이 유일하다.삼진제약은 ‘플래리스 정’ 외에도 필리핀 시장에서의 제품 다각화를 위해 새롭게 출시한 항응고제 ‘엘사반 정’, 항암제 ‘페트라 정’ 등의 추가 수출을 논의 중이다. ‘엘사반 정’의 경우 올해 아제르바이잔 수출 허가를 완료하고 수출을 개시하는 등 해외시장 공략에 본격적으로 나서고 있다.김상진 삼진제약 사장은 “항혈전제 ‘플래리스 정’의 필리핀 진출은 삼진제약의 미래 글로벌 도약을 위한 중요한 성과다. 글로벌 네트워크 확장을 통해 해외시장 진출 다각화에 박차를 가할 것”이라고 밝혔다.2025-10-13 16:32:50이석준 -
 엘리퀴스 재추격 나선 리퀴시아, 내달 약가 자진인하[데일리팜=정흥준 기자] 한국BMS제약의 항응고제 엘리퀴스를 재추격하고 있는 종근당의 리퀴시아정(아픽사반)이 내달 자진인하로 약가가 내려간다.작년 9월 재출시 후 1년 만에 상한액 조정이다. 엘리퀴스 제네릭들은 특허소송에 패소하며 장기간 공백이 생겼던 매출을 조금씩 회복하고 있다.시장 철수 전 제네릭 경쟁에서 선두를 차지했던 리퀴시아도 바닥을 찍고 매출 반등에 힘을 쏟고 있다. 재출시 후 세브란스병원과 삼성서울병원에서도 처방이 나오고 있다.29일 업계에 따르면 리퀴시아정 2.5mg와 5mg는 570원이었던 상한액이 내달 1일부터 567원으로 인하된다.제약사의 상한금액 자진인하 신청에 따른 가격 조정이다. 나란히 상급종병 진입을 하고 있는 삼진제약 ‘엘사반정’ 상한액 550원과도 차이가 소폭 좁혀진다.지난 2019년 출시했던 리퀴시아정은 특허소송에 패소해 2021년 4월 시장철수를 하기 전까지 승승장구했다. 2020년 원외처방액 26억을 기록한 바 있다.하지만 특허만료까지 3년 5개월의 공백은 컸다. 의약품 시장조사기관 유비스트에 따르면 작년 리퀴시아 시장 복귀 후 4분기 매출은 1억 미만이었다.엘리퀴스 제네릭들은 재출시 후 매출 반등을 시도하고 있다. 작년 4분기 2억원이었던 제네릭 처방 실적은 올해 2분기 11억원으로 증가했다. 높은 제네릭 점유율을 보이는 종근당 리퀴시아도 개원가뿐만 아니라 종병급으로 처방을 늘려가며 매출 상승세를 보이고 있다.특허만료와 제네릭 출시 영향으로 엘리퀴스 매출은 재작년 772억원에서 작년 742억원으로 3.9% 감소했다. 올해 매출 변동폭은 더 커질 것으로 예상된다.종근당은 리퀴시아 외 항응고제 라인업 강화를 예고하고 있다. 다이이찌산쿄의 항응고제 릭시아나(에독사반)의 내년 11월 물질특허 만료에 대비하고 있다.지난 2021년 릭시아나 제네릭 임상 1상을 승인받았고, 특허만료 시점 출시를 목표로 작년 8월 생동성 시험 승인을 받기도 했다.유비스트에 따르면 릭시아나 매출은 작년 1174억원으로 전년 1052억 대비 11.6% 올라 큰 폭의 상승세를 보이고 있다.2025-09-28 16:35:51정흥준
엘리퀴스 재추격 나선 리퀴시아, 내달 약가 자진인하[데일리팜=정흥준 기자] 한국BMS제약의 항응고제 엘리퀴스를 재추격하고 있는 종근당의 리퀴시아정(아픽사반)이 내달 자진인하로 약가가 내려간다.작년 9월 재출시 후 1년 만에 상한액 조정이다. 엘리퀴스 제네릭들은 특허소송에 패소하며 장기간 공백이 생겼던 매출을 조금씩 회복하고 있다.시장 철수 전 제네릭 경쟁에서 선두를 차지했던 리퀴시아도 바닥을 찍고 매출 반등에 힘을 쏟고 있다. 재출시 후 세브란스병원과 삼성서울병원에서도 처방이 나오고 있다.29일 업계에 따르면 리퀴시아정 2.5mg와 5mg는 570원이었던 상한액이 내달 1일부터 567원으로 인하된다.제약사의 상한금액 자진인하 신청에 따른 가격 조정이다. 나란히 상급종병 진입을 하고 있는 삼진제약 ‘엘사반정’ 상한액 550원과도 차이가 소폭 좁혀진다.지난 2019년 출시했던 리퀴시아정은 특허소송에 패소해 2021년 4월 시장철수를 하기 전까지 승승장구했다. 2020년 원외처방액 26억을 기록한 바 있다.하지만 특허만료까지 3년 5개월의 공백은 컸다. 의약품 시장조사기관 유비스트에 따르면 작년 리퀴시아 시장 복귀 후 4분기 매출은 1억 미만이었다.엘리퀴스 제네릭들은 재출시 후 매출 반등을 시도하고 있다. 작년 4분기 2억원이었던 제네릭 처방 실적은 올해 2분기 11억원으로 증가했다. 높은 제네릭 점유율을 보이는 종근당 리퀴시아도 개원가뿐만 아니라 종병급으로 처방을 늘려가며 매출 상승세를 보이고 있다.특허만료와 제네릭 출시 영향으로 엘리퀴스 매출은 재작년 772억원에서 작년 742억원으로 3.9% 감소했다. 올해 매출 변동폭은 더 커질 것으로 예상된다.종근당은 리퀴시아 외 항응고제 라인업 강화를 예고하고 있다. 다이이찌산쿄의 항응고제 릭시아나(에독사반)의 내년 11월 물질특허 만료에 대비하고 있다.지난 2021년 릭시아나 제네릭 임상 1상을 승인받았고, 특허만료 시점 출시를 목표로 작년 8월 생동성 시험 승인을 받기도 했다.유비스트에 따르면 릭시아나 매출은 작년 1174억원으로 전년 1052억 대비 11.6% 올라 큰 폭의 상승세를 보이고 있다.2025-09-28 16:35:51정흥준 -
 첫 RNA 기반 ATTR-CM 치료제 '암부트라'④최초의 RNAi 기반 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 치료제, ‘암부트라(Vutrisiran)’암부트라(Amvuttra®, 성분명: 부트리시란 Vutrisiran, Alnylam Pharmaceuticals)는 소간섭 RNA(small interfering RNA, siRNA) 치료제로, 2022년 6월 미국 FDA에서 유전성 트랜스티레틴 매개 아밀로이드 다발신경병증(hATTR-PN) 치료제로 최초 승인되었다. 이어 2025년 3월에는 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 환자의 심혈관 사망, 입원 및 응급실 방문을 감소시키는 최초의 RNAi 치료제로 추가 승인을 받았다.Alnylam Pharmaceuticals는 siRNA 기술을 기반으로 간세포 내 TTR 합성을 직접 억제하는 신약 개발을 선도해 왔으며, 2018년 파티시란(Patisiran, Onpattro®)이 hATTR-PN 치료제로 최초 승인되었다. 이후 이를 개량한 2세대 제형인 부트리시란(Amvuttra®)이 개발되어 hATTR-PN과 ATTR-CM 모두에 사용 가능하게 되었다.트랜스티레틴 매개 아밀로이드증(ATTR amyloidosis)은 간에서 합성되는 단백질인 트랜스티레틴(TTR)의 구조적 불안정성에 의해 발생한다. 불안정한 TTR 사량체(tetramer)는 쉽게 해리되어 아밀로이드 형성 성향(amyloidogenic)을 띠는 잘못 접힌 단량체(misfolded monomer)로 전환된다. 이 단량체들이 서로 응집해 β-sheet 구조를 형성하면서 아밀로이드 섬유(amyloid fibril)로 축적되고, 신경·심장·소화관 등 다양한 장기에 침착되어 임상 증상을 유발한다.유전성 ATTR 다발신경병증(hATTR-PN)은 TTR 유전자 변이에 의해 발생하며, 주로 말초 및 자율신경에 침착해 신경병증을 유발한다.ATTR 심근병증(ATTR-CM)은 유전성(hATTR-CM) 또는 노화와 관련된 야생형(wild-type ATTR-CM)으로 발생할 수 있으며, 주 침착 부위는 심근이다.부트리시란은 RNAi 치료제로, 3개월 간격으로 1회 피하주사한다. 특정 mRNA를 표적·침묵시켜 야생형과 변이형 모두의 TTR 생성을 차단한다.HELIOS-A 시험은 hATTR-PN 환자를 대상으로 한 무작위 배정, 공개라벨, 다국가 3상 임상으로 진행되었다. 환자들은 3개월마다 피하로 부트리시란을 투여받거나 대조군으로 파티시란 정맥주사를 투여받았다.주요 유효성 평가는 mNIS+7 점수, Norfolk QoL-DN 설문, 보행 검사 등이었으며, 외부 위약군(APOLLO 연구 placebo arm)과의 비교를 통해 신뢰성을 보강하였다. 그 결과, 부트리시란 투여군은 신경학적 기능 악화를 유의하게 억제했으며 삶의 질과 신체 기능이 향상되는 양상을 보였다. 안전성 측면에서도 대부분의 이상반응은 경미하거나 중등도 수준에 그쳐 장기 투여의 내약성이 입증되었다.HELIOS-B 시험은 hATTR-CM뿐 아니라 야생형 ATTR-CM 환자를 포함한 심근병증 환자군을 대상으로 수행된 무작위 배정, 이중맹검, 위약 대조 3상 임상시험이다. ATTR-CM 환자에서 부트리시란의 심혈관 사망 및 입원 위험 감소 효과를 평가하는 데 중점을 두었으며, 1차 종료점으로 심혈관 사망률과 심부전 입원율이 설정되었다.연구 결과, 부트리시란은 ATTR-CM 환자에서 주요 심혈관 사건의 발생을 줄이는 경향을 보였고, 타파미디스(Tafamidis) 치료 경험 여부와 무관하게 일관된 효과를 나타냈다.트랜스티레틴(Transthyretin, TTR)은 무엇인가? 트랜스티레틴(Transthyretin)은 그 명칭이 transport + thyroxin + retinol에서 유래하였으며, 혈액과 뇌척수액에서 갑상선 호르몬과 비타민 A를 운반하는 필수 단백질이다.분자량 약 55kDa의 사량체(tetramer) 구조를 가진 TTR은 주로 간세포에서 합성되어 혈장으로 분비되며, 전체의 90% 이상이 간에서 생산된다. 혈중 TTR은 전체 단백질의 약 0.1& 8211;0.3%를 차지하며, 갑상선 호르몬 및 비타민 A 운반뿐 아니라 단백-에너지 영양 상태를 반영하는 민감한 지표로 활용된다.간 외에도 뇌의 맥락얼기(choroid plexus) 상피세포와 망막색소상피(retinal pigment epithelium, RPE)에서 국소적으로 합성된다. 맥락얼기에서 생성된 TTR은 뇌척수액 내에 풍부하게 존재하며, thyroxine(T4)의 주요 운반체로 기능한다. 혈액-뇌 장벽을 통한 갑상선 호르몬의 직접적 이동이 제한적이라는 점을 고려할 때, TTR은 중추신경계 발달과 대사 항상성 유지에 핵심적 역할을 한다.망막에서 합성된 TTR은 retinol-binding protein(RBP)과 결합하여 레티놀을 안정적으로 운반하고, RBP의 신장 여과를 방지함으로써 시각 회로 유지와 비타민 A 항상성 조절에 기여한다. TTR의 주요 기능은 세 가지로 요약된다. 첫째, 갑상선 호르몬 운반으로 혈중 thyroxine 운반의 약 15%를 담당하며, 알부민과 티록신 결합 글로불린(TBG)과 보완적으로 작용한다. 특히 뇌척수액에서는 TTR이 유일한 주요 운반 단백질이다. 둘째, 비타민 A 대사 및 운반으로 RBP와의 결합을 통해 레티놀을 안정화시키고 체내 항상성을 유지한다. 셋째, 대사적 지표 기능으로 혈중 농도가 영양 상태 및 단백질 합성 능력을 반영하여 임상적으로 영양평가의 바이오마커로 활용된다.한편, TTR은 구조적 불안정성으로 인해 단량체(monomer)로 분리되면 잘못 접힘(misfolding)이 발생하고, 이는 β-sheet 기반의 아밀로이드 섬유를 형성하여 조직에 침착할 수 있다. 이러한 병리적 변화가 트랜스티레틴 아밀로이드증(ATTR amyloidosis)의 기전이며, 연령 증가에 따른 야생형(wild-type) TTR의 불안정성은 심근병증(ATTR-CM)과 연관되고, 특정 유전자 변이에 의한 변이형 TTR은 다발신경병증(ATTR-PN)의 주요 원인으로 작용한다.트랜스티레틴 매개 아밀로이드증(Transthyretin-mediated amyloidosis, ATTR 아밀로이드증)이란 어떤 질환인가? ATTR 아밀로이드증은 트랜스티레틴(TTR)의 구조적 불안정성으로 인해 발생하는 전신성 단백질 침착 질환이다.TTR은 간에서 주로 합성되는 사량체 운반 단백질로, 정상 상태에서는 갑상선 호르몬과 비타민 A를 안정적으로 운반한다. 그러나 유전적 변이나 노화로 인해 단백질의 안정성이 저하되면 사량체(tetramer)가 단량체(monomer)로 해리되고, 이 단량체가 잘못 접힘(misfolding)을 거쳐 β-sheet 구조의 불용성 아밀로이드 섬유(amyloid fibril)로 전환된다. 축적된 아밀로이드 섬유는 다양한 장기에 침착하여 구조적 손상과 기능 저하를 유발한다.ATTR 아밀로이드증은 원인에 따라 변이형(hereditary ATTR, ATTRv)과 야생형(wild-type ATTR, ATTRwt)으로 구분된다. 변이형 ATTR은 TTR 유전자 변이에 의해 사량체의 안정성이 손상되면서 발생하며, 현재까지 120개 이상의 병인성 변이가 보고되어 있다. 임상 양상은 돌연변이 유형에 따라 다르지만, 크게 두 가지 표현형으로 나눌 수 있다.다발신경병증형(ATTR-PN, familial amyloid polyneuropathy, FAP)는 말초 및 자율신경계를 침범하며, 감각·운동 신경병증, 기립성 저혈압, 위장관 운동장애, 체중 감소 등을 동반한다.심근병증형(ATTR-CM, familial amyloid cardiomyopathy, FAC)는 심장 침착을 특징으로 하며, 심실 비후, 이완기 기능장애, 진행성 심부전 및 부정맥을 유발한다. 일부 변이는 신장, 안구, 연부조직을 동시에 침범해 복합적인 임상 양상을 보인다.ATTRv는 주로 성인기에 발병하며, 발현 연령과 진행 속도는 변이 종류와 지역적 특성에 따라 다양하다.야생형 ATTR은 유전자 이상이 없는 정상 TTR이 노화 과정에서 불안정해지며 발생한다. 과거에는 노인성 전신 아밀로이드증(senile systemic amyloidosis)으로 불렸으며, 주로 65세 이상 고령 남성에서 발견된다. 임상적으로는 대부분 심장을 침범하여 심근병증(ATTRwt-CM)의 형태로 발현되고, 진행성 심부전, 심실 비후, 전도장애, 심방세동이 주요 특징이다. 또한 손목터널증후군, 이두근건 파열, 척추관 협착증 등 근골격계 질환이 전구 증상으로 나타날 수 있으나, 비특이적인 증상과 고령 발병 특성으로 인해 과소진단되는 경우가 많다.ATTR 아밀로이드증의 치료는 이러한 발병 기전에 착안해 개발되었으며, 현재는 간에서 TTR 합성을 억제하는 RNA 기반 치료제, 사량체의 해리를 방지하는 안정화제, 그리고 이미 형성된 아밀로이드 침착을 제거하려는 면역학적 접근이 임상에 적용되고 있다.ATTR 아밀로이드증 치료에는 어떤 방법이 있는가? ATTR 아밀로이드증의 치료는 크게 두 축으로 발전해 왔다. 첫 번째는 증상을 조절하고 삶의 질을 유지하기 위한 기본 유지요법이며, 두 번째는 병태생리 자체를 교정하려는 표적 치료 전략이다.기본 유지요법은 질환의 근본적 진행을 막을 수는 없지만 환자의 기능 상태를 유지하고 합병증을 최소화하는 데 필수적이다. 울혈성 심부전 관리에는 루프 이뇨제가 주로 사용되며, 심방세동 및 전도 장애는 항응고제 투여와 함께 페이스메이커나 삽입형 제세동기(ICD)로 조절할 수 있다.신경병증성 통증은 가바펜티노이드, 삼환계 항우울제, SNRIs로 관리하며, 물리·재활 치료가 보조적 역할을 한다. 또한 기립성 저혈압과 같은 자율신경계 증상은 미도드린이나 플루드로코르티손으로 개선할 수 있고, 위장관 증상은 식이 조절 및 약물 치료로 완화할 수 있다.무엇보다 ATTR 아밀로이드증은 다장기 질환의 특성을 지니므로, 심장내과·신경과·소화기내과·재활의학과를 포함한 다학제적 접근이 필수적이다.병태생리 기반의 표적 치료는 TTR 단백질의 안정화, 합성 억제, 축적된 아밀로이드 제거, 그리고 간이식으로 구분된다. TTR 안정화제인 타파미디스(Tafamidis)는 사량체의 안정성을 높여 해체와 잘못 접힘을 억제하며, 임상시험에서 ATTR-CM 환자의 사망률과 입원율을 의미 있게 감소시켰다.RNA 기반 치료제는 TTR 합성을 근본적으로 차단하는 전략으로, siRNA 계열(파티시란, 부트리시란)과 ASO 계열(이노테르센, 에플로네르센)이 대표적이다. 이들 약제는 특히 hATTR-PN 환자에서 신경병증 진행을 억제하였고, 일부는 심근 침범 환자에서도 임상적 유효성이 입증되었다. 이미 형성된 아밀로이드 섬유를 제거하기 위한 항체 기반 치료도 연구되었으나 일부는 임상시험에서 실패하였고, 최근 새로운 접근법이 다시 모색되고 있다.마지막으로, 과거 hATTR 치료의 중요한 축이었던 간이식은 변이 TTR 합성을 근본적으로 차단할 수 있다는 장점이 있었으나, 이미 침착된 아밀로이드는 제거되지 않으며 야생형(wt) TTR에 의한 진행이 지속될 수 있다. 이러한 한계로 인해 현재는 RNA 기반 치료제의 도입과 함께 그 역할이 크게 줄어든 상태이다.TTR 안정화제(TTR stabilizer)는 어떤 약제인가? 최초의 트랜스티레틴 안정화제 타파미디스(Tafamidis)는 빈다켈(Vyndaqel& 9415;) 캡슐 20mg과 빈다맥스(Vyndamax& 9415;) 캡슐 61mg 제형으로 출시되었다. 국내에서는 빈다켈이 ‘트랜스티레틴 가족성 아밀로이드성 다발신경병증(ATTR-PN)’ 치료제로, 빈다맥스가 ‘정상형(wild type) 또는 유전성 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원 감소’ 적응증으로 각각 승인되어 있다.타파미디스는 TTR 단백질 사량체(tetramer)의 티록신 결합 부위에 선택적으로 결합하여 단량체(monomer)로의 해체를 억제한다. 이를 통해 잘못 접힌 단량체의 발생을 차단하고 아밀로이드 섬유 형성을 예방한다.두 번째 트랜스티레틴 안정화제 아코라미디스(Acoramidis, Attruby& 9415;)는 2024년 11월 미국 FDA에서 ‘정상형(wild type) 또는 유전성 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원 감소’ 적응증으로 승인되었다.아코라미디스는 타파미디스 이후 처음 승인된 고강도 TTR 안정화제이자 경구 투여가 가능한 최신 치료제로, ATTR-CM 환자에서 생존률 및 입원율을 유의하게 개선한 점에서 임상적 의의가 크다.그러나 TTR 안정화제는 근본적으로 새로운 TTR 단백질 합성을 억제하지 못하고, 이미 형성된 아밀로이드 침착을 제거하지 못한다는 한계가 있다. 따라서 질환의 진행을 완전히 억제하기 어렵고, 특히 신경병증 환자에서는 RNAi 제제나 안티센스 올리고뉴클레오타이드(ASO) 제제에 비해 상대적으로 제한적인 효과를 보일 수 있다.트랜스티레틴 억제제(Transthyretin silencers)는 어떤 약제인가? TTR 억제제는 트랜스티레틴(TTR) 발현을 감소시키거나 제거함으로써 ATTR-CM의 진행을 늦추는 치료 전략이다. 이 접근법은 혈중 TTR 수치를 효과적으로 낮출 수 있으나, 동시에 TTR이 정상적으로 수행하는 운반 단백질로서의 기능까지 억제하게 된다는 한계를 지닌다.TTR 억제 요법에는 크게 두 가지 계열이 있다. 소간섭 RNA(siRNA)와 안티센스 올리고뉴클레오타이드(ASO) 모두 TTR mRNA에 결합하여 분해를 유도하지만, 세포 내에서 작용하는 기전에는 차이가 있다. siRNA는 표적 mRNA의 sense 가닥과 antisense 가닥으로 이루어진 이중가닥 RNA이다. 세포 내로 유입된 siRNA는 RNA-induced silencing complex(RISC)에 탑재되며, Ago2 엔도뉴클레아제가 sense 가닥을 제거하면 antisense 가닥이 노출되어 표적 mRNA와 상보적으로 결합한다. 이로 인해 해당 mRNA가 분해되어 유전자 발현이 억제된다.이러한 RNA 간섭 기전을 통해 siRNA는 특정 단백질 합성을 효과적으로 차단할 수 있으나, 세포 내 흡수율이 낮고 장기 특이성이 부족하다는 한계가 있다. 따라서 임상 적용을 위해서는 지질 나노입자(lipid nanoparticle, LNP)와 같은 전달체가 필요하다.이 문제를 해결하기 위해 개발된 첫 번째 상용화 약제가 파티시란(Patisiran)이다. 파티시란은 LNP 기반 전달체를 이용해 간세포 표적화를 가능하게 하였으며, 2015년 제2상 임상시험에서 3주 간격 투여 시 혈중 트랜스티레틴(TTR) 농도를 평균 약 80%까지 감소시켰다. 이어진 제3상 APOLLO 시험에서는 좌심실 벽 두께 감소(약 1 mm)와 NT-proBNP 수치 약 55% 감소가 확인되어, 신경병증뿐만 아니라 심혈관계 지표 개선 효과도 입증되었다.후속 약제인 부트리시란(Vutrisiran)은 2세대 siRNA 치료제로, LNP 대신 N-아세틸갈락토사민(GalNAc) 결합체를 적용하여 간세포 선택성을 높이고 약효 지속성을 강화하였다. 투여 용량은 파티시란보다 현저히 적으며, 3개월마다 피하주사 1회로 충분한 효과를 유지할 수 있다. 제1상 임상시험에서는 단일 투여 후 6주 시점에 혈중 TTR 농도가 약 83% 감소하였고, 이 억제 효과는 약 90일간 지속된 뒤 점진적으로 회복되는 양상이 관찰되었다.결론적으로, siRNA 기반 TTR 억제제는 ATTR 아밀로이드증 환자에서 혈중 TTR 농도를 크게 낮추고, 신경학적·심혈관학적 임상 지표를 개선하는 효과를 보인다. 특히 부트리시란은 투여 편의성과 안전성에서 진전을 이루어 ATTR-CM을 포함한 다양한 임상 영역에서 활용 가능성이 확대되고 있다.안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, ASO) ASO는 특정 mRNA에 직접 결합하여 RNase H 매개 절단을 유도하거나 스플라이싱을 조절함으로써 단백질 발현을 억제한다. 트랜스티레틴 아밀로이드증에서는 간세포에서 합성되는 TTR mRNA를 표적으로 하여 혈중 TTR 단백질 농도를 감소시킴으로써 질병의 진행을 억제한다.이러한 접근법은 RNA 간섭 기전을 활용하는 siRNA 기반 약물과 달리, RISC 복합체를 필요로 하지 않고 단일가닥 핵산 서열을 통해 작용한다는 점에서 차별성을 가진다.현재 승인된 대표적인 ASO 약제로는 이노테르센(Inotersen, Tegsedi& 9415;)과 에플로네르센(Eplontersen, Wainua& 9415;)이 있다. 미국 FDA는 이노테르센을 2018년 10월, 에플로네르센을 2023년 12월에 각각 ‘ATTRv-PN’ 치료제로 승인하였지만, 국내에는 아직 소개되지 않았다. 두 약제 모두 간에서 TTR 합성을 억제하여 혈중 TTR 농도를 낮추고, 아밀로이드 침착을 줄여 질환의 진행을 늦추거나 증상을 개선한다.이노테르센은 주 1회 피하주사로 투여되며, 임상시험에서 혈중 TTR 농도를 평균 70~80% 감소시키고 신경병증 점수 및 삶의 질 지표를 개선하는 효과가 확인되었다. 그러나 치료 과정에서 혈소판 감소와 신장 이상이 보고되어 정기적인 모니터링이 필요하다는 한계가 있다.이러한 안전성 문제와 투여 편의성의 제약을 개선하기 위해 개발된 차세대 약제가 에플로네르센이다. 에플로네르센은 N-아세틸갈락토사민(GalNAc) 결합체를 도입하여 간세포 특이적 흡수 효율을 높임으로써 약효를 극대화하는 동시에 부작용을 줄이도록 설계되었다.또한 이노테르센이 주 1회 투여를 필요로 하는 반면, 에플로네르센은 월 1회 피하주사만으로도 충분한 효과를 유지할 수 있어 환자 순응도를 크게 향상시켰다.부티리시란(Vutrisiran)는 어떤 약제인가? 부트리시란은 GalNAc(N-acetylgalactosamine) 플랫폼을 적용한 차세대 소간섭 RNA(siRNA) 치료제로, hATTR-PN과 ATTR-CM 환자 모두에서 사용 가능한 약제이다.이 약제는 기존의 파티시란(Patisiran)과 동일하게 TTR mRNA를 표적하여 단백질 발현을 억제하지만, 약리학적 특성에서 중요한 차별성을 지닌다. 먼저, 인산다이에스터(phosphodiester) 결합을 인산티오에이트(phosphorothioate) 결합으로 치환하여 핵산 분해효소에 대한 저항성을 강화하고 분자의 전신 안정성을 크게 향상시켰다. 이를 통해 보다 적은 용량으로도 지속적이고 강력한 TTR 억제 효과를 유지할 수 있게 되었다.또한 siRNA 분자와 삼분지(triantennary) N-아세틸갈락토사민(GalNAc) 리간드의 공유결합은 간세포 표면의 아실로글리코단백질 수용체(asialoglycoprotein receptor, ASGPR)를 통한 고효율적 내재화를 유도한다. 이로써 간세포 특이적 전달이 극대화되고 전신적 비특이적 분포가 최소화되어 약효의 선택성과 안전성이 동시에 확보된다.GalNAc 플랫폼의 도입은 정맥투여 대신 피하주사(SC) 제형을 가능하게 하였으며, 결과적으로 짧은 시간 내 간단한 투여가 가능해졌다. 부트리시란은 3개월마다 한 번의 피하 투여만으로 효과를 유지할 수 있어 환자의 치료 편의성과 순응도를 획기적으로 개선하였다. 더불어, 투여 전 스테로이드나 항히스타민제와 같은 항염증 전처치가 필요하지 않아 안전성과 내약성 측면에서도 우수한 특성을 보인다.임상적으로, 부트리시란은 HELIOS-A 3상 시험에서 파티시란과 동등한 수준의 신경학적 개선 효과를 보였으며, 주사 경로가 단순화되었음에도 불구하고 안전성 측면에서 우수한 결과를 나타냈다. 이어서 HELIOS-B 연구에서는 ATTR-CM 환자를 대상으로 심혈관 사망률과 입원율을 유의하게 감소시키는 효과가 확인되었고, 이를 근거로 2025년 FDA는 부트리시란의 적응증을 ATTR-CM으로 확장 승인하였다.부티리시란(Vutrisiran)의 약리 기전은? 부티시란은 소간섭 RNA(siRNA) 기술을 기반으로 트랜스티레틴(TTR) 단백질 합성을 근본적으로 억제하는 기전을 가진다. 일반적으로 siRNA는 이중가닥 구조를 이루어 세포 내로 유입된 뒤 RNA-induced silencing complex(RISC)에 탑재된다.이 과정에서 비표적 가닥(sense strand)은 분해되고, 표적을 인식하는 가닥(antisense strand)이 노출되어 상보적인 TTR mRNA와 결합한다. 결합된 mRNA는 Ago2와 같은 효소에 의해 절단·분해되며, 결과적으로 TTR 단백질 합성이 차단된다. 부티시란은 이러한 RNA 간섭(RNAi) 경로를 통해 병태생리의 근본 원인인 TTR 단백질 축적을 억제한다.특히 부티시란은 TTR 합성이 주로 일어나는 간세포로 siRNA를 선택적으로 전달함으로써 약효를 극대화하고 전신적 부작용을 최소화한다. 또한 화학적 변형인 인산티오에이트(phosphorothioate)를 도입하여 체내 핵산 분해효소에 대한 저항성을 강화하고, 안정성을 향상시켰다.이러한 최적화된 설계는 낮은 용량에서도 장기간 TTR 억제를 가능하게 하며, 3개월마다 한 번의 피하 투여만으로도 안정적인 약리 효과를 유지할 수 있게 한다.부트리시란(AMVUTTRA)의 허가임상은 어떠한가? -Polyneuropathy of Hereditary Transthyretin-mediated AmyloidosisAMVUTTRA(부트리시란, vutrisiran)의 유효성은 hATTR-PN 성인 환자를 대상으로 한 무작위 배정, 공개 임상시험(HELIOS-A; NCT03759379)에서 평가되었다.환자들은 3:1의 비율로 무작위 배정되어, 25mg의 AMVUTTRA를 3개월마다 피하 투여받은 군(N=122)과, 대조(reference)군으로서 0.3mg/kg의 파티시란(Patisiran)을 3주마다 정맥 투여받은 군(N=42)에 배정되었다. AMVUTTRA 투여군 환자의 97%, 파티시란 투여군 환자의 93%가 최소 9개월 동안 배정된 치료를 완료하였다.유효성 평가는 hATTR 아밀로이드증에 의한 다발신경병증(PN)을 가진 성인 환자군으로 구성된 외부 위약 대조군과 HELIOS-A 시험의 AMVUTTRA 투여군을 비교하는 방식으로 이루어졌다.주요 유효성 평가 변수는 기저치 대비 9개월 시점의 수정된 신경병증 장애 점수+7(modified Neuropathy Impairment Score +7, mNIS+7)의 변화였다. mNIS+7은 객관적인 신경병증 평가 도구로, 기본 NIS와 Modified +7 복합 점수로 구성된다.본 시험에서 사용된 mNIS+7 버전은, NIS가 뇌신경 기능, 근력, 반사 기능의 장애를 객관적으로 측정하고, +7 항목이 기립성 혈압(postural blood pressure), 정량적 감각 검사(quantitative sensory testing), 말초신경 전기생리학(peripheral nerve electrophysiology)을 평가하도록 설계되었다. mNIS+7은 총 0~304점 범위를 가지며, 점수가 높을수록 질환의 중증도가 크다는 것을 의미한다.mNIS+7 효과의 임상적 유의성은 기저치 대비 9개월 시점의 Norfolk 삶의 질-당뇨병성 신경병증(Norfolk Quality of Life-Diabetic Neuropathy, QoL-DN)총점 변화를 통해 추가적으로 평가되었다.Norfolk QoL-DN 척도는 환자 보고 기반 평가(patient-reported outcome)로서, 신경병증의 주관적 경험을 평가하며, 대섬유 신경병증/신체 기능(physical functioning/large fiber neuropathy), 일상생활 수행능력(activities of daily living), 증상(symptoms), 소섬유 신경병증(small fiber neuropathy), 자율신경병증(autonomic neuropathy) 영역을 포함한다. Norfolk QoL-DN의 총점 범위는 -4~136점이며, 점수가 높을수록 삶의 질 저하와 신경병증의 심각성이 큼을 의미한다.추가 평가 변수로는 10미터 보행 검사(10-meter walk test, 10MWT)를 통한 보행 속도와, 수정 체질량지수(modified body mass index, mBMI)가 포함되었다.HELIOS-A 시험에서 AMVUTTRA 치료는 위약군과 비교했을 때, 9개월 시점의 mNIS+7, Norfolk QoL-DN 총점, 10MWT에서 통계적으로 유의한 개선을 보였다(p2025-09-19 06:01:02최병철 박사
첫 RNA 기반 ATTR-CM 치료제 '암부트라'④최초의 RNAi 기반 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 치료제, ‘암부트라(Vutrisiran)’암부트라(Amvuttra®, 성분명: 부트리시란 Vutrisiran, Alnylam Pharmaceuticals)는 소간섭 RNA(small interfering RNA, siRNA) 치료제로, 2022년 6월 미국 FDA에서 유전성 트랜스티레틴 매개 아밀로이드 다발신경병증(hATTR-PN) 치료제로 최초 승인되었다. 이어 2025년 3월에는 트랜스티레틴 아밀로이드 심근병증(ATTR-CM) 환자의 심혈관 사망, 입원 및 응급실 방문을 감소시키는 최초의 RNAi 치료제로 추가 승인을 받았다.Alnylam Pharmaceuticals는 siRNA 기술을 기반으로 간세포 내 TTR 합성을 직접 억제하는 신약 개발을 선도해 왔으며, 2018년 파티시란(Patisiran, Onpattro®)이 hATTR-PN 치료제로 최초 승인되었다. 이후 이를 개량한 2세대 제형인 부트리시란(Amvuttra®)이 개발되어 hATTR-PN과 ATTR-CM 모두에 사용 가능하게 되었다.트랜스티레틴 매개 아밀로이드증(ATTR amyloidosis)은 간에서 합성되는 단백질인 트랜스티레틴(TTR)의 구조적 불안정성에 의해 발생한다. 불안정한 TTR 사량체(tetramer)는 쉽게 해리되어 아밀로이드 형성 성향(amyloidogenic)을 띠는 잘못 접힌 단량체(misfolded monomer)로 전환된다. 이 단량체들이 서로 응집해 β-sheet 구조를 형성하면서 아밀로이드 섬유(amyloid fibril)로 축적되고, 신경·심장·소화관 등 다양한 장기에 침착되어 임상 증상을 유발한다.유전성 ATTR 다발신경병증(hATTR-PN)은 TTR 유전자 변이에 의해 발생하며, 주로 말초 및 자율신경에 침착해 신경병증을 유발한다.ATTR 심근병증(ATTR-CM)은 유전성(hATTR-CM) 또는 노화와 관련된 야생형(wild-type ATTR-CM)으로 발생할 수 있으며, 주 침착 부위는 심근이다.부트리시란은 RNAi 치료제로, 3개월 간격으로 1회 피하주사한다. 특정 mRNA를 표적·침묵시켜 야생형과 변이형 모두의 TTR 생성을 차단한다.HELIOS-A 시험은 hATTR-PN 환자를 대상으로 한 무작위 배정, 공개라벨, 다국가 3상 임상으로 진행되었다. 환자들은 3개월마다 피하로 부트리시란을 투여받거나 대조군으로 파티시란 정맥주사를 투여받았다.주요 유효성 평가는 mNIS+7 점수, Norfolk QoL-DN 설문, 보행 검사 등이었으며, 외부 위약군(APOLLO 연구 placebo arm)과의 비교를 통해 신뢰성을 보강하였다. 그 결과, 부트리시란 투여군은 신경학적 기능 악화를 유의하게 억제했으며 삶의 질과 신체 기능이 향상되는 양상을 보였다. 안전성 측면에서도 대부분의 이상반응은 경미하거나 중등도 수준에 그쳐 장기 투여의 내약성이 입증되었다.HELIOS-B 시험은 hATTR-CM뿐 아니라 야생형 ATTR-CM 환자를 포함한 심근병증 환자군을 대상으로 수행된 무작위 배정, 이중맹검, 위약 대조 3상 임상시험이다. ATTR-CM 환자에서 부트리시란의 심혈관 사망 및 입원 위험 감소 효과를 평가하는 데 중점을 두었으며, 1차 종료점으로 심혈관 사망률과 심부전 입원율이 설정되었다.연구 결과, 부트리시란은 ATTR-CM 환자에서 주요 심혈관 사건의 발생을 줄이는 경향을 보였고, 타파미디스(Tafamidis) 치료 경험 여부와 무관하게 일관된 효과를 나타냈다.트랜스티레틴(Transthyretin, TTR)은 무엇인가? 트랜스티레틴(Transthyretin)은 그 명칭이 transport + thyroxin + retinol에서 유래하였으며, 혈액과 뇌척수액에서 갑상선 호르몬과 비타민 A를 운반하는 필수 단백질이다.분자량 약 55kDa의 사량체(tetramer) 구조를 가진 TTR은 주로 간세포에서 합성되어 혈장으로 분비되며, 전체의 90% 이상이 간에서 생산된다. 혈중 TTR은 전체 단백질의 약 0.1& 8211;0.3%를 차지하며, 갑상선 호르몬 및 비타민 A 운반뿐 아니라 단백-에너지 영양 상태를 반영하는 민감한 지표로 활용된다.간 외에도 뇌의 맥락얼기(choroid plexus) 상피세포와 망막색소상피(retinal pigment epithelium, RPE)에서 국소적으로 합성된다. 맥락얼기에서 생성된 TTR은 뇌척수액 내에 풍부하게 존재하며, thyroxine(T4)의 주요 운반체로 기능한다. 혈액-뇌 장벽을 통한 갑상선 호르몬의 직접적 이동이 제한적이라는 점을 고려할 때, TTR은 중추신경계 발달과 대사 항상성 유지에 핵심적 역할을 한다.망막에서 합성된 TTR은 retinol-binding protein(RBP)과 결합하여 레티놀을 안정적으로 운반하고, RBP의 신장 여과를 방지함으로써 시각 회로 유지와 비타민 A 항상성 조절에 기여한다. TTR의 주요 기능은 세 가지로 요약된다. 첫째, 갑상선 호르몬 운반으로 혈중 thyroxine 운반의 약 15%를 담당하며, 알부민과 티록신 결합 글로불린(TBG)과 보완적으로 작용한다. 특히 뇌척수액에서는 TTR이 유일한 주요 운반 단백질이다. 둘째, 비타민 A 대사 및 운반으로 RBP와의 결합을 통해 레티놀을 안정화시키고 체내 항상성을 유지한다. 셋째, 대사적 지표 기능으로 혈중 농도가 영양 상태 및 단백질 합성 능력을 반영하여 임상적으로 영양평가의 바이오마커로 활용된다.한편, TTR은 구조적 불안정성으로 인해 단량체(monomer)로 분리되면 잘못 접힘(misfolding)이 발생하고, 이는 β-sheet 기반의 아밀로이드 섬유를 형성하여 조직에 침착할 수 있다. 이러한 병리적 변화가 트랜스티레틴 아밀로이드증(ATTR amyloidosis)의 기전이며, 연령 증가에 따른 야생형(wild-type) TTR의 불안정성은 심근병증(ATTR-CM)과 연관되고, 특정 유전자 변이에 의한 변이형 TTR은 다발신경병증(ATTR-PN)의 주요 원인으로 작용한다.트랜스티레틴 매개 아밀로이드증(Transthyretin-mediated amyloidosis, ATTR 아밀로이드증)이란 어떤 질환인가? ATTR 아밀로이드증은 트랜스티레틴(TTR)의 구조적 불안정성으로 인해 발생하는 전신성 단백질 침착 질환이다.TTR은 간에서 주로 합성되는 사량체 운반 단백질로, 정상 상태에서는 갑상선 호르몬과 비타민 A를 안정적으로 운반한다. 그러나 유전적 변이나 노화로 인해 단백질의 안정성이 저하되면 사량체(tetramer)가 단량체(monomer)로 해리되고, 이 단량체가 잘못 접힘(misfolding)을 거쳐 β-sheet 구조의 불용성 아밀로이드 섬유(amyloid fibril)로 전환된다. 축적된 아밀로이드 섬유는 다양한 장기에 침착하여 구조적 손상과 기능 저하를 유발한다.ATTR 아밀로이드증은 원인에 따라 변이형(hereditary ATTR, ATTRv)과 야생형(wild-type ATTR, ATTRwt)으로 구분된다. 변이형 ATTR은 TTR 유전자 변이에 의해 사량체의 안정성이 손상되면서 발생하며, 현재까지 120개 이상의 병인성 변이가 보고되어 있다. 임상 양상은 돌연변이 유형에 따라 다르지만, 크게 두 가지 표현형으로 나눌 수 있다.다발신경병증형(ATTR-PN, familial amyloid polyneuropathy, FAP)는 말초 및 자율신경계를 침범하며, 감각·운동 신경병증, 기립성 저혈압, 위장관 운동장애, 체중 감소 등을 동반한다.심근병증형(ATTR-CM, familial amyloid cardiomyopathy, FAC)는 심장 침착을 특징으로 하며, 심실 비후, 이완기 기능장애, 진행성 심부전 및 부정맥을 유발한다. 일부 변이는 신장, 안구, 연부조직을 동시에 침범해 복합적인 임상 양상을 보인다.ATTRv는 주로 성인기에 발병하며, 발현 연령과 진행 속도는 변이 종류와 지역적 특성에 따라 다양하다.야생형 ATTR은 유전자 이상이 없는 정상 TTR이 노화 과정에서 불안정해지며 발생한다. 과거에는 노인성 전신 아밀로이드증(senile systemic amyloidosis)으로 불렸으며, 주로 65세 이상 고령 남성에서 발견된다. 임상적으로는 대부분 심장을 침범하여 심근병증(ATTRwt-CM)의 형태로 발현되고, 진행성 심부전, 심실 비후, 전도장애, 심방세동이 주요 특징이다. 또한 손목터널증후군, 이두근건 파열, 척추관 협착증 등 근골격계 질환이 전구 증상으로 나타날 수 있으나, 비특이적인 증상과 고령 발병 특성으로 인해 과소진단되는 경우가 많다.ATTR 아밀로이드증의 치료는 이러한 발병 기전에 착안해 개발되었으며, 현재는 간에서 TTR 합성을 억제하는 RNA 기반 치료제, 사량체의 해리를 방지하는 안정화제, 그리고 이미 형성된 아밀로이드 침착을 제거하려는 면역학적 접근이 임상에 적용되고 있다.ATTR 아밀로이드증 치료에는 어떤 방법이 있는가? ATTR 아밀로이드증의 치료는 크게 두 축으로 발전해 왔다. 첫 번째는 증상을 조절하고 삶의 질을 유지하기 위한 기본 유지요법이며, 두 번째는 병태생리 자체를 교정하려는 표적 치료 전략이다.기본 유지요법은 질환의 근본적 진행을 막을 수는 없지만 환자의 기능 상태를 유지하고 합병증을 최소화하는 데 필수적이다. 울혈성 심부전 관리에는 루프 이뇨제가 주로 사용되며, 심방세동 및 전도 장애는 항응고제 투여와 함께 페이스메이커나 삽입형 제세동기(ICD)로 조절할 수 있다.신경병증성 통증은 가바펜티노이드, 삼환계 항우울제, SNRIs로 관리하며, 물리·재활 치료가 보조적 역할을 한다. 또한 기립성 저혈압과 같은 자율신경계 증상은 미도드린이나 플루드로코르티손으로 개선할 수 있고, 위장관 증상은 식이 조절 및 약물 치료로 완화할 수 있다.무엇보다 ATTR 아밀로이드증은 다장기 질환의 특성을 지니므로, 심장내과·신경과·소화기내과·재활의학과를 포함한 다학제적 접근이 필수적이다.병태생리 기반의 표적 치료는 TTR 단백질의 안정화, 합성 억제, 축적된 아밀로이드 제거, 그리고 간이식으로 구분된다. TTR 안정화제인 타파미디스(Tafamidis)는 사량체의 안정성을 높여 해체와 잘못 접힘을 억제하며, 임상시험에서 ATTR-CM 환자의 사망률과 입원율을 의미 있게 감소시켰다.RNA 기반 치료제는 TTR 합성을 근본적으로 차단하는 전략으로, siRNA 계열(파티시란, 부트리시란)과 ASO 계열(이노테르센, 에플로네르센)이 대표적이다. 이들 약제는 특히 hATTR-PN 환자에서 신경병증 진행을 억제하였고, 일부는 심근 침범 환자에서도 임상적 유효성이 입증되었다. 이미 형성된 아밀로이드 섬유를 제거하기 위한 항체 기반 치료도 연구되었으나 일부는 임상시험에서 실패하였고, 최근 새로운 접근법이 다시 모색되고 있다.마지막으로, 과거 hATTR 치료의 중요한 축이었던 간이식은 변이 TTR 합성을 근본적으로 차단할 수 있다는 장점이 있었으나, 이미 침착된 아밀로이드는 제거되지 않으며 야생형(wt) TTR에 의한 진행이 지속될 수 있다. 이러한 한계로 인해 현재는 RNA 기반 치료제의 도입과 함께 그 역할이 크게 줄어든 상태이다.TTR 안정화제(TTR stabilizer)는 어떤 약제인가? 최초의 트랜스티레틴 안정화제 타파미디스(Tafamidis)는 빈다켈(Vyndaqel& 9415;) 캡슐 20mg과 빈다맥스(Vyndamax& 9415;) 캡슐 61mg 제형으로 출시되었다. 국내에서는 빈다켈이 ‘트랜스티레틴 가족성 아밀로이드성 다발신경병증(ATTR-PN)’ 치료제로, 빈다맥스가 ‘정상형(wild type) 또는 유전성 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원 감소’ 적응증으로 각각 승인되어 있다.타파미디스는 TTR 단백질 사량체(tetramer)의 티록신 결합 부위에 선택적으로 결합하여 단량체(monomer)로의 해체를 억제한다. 이를 통해 잘못 접힌 단량체의 발생을 차단하고 아밀로이드 섬유 형성을 예방한다.두 번째 트랜스티레틴 안정화제 아코라미디스(Acoramidis, Attruby& 9415;)는 2024년 11월 미국 FDA에서 ‘정상형(wild type) 또는 유전성 트랜스티레틴 아밀로이드성 심근병증(ATTR-CM) 성인 환자의 심혈관계 사망률 및 심혈관계 관련 입원 감소’ 적응증으로 승인되었다.아코라미디스는 타파미디스 이후 처음 승인된 고강도 TTR 안정화제이자 경구 투여가 가능한 최신 치료제로, ATTR-CM 환자에서 생존률 및 입원율을 유의하게 개선한 점에서 임상적 의의가 크다.그러나 TTR 안정화제는 근본적으로 새로운 TTR 단백질 합성을 억제하지 못하고, 이미 형성된 아밀로이드 침착을 제거하지 못한다는 한계가 있다. 따라서 질환의 진행을 완전히 억제하기 어렵고, 특히 신경병증 환자에서는 RNAi 제제나 안티센스 올리고뉴클레오타이드(ASO) 제제에 비해 상대적으로 제한적인 효과를 보일 수 있다.트랜스티레틴 억제제(Transthyretin silencers)는 어떤 약제인가? TTR 억제제는 트랜스티레틴(TTR) 발현을 감소시키거나 제거함으로써 ATTR-CM의 진행을 늦추는 치료 전략이다. 이 접근법은 혈중 TTR 수치를 효과적으로 낮출 수 있으나, 동시에 TTR이 정상적으로 수행하는 운반 단백질로서의 기능까지 억제하게 된다는 한계를 지닌다.TTR 억제 요법에는 크게 두 가지 계열이 있다. 소간섭 RNA(siRNA)와 안티센스 올리고뉴클레오타이드(ASO) 모두 TTR mRNA에 결합하여 분해를 유도하지만, 세포 내에서 작용하는 기전에는 차이가 있다. siRNA는 표적 mRNA의 sense 가닥과 antisense 가닥으로 이루어진 이중가닥 RNA이다. 세포 내로 유입된 siRNA는 RNA-induced silencing complex(RISC)에 탑재되며, Ago2 엔도뉴클레아제가 sense 가닥을 제거하면 antisense 가닥이 노출되어 표적 mRNA와 상보적으로 결합한다. 이로 인해 해당 mRNA가 분해되어 유전자 발현이 억제된다.이러한 RNA 간섭 기전을 통해 siRNA는 특정 단백질 합성을 효과적으로 차단할 수 있으나, 세포 내 흡수율이 낮고 장기 특이성이 부족하다는 한계가 있다. 따라서 임상 적용을 위해서는 지질 나노입자(lipid nanoparticle, LNP)와 같은 전달체가 필요하다.이 문제를 해결하기 위해 개발된 첫 번째 상용화 약제가 파티시란(Patisiran)이다. 파티시란은 LNP 기반 전달체를 이용해 간세포 표적화를 가능하게 하였으며, 2015년 제2상 임상시험에서 3주 간격 투여 시 혈중 트랜스티레틴(TTR) 농도를 평균 약 80%까지 감소시켰다. 이어진 제3상 APOLLO 시험에서는 좌심실 벽 두께 감소(약 1 mm)와 NT-proBNP 수치 약 55% 감소가 확인되어, 신경병증뿐만 아니라 심혈관계 지표 개선 효과도 입증되었다.후속 약제인 부트리시란(Vutrisiran)은 2세대 siRNA 치료제로, LNP 대신 N-아세틸갈락토사민(GalNAc) 결합체를 적용하여 간세포 선택성을 높이고 약효 지속성을 강화하였다. 투여 용량은 파티시란보다 현저히 적으며, 3개월마다 피하주사 1회로 충분한 효과를 유지할 수 있다. 제1상 임상시험에서는 단일 투여 후 6주 시점에 혈중 TTR 농도가 약 83% 감소하였고, 이 억제 효과는 약 90일간 지속된 뒤 점진적으로 회복되는 양상이 관찰되었다.결론적으로, siRNA 기반 TTR 억제제는 ATTR 아밀로이드증 환자에서 혈중 TTR 농도를 크게 낮추고, 신경학적·심혈관학적 임상 지표를 개선하는 효과를 보인다. 특히 부트리시란은 투여 편의성과 안전성에서 진전을 이루어 ATTR-CM을 포함한 다양한 임상 영역에서 활용 가능성이 확대되고 있다.안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, ASO) ASO는 특정 mRNA에 직접 결합하여 RNase H 매개 절단을 유도하거나 스플라이싱을 조절함으로써 단백질 발현을 억제한다. 트랜스티레틴 아밀로이드증에서는 간세포에서 합성되는 TTR mRNA를 표적으로 하여 혈중 TTR 단백질 농도를 감소시킴으로써 질병의 진행을 억제한다.이러한 접근법은 RNA 간섭 기전을 활용하는 siRNA 기반 약물과 달리, RISC 복합체를 필요로 하지 않고 단일가닥 핵산 서열을 통해 작용한다는 점에서 차별성을 가진다.현재 승인된 대표적인 ASO 약제로는 이노테르센(Inotersen, Tegsedi& 9415;)과 에플로네르센(Eplontersen, Wainua& 9415;)이 있다. 미국 FDA는 이노테르센을 2018년 10월, 에플로네르센을 2023년 12월에 각각 ‘ATTRv-PN’ 치료제로 승인하였지만, 국내에는 아직 소개되지 않았다. 두 약제 모두 간에서 TTR 합성을 억제하여 혈중 TTR 농도를 낮추고, 아밀로이드 침착을 줄여 질환의 진행을 늦추거나 증상을 개선한다.이노테르센은 주 1회 피하주사로 투여되며, 임상시험에서 혈중 TTR 농도를 평균 70~80% 감소시키고 신경병증 점수 및 삶의 질 지표를 개선하는 효과가 확인되었다. 그러나 치료 과정에서 혈소판 감소와 신장 이상이 보고되어 정기적인 모니터링이 필요하다는 한계가 있다.이러한 안전성 문제와 투여 편의성의 제약을 개선하기 위해 개발된 차세대 약제가 에플로네르센이다. 에플로네르센은 N-아세틸갈락토사민(GalNAc) 결합체를 도입하여 간세포 특이적 흡수 효율을 높임으로써 약효를 극대화하는 동시에 부작용을 줄이도록 설계되었다.또한 이노테르센이 주 1회 투여를 필요로 하는 반면, 에플로네르센은 월 1회 피하주사만으로도 충분한 효과를 유지할 수 있어 환자 순응도를 크게 향상시켰다.부티리시란(Vutrisiran)는 어떤 약제인가? 부트리시란은 GalNAc(N-acetylgalactosamine) 플랫폼을 적용한 차세대 소간섭 RNA(siRNA) 치료제로, hATTR-PN과 ATTR-CM 환자 모두에서 사용 가능한 약제이다.이 약제는 기존의 파티시란(Patisiran)과 동일하게 TTR mRNA를 표적하여 단백질 발현을 억제하지만, 약리학적 특성에서 중요한 차별성을 지닌다. 먼저, 인산다이에스터(phosphodiester) 결합을 인산티오에이트(phosphorothioate) 결합으로 치환하여 핵산 분해효소에 대한 저항성을 강화하고 분자의 전신 안정성을 크게 향상시켰다. 이를 통해 보다 적은 용량으로도 지속적이고 강력한 TTR 억제 효과를 유지할 수 있게 되었다.또한 siRNA 분자와 삼분지(triantennary) N-아세틸갈락토사민(GalNAc) 리간드의 공유결합은 간세포 표면의 아실로글리코단백질 수용체(asialoglycoprotein receptor, ASGPR)를 통한 고효율적 내재화를 유도한다. 이로써 간세포 특이적 전달이 극대화되고 전신적 비특이적 분포가 최소화되어 약효의 선택성과 안전성이 동시에 확보된다.GalNAc 플랫폼의 도입은 정맥투여 대신 피하주사(SC) 제형을 가능하게 하였으며, 결과적으로 짧은 시간 내 간단한 투여가 가능해졌다. 부트리시란은 3개월마다 한 번의 피하 투여만으로 효과를 유지할 수 있어 환자의 치료 편의성과 순응도를 획기적으로 개선하였다. 더불어, 투여 전 스테로이드나 항히스타민제와 같은 항염증 전처치가 필요하지 않아 안전성과 내약성 측면에서도 우수한 특성을 보인다.임상적으로, 부트리시란은 HELIOS-A 3상 시험에서 파티시란과 동등한 수준의 신경학적 개선 효과를 보였으며, 주사 경로가 단순화되었음에도 불구하고 안전성 측면에서 우수한 결과를 나타냈다. 이어서 HELIOS-B 연구에서는 ATTR-CM 환자를 대상으로 심혈관 사망률과 입원율을 유의하게 감소시키는 효과가 확인되었고, 이를 근거로 2025년 FDA는 부트리시란의 적응증을 ATTR-CM으로 확장 승인하였다.부티리시란(Vutrisiran)의 약리 기전은? 부티시란은 소간섭 RNA(siRNA) 기술을 기반으로 트랜스티레틴(TTR) 단백질 합성을 근본적으로 억제하는 기전을 가진다. 일반적으로 siRNA는 이중가닥 구조를 이루어 세포 내로 유입된 뒤 RNA-induced silencing complex(RISC)에 탑재된다.이 과정에서 비표적 가닥(sense strand)은 분해되고, 표적을 인식하는 가닥(antisense strand)이 노출되어 상보적인 TTR mRNA와 결합한다. 결합된 mRNA는 Ago2와 같은 효소에 의해 절단·분해되며, 결과적으로 TTR 단백질 합성이 차단된다. 부티시란은 이러한 RNA 간섭(RNAi) 경로를 통해 병태생리의 근본 원인인 TTR 단백질 축적을 억제한다.특히 부티시란은 TTR 합성이 주로 일어나는 간세포로 siRNA를 선택적으로 전달함으로써 약효를 극대화하고 전신적 부작용을 최소화한다. 또한 화학적 변형인 인산티오에이트(phosphorothioate)를 도입하여 체내 핵산 분해효소에 대한 저항성을 강화하고, 안정성을 향상시켰다.이러한 최적화된 설계는 낮은 용량에서도 장기간 TTR 억제를 가능하게 하며, 3개월마다 한 번의 피하 투여만으로도 안정적인 약리 효과를 유지할 수 있게 한다.부트리시란(AMVUTTRA)의 허가임상은 어떠한가? -Polyneuropathy of Hereditary Transthyretin-mediated AmyloidosisAMVUTTRA(부트리시란, vutrisiran)의 유효성은 hATTR-PN 성인 환자를 대상으로 한 무작위 배정, 공개 임상시험(HELIOS-A; NCT03759379)에서 평가되었다.환자들은 3:1의 비율로 무작위 배정되어, 25mg의 AMVUTTRA를 3개월마다 피하 투여받은 군(N=122)과, 대조(reference)군으로서 0.3mg/kg의 파티시란(Patisiran)을 3주마다 정맥 투여받은 군(N=42)에 배정되었다. AMVUTTRA 투여군 환자의 97%, 파티시란 투여군 환자의 93%가 최소 9개월 동안 배정된 치료를 완료하였다.유효성 평가는 hATTR 아밀로이드증에 의한 다발신경병증(PN)을 가진 성인 환자군으로 구성된 외부 위약 대조군과 HELIOS-A 시험의 AMVUTTRA 투여군을 비교하는 방식으로 이루어졌다.주요 유효성 평가 변수는 기저치 대비 9개월 시점의 수정된 신경병증 장애 점수+7(modified Neuropathy Impairment Score +7, mNIS+7)의 변화였다. mNIS+7은 객관적인 신경병증 평가 도구로, 기본 NIS와 Modified +7 복합 점수로 구성된다.본 시험에서 사용된 mNIS+7 버전은, NIS가 뇌신경 기능, 근력, 반사 기능의 장애를 객관적으로 측정하고, +7 항목이 기립성 혈압(postural blood pressure), 정량적 감각 검사(quantitative sensory testing), 말초신경 전기생리학(peripheral nerve electrophysiology)을 평가하도록 설계되었다. mNIS+7은 총 0~304점 범위를 가지며, 점수가 높을수록 질환의 중증도가 크다는 것을 의미한다.mNIS+7 효과의 임상적 유의성은 기저치 대비 9개월 시점의 Norfolk 삶의 질-당뇨병성 신경병증(Norfolk Quality of Life-Diabetic Neuropathy, QoL-DN)총점 변화를 통해 추가적으로 평가되었다.Norfolk QoL-DN 척도는 환자 보고 기반 평가(patient-reported outcome)로서, 신경병증의 주관적 경험을 평가하며, 대섬유 신경병증/신체 기능(physical functioning/large fiber neuropathy), 일상생활 수행능력(activities of daily living), 증상(symptoms), 소섬유 신경병증(small fiber neuropathy), 자율신경병증(autonomic neuropathy) 영역을 포함한다. Norfolk QoL-DN의 총점 범위는 -4~136점이며, 점수가 높을수록 삶의 질 저하와 신경병증의 심각성이 큼을 의미한다.추가 평가 변수로는 10미터 보행 검사(10-meter walk test, 10MWT)를 통한 보행 속도와, 수정 체질량지수(modified body mass index, mBMI)가 포함되었다.HELIOS-A 시험에서 AMVUTTRA 치료는 위약군과 비교했을 때, 9개월 시점의 mNIS+7, Norfolk QoL-DN 총점, 10MWT에서 통계적으로 유의한 개선을 보였다(p2025-09-19 06:01:02최병철 박사 -
 약사회, 다함량 동일 의약품 포장에 함량 표기 협조 요청[데일리팜=김지은 기자] 대한약사회(권영희)가 제약사들을 향해 약사의 조제 실수를 유발하는 의약품 표기 개선을 요구하고 나섰다.약사회 환자안전약물관리본부 지역환자안전센터는 27일 동일 성분이지만 여러 함량을 가진 의약품 관련, 제품명에 함량을 표기해 줄 요청하는 내용의 협조 공문을 97개 제약사에 발송할 예정이라고 밝혔다.지역환자안전센터에 따르면 전국 약국에서 보고되는 환자안전사고를 수집·분석해 유사 사고의 재발 방지와 예방 활동을 수행하는 과정에서 제품명에 함량이 표기되지 않아 오조제 되는 사고가 반복적으로 발생하고 있다.특히 동일 제약사의 동일 성분의 제품이지만 여러 함량을 가진 제품군에서 이 같은 사고가 다수 확인됐다는 것이 센터 측 설명이다.구체적인 예로 ▲항응고제 와파린정(2mg, 5mg) 함량 착오로 인한 오조제로 고용량 복용 후 장출혈 및 쇼크, 저용량 복용 후 뇌경색 발생 사례 ▲고혈압 치료제 아테놀롤정(25mg, 50mg)과 로사르탄정(50mg, 100mg)의 함량 착오로 인한 오조제로 저혈압 위험 ▲혈당강하제인 메트포르민엑스알서방정(500mg, 1,000mg), 글리클라짓서방정(30mg, 60mg)의 함량 착각으로 인한 오조제로 저혈당 위험 발생 등이 보고된 바 있다.권영희 대한약사회장은 “환자안전을 위한 활동은 약사의 핵심 책무”라며 “제품명에 함량을 표기하는 것은 단순하지만 환자나 보건의료 전문가 모두가 쉽게 공감할 수 있는 매우 효과적인 사고 예방 조치”라고 강조했다.이모세 환자안전약물관리본부장은 “약사는 제품명에 함량 표기가 없는 의약품으로 인한 오조제를 막기 위해 별도의 표기·분류 작업을 하는 등의 업무 부담을 겪고 있다”며 “동일성분이면서 여러 함량을 가진 의약품 제품명에 모두 함량이 표기되면 조제 효율뿐만 아니라 환자안전에 큰 도움이 될 것”이라고 말했다.이 본부장은 “이런 조치가 모든 의약품으로 확대 적용돼 제품명 함량 표기가 의약품 안전의 표준으로 정착될 수 있도록 지속적으로 모니터링하고 관련 기관과 협력해 나가겠다”고 했다.한편 대한약사회는 지난 2022년 11월 와파린 제품과 관련 해당 제품을 생산하는 2개 제약회사에 함량을 제품명에 모두 표기하도록 제품명 변경을 요청하는 공문을 발송한 바 있다.그 결과 지난 2023년 4월부터 제품명에 함량이 모두 표기된 와파린 제품이 유통되고 있으며 이는 중대한 환자안전사고 예방에 기여한 대표 사례로 평가되고 있다.2025-08-28 17:09:34김지은
약사회, 다함량 동일 의약품 포장에 함량 표기 협조 요청[데일리팜=김지은 기자] 대한약사회(권영희)가 제약사들을 향해 약사의 조제 실수를 유발하는 의약품 표기 개선을 요구하고 나섰다.약사회 환자안전약물관리본부 지역환자안전센터는 27일 동일 성분이지만 여러 함량을 가진 의약품 관련, 제품명에 함량을 표기해 줄 요청하는 내용의 협조 공문을 97개 제약사에 발송할 예정이라고 밝혔다.지역환자안전센터에 따르면 전국 약국에서 보고되는 환자안전사고를 수집·분석해 유사 사고의 재발 방지와 예방 활동을 수행하는 과정에서 제품명에 함량이 표기되지 않아 오조제 되는 사고가 반복적으로 발생하고 있다.특히 동일 제약사의 동일 성분의 제품이지만 여러 함량을 가진 제품군에서 이 같은 사고가 다수 확인됐다는 것이 센터 측 설명이다.구체적인 예로 ▲항응고제 와파린정(2mg, 5mg) 함량 착오로 인한 오조제로 고용량 복용 후 장출혈 및 쇼크, 저용량 복용 후 뇌경색 발생 사례 ▲고혈압 치료제 아테놀롤정(25mg, 50mg)과 로사르탄정(50mg, 100mg)의 함량 착오로 인한 오조제로 저혈압 위험 ▲혈당강하제인 메트포르민엑스알서방정(500mg, 1,000mg), 글리클라짓서방정(30mg, 60mg)의 함량 착각으로 인한 오조제로 저혈당 위험 발생 등이 보고된 바 있다.권영희 대한약사회장은 “환자안전을 위한 활동은 약사의 핵심 책무”라며 “제품명에 함량을 표기하는 것은 단순하지만 환자나 보건의료 전문가 모두가 쉽게 공감할 수 있는 매우 효과적인 사고 예방 조치”라고 강조했다.이모세 환자안전약물관리본부장은 “약사는 제품명에 함량 표기가 없는 의약품으로 인한 오조제를 막기 위해 별도의 표기·분류 작업을 하는 등의 업무 부담을 겪고 있다”며 “동일성분이면서 여러 함량을 가진 의약품 제품명에 모두 함량이 표기되면 조제 효율뿐만 아니라 환자안전에 큰 도움이 될 것”이라고 말했다.이 본부장은 “이런 조치가 모든 의약품으로 확대 적용돼 제품명 함량 표기가 의약품 안전의 표준으로 정착될 수 있도록 지속적으로 모니터링하고 관련 기관과 협력해 나가겠다”고 했다.한편 대한약사회는 지난 2022년 11월 와파린 제품과 관련 해당 제품을 생산하는 2개 제약회사에 함량을 제품명에 모두 표기하도록 제품명 변경을 요청하는 공문을 발송한 바 있다.그 결과 지난 2023년 4월부터 제품명에 함량이 모두 표기된 와파린 제품이 유통되고 있으며 이는 중대한 환자안전사고 예방에 기여한 대표 사례로 평가되고 있다.2025-08-28 17:09:34김지은 -
 릭시아나 독주, 자렐토·엘리퀴스↓…DOAC 시장 희비(왼쪽 위부터 시계방향으로)릭시아나, 엘리퀴스, 프라닥사, 자렐토 제품사진. [데일리팜=김진구 기자] 직접작용 경구용 항응고제(DOAC, Direct Oral Anti-Coagulant) 시장에서 오리지널 제품 간 희비가 교차했다.릭시아나(에독사반)는 전년대비 처방실적을 8% 늘리며 독주체제를 굳혔다. DOAC 시장에서의 점유율은 49%로 더욱 확대됐다. 내년 물질특허 만료 전까지 이러한 독주체제가 유지될 것이란 전망이 나온다.엘리퀴스(아픽사반)와 자렐토(리바록사반)는 주춤한 모습이다. 릭시아나는 작년 4분기 제네릭 발매에 따른 약가인하로 처방실적이 30% 줄었다. 이에 앞서 특허가 만료된 자렐토도 최근 몇 년간 하락세가 완연한 모습이다.상반기 DOAC 처방실적 1224억원…릭시아나 독주체제 강화28일 의약품 시장조사기관 유비스트에 따르면 지난 상반기 국내 DOAC 시장 처방규모는 1224억원이다. 작년 상반기 1271억원 대비 4% 감소했다.DOAC은 혈액 응고인자에 직접 작용하는 기전으로 혈전을 예방하는 항응고제다. 비타민K의 대사를 억제하는 기전의 와파린을 대체하며 처방현장에서 쓰임새가 확대되고 있다. 국내에는 2009년 자렐토에 이어 2011년 프라닥사·엘리퀴스, 2015년 릭시아나가 차례로 허가됐다.제품이 처음 등장했을 땐 새로운 경구용 항응고제라는 의미의 NOAC(New Oral Anti-Coagulant)이란 용어로 통용됐으나, 첫 허가 후 10년여가 지난 최근엔 응고인자에 직접 작용한다는 의미의 DOAC(Direct Oral Anti-Coagulant)이란 용어로 대체되는 중이다. 릭시아나가 독주 체제를 더욱 강화했다. 릭시아나의 상반기 처방실적은 599억원으로, 작년 상반기 557억원 대비 8% 증가했다.릭시아나는 DOAC 가운데 가장 늦게 발매됐으나, 빠르게 처방실적을 늘리며 2019년 이후론 시장 선두를 유지하고 있다. 매년 10% 내외의 성장을 반복하며 2019년 604억원이던 처방실적이 지난해 1175억원으로 5년 새 2배 가까이 늘었다.전체 DOAC 시장에서의 점유율은 올해 상반기 기준 49% 수준까지 확대됐다. 연 2600억원 규모의 DOAC 시장에서 절반 가까이를 차지하고 있는 셈이다.제약업계에선 내년 말까지 이러한 독주 체제가 유지될 것이란 전망이 나온다. 릭시아나의 물질특허는 내년 11월 만료된다. 국내 제약사 20여곳이 이 시점에 맞춰 제네릭을 발매할 것으로 예상된다.현재 릭시아나 제네릭을 허가받은 업체는 넥스팜코리아·동아에스티·삼성제약·신일제약·신풍제약·안국약품·일동제약·제뉴원사이언스·한국유니온제약·한국프라임제약·한국휴텍스제약·한독 등 13곳이다.여기에 삼진제약·에이치엘비제약·테라젠이텍스·동광제약은 릭시아나 제제특허에 소극적 권리범위확인 심판을 청구했다. 앞선 업체들과 마찬가지로 1심에서 승리할 경우 물질특허 만료 시점에 맞춰 제네릭 발매가 가능해진다. 또 알리코제약·고려제약은 릭시아나 제네릭 발매를 위해 생동성시험을 승인받았다.엘리퀴스·자렐토 하락세 완연…제네릭 발매·약가인하 영향반면 엘리퀴스와 자렐토는 하락세가 완연하다. 두 제품 모두 특허 만료와 이에 따른 제네릭 진입의 영향으로 분석된다.엘리퀴스는 작년 상반기 388억원에서 올해 상반기 271억원으로 30% 감소했다. 제네릭 진입에 따른 약가인하의 영향이다. 엘리퀴스는 작년 9월 약가가 30% 인하됐다. 엘리퀴스 제네릭은 작년 4분기 DOAC 시장에 재진입했다. 당초 엘리퀴스 제네릭은 지난 2019년 6월 발매된 바 있다. 당시 제네릭사들은 특허 소송 1·2심 승소 판결을 근거로 제품을 발매했다.그러나 2021년 4월 대법원이 1·2심을 뒤집는 판결을 내리면서 상황이 반전됐다. 제네릭은 즉시 시장에서 철수했다. 이어 작년 9월 엘리퀴스 물질특허가 만료되자, 제네릭들은 3년 반 만에 복귀했다.엘리퀴스 제네릭은 시장 복귀 후 작년 4분기 2억원, 올해 1분기 6억원, 2분기 11억원 등으로 처방실적을 확대하는 중이다. 제품별로는 시장 철수 이전의 모습을 재현하는 양상이다. 당시 제네릭 중 처방실적 1·2위 제품인 종근당 ‘리퀴시아’와 삼진제약 ‘엘사반’은 재진입 이후에도 나란히 1·2위를 기록하고 있다.자렐토의 경우 올해 상반기 153억원을 기록하며, 작년 상반기 처방실적을 유지했다. 다만 2021년 이후로 하락세가 완연하다. 2021년 상반기 289억원 대비 4년 새 절반 수준으로 감소했다.제네릭 침투의 영향이다. 자렐토 제네릭은 2021년 2분기 첫 등장했다. 자렐토 물질특허 만료 시점에 맞춰 40여개 제품이 동시다발로 발매됐다. 이어 꾸준히 처방실적을 확대했다. 2022년 상반기 40억원, 2023년 상반기 80억원, 2024년 상반기 124억원, 올해 상반기 137억원 등으로 증가했다. 제품별로는 한미약품 리록스반 43억원, 삼진제약 리복사반 25억원, 종근당 리록시아 22억원 등을 기록했다. 나머지 제품은 상반기 처방실적이 10억원 미만이다. 오리지널이 주춤한 사이 제네릭이 영향력을 확대하면서, 리바록사반 성분 DOAC 시장에서의 제네릭 점유율은 올해 상반기 기준 47% 수준으로 확대됐다.또 다른 오리지널 제품인 프라닥사(다비가트란)는 DOAC 시장에서 좀처럼 힘을 내지 못하는 모습이다. 상반기 프라닥사의 처방실적은 47억원으로 전년동기 48억원 대비 소폭 감소했다.경구용 항응고제 시장 분석2025-07-30 06:18:46김진구
릭시아나 독주, 자렐토·엘리퀴스↓…DOAC 시장 희비(왼쪽 위부터 시계방향으로)릭시아나, 엘리퀴스, 프라닥사, 자렐토 제품사진. [데일리팜=김진구 기자] 직접작용 경구용 항응고제(DOAC, Direct Oral Anti-Coagulant) 시장에서 오리지널 제품 간 희비가 교차했다.릭시아나(에독사반)는 전년대비 처방실적을 8% 늘리며 독주체제를 굳혔다. DOAC 시장에서의 점유율은 49%로 더욱 확대됐다. 내년 물질특허 만료 전까지 이러한 독주체제가 유지될 것이란 전망이 나온다.엘리퀴스(아픽사반)와 자렐토(리바록사반)는 주춤한 모습이다. 릭시아나는 작년 4분기 제네릭 발매에 따른 약가인하로 처방실적이 30% 줄었다. 이에 앞서 특허가 만료된 자렐토도 최근 몇 년간 하락세가 완연한 모습이다.상반기 DOAC 처방실적 1224억원…릭시아나 독주체제 강화28일 의약품 시장조사기관 유비스트에 따르면 지난 상반기 국내 DOAC 시장 처방규모는 1224억원이다. 작년 상반기 1271억원 대비 4% 감소했다.DOAC은 혈액 응고인자에 직접 작용하는 기전으로 혈전을 예방하는 항응고제다. 비타민K의 대사를 억제하는 기전의 와파린을 대체하며 처방현장에서 쓰임새가 확대되고 있다. 국내에는 2009년 자렐토에 이어 2011년 프라닥사·엘리퀴스, 2015년 릭시아나가 차례로 허가됐다.제품이 처음 등장했을 땐 새로운 경구용 항응고제라는 의미의 NOAC(New Oral Anti-Coagulant)이란 용어로 통용됐으나, 첫 허가 후 10년여가 지난 최근엔 응고인자에 직접 작용한다는 의미의 DOAC(Direct Oral Anti-Coagulant)이란 용어로 대체되는 중이다. 릭시아나가 독주 체제를 더욱 강화했다. 릭시아나의 상반기 처방실적은 599억원으로, 작년 상반기 557억원 대비 8% 증가했다.릭시아나는 DOAC 가운데 가장 늦게 발매됐으나, 빠르게 처방실적을 늘리며 2019년 이후론 시장 선두를 유지하고 있다. 매년 10% 내외의 성장을 반복하며 2019년 604억원이던 처방실적이 지난해 1175억원으로 5년 새 2배 가까이 늘었다.전체 DOAC 시장에서의 점유율은 올해 상반기 기준 49% 수준까지 확대됐다. 연 2600억원 규모의 DOAC 시장에서 절반 가까이를 차지하고 있는 셈이다.제약업계에선 내년 말까지 이러한 독주 체제가 유지될 것이란 전망이 나온다. 릭시아나의 물질특허는 내년 11월 만료된다. 국내 제약사 20여곳이 이 시점에 맞춰 제네릭을 발매할 것으로 예상된다.현재 릭시아나 제네릭을 허가받은 업체는 넥스팜코리아·동아에스티·삼성제약·신일제약·신풍제약·안국약품·일동제약·제뉴원사이언스·한국유니온제약·한국프라임제약·한국휴텍스제약·한독 등 13곳이다.여기에 삼진제약·에이치엘비제약·테라젠이텍스·동광제약은 릭시아나 제제특허에 소극적 권리범위확인 심판을 청구했다. 앞선 업체들과 마찬가지로 1심에서 승리할 경우 물질특허 만료 시점에 맞춰 제네릭 발매가 가능해진다. 또 알리코제약·고려제약은 릭시아나 제네릭 발매를 위해 생동성시험을 승인받았다.엘리퀴스·자렐토 하락세 완연…제네릭 발매·약가인하 영향반면 엘리퀴스와 자렐토는 하락세가 완연하다. 두 제품 모두 특허 만료와 이에 따른 제네릭 진입의 영향으로 분석된다.엘리퀴스는 작년 상반기 388억원에서 올해 상반기 271억원으로 30% 감소했다. 제네릭 진입에 따른 약가인하의 영향이다. 엘리퀴스는 작년 9월 약가가 30% 인하됐다. 엘리퀴스 제네릭은 작년 4분기 DOAC 시장에 재진입했다. 당초 엘리퀴스 제네릭은 지난 2019년 6월 발매된 바 있다. 당시 제네릭사들은 특허 소송 1·2심 승소 판결을 근거로 제품을 발매했다.그러나 2021년 4월 대법원이 1·2심을 뒤집는 판결을 내리면서 상황이 반전됐다. 제네릭은 즉시 시장에서 철수했다. 이어 작년 9월 엘리퀴스 물질특허가 만료되자, 제네릭들은 3년 반 만에 복귀했다.엘리퀴스 제네릭은 시장 복귀 후 작년 4분기 2억원, 올해 1분기 6억원, 2분기 11억원 등으로 처방실적을 확대하는 중이다. 제품별로는 시장 철수 이전의 모습을 재현하는 양상이다. 당시 제네릭 중 처방실적 1·2위 제품인 종근당 ‘리퀴시아’와 삼진제약 ‘엘사반’은 재진입 이후에도 나란히 1·2위를 기록하고 있다.자렐토의 경우 올해 상반기 153억원을 기록하며, 작년 상반기 처방실적을 유지했다. 다만 2021년 이후로 하락세가 완연하다. 2021년 상반기 289억원 대비 4년 새 절반 수준으로 감소했다.제네릭 침투의 영향이다. 자렐토 제네릭은 2021년 2분기 첫 등장했다. 자렐토 물질특허 만료 시점에 맞춰 40여개 제품이 동시다발로 발매됐다. 이어 꾸준히 처방실적을 확대했다. 2022년 상반기 40억원, 2023년 상반기 80억원, 2024년 상반기 124억원, 올해 상반기 137억원 등으로 증가했다. 제품별로는 한미약품 리록스반 43억원, 삼진제약 리복사반 25억원, 종근당 리록시아 22억원 등을 기록했다. 나머지 제품은 상반기 처방실적이 10억원 미만이다. 오리지널이 주춤한 사이 제네릭이 영향력을 확대하면서, 리바록사반 성분 DOAC 시장에서의 제네릭 점유율은 올해 상반기 기준 47% 수준으로 확대됐다.또 다른 오리지널 제품인 프라닥사(다비가트란)는 DOAC 시장에서 좀처럼 힘을 내지 못하는 모습이다. 상반기 프라닥사의 처방실적은 47억원으로 전년동기 48억원 대비 소폭 감소했다.경구용 항응고제 시장 분석2025-07-30 06:18:46김진구 -
 6개월 처방액 1천억 '훌쩍'...로수젯·케이캡 파죽지세[데일리팜=천승현 기자] 국내제약사가 연구개발(R&D) 역량으로 개발한 의약품이 외래 처방시장에서 양강체제를 견고하게 수성했다. 복합신약 로수젯과 신약 케이캡이 상반기에만 처방액 1000억원을 넘으며 선두권을 장악했다. 항암제 타그리소가 급여 확대를 발판으로 가파른 성장세를 나타냈고 국내개발 복합신약 리바로젯이 빠른 시장 침투로 두각을 나타냈다.14일 의약품 조사기관 유비스트에 따르면 지난 상반기 한미약품의 고지혈증복합제 로수젯이 가장 많은 1103억원의 외래 처방금액을 기록했다. 로수젯은 올해 1분기와 2분기에 각각 543억원, 560억원의 처방액으로 선두를 질주했다. 상반기 처방액은 전년대비 10.2% 성장했다.2025년 상반기 의약품 외래 처방금액 순위(단위: 억원, 자료: 유비스트) 2015년 말 출시된 로수젯은 로수바스타틴과 에제티미브 2개 성분으로 구성된 고지혈증 복합제다. 스타틴·에제티미브 복합제는 저밀도 저단백 콜레스테롤을 낮추는 데 탁월한 효과를 보이는 데다 약값 부담이 크지 않다는 이유로 처방현장에서 수요가 치솟고 있다.로수젯은 작년 1분기 국내 개발 의약품 중 처음으로 외래 처방시장 전체 선두에 올랐고 6분기 연속 1위 자리를 지켰다. 로수젯은 지난 2021년부터 2023년까지 3년 연속 전체 2위를 기록했고 지난해 처음으로 연간 외래 처방금액 선두에 올랐다.로수젯은 지난 2020년부터 5년 연속 처방액 1000억원 이상을 기록했고 지난해 2103억원을 올리며 국내 개발 의약품 중 최초로 연간 처방액 2000억원을 돌파했다. 올해 상반기에만 1000억원을 넘어서며 2년 연속 2000억원 돌파를 예약했다. 로수젯은 작년 2분기 처방액 511억원을 기록한 이후 5분기 연속 500억원대를 형성했다.HK이노엔의 신약 케이캡은 상반기 처방액이 전년동기보다 14.0% 증가한 1047억원을 기록하며 2위에 올랐다. 전체 의약품 중 상반기 처방금액이 1000억원을 넘어선 제품은 로수젯과 케이캡 2개 제품이다. 케이캡은 1분기와 2분기 처방액이 각각 514억원, 533억원을 기록했다. 작년 3분기부터 4분기 연속 500억원을 넘어섰다.지난 2018년 국내개발 신약 30호로 허가받은 케이캡은 '칼륨 경쟁적 위산분비억제제(P-CAB)’ 계열의 위식도역류질환치료제다. 위벽 세포에서 산분비 최종 단계에 위치하는 양성자펌프와 칼륨이온을 경쟁적으로 결합시켜 위산 분비를 저해하는 작용기전을 나타낸다.케이캡은 기존 프로톤펌프억제제(PPI) 계열 제품보다 약효가 빠르게 나타나고, 식사 전후 상관 없이 복용이 가능한 점 등 장점을 앞세워 높은 성장세를 지속하고 있다. 케이캡은 출시 3년째인 2021년 처방액 1000억원을 돌파했고 4년 연속 1000억원 이상의 처방실적을 나타냈다. 올해 상반기에만 1000억원을 넘어서며 연간 처방액 2000억원 돌파도 유력하다.케이캡은 미란성과 비미란성 위식도역류질환에 이어 위궤양, 소화성 궤양·만성 위축성 위염 환자에서 헬리코박터파일로리 제균을 위한 항생제 병용요법, 미란성 위식도역류질환 치료 후 유지요법 등 5개 적응증을 순차적으로 확보했다. 아스트라제네카의 항암제 타그리소가 상위권에서 가장 두각을 나타냈다. 타그리소는 상반기 외래 처방금액이 902억원으로 전년보다 49.8% 늘었다. 타그리소는 1분기 처방금액이 430억원으로 전년동기보다 53.7% 늘었고 2분기에는 473억원으로 46.4% 확대됐다.타그리소는 상피세포성장인자수용체(EGFR) 티로신키나제억제제(TKI)다. EGFR-TKI는 EGFR 돌연변이를 동반한 전이성 비소세포폐암(NSCLC) 환자에게 처방되는 표적항암제다. 타그리소는 지난해부터 유한양행의 렉라자와 함께 특정 유전자 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 1차 치료’로 건강보험 급여 범위가 확대됐다.항암제는 입원 환자 처방 비중이 크지만 타그리소는 경구용이라는 특성상 외래 처방액도 큰 폭으로 확대된 것으로 분석된다. 타그리소는 2023년 4분기 처방실적 210억원을 기록했는데 지난해 1분기 323억원으로 확대됐고 작년 4분기부터 400억원을 넘어섰다.JW중외제약의 고지혈증복합제 리바로젯은 상반기 처방액이 전년보다 26.9% 증가한 543억원을 기록하며 10위권에 새롭게 이름을 올렸다. 리바로젯은 피타바스타틴과 에제티미브가 결합된 복합제다.지난 2021년 10월 출시된 리바로젯은 발매 이후 가파른 상승세를 지속했다. 리바로젯은 2022년 처방액이 318억원을 올리며 돌풍을 일으켰고 2023년과 지난해 각각 933억원으로 치솟았다. 리바로젯은 지난 1분기 처방액이 262억원으로 전년대비 27.4% 뛰었고 2분기에는 282억원으로 26.4% 늘었다.한국오가논의 고지혈증복합제 아토젯은 6월까지 누적 처방액이 625억원으로 전년대비 11.9% 증가하며 상위권에 포진했다. 아토젯은 아토르바스타틴과 에제티미브를 결합한 복합제다. 2021년부터 국내기업 100여곳이 아토르바스타틴·에제티미브 시장에 동시다발로 진입했지만 아토젯은 더욱 견고한 상승세를 나타냈다. 아토젯은 종근당이 판매 중이다.대웅바이오의 콜린알포세레이트 성분의 뇌기능개선제 글리아타민은 상반기 처방액이 전년보다 14.5% 증가한 873억원을 기록했다. 효능 논란에 이은 급여 축소, 환수협상 명령 등 악재를 겪고 있는데도 처방의약품 시장에서는 강세를 이어갔다. 종근당의 콜린알포세레이트 성분 종근당글리아티린은 6월 누적 처방액이 전년보다 2.3% 증가한 599억원을 기록했다.다이이찌산쿄의 항응고제 릭시아나와 사노피의 항혈전제 플라빅스는 상반기에 각각 625억원, 641억원의 처방액을 올리며 꾸준한 상승세를 나타냈다.[분석] 상반기 외래처방약 시장2025-07-14 12:05:01천승현
6개월 처방액 1천억 '훌쩍'...로수젯·케이캡 파죽지세[데일리팜=천승현 기자] 국내제약사가 연구개발(R&D) 역량으로 개발한 의약품이 외래 처방시장에서 양강체제를 견고하게 수성했다. 복합신약 로수젯과 신약 케이캡이 상반기에만 처방액 1000억원을 넘으며 선두권을 장악했다. 항암제 타그리소가 급여 확대를 발판으로 가파른 성장세를 나타냈고 국내개발 복합신약 리바로젯이 빠른 시장 침투로 두각을 나타냈다.14일 의약품 조사기관 유비스트에 따르면 지난 상반기 한미약품의 고지혈증복합제 로수젯이 가장 많은 1103억원의 외래 처방금액을 기록했다. 로수젯은 올해 1분기와 2분기에 각각 543억원, 560억원의 처방액으로 선두를 질주했다. 상반기 처방액은 전년대비 10.2% 성장했다.2025년 상반기 의약품 외래 처방금액 순위(단위: 억원, 자료: 유비스트) 2015년 말 출시된 로수젯은 로수바스타틴과 에제티미브 2개 성분으로 구성된 고지혈증 복합제다. 스타틴·에제티미브 복합제는 저밀도 저단백 콜레스테롤을 낮추는 데 탁월한 효과를 보이는 데다 약값 부담이 크지 않다는 이유로 처방현장에서 수요가 치솟고 있다.로수젯은 작년 1분기 국내 개발 의약품 중 처음으로 외래 처방시장 전체 선두에 올랐고 6분기 연속 1위 자리를 지켰다. 로수젯은 지난 2021년부터 2023년까지 3년 연속 전체 2위를 기록했고 지난해 처음으로 연간 외래 처방금액 선두에 올랐다.로수젯은 지난 2020년부터 5년 연속 처방액 1000억원 이상을 기록했고 지난해 2103억원을 올리며 국내 개발 의약품 중 최초로 연간 처방액 2000억원을 돌파했다. 올해 상반기에만 1000억원을 넘어서며 2년 연속 2000억원 돌파를 예약했다. 로수젯은 작년 2분기 처방액 511억원을 기록한 이후 5분기 연속 500억원대를 형성했다.HK이노엔의 신약 케이캡은 상반기 처방액이 전년동기보다 14.0% 증가한 1047억원을 기록하며 2위에 올랐다. 전체 의약품 중 상반기 처방금액이 1000억원을 넘어선 제품은 로수젯과 케이캡 2개 제품이다. 케이캡은 1분기와 2분기 처방액이 각각 514억원, 533억원을 기록했다. 작년 3분기부터 4분기 연속 500억원을 넘어섰다.지난 2018년 국내개발 신약 30호로 허가받은 케이캡은 '칼륨 경쟁적 위산분비억제제(P-CAB)’ 계열의 위식도역류질환치료제다. 위벽 세포에서 산분비 최종 단계에 위치하는 양성자펌프와 칼륨이온을 경쟁적으로 결합시켜 위산 분비를 저해하는 작용기전을 나타낸다.케이캡은 기존 프로톤펌프억제제(PPI) 계열 제품보다 약효가 빠르게 나타나고, 식사 전후 상관 없이 복용이 가능한 점 등 장점을 앞세워 높은 성장세를 지속하고 있다. 케이캡은 출시 3년째인 2021년 처방액 1000억원을 돌파했고 4년 연속 1000억원 이상의 처방실적을 나타냈다. 올해 상반기에만 1000억원을 넘어서며 연간 처방액 2000억원 돌파도 유력하다.케이캡은 미란성과 비미란성 위식도역류질환에 이어 위궤양, 소화성 궤양·만성 위축성 위염 환자에서 헬리코박터파일로리 제균을 위한 항생제 병용요법, 미란성 위식도역류질환 치료 후 유지요법 등 5개 적응증을 순차적으로 확보했다. 아스트라제네카의 항암제 타그리소가 상위권에서 가장 두각을 나타냈다. 타그리소는 상반기 외래 처방금액이 902억원으로 전년보다 49.8% 늘었다. 타그리소는 1분기 처방금액이 430억원으로 전년동기보다 53.7% 늘었고 2분기에는 473억원으로 46.4% 확대됐다.타그리소는 상피세포성장인자수용체(EGFR) 티로신키나제억제제(TKI)다. EGFR-TKI는 EGFR 돌연변이를 동반한 전이성 비소세포폐암(NSCLC) 환자에게 처방되는 표적항암제다. 타그리소는 지난해부터 유한양행의 렉라자와 함께 특정 유전자 변이가 있는 국소 진행성 또는 전이성 비소세포폐암 1차 치료’로 건강보험 급여 범위가 확대됐다.항암제는 입원 환자 처방 비중이 크지만 타그리소는 경구용이라는 특성상 외래 처방액도 큰 폭으로 확대된 것으로 분석된다. 타그리소는 2023년 4분기 처방실적 210억원을 기록했는데 지난해 1분기 323억원으로 확대됐고 작년 4분기부터 400억원을 넘어섰다.JW중외제약의 고지혈증복합제 리바로젯은 상반기 처방액이 전년보다 26.9% 증가한 543억원을 기록하며 10위권에 새롭게 이름을 올렸다. 리바로젯은 피타바스타틴과 에제티미브가 결합된 복합제다.지난 2021년 10월 출시된 리바로젯은 발매 이후 가파른 상승세를 지속했다. 리바로젯은 2022년 처방액이 318억원을 올리며 돌풍을 일으켰고 2023년과 지난해 각각 933억원으로 치솟았다. 리바로젯은 지난 1분기 처방액이 262억원으로 전년대비 27.4% 뛰었고 2분기에는 282억원으로 26.4% 늘었다.한국오가논의 고지혈증복합제 아토젯은 6월까지 누적 처방액이 625억원으로 전년대비 11.9% 증가하며 상위권에 포진했다. 아토젯은 아토르바스타틴과 에제티미브를 결합한 복합제다. 2021년부터 국내기업 100여곳이 아토르바스타틴·에제티미브 시장에 동시다발로 진입했지만 아토젯은 더욱 견고한 상승세를 나타냈다. 아토젯은 종근당이 판매 중이다.대웅바이오의 콜린알포세레이트 성분의 뇌기능개선제 글리아타민은 상반기 처방액이 전년보다 14.5% 증가한 873억원을 기록했다. 효능 논란에 이은 급여 축소, 환수협상 명령 등 악재를 겪고 있는데도 처방의약품 시장에서는 강세를 이어갔다. 종근당의 콜린알포세레이트 성분 종근당글리아티린은 6월 누적 처방액이 전년보다 2.3% 증가한 599억원을 기록했다.다이이찌산쿄의 항응고제 릭시아나와 사노피의 항혈전제 플라빅스는 상반기에 각각 625억원, 641억원의 처방액을 올리며 꾸준한 상승세를 나타냈다.[분석] 상반기 외래처방약 시장2025-07-14 12:05:01천승현 -
 다이이찌·오노 '껑충'...일본계 제약사 매출 동반 상승[데일리팜=손형민 기자] 국내 진출한 일본계 제약사들의 작년 매출이 전반적인 증가세를 나타냈다. 조사 대상 7개사 모두가 전년 대비 매출 증가를 이뤄냈으며, 특히 한국다이이찌산쿄와 한국오노약품공업은 두 자리수 성장률로 실적을 견인했다. 반면 영업이익 면에서는 각사의 희비가 엇갈렸다.11일 금융감독원 전자공시시스템에 따르면 3월 결산법인 7개 일본계 제약사의 실적은 1조2499억원으로 전년 1조1759억원보다 6.3% 늘었다. 같은 기간 영업이익은 920억원에서 817억원으로 11.2% 감소했다. 주요 일본계 제약사 한국법인은 일본 회계 연도가 적용돼 지난해 4월부터 올해 3월까지를 2024년 연간 매출로 인식하고 있다. 다이이찌 매출 3천억 첫 돌파…오노는 4년새 매출 2배↑한국다이이찌산쿄의 지난해 매출은 3098억원으로 전년 대비 13.0% 증가했다. 같은 기간 영업이익은 266억원에서 242억원으로 9.2% 감소했다.한국다이이찌산쿄의 매출은 2020년부터 꾸준히 늘어나고 있다. 이 회사는 2020년 2179억원으로 처음으로 매출 2000억원을 돌파한 이후 2021년 2454억원, 2022년 2532억원, 2023년 2740억원으로 지속 상승세에 접어들었다.특히 릭시아나, 세비카 등 일부 순환기 품목을 국내 제약사 대웅제약과 협업하며 시너지 효과를 냈다는 분석이다. 한국다이이찌산쿄는 2013년 세비카, 2015년 릭사아나를 대웅제약과 공동판매 계약을 체결하고 현재까지 파트너십 관계를 이어나가고 있다.다이이찌산쿄 항응고제 '릭시아나'그중 가장 매출이 높은 건 직접작용 경구용 항응고제(DOAC) 릭시아나다. 시장조사기관 유비스트에 따르면 릭시아나의 지난해 처방액은 1175억원으로, 2023년 1053억원 대비 11.6% 증가했다.고혈압 3제 복합제 세비카HCT도 성장세를 유지했다. 세비카HCT의 지난해 처방액은 421억원으로 전년 대비 4.0% 늘었다. 한국다이이찌산쿄는 세비카HCT(421억원), 올메텍(306억원), 세비카(688억원) 등 올메사르탄 기반 고혈압 치료제로만 처방액 1400억원가량을 올렸다.한국다이이찌산쿄는 순환기 전문 기업에서 항암 분야로 나아가기 위한 작업을 진행하고 있다. 특히 이 회사는 항체약물접합체(ADC) 분야에 연구개발(R&D) 역량을 집중하는 등 새로운 먹거리에 집중하고 있다. 현재 기 허가받은 엔허투 이후에도 다트로웨이, 파트리투맙데룩스테칸, DS-7300, DS-6000 등 5 ADC 전략을 구사하며 다양한 치료제들의 출시도 준비하고 있다.작년 한국다케다제약의 매출액은 전년 대비 5.4% 증가한 2677억원으로 나타났다. 영업이익은 102억원으로 6.9% 늘었다.제줄라·알룬브릭·닌라로 등 항암제가 꾸준히 성장하며 매출 확대에 기여했다.시장조사기관 유비스트에 따르면 알룬브릭은 지난해 처방액 121억원을 기록했다. 2019년 출시 이후 지속 처방액이 증가세에 있다. 이 치료제는 ALK 양성 비소세포폐암 적응증으로 시장을 점유해 나가고 있다.알룬브릭은 화이자의 로비큐아, 로슈의 알레센자와 치열한 경쟁을 펼치고 있다. 다만 알룬브릭의 경우 1일 1회 1정 복용으로 질환 관리가 가능하고 식사 유무와 관계없이 복용이 가능하다. 이처럼 환자들이 복용 시 신경 써야 할 요소들이 적다는 장점이 있다.난소암 치료제 제줄라 역시 지난해 143억원을 기록하며 전년 대비 51.6% 처방액이 늘었다.제줄라는 지난해 10월부터 건강보험 급여 기준이 상동재조합결핍(HRd) 양성 난소암 치료로 확대됐다. 그간 제줄라는 난소암 1차요법에서 백금기반요법에 반응한 BRCA 변이 난소암 환자 대상 유지요법에 급여가 인정되고 있었다.한국오노약품공업의 성장세도 두드려졌다. 오노약품의 작년 매출은 603억원으로 전년 대비 10.7% 증가했다. 같은 기간 영업이익은 39억원에서 44억원으로 11.7% 늘었다. 오노약품이 지난해 기록한 매출과 영업이익은 회사가 감사보고서를 제출하기 시작한 2017년 이후 최대 수치다.오노약품은 2021년 매출 400억원 이상을 기록했으며, 이듬해 500억원을 처음으로 돌파했다. 오노약품이 지난해 기록한 603억원과 2020년 매출 310억원을 비교하면 4년새 94.5% 증가한 것으로 확인됐다.면역항암제 옵디보가 오노약품의 매출 성장세를 견인했다. 옵디보는 오노약품과 BMS가 공동 개발한 항 PD-1 계열 면역항암제로 지난 2015년 국내 허가됐다. 오노약품은 한국과 일본, 대만 등 아시아 지역의 개발·판매 권리를 갖고 있다.특히 옵디보와 BMS의 CTLA-4 타깃 면역항암제 여보이 조합이 흑색종, 신세포암, 간세포암 등 다양한 고형암에서 효과를 나타내며 시장 점유율을 끌어올리는 데 기여했다. 시장조사기관 아이큐비아에 따르면 옵디보는 2022년부터 국내 매출 1000억원을 넘어섰다.외형 성장했지만…영업익은 희비한국아스텔라스제약, 한국에자이, 한국산텐제약 등은 매출은 소폭 증가했지만, 영업이익은 모두 감소했다.한국아스텔라스제약은 작년 매출 2587억원으로 전년보다 3.0% 증가했다. 하루날, 베타미가, 프로그랍, 엑스탄디 등이 선전하며 매출 신장을 이뤄냈다.전립선 비대증 치료제 하루날은 지난해 처방액 662억원을 기록하며 전년 대비 0.8% 늘었다. 과민성 방광 치료제 베타미가와 면역억제제 프로그랍은 특허 만료에 이후에도 꾸준히 처방액 300억원 이상을 기록하고 있다. 지난해 처방액은 베타미가 334억원, 프로그랍 336억원으로 전년 대비 각각 2.6%, 3.9% 올랐다.영업이익은 지난해 161억원으로 전년 대비 10.7% 줄었다. 매출원가가 소폭 증가하며 매출총이익 감소에 영향을 미쳤다.한국아스텔라스제약은 후발 항암제에 기대를 모으고 있다. 이 회사가 개발한 ADC 항암제 파드셉과 클라우딘18.2를 타깃하는 신규 위암 표적치료제 빌로이가 국내 상륙한 상황이다. 두 약제 모두 임상에서 괄목할 만한 결과를 나타냈다. 현재 한국아스텔라스제약은 두 약제에 대한 보험급여 신청을 완료했다.한국에자이는 2023년 1393억원에서 지난해 1465억원으로 매출이 5.2% 올랐다. 같은 기간 영업이익은 6.4% 줄어든 88억원에 머물렀다. 항암제 렌비마, 위식도역류질환 치료제 파리에트, 치매치료제 아리셉트 등 기존 제품의 매출이 꾸준히 나타나고 있다.아리셉트(959억원), 파리에트(179억원), 렌비마(129억원) 등 세 제품은 지난해 매출 1000억원 이상을 합작했다. 영업이익은 매출원가 증가 등의 영향으로 소폭 줄어든 것으로 나타났다.에자이 알츠하이머병 치료제 '레켐비'에자이는 알츠하이머병 신약 ‘레켐비’의 선전을 기대하고 있다. 레켐비는 에자이와 바이오젠이 개발한 알츠하이머병 치료제로 발병 원인 물질로 알려진 아밀로이드 베타에 선택적으로 결합해 질병의 진행속도를 감소시키고 인지 기능 저하를 늦추는 것이 입증된 약물이다.현재 다양한 국내 종합병원, 세미종합병원 등에서 레켐비의 처방이 이뤄지고 있는 것으로 알려진다.한국산텐제약은 지난해 매출 1361억원으로 전년 대비 2.2% 증가했다. 반면 영업이익은 143억원을 기록하며 17.3% 줄었다.산텐제약은 안과 품목 전문 개발사로 디쿠아포솔 등 다양한 제제를 보유하고 있다. 다만 국내에서는 점안제 히알루론산이 주로 활용되며 처방액을 크게 늘리지 못하고 있다. 작년 기준 산텐제약의 품목 중 가장 높은 매출은 녹내장 치료제 활용되는 코솝에스 점안액이다. 코솝에스의 작년 처방액은 339억원으로 전년 대비 2.6% 늘었다.미쓰비시다나베코리아의 지난해 매출은 708억원으로 2023년보다 1.5% 늘었지만, 영업이익은 같은기간 49.1% 급감했다. 급여, 퇴직급여 지급 등 판매관리비가 증가했으며 매출원가가 늘어난 부분도 영업이익 감소에 기인했다.2025-07-11 06:19:52손형민
다이이찌·오노 '껑충'...일본계 제약사 매출 동반 상승[데일리팜=손형민 기자] 국내 진출한 일본계 제약사들의 작년 매출이 전반적인 증가세를 나타냈다. 조사 대상 7개사 모두가 전년 대비 매출 증가를 이뤄냈으며, 특히 한국다이이찌산쿄와 한국오노약품공업은 두 자리수 성장률로 실적을 견인했다. 반면 영업이익 면에서는 각사의 희비가 엇갈렸다.11일 금융감독원 전자공시시스템에 따르면 3월 결산법인 7개 일본계 제약사의 실적은 1조2499억원으로 전년 1조1759억원보다 6.3% 늘었다. 같은 기간 영업이익은 920억원에서 817억원으로 11.2% 감소했다. 주요 일본계 제약사 한국법인은 일본 회계 연도가 적용돼 지난해 4월부터 올해 3월까지를 2024년 연간 매출로 인식하고 있다. 다이이찌 매출 3천억 첫 돌파…오노는 4년새 매출 2배↑한국다이이찌산쿄의 지난해 매출은 3098억원으로 전년 대비 13.0% 증가했다. 같은 기간 영업이익은 266억원에서 242억원으로 9.2% 감소했다.한국다이이찌산쿄의 매출은 2020년부터 꾸준히 늘어나고 있다. 이 회사는 2020년 2179억원으로 처음으로 매출 2000억원을 돌파한 이후 2021년 2454억원, 2022년 2532억원, 2023년 2740억원으로 지속 상승세에 접어들었다.특히 릭시아나, 세비카 등 일부 순환기 품목을 국내 제약사 대웅제약과 협업하며 시너지 효과를 냈다는 분석이다. 한국다이이찌산쿄는 2013년 세비카, 2015년 릭사아나를 대웅제약과 공동판매 계약을 체결하고 현재까지 파트너십 관계를 이어나가고 있다.다이이찌산쿄 항응고제 '릭시아나'그중 가장 매출이 높은 건 직접작용 경구용 항응고제(DOAC) 릭시아나다. 시장조사기관 유비스트에 따르면 릭시아나의 지난해 처방액은 1175억원으로, 2023년 1053억원 대비 11.6% 증가했다.고혈압 3제 복합제 세비카HCT도 성장세를 유지했다. 세비카HCT의 지난해 처방액은 421억원으로 전년 대비 4.0% 늘었다. 한국다이이찌산쿄는 세비카HCT(421억원), 올메텍(306억원), 세비카(688억원) 등 올메사르탄 기반 고혈압 치료제로만 처방액 1400억원가량을 올렸다.한국다이이찌산쿄는 순환기 전문 기업에서 항암 분야로 나아가기 위한 작업을 진행하고 있다. 특히 이 회사는 항체약물접합체(ADC) 분야에 연구개발(R&D) 역량을 집중하는 등 새로운 먹거리에 집중하고 있다. 현재 기 허가받은 엔허투 이후에도 다트로웨이, 파트리투맙데룩스테칸, DS-7300, DS-6000 등 5 ADC 전략을 구사하며 다양한 치료제들의 출시도 준비하고 있다.작년 한국다케다제약의 매출액은 전년 대비 5.4% 증가한 2677억원으로 나타났다. 영업이익은 102억원으로 6.9% 늘었다.제줄라·알룬브릭·닌라로 등 항암제가 꾸준히 성장하며 매출 확대에 기여했다.시장조사기관 유비스트에 따르면 알룬브릭은 지난해 처방액 121억원을 기록했다. 2019년 출시 이후 지속 처방액이 증가세에 있다. 이 치료제는 ALK 양성 비소세포폐암 적응증으로 시장을 점유해 나가고 있다.알룬브릭은 화이자의 로비큐아, 로슈의 알레센자와 치열한 경쟁을 펼치고 있다. 다만 알룬브릭의 경우 1일 1회 1정 복용으로 질환 관리가 가능하고 식사 유무와 관계없이 복용이 가능하다. 이처럼 환자들이 복용 시 신경 써야 할 요소들이 적다는 장점이 있다.난소암 치료제 제줄라 역시 지난해 143억원을 기록하며 전년 대비 51.6% 처방액이 늘었다.제줄라는 지난해 10월부터 건강보험 급여 기준이 상동재조합결핍(HRd) 양성 난소암 치료로 확대됐다. 그간 제줄라는 난소암 1차요법에서 백금기반요법에 반응한 BRCA 변이 난소암 환자 대상 유지요법에 급여가 인정되고 있었다.한국오노약품공업의 성장세도 두드려졌다. 오노약품의 작년 매출은 603억원으로 전년 대비 10.7% 증가했다. 같은 기간 영업이익은 39억원에서 44억원으로 11.7% 늘었다. 오노약품이 지난해 기록한 매출과 영업이익은 회사가 감사보고서를 제출하기 시작한 2017년 이후 최대 수치다.오노약품은 2021년 매출 400억원 이상을 기록했으며, 이듬해 500억원을 처음으로 돌파했다. 오노약품이 지난해 기록한 603억원과 2020년 매출 310억원을 비교하면 4년새 94.5% 증가한 것으로 확인됐다.면역항암제 옵디보가 오노약품의 매출 성장세를 견인했다. 옵디보는 오노약품과 BMS가 공동 개발한 항 PD-1 계열 면역항암제로 지난 2015년 국내 허가됐다. 오노약품은 한국과 일본, 대만 등 아시아 지역의 개발·판매 권리를 갖고 있다.특히 옵디보와 BMS의 CTLA-4 타깃 면역항암제 여보이 조합이 흑색종, 신세포암, 간세포암 등 다양한 고형암에서 효과를 나타내며 시장 점유율을 끌어올리는 데 기여했다. 시장조사기관 아이큐비아에 따르면 옵디보는 2022년부터 국내 매출 1000억원을 넘어섰다.외형 성장했지만…영업익은 희비한국아스텔라스제약, 한국에자이, 한국산텐제약 등은 매출은 소폭 증가했지만, 영업이익은 모두 감소했다.한국아스텔라스제약은 작년 매출 2587억원으로 전년보다 3.0% 증가했다. 하루날, 베타미가, 프로그랍, 엑스탄디 등이 선전하며 매출 신장을 이뤄냈다.전립선 비대증 치료제 하루날은 지난해 처방액 662억원을 기록하며 전년 대비 0.8% 늘었다. 과민성 방광 치료제 베타미가와 면역억제제 프로그랍은 특허 만료에 이후에도 꾸준히 처방액 300억원 이상을 기록하고 있다. 지난해 처방액은 베타미가 334억원, 프로그랍 336억원으로 전년 대비 각각 2.6%, 3.9% 올랐다.영업이익은 지난해 161억원으로 전년 대비 10.7% 줄었다. 매출원가가 소폭 증가하며 매출총이익 감소에 영향을 미쳤다.한국아스텔라스제약은 후발 항암제에 기대를 모으고 있다. 이 회사가 개발한 ADC 항암제 파드셉과 클라우딘18.2를 타깃하는 신규 위암 표적치료제 빌로이가 국내 상륙한 상황이다. 두 약제 모두 임상에서 괄목할 만한 결과를 나타냈다. 현재 한국아스텔라스제약은 두 약제에 대한 보험급여 신청을 완료했다.한국에자이는 2023년 1393억원에서 지난해 1465억원으로 매출이 5.2% 올랐다. 같은 기간 영업이익은 6.4% 줄어든 88억원에 머물렀다. 항암제 렌비마, 위식도역류질환 치료제 파리에트, 치매치료제 아리셉트 등 기존 제품의 매출이 꾸준히 나타나고 있다.아리셉트(959억원), 파리에트(179억원), 렌비마(129억원) 등 세 제품은 지난해 매출 1000억원 이상을 합작했다. 영업이익은 매출원가 증가 등의 영향으로 소폭 줄어든 것으로 나타났다.에자이 알츠하이머병 치료제 '레켐비'에자이는 알츠하이머병 신약 ‘레켐비’의 선전을 기대하고 있다. 레켐비는 에자이와 바이오젠이 개발한 알츠하이머병 치료제로 발병 원인 물질로 알려진 아밀로이드 베타에 선택적으로 결합해 질병의 진행속도를 감소시키고 인지 기능 저하를 늦추는 것이 입증된 약물이다.현재 다양한 국내 종합병원, 세미종합병원 등에서 레켐비의 처방이 이뤄지고 있는 것으로 알려진다.한국산텐제약은 지난해 매출 1361억원으로 전년 대비 2.2% 증가했다. 반면 영업이익은 143억원을 기록하며 17.3% 줄었다.산텐제약은 안과 품목 전문 개발사로 디쿠아포솔 등 다양한 제제를 보유하고 있다. 다만 국내에서는 점안제 히알루론산이 주로 활용되며 처방액을 크게 늘리지 못하고 있다. 작년 기준 산텐제약의 품목 중 가장 높은 매출은 녹내장 치료제 활용되는 코솝에스 점안액이다. 코솝에스의 작년 처방액은 339억원으로 전년 대비 2.6% 늘었다.미쓰비시다나베코리아의 지난해 매출은 708억원으로 2023년보다 1.5% 늘었지만, 영업이익은 같은기간 49.1% 급감했다. 급여, 퇴직급여 지급 등 판매관리비가 증가했으며 매출원가가 늘어난 부분도 영업이익 감소에 기인했다.2025-07-11 06:19:52손형민 -
 HLB제약, 강성권 박사 중앙연구소장 선임[데일리팜=이석준 기자] HLB제약은 최근 강성권 박사를 중앙연구소장으로 선임했다고 8일 밝혔다. 강 소장은 HLB제약의 장기지속형 주사제 플랫폼인 SMEB(Smart continuous Manufacturing system for Encapsulated Biodrug·스마트 연속 제조 시스템) 기술 기반 파이프라인 개발과 사업화 전략을 이끌게 된다.강 소장은 서울대학교 자연과학부를 졸업하고 동 대학원에서 화학 석사와 약학 박사 학위를 취득했다. 2003년부터 종근당에서 합성연구실장과 기술연구소장을 역임하며 합성신약, 개량신약, 천연물신약 등 다양한 신제품 개발 프로젝트를 주도했다. 특히 DDS 기반 기술과 응용 분야에서 폭넓은 연구개발 경험과 성과를 쌓아 국내 의약품 R&D 업계에서 전문성을 인정받았다.HLB제약은 이번 인사를 통해 SMEB 기반의 장기지속형 주사제 플랫폼 기술을 더욱 고도화하고 글로벌 파트너링과 기술이전 사업을 본격 추진한다는 방침이다.HLB제약은 현재 GLP-1 기반 비만·당뇨 치료제와 항응고제, 항암제, 치매 치료제, 필러 등으로 장기지속형 주사제 파이프라인을 확장하고 있다. 최근에는 자체적으로 미세유체 핵심 모듈을 개발해 균일한 미립구를 안정적으로 대량 생산할 수 있는 생산 설비를 구축했다.강성권 소장은 “HLB제약의 SMEB 기술을 더욱 고도화해 글로벌 시장에서 신뢰받는 혁신 약물전달 솔루션으로 자리잡을 수 있도록 최선을 다하겠다. 장기지속형 주사제를 비롯한 혁신 의약품 개발을 통해 환자 편의성과 치료 효과를 높이고, 글로벌 시장에서 HLB제약의 위상을 강화해 가겠다”고 말했다.2025-07-08 09:10:32이석준
HLB제약, 강성권 박사 중앙연구소장 선임[데일리팜=이석준 기자] HLB제약은 최근 강성권 박사를 중앙연구소장으로 선임했다고 8일 밝혔다. 강 소장은 HLB제약의 장기지속형 주사제 플랫폼인 SMEB(Smart continuous Manufacturing system for Encapsulated Biodrug·스마트 연속 제조 시스템) 기술 기반 파이프라인 개발과 사업화 전략을 이끌게 된다.강 소장은 서울대학교 자연과학부를 졸업하고 동 대학원에서 화학 석사와 약학 박사 학위를 취득했다. 2003년부터 종근당에서 합성연구실장과 기술연구소장을 역임하며 합성신약, 개량신약, 천연물신약 등 다양한 신제품 개발 프로젝트를 주도했다. 특히 DDS 기반 기술과 응용 분야에서 폭넓은 연구개발 경험과 성과를 쌓아 국내 의약품 R&D 업계에서 전문성을 인정받았다.HLB제약은 이번 인사를 통해 SMEB 기반의 장기지속형 주사제 플랫폼 기술을 더욱 고도화하고 글로벌 파트너링과 기술이전 사업을 본격 추진한다는 방침이다.HLB제약은 현재 GLP-1 기반 비만·당뇨 치료제와 항응고제, 항암제, 치매 치료제, 필러 등으로 장기지속형 주사제 파이프라인을 확장하고 있다. 최근에는 자체적으로 미세유체 핵심 모듈을 개발해 균일한 미립구를 안정적으로 대량 생산할 수 있는 생산 설비를 구축했다.강성권 소장은 “HLB제약의 SMEB 기술을 더욱 고도화해 글로벌 시장에서 신뢰받는 혁신 약물전달 솔루션으로 자리잡을 수 있도록 최선을 다하겠다. 장기지속형 주사제를 비롯한 혁신 의약품 개발을 통해 환자 편의성과 치료 효과를 높이고, 글로벌 시장에서 HLB제약의 위상을 강화해 가겠다”고 말했다.2025-07-08 09:10:32이석준 -
 글로벌제약, 스몰딜 잇단 성사…희귀질환 신약 러브콜[데일리팜=손형민 기자] 올해 상반기 글로벌 제약업계의 인수합병(M&A)은 희귀질환 분야에 초점이 맞춰졌다. 주요 글로벌제약사들은 M&A를 통해 중추신경질환(CNS), 세포치료제, 알츠하이머병 치료제, 심혈관계 치료제 등 다양한 희귀질환 파이프라인을 확보했다.CAR-T·조현병 치료제 등 희귀질환 영역에 집중27일 관련 업계에 따르면 GSK, 존슨앤드존슨, 사노피, 노바티스, 릴리, 사노피 등 주요 글로벌 제약사들이 올해 상반기 M&A를 통해 추가 파이프라인 확보에 나섰다.GSK는 올해 첫 딜을 성사시켰다. 이 회사는 지난 1월 열린 JP모건헬스케어 컨퍼런스를 통해 위장암 치료제를 개발하고 있는 미국 생명공학 회사 IDRx를 11억 5000만달러(약 1조7000억원)에 인수했다. 선급금은 10억 달러다.이번 거래로 GSK는 IDRx의 표적항암제 후보물질 ‘IDRX-42’을 확보했다. IDRX-42는 위장관기질종양에서 80% 비율로 발현되는 KIT 유전자 변이를 타깃한다. IDRX-42는 기존 표적치료제와 달리 임상적으로 유의미한 KIT 돌연변이의 전체 스펙트럼을 억제할 수 있는 잠재력을 갖고 있다는 평가를 받고 있다.GSK는 면역항암제 ‘젬퍼리’의 적응증 확대, B7-H3 표적 항체약물접합체(ADC) 임상 등에 IDRX-42 병용요법 가능성을 확인한다.존슨앤드존슨도 지난 1월 미국 바이오제약기업 인트라-셀룰러를 인수하며 146억달러(약21조 5000억원)를 지출했다. 이 회사는 이번 인수로 미국에서 승인된 조현병, 양극성 장애 치료제 '캐플리타'를 파이프라인에 추가했다.캐플리타는 세로토닌 5-HT2A 수용체 점유율이 높고 도파민 D2 수용체 점유율은 낮다는 특징을 갖고 있다. 존슨앤드존슨은 캐플리타의 연간 매출액이 50억 달러 이상을 기록할 것으로 내다봤다.아스트라제네카는 지난 3월 벨기에 생명공학사 에소바이오텍을 인수했다. 계약 규모는 최대 10억 달러다. 이번 인수로 아스트라제네카는 생체내(in vivo) 기반 키메릭항원수용체 T세포(CAR-T) 치료제 분야에 분격 뛰어들었다. 이 회사는 지난 2023년 세포치료제 개발사 그라셀 바이오테크를 인수한 바 있다.에소바이오텍은 렌티바이러스 기반 유전자 전달 기술을 활용해, 환자 체내의 T세포에 직접 유전자를 삽입하는 기술을 보유하고 있다. ‘ENaBL(Engineered NanoBody Lentiviral)’로 명명된 이 플랫폼은 정맥주사 한 번만으로 체내 CAR-T 세포를 유도할 수 있다. 심혈관계 질환 치료제 등 순환기 영역도 집중최근에는 항암제뿐만 아니라 심혈관계 질환 치료제에서도 집중하는 글로벌제약사들이 늘어나고 있다.지난 2월 노바티스는 심혈관질환 치료제 개발사 안토스 테라퓨틱스를 31억 달러에 인수했다. 이번 인수는 항응고제 분야에서의 경쟁력 강화를 목표한 노바티스의 전략적 결정이다.안토스의 핵심 파이프라인은 후천성 혈전증 예방 신약후보물질 아벨라시맙으로, 기존 항응고제 대비 출혈 위험을 현저히 줄일 수 있는 기전으로 주목받고 있다.아벨라시맙은 XIIa 인자 억제제 계열의 신규 작용제로, 정맥혈전색전증(VTE) 예방을 포함해 심방세동 환자 대상 적응증 확보를 목표하고 있다. 현재 아벨리시맙은 임상 3상에 진입해 있으며, 기존 항응고제 대비 출혈 안전성 측면에서 유리한 데이터가 일부 확보된 상태다.또 노바티스는 5월 레귤러스 테라퓨틱스를 17억 달러에 인수하며 신장질환 RNA 치료제도 확보했다.레귤러스는 마이크로RNA(miRNA) 조절 플랫폼을 기반으로 다양한 신장질환 치료제를 개발하고 있다. 특히 주목받는 신약후보물질은 RGLS8429다. 이 신약후보물질은 miR-21을 표적해 염증과 섬유화를 억제함으로써 신장 기능 저하를 방지하는 작용기전을 갖고 있다. RGLS8429는 현재 알포트증후군 환자 대상 임상 2상에 진입한 상태로, 초기 데이터에서 신장기능 개선을 유의미하게 입증했다는 평가를 받고 있다.노바티스는 이번 인수를 통해 기존의 신장·심혈관 치료제 포트폴리오에 RNA 기반 혁신 치료제를 접목해 중장기적으로 항섬유화 치료제 시장의 주도권을 노린다는 전략이다사노피는 TREM2 항체를 주목하고 있다. 사노피는 지난달 비질 뉴로사이언스(Vigil Neuroscience)를 인수했다. 계약 규모는 총 4억7000만 달러(약 6400억원)다. 이번 인수로 사노피는 TREM2 항체 활성화에 관여하는 소분자 제제 ‘VG-3927’을 확보했다.TREM2는 수지상세포 표면에 발현돼 면역 반응을 조절하는 중요한 분자다. 특히 항원 제시, 면역 활성화, 뇌 기능 유지 등 다양한 생물학적 과정에 관여하며, 신경 질환 및 염증 질환 연구에서 중요한 표적으로 간주된다.특히 기존 항체들이 혈중 가용 STREM2(soluble TREM2)에 비특이적으로 결합해 효과가 제한됐던 것과 달리 VG-3927은 세포막 상 수용체에만 작용해 미세아교세포 기능 활성화를 극대화할 수 있다는 강점이 있다. 사노피는 올해 3분기 중 VG-3927의 임상 2상을 착수할 계획이다.일라이릴리는 버브 테라퓨틱스를 인수에 13억 달러를 지출하며 차세대 유전자 편집 기반 심혈관 치료제 개발에 착수했다.버브 테라퓨틱스는 크리스퍼(CRISPR) 유전자 편집 기술을 기반으로 심혈관질환의 근본 원인을 차단하는 접근법을 개발 중이며, 주요 파이프라인은 고콜레스테롤혈증 치료용 유전자 편집 신약후보물질 'VERVE-101'이다.VERVE-101은 PCSK9 유전자를 영구적으로 불활성화시켜, 단 1회 투여만으로도 지속적인 LDL 콜레스테롤 수치를 낮추는 효과를 목표로 한다. 현재 미국과 영국에서 이상지질혈증 및 유전성 고콜레스테롤혈증 환자 대상 임상 1/2상이 진행 중이며, 중간 분석에서 지속적이고 유의미한 LDL 감소 효과가 보고된 바 있다.릴리는 이번 인수를 통해 CRISPR 기술을 활용한 심혈관질환 치료 영역에 조기 진입하는 동시에, 기존 GLP-1 계열 대사질환 치료제와 적응증 연계 시너지를 창출할 것으로 기대하고 있다.2025-06-27 12:00:19손형민
글로벌제약, 스몰딜 잇단 성사…희귀질환 신약 러브콜[데일리팜=손형민 기자] 올해 상반기 글로벌 제약업계의 인수합병(M&A)은 희귀질환 분야에 초점이 맞춰졌다. 주요 글로벌제약사들은 M&A를 통해 중추신경질환(CNS), 세포치료제, 알츠하이머병 치료제, 심혈관계 치료제 등 다양한 희귀질환 파이프라인을 확보했다.CAR-T·조현병 치료제 등 희귀질환 영역에 집중27일 관련 업계에 따르면 GSK, 존슨앤드존슨, 사노피, 노바티스, 릴리, 사노피 등 주요 글로벌 제약사들이 올해 상반기 M&A를 통해 추가 파이프라인 확보에 나섰다.GSK는 올해 첫 딜을 성사시켰다. 이 회사는 지난 1월 열린 JP모건헬스케어 컨퍼런스를 통해 위장암 치료제를 개발하고 있는 미국 생명공학 회사 IDRx를 11억 5000만달러(약 1조7000억원)에 인수했다. 선급금은 10억 달러다.이번 거래로 GSK는 IDRx의 표적항암제 후보물질 ‘IDRX-42’을 확보했다. IDRX-42는 위장관기질종양에서 80% 비율로 발현되는 KIT 유전자 변이를 타깃한다. IDRX-42는 기존 표적치료제와 달리 임상적으로 유의미한 KIT 돌연변이의 전체 스펙트럼을 억제할 수 있는 잠재력을 갖고 있다는 평가를 받고 있다.GSK는 면역항암제 ‘젬퍼리’의 적응증 확대, B7-H3 표적 항체약물접합체(ADC) 임상 등에 IDRX-42 병용요법 가능성을 확인한다.존슨앤드존슨도 지난 1월 미국 바이오제약기업 인트라-셀룰러를 인수하며 146억달러(약21조 5000억원)를 지출했다. 이 회사는 이번 인수로 미국에서 승인된 조현병, 양극성 장애 치료제 '캐플리타'를 파이프라인에 추가했다.캐플리타는 세로토닌 5-HT2A 수용체 점유율이 높고 도파민 D2 수용체 점유율은 낮다는 특징을 갖고 있다. 존슨앤드존슨은 캐플리타의 연간 매출액이 50억 달러 이상을 기록할 것으로 내다봤다.아스트라제네카는 지난 3월 벨기에 생명공학사 에소바이오텍을 인수했다. 계약 규모는 최대 10억 달러다. 이번 인수로 아스트라제네카는 생체내(in vivo) 기반 키메릭항원수용체 T세포(CAR-T) 치료제 분야에 분격 뛰어들었다. 이 회사는 지난 2023년 세포치료제 개발사 그라셀 바이오테크를 인수한 바 있다.에소바이오텍은 렌티바이러스 기반 유전자 전달 기술을 활용해, 환자 체내의 T세포에 직접 유전자를 삽입하는 기술을 보유하고 있다. ‘ENaBL(Engineered NanoBody Lentiviral)’로 명명된 이 플랫폼은 정맥주사 한 번만으로 체내 CAR-T 세포를 유도할 수 있다. 심혈관계 질환 치료제 등 순환기 영역도 집중최근에는 항암제뿐만 아니라 심혈관계 질환 치료제에서도 집중하는 글로벌제약사들이 늘어나고 있다.지난 2월 노바티스는 심혈관질환 치료제 개발사 안토스 테라퓨틱스를 31억 달러에 인수했다. 이번 인수는 항응고제 분야에서의 경쟁력 강화를 목표한 노바티스의 전략적 결정이다.안토스의 핵심 파이프라인은 후천성 혈전증 예방 신약후보물질 아벨라시맙으로, 기존 항응고제 대비 출혈 위험을 현저히 줄일 수 있는 기전으로 주목받고 있다.아벨라시맙은 XIIa 인자 억제제 계열의 신규 작용제로, 정맥혈전색전증(VTE) 예방을 포함해 심방세동 환자 대상 적응증 확보를 목표하고 있다. 현재 아벨리시맙은 임상 3상에 진입해 있으며, 기존 항응고제 대비 출혈 안전성 측면에서 유리한 데이터가 일부 확보된 상태다.또 노바티스는 5월 레귤러스 테라퓨틱스를 17억 달러에 인수하며 신장질환 RNA 치료제도 확보했다.레귤러스는 마이크로RNA(miRNA) 조절 플랫폼을 기반으로 다양한 신장질환 치료제를 개발하고 있다. 특히 주목받는 신약후보물질은 RGLS8429다. 이 신약후보물질은 miR-21을 표적해 염증과 섬유화를 억제함으로써 신장 기능 저하를 방지하는 작용기전을 갖고 있다. RGLS8429는 현재 알포트증후군 환자 대상 임상 2상에 진입한 상태로, 초기 데이터에서 신장기능 개선을 유의미하게 입증했다는 평가를 받고 있다.노바티스는 이번 인수를 통해 기존의 신장·심혈관 치료제 포트폴리오에 RNA 기반 혁신 치료제를 접목해 중장기적으로 항섬유화 치료제 시장의 주도권을 노린다는 전략이다사노피는 TREM2 항체를 주목하고 있다. 사노피는 지난달 비질 뉴로사이언스(Vigil Neuroscience)를 인수했다. 계약 규모는 총 4억7000만 달러(약 6400억원)다. 이번 인수로 사노피는 TREM2 항체 활성화에 관여하는 소분자 제제 ‘VG-3927’을 확보했다.TREM2는 수지상세포 표면에 발현돼 면역 반응을 조절하는 중요한 분자다. 특히 항원 제시, 면역 활성화, 뇌 기능 유지 등 다양한 생물학적 과정에 관여하며, 신경 질환 및 염증 질환 연구에서 중요한 표적으로 간주된다.특히 기존 항체들이 혈중 가용 STREM2(soluble TREM2)에 비특이적으로 결합해 효과가 제한됐던 것과 달리 VG-3927은 세포막 상 수용체에만 작용해 미세아교세포 기능 활성화를 극대화할 수 있다는 강점이 있다. 사노피는 올해 3분기 중 VG-3927의 임상 2상을 착수할 계획이다.일라이릴리는 버브 테라퓨틱스를 인수에 13억 달러를 지출하며 차세대 유전자 편집 기반 심혈관 치료제 개발에 착수했다.버브 테라퓨틱스는 크리스퍼(CRISPR) 유전자 편집 기술을 기반으로 심혈관질환의 근본 원인을 차단하는 접근법을 개발 중이며, 주요 파이프라인은 고콜레스테롤혈증 치료용 유전자 편집 신약후보물질 'VERVE-101'이다.VERVE-101은 PCSK9 유전자를 영구적으로 불활성화시켜, 단 1회 투여만으로도 지속적인 LDL 콜레스테롤 수치를 낮추는 효과를 목표로 한다. 현재 미국과 영국에서 이상지질혈증 및 유전성 고콜레스테롤혈증 환자 대상 임상 1/2상이 진행 중이며, 중간 분석에서 지속적이고 유의미한 LDL 감소 효과가 보고된 바 있다.릴리는 이번 인수를 통해 CRISPR 기술을 활용한 심혈관질환 치료 영역에 조기 진입하는 동시에, 기존 GLP-1 계열 대사질환 치료제와 적응증 연계 시너지를 창출할 것으로 기대하고 있다.2025-06-27 12:00:19손형민 -
 '릭시아나' 내년 물질특허 만료...제네릭 개발 활발[데일리팜=이혜경 기자] 내년 11월 물질특허 만료를 앞두고 있는 직접작용 경구용 항응고제(DOAC, Direct Oral Anti-Coagulant) '릭시아나(에독사반토실산염수화물)' 제네릭 출시를 위한 국내사들의 움직임이 활발하다.식품의약품안전처는 지난 19일 고려제약이 신청한 '고려에독사반정60mg과 한국다이이찌산쿄 릭시아나정60mg(에독사반토실산염수화물)의 생물학적 동등성 평가를 위한 건강한 성인에서의 공개, 무작위배정, 공복, 단회 경구 투여, 2군, 2기, 교차 시험'을 승인했다.릭시아나 제네릭 개발을 위한 생동성 시험 승인은 이달에만 2건이 이뤄졌다. 고려제약 이전 알리코제약이 지난 9일 '알릭사반정60mg'에 대한 생동성 시험을 승인 받았다.그동안 릭시아나 제네릭 개발을 위한 생동성 시험을 찾아보면 총 10건의 식약처 승인이 이뤄졌다.이미 보령, 동아에스티, HK이노엔, 삼진제약, 신일제약, 종근당, 콜마파마, 한국콜마, 한국휴텍스, 한미약품 등 특허 회피에 성공한 10여개 제약사들은 이미 제네릭 허가를 획득하면서 릭시아나 제네릭 17개 품목이 허가 목록에 이름을 올린 상태다.지난해 특허심판을 청구한 테라젠이텍스과 동광제약 또한 최근 청구성립 판결을 받은 바 있다.특허회피에 성공한 국내사들의 경우 오는 2026년 11월 물질특허가 만료 시점에 맞춰 제네릭 출시를 할 수 있게 된다.뒤늦게 제네릭 개발에 나선 제약회사들도 다이이찌산쿄를 상대로 의약 조성물 특허에 대한 소극적 권리범위 확인 심판을 청구하면서 제네릭 출시를 앞당기기 위한 노력을 하고 있다.올해 1월 HLB제약과 3월 삼진제약이 릭시아나 제제특허에 대한 소극적 권리범위확인 심판을 청구한 상황이다.식약처 특허목록집에 등재된 릭시아나 특허는 2026년 11월 만료되는 물질특허와 2028년 8월 만료되는 제제특허가 있다.릭시아나 제제특허에 대한 도전은 지난 2020년부터 시작됐다. 당시 보령을 비롯한 10여개 업체는 2018년 7월 릭시아나 제제특허에 회피 심판을 청구했다. 2년여 만에 특허도전 업체들은 1심에서 승리했다. 다이이찌산쿄의 항소 없이 승리는 확정됐다.2021년 12월 이후로 넥스팜코리아, 동아에스티, 삼성제약, 신일제약, 신풍제약, 안국약품, 일동제약, 제뉴원사이언스, 한국유니온제약, 한국프라임제약, 한국휴텍스제약, 한독이 각각 제네릭 품목허가를 획득했다.릭시아나는 연 1000억원 이상 처방실적으로 DOAC 시장에서 장기간 선두를 유지해오고 있다.의약품 시장조사기관 유비스트에 따르면 지난 2023년 릭시아나의 처방실적은 1053억원이다. 2022년 967억원 대비 9% 증가했다. 지난해 상반기에만 557억원의 처방실적을 기록했다.릭시아나는 2019년 처음 시장 선두에 오른 뒤 꾸준히 선두를 유지하고 있다.대웅제약과의 공동판매 시너지가 처방실적 상승에 긍정적으로 작용했다는 분석도 나온다.2025-06-22 10:16:46이혜경
'릭시아나' 내년 물질특허 만료...제네릭 개발 활발[데일리팜=이혜경 기자] 내년 11월 물질특허 만료를 앞두고 있는 직접작용 경구용 항응고제(DOAC, Direct Oral Anti-Coagulant) '릭시아나(에독사반토실산염수화물)' 제네릭 출시를 위한 국내사들의 움직임이 활발하다.식품의약품안전처는 지난 19일 고려제약이 신청한 '고려에독사반정60mg과 한국다이이찌산쿄 릭시아나정60mg(에독사반토실산염수화물)의 생물학적 동등성 평가를 위한 건강한 성인에서의 공개, 무작위배정, 공복, 단회 경구 투여, 2군, 2기, 교차 시험'을 승인했다.릭시아나 제네릭 개발을 위한 생동성 시험 승인은 이달에만 2건이 이뤄졌다. 고려제약 이전 알리코제약이 지난 9일 '알릭사반정60mg'에 대한 생동성 시험을 승인 받았다.그동안 릭시아나 제네릭 개발을 위한 생동성 시험을 찾아보면 총 10건의 식약처 승인이 이뤄졌다.이미 보령, 동아에스티, HK이노엔, 삼진제약, 신일제약, 종근당, 콜마파마, 한국콜마, 한국휴텍스, 한미약품 등 특허 회피에 성공한 10여개 제약사들은 이미 제네릭 허가를 획득하면서 릭시아나 제네릭 17개 품목이 허가 목록에 이름을 올린 상태다.지난해 특허심판을 청구한 테라젠이텍스과 동광제약 또한 최근 청구성립 판결을 받은 바 있다.특허회피에 성공한 국내사들의 경우 오는 2026년 11월 물질특허가 만료 시점에 맞춰 제네릭 출시를 할 수 있게 된다.뒤늦게 제네릭 개발에 나선 제약회사들도 다이이찌산쿄를 상대로 의약 조성물 특허에 대한 소극적 권리범위 확인 심판을 청구하면서 제네릭 출시를 앞당기기 위한 노력을 하고 있다.올해 1월 HLB제약과 3월 삼진제약이 릭시아나 제제특허에 대한 소극적 권리범위확인 심판을 청구한 상황이다.식약처 특허목록집에 등재된 릭시아나 특허는 2026년 11월 만료되는 물질특허와 2028년 8월 만료되는 제제특허가 있다.릭시아나 제제특허에 대한 도전은 지난 2020년부터 시작됐다. 당시 보령을 비롯한 10여개 업체는 2018년 7월 릭시아나 제제특허에 회피 심판을 청구했다. 2년여 만에 특허도전 업체들은 1심에서 승리했다. 다이이찌산쿄의 항소 없이 승리는 확정됐다.2021년 12월 이후로 넥스팜코리아, 동아에스티, 삼성제약, 신일제약, 신풍제약, 안국약품, 일동제약, 제뉴원사이언스, 한국유니온제약, 한국프라임제약, 한국휴텍스제약, 한독이 각각 제네릭 품목허가를 획득했다.릭시아나는 연 1000억원 이상 처방실적으로 DOAC 시장에서 장기간 선두를 유지해오고 있다.의약품 시장조사기관 유비스트에 따르면 지난 2023년 릭시아나의 처방실적은 1053억원이다. 2022년 967억원 대비 9% 증가했다. 지난해 상반기에만 557억원의 처방실적을 기록했다.릭시아나는 2019년 처음 시장 선두에 오른 뒤 꾸준히 선두를 유지하고 있다.대웅제약과의 공동판매 시너지가 처방실적 상승에 긍정적으로 작용했다는 분석도 나온다.2025-06-22 10:16:46이혜경 -
 다이이찌산쿄, 매출 첫 3천억 돌파…신약 성장세 견인[데일리팜=손형민 기자] 한국다이이찌산쿄가 순환기 품목들과 항체약물접합체(ADC) 항암신약을 앞세워 매출 3000억원을 처음 돌파했다. 한국다이이찌산쿄는 세비카, 릭시아나, 올메텍 등 기존 순환기 품목들의 견고한 성장세와 함께 ADC 신약들로의 세대교체 작업을 성공적으로 진행하고 있다.16일 금융감독원 전자공시시스템에 따르면 한국다이이찌산쿄의 지난해 매출은 3098억원으로 전년 대비 13% 증가했다. 같은 기간 영업이익은 266억원에서 242억원으로 9% 감소했다. 한국다이이찌산쿄는 일본 회계 연도가 적용돼 지난해 4월부터 올해 3월까지를 2024년 매출로 인식하고 있다. 한국다이이찌산쿄의 매출은 2020년부터 꾸준히 늘어나고 있다. 이 회사는 2020년 2179억원으로 처음으로 매출 2000억원을 돌파한 이후 2021년 2454억원, 2022년 2532억원, 2023년 2740억원으로 지속 상승세에 접어들었다.특히 릭시아나, 세비카 등 일부 순환기 품목을 국내 제약사 대웅제약과 협업하며 시너지 효과를 냈다는 분석이다. 한국다이이찌산쿄는 2013년 세비카, 2015년 릭사아나를 대웅제약과 공동판매 계약을 체결하고 현재까지 파트너십 관계를 이어나가고 있다.그중 가장 매출이 높은 건 직접작용 경구용 항응고제(DOAC) 릭시아나다. 시장조사기관 유비스트에 따르면 릭시아나의 지난해 처방액은 1175억원으로, 2023년 1053억원 대비 12% 증가했다.DOAC은 혈액 응고인자에 직접 작용하는 기전으로 혈전을 예방하는 항응고제다. 비타민K의 대사를 억제하는 기전의 와파린을 대체하며 처방현장에서 쓰임새가 확대되고 있다. 국내에는 2009년 자렐토에 이어 2011년 프라닥사·엘리퀴스, 2015년 릭시아나가 차례로 허가됐다.릭시아나는 가운데 가장 늦게 발매됐으나, 임상 데이터를 무기로 빠르게 처방실적을 늘리며 2019년 이후론 시장 선두를 유지하고 있다. 매년 10% 내외의 성장을 반복하며 2019년 604억원이던 처방실적이 5년 만에 2배 가까이 늘었다. 전체 DOAC 시장에서의 점유율도 2019년 33%에서 지난해 45%로 확대됐다.올메사르탄 기반 고혈압 복합제 세비카도 처방액도 선전을 이어나가고 있다. 세비카의 지난해 처방액은 688억원으로 전년 대비 4% 늘었다.글로벌제약사를 비롯해 국내제약사들이 대거 이 시장에 참전했지만, 세비카의 처방액은 지속 늘어나고 있다. 지난 2019년 534억원이었던 세비카의 처방액은 2022년 600억원을 돌파했다. 지난 2023년에는 659억원을 기록하며 5년 연속 처방액이 증가했다.고혈압 3제 복합제 세비카HCT도 성장세를 유지했다. 세비카HCT의 지난해 처방액은 421억원으로 전년 대비 4% 늘었다. 한국다이이찌산쿄는 세비카HCT(421억원), 올메텍(306억원), 세비카(688억원) 등 올메사르탄 기반 고혈압 치료제로만 처방액 1400억원가량을 올렸다.5 ADC 전략…엔허투 이후 R&D 성과 빛보나한국다이이찌산쿄는 순환기 전문 기업에서 항암 분야로 나아가기 위한 작업을 진행하고 있다. 특히 ADC 분야에 R&D 역량을 집중하는 등 새로운 먹거리에 집중하고 있다. 현재 기 허가받은 엔허투 이후에도 다트로웨이, 파틀리투맙데룩스테칸, DS-7300, DS-6000 등 5 ADC 전략을 구사하며 다양한 치료제들의 출시도 준비하고 있다.ADC는 암세포 표면의 특정 표적 항원에 결합하는 항체와 세포사멸 기능을 갖는 약물을 링커로 연결해 만든 항암 신약이다. ADC는 항체의 표적에 대한 선택성과 약물의 사멸 활성을 이용해 약물이 암세포에만 선택적으로 작용하게 함으로써 치료효과는 높이고 부작용은 최소화할 수 있다는 장점이 있다.ADC 항암제 '엔허투'1세대 ADC인 로슈 캐싸일라가 유방암 적응증 확보에 그친 반면 2세대 ADC들은 다양한 적응증 확보에 성공하고 있다.그중 엔허투는 한국다이이찌산쿄가 내놓은 2세대 ADC 신약이다. 엔허투는 암세포 표면에 과발현된 특정 표적 수용체에 결합하는 트라스투주맙과 동일한 구조의 단일클론항체와 고효력의 새로운 기전인 토포이소머라제 I 저해제 페이로드를 종양 선택적 절단 링커로 연결한 차세대 ADC다.현재 엔허투는 HER2 양성 유방암과 위암, 비소세포폐암에 국내 허가를 얻어냈으며 주로 2차 치료제로 활용되고 있다. 현재 유방암 1차 치료제로서의 가능성도 확인 중이다.또 다이이찌산쿄는 2번째 ADC 신약 다트로웨이도 출시 준비 중이다. 이 ADC는 Trop-2 단백질을 타깃하며 현재 유방암 치료제로 미국에서 허가된 바 있다.Trop-2 단백질은 유방암에서 과발현되는 세포막항원으로 특히 삼중음성유방암의 90% 이상에서 과발현된다. 다트로웨이는 Trop-2 단백질과 결합해 세포독성물질을 암세포 내부로 투하한다. 표적항암제와 세포독성항암제의 장점은 살리고 건강한 세포의 손상을 최소화할 수 있는 강점이 있다. 현재 다이이찌산쿄는 엔허투와 다트로웨이를 아스트라제네카와 공동 개발 및 판매 중에 있다.또 다이이찌산쿄는 머크와 ADC를 개발하고 있다. 양사가 개발 중인 HER3를 타깃하는 파틀리투맙은 임상2상 HERTHENA-Lung01 연구에서 백금 기반 항암화학요법 대비 EGFR 변이 환자에게 효과를 보였다.다이이찌산쿄는 HER2 바이오마커를 타깃하는 엔허투 이후 후속 ADC 후보물질 연구를 지속하고 있다. 이 회사는 고형암에서 새로운 바이오마커로 급부상한 B7-H3를 타깃하는 DS-7300과 CDH6 타깃 ADC DS-6000 임상 연구도 머크와 공동 진행 중이다.2025-06-17 06:17:22손형민
다이이찌산쿄, 매출 첫 3천억 돌파…신약 성장세 견인[데일리팜=손형민 기자] 한국다이이찌산쿄가 순환기 품목들과 항체약물접합체(ADC) 항암신약을 앞세워 매출 3000억원을 처음 돌파했다. 한국다이이찌산쿄는 세비카, 릭시아나, 올메텍 등 기존 순환기 품목들의 견고한 성장세와 함께 ADC 신약들로의 세대교체 작업을 성공적으로 진행하고 있다.16일 금융감독원 전자공시시스템에 따르면 한국다이이찌산쿄의 지난해 매출은 3098억원으로 전년 대비 13% 증가했다. 같은 기간 영업이익은 266억원에서 242억원으로 9% 감소했다. 한국다이이찌산쿄는 일본 회계 연도가 적용돼 지난해 4월부터 올해 3월까지를 2024년 매출로 인식하고 있다. 한국다이이찌산쿄의 매출은 2020년부터 꾸준히 늘어나고 있다. 이 회사는 2020년 2179억원으로 처음으로 매출 2000억원을 돌파한 이후 2021년 2454억원, 2022년 2532억원, 2023년 2740억원으로 지속 상승세에 접어들었다.특히 릭시아나, 세비카 등 일부 순환기 품목을 국내 제약사 대웅제약과 협업하며 시너지 효과를 냈다는 분석이다. 한국다이이찌산쿄는 2013년 세비카, 2015년 릭사아나를 대웅제약과 공동판매 계약을 체결하고 현재까지 파트너십 관계를 이어나가고 있다.그중 가장 매출이 높은 건 직접작용 경구용 항응고제(DOAC) 릭시아나다. 시장조사기관 유비스트에 따르면 릭시아나의 지난해 처방액은 1175억원으로, 2023년 1053억원 대비 12% 증가했다.DOAC은 혈액 응고인자에 직접 작용하는 기전으로 혈전을 예방하는 항응고제다. 비타민K의 대사를 억제하는 기전의 와파린을 대체하며 처방현장에서 쓰임새가 확대되고 있다. 국내에는 2009년 자렐토에 이어 2011년 프라닥사·엘리퀴스, 2015년 릭시아나가 차례로 허가됐다.릭시아나는 가운데 가장 늦게 발매됐으나, 임상 데이터를 무기로 빠르게 처방실적을 늘리며 2019년 이후론 시장 선두를 유지하고 있다. 매년 10% 내외의 성장을 반복하며 2019년 604억원이던 처방실적이 5년 만에 2배 가까이 늘었다. 전체 DOAC 시장에서의 점유율도 2019년 33%에서 지난해 45%로 확대됐다.올메사르탄 기반 고혈압 복합제 세비카도 처방액도 선전을 이어나가고 있다. 세비카의 지난해 처방액은 688억원으로 전년 대비 4% 늘었다.글로벌제약사를 비롯해 국내제약사들이 대거 이 시장에 참전했지만, 세비카의 처방액은 지속 늘어나고 있다. 지난 2019년 534억원이었던 세비카의 처방액은 2022년 600억원을 돌파했다. 지난 2023년에는 659억원을 기록하며 5년 연속 처방액이 증가했다.고혈압 3제 복합제 세비카HCT도 성장세를 유지했다. 세비카HCT의 지난해 처방액은 421억원으로 전년 대비 4% 늘었다. 한국다이이찌산쿄는 세비카HCT(421억원), 올메텍(306억원), 세비카(688억원) 등 올메사르탄 기반 고혈압 치료제로만 처방액 1400억원가량을 올렸다.5 ADC 전략…엔허투 이후 R&D 성과 빛보나한국다이이찌산쿄는 순환기 전문 기업에서 항암 분야로 나아가기 위한 작업을 진행하고 있다. 특히 ADC 분야에 R&D 역량을 집중하는 등 새로운 먹거리에 집중하고 있다. 현재 기 허가받은 엔허투 이후에도 다트로웨이, 파틀리투맙데룩스테칸, DS-7300, DS-6000 등 5 ADC 전략을 구사하며 다양한 치료제들의 출시도 준비하고 있다.ADC는 암세포 표면의 특정 표적 항원에 결합하는 항체와 세포사멸 기능을 갖는 약물을 링커로 연결해 만든 항암 신약이다. ADC는 항체의 표적에 대한 선택성과 약물의 사멸 활성을 이용해 약물이 암세포에만 선택적으로 작용하게 함으로써 치료효과는 높이고 부작용은 최소화할 수 있다는 장점이 있다.ADC 항암제 '엔허투'1세대 ADC인 로슈 캐싸일라가 유방암 적응증 확보에 그친 반면 2세대 ADC들은 다양한 적응증 확보에 성공하고 있다.그중 엔허투는 한국다이이찌산쿄가 내놓은 2세대 ADC 신약이다. 엔허투는 암세포 표면에 과발현된 특정 표적 수용체에 결합하는 트라스투주맙과 동일한 구조의 단일클론항체와 고효력의 새로운 기전인 토포이소머라제 I 저해제 페이로드를 종양 선택적 절단 링커로 연결한 차세대 ADC다.현재 엔허투는 HER2 양성 유방암과 위암, 비소세포폐암에 국내 허가를 얻어냈으며 주로 2차 치료제로 활용되고 있다. 현재 유방암 1차 치료제로서의 가능성도 확인 중이다.또 다이이찌산쿄는 2번째 ADC 신약 다트로웨이도 출시 준비 중이다. 이 ADC는 Trop-2 단백질을 타깃하며 현재 유방암 치료제로 미국에서 허가된 바 있다.Trop-2 단백질은 유방암에서 과발현되는 세포막항원으로 특히 삼중음성유방암의 90% 이상에서 과발현된다. 다트로웨이는 Trop-2 단백질과 결합해 세포독성물질을 암세포 내부로 투하한다. 표적항암제와 세포독성항암제의 장점은 살리고 건강한 세포의 손상을 최소화할 수 있는 강점이 있다. 현재 다이이찌산쿄는 엔허투와 다트로웨이를 아스트라제네카와 공동 개발 및 판매 중에 있다.또 다이이찌산쿄는 머크와 ADC를 개발하고 있다. 양사가 개발 중인 HER3를 타깃하는 파틀리투맙은 임상2상 HERTHENA-Lung01 연구에서 백금 기반 항암화학요법 대비 EGFR 변이 환자에게 효과를 보였다.다이이찌산쿄는 HER2 바이오마커를 타깃하는 엔허투 이후 후속 ADC 후보물질 연구를 지속하고 있다. 이 회사는 고형암에서 새로운 바이오마커로 급부상한 B7-H3를 타깃하는 DS-7300과 CDH6 타깃 ADC DS-6000 임상 연구도 머크와 공동 진행 중이다.2025-06-17 06:17:22손형민 -
 7년만에 '릭시아나' 제네릭 특허 재도전...이유는?[데일리팜=김진구 기자] 제네릭사들이 다이이찌산쿄의 직접작용 경구용 항응고제(DOAC) ‘릭시아나(에독사반)’ 제제특허에 뒤늦게 도전장을 내고 있다. 이 특허에 대한 회피 심판 청구가 지난 2018년 동시다발로 진행된 점을 감안하면, 약 7년의 간격을 두고 두 번째 도전 행렬이 이어지는 셈이다.릭시아나의 물질특허 만료가 1년 반 앞으로 다가왔기 때문으로 풀이된다. 최근 심판을 청구한 업체들은 내년 11월 물질특허 만료 시점에 맞춰 제네릭을 발매한다는 방침이다. 지난 7년 새 릭시아나가 DOAC 시장 1위 제품으로 올라선 점도 제네릭사들의 늦깎이 도전 이유로 꼽힌다.릭시아나 물질특허 내년 11월 만료…제네릭 조기발매 노린 특허도전 잇달아10일 제약업계에 따르면 테라젠이텍스과 동광제약은 최근 특허심판원으로부터 릭시아나 제제특허에 대한 소극적 권리범위확인 심판에서 ‘청구 성립’ 심결을 받았다. 두 회사는 지난해 8월과 9월 연이어 해당 심판을 청구한 바 있다.두 회사를 포함해 최근 1년 새 릭시아나 제제특허에 도전장을 낸 업체는 4개에 달한다. HLB제약은 올해 1월, 삼진제약은 올해 3월 각각 같은 특허에 회피 심판을 청구했다. 동일한 특허에 대한 동일한 방식의 심판 청구라는 점에서 HLB제약과 삼진제약도 승리할 가능성이 높게 점쳐진다.릭시아나 제제특허에 대한 도전은 지난 2020년 일단락된 바 있다. 당시 보령을 비롯한 10여개 업체는 2018년 7월 릭시아나 제제특허에 회피 심판을 청구했다. 2년여 만에 특허도전 업체들은 1심에서 승리했다. 다이이찌산쿄의 항소 없이 이 승리는 확정됐다.1심 승리를 근거로 특허도전 업체들은 제네릭 품목허가까지 받아둔 상태다. 2021년 12월 이후로 넥스팜코리아, 동아에스티, 삼성제약, 신일제약, 신풍제약, 안국약품, 일동제약, 제뉴원사이언스, 한국유니온제약, 한국프라임제약, 한국휴텍스제약, 한독이 각각 제네릭 품목허가를 획득했다.기존 특허도전 시점으로부터 약 7년, 1심 승리 시점으로부터 약 5년 만에 제네릭사들의 특허도전이 재개된 셈이다.제약업계에선 릭시아나의 물질특허 만료 시점이 가까워졌기 때문이라는 분석이 나온다. 식품의약품안전처 특허목록집에 등재된 릭시아나 특허는 2개로, 2026년 11월 만료되는 물질특허와 2028년 8월 만료되는 제제특허다.제네릭사들은 제제특허를 회피한 상태로 내년 11월 물질특허 만료 시점에 맞춰 릭시아나 제네릭을 조기 발매한다는 계획이다. 기존에 릭시아나 제네릭을 허가받은 12개 업체뿐 아니라, 최근 도전에 나선 4개 업체들도 내년 말 릭시아나 제네릭 발매에 나설 것으로 전망된다.릭시아나, 7년 전과 달라진 위상…시장 1위 독주에 제네릭사 특허도전 관심↑7년 전과 릭시아나의 위상이 달라진 점도 제네릭사들의 늦깎이 특허도전 이유로 설명된다.릭시아나는 DOAC 계열 약물 가운데 가장 늦게 출시됐다. 국내에선 2009년 자렐토(리바록사반)에 이어 2011년 프라닥사(다비가트란)와 엘리퀴스(아픽사반)가, 2015년 릭시아나가 차례로 허가됐다. 발매 초기엔 자렐토·릭시아나에 밀려 힘을 쓰지 못했다.특히 제네릭사의 특허 도전이 잇따르던 2018년의 경우 자렐토와 릭시아나에 이어 DOAC 시장 3위에 자리하던 상황이었다. 그러나 이듬해 릭시아나는 시장 1위로 올라섰다. 국내 공동판매 파트너사로 대웅제약과 손을 잡은 점이 후발주자임에도 빠르게 처방실적을 늘릴 수 있었던 원인 중 하나로 꼽힌다.자렐토와 릭시아나의 물질특허가 잇달아 만료되면서 관련 제네릭이 시장에 가세한 이후론 독주체제를 더욱 굳히는 모습이다. 의약품 시장조사기관 유비스트에 따르면 릭시아나의 지난해 처방실적은 전년대비 12% 증가한 1175억원에 달한다. 전체 DOAC 시장에서의 점유율은 2023년 33%에서 지난해 45%로 확대됐다. 반면 자렐토와 릭시아나는 제네릭 진입과 약가 인하의 여파로 처방실적이 전년대비 감소했다. 연 1200억원에 가까운 처방실적으로 릭시아나의 독주체제가 굳어지는 상황에서 제네릭사들의 관심도 덩달아 커졌다는 분석이다.제약업계에선 향후 릭시아나 제제특허에 대한 도전이 더욱 늘어날 가능성에 주목한다. 이미 씨엠지제약과 한림제약, 비보존제약은 릭시아나 제네릭 허가를 위한 생동성시험을 진행 중이다. 이들이 제네릭을 조기 발매하려면 릭시아나 제제특허를 회피해야 한다. 이들 외에도 1~2개 업체가 릭시아나 제제특허 회피 도전에 나설 것이란 전망이 나온다.DOAC은 혈액 응고인자에 직접 작용하는 기전으로 혈전을 예방하는 항응고제다. 비타민K의 대사를 억제하는 기전의 와파린을 대체하며 처방현장에서 쓰임새가 확대되고 있다. 제품이 처음 등장했을 땐 새로운 경구용 항응고제라는 의미의 NOAC(New Oral Anti-Coagulant)이란 용어로 통용됐으나, 첫 허가 후 10년 넘게 지난 최근엔 응고인자에 직접 작용한다는 의미의 DOAC(Direct Oral Anti-Coagulant)이란 용어로 대체되는 중이다.2025-06-11 06:19:05김진구
7년만에 '릭시아나' 제네릭 특허 재도전...이유는?[데일리팜=김진구 기자] 제네릭사들이 다이이찌산쿄의 직접작용 경구용 항응고제(DOAC) ‘릭시아나(에독사반)’ 제제특허에 뒤늦게 도전장을 내고 있다. 이 특허에 대한 회피 심판 청구가 지난 2018년 동시다발로 진행된 점을 감안하면, 약 7년의 간격을 두고 두 번째 도전 행렬이 이어지는 셈이다.릭시아나의 물질특허 만료가 1년 반 앞으로 다가왔기 때문으로 풀이된다. 최근 심판을 청구한 업체들은 내년 11월 물질특허 만료 시점에 맞춰 제네릭을 발매한다는 방침이다. 지난 7년 새 릭시아나가 DOAC 시장 1위 제품으로 올라선 점도 제네릭사들의 늦깎이 도전 이유로 꼽힌다.릭시아나 물질특허 내년 11월 만료…제네릭 조기발매 노린 특허도전 잇달아10일 제약업계에 따르면 테라젠이텍스과 동광제약은 최근 특허심판원으로부터 릭시아나 제제특허에 대한 소극적 권리범위확인 심판에서 ‘청구 성립’ 심결을 받았다. 두 회사는 지난해 8월과 9월 연이어 해당 심판을 청구한 바 있다.두 회사를 포함해 최근 1년 새 릭시아나 제제특허에 도전장을 낸 업체는 4개에 달한다. HLB제약은 올해 1월, 삼진제약은 올해 3월 각각 같은 특허에 회피 심판을 청구했다. 동일한 특허에 대한 동일한 방식의 심판 청구라는 점에서 HLB제약과 삼진제약도 승리할 가능성이 높게 점쳐진다.릭시아나 제제특허에 대한 도전은 지난 2020년 일단락된 바 있다. 당시 보령을 비롯한 10여개 업체는 2018년 7월 릭시아나 제제특허에 회피 심판을 청구했다. 2년여 만에 특허도전 업체들은 1심에서 승리했다. 다이이찌산쿄의 항소 없이 이 승리는 확정됐다.1심 승리를 근거로 특허도전 업체들은 제네릭 품목허가까지 받아둔 상태다. 2021년 12월 이후로 넥스팜코리아, 동아에스티, 삼성제약, 신일제약, 신풍제약, 안국약품, 일동제약, 제뉴원사이언스, 한국유니온제약, 한국프라임제약, 한국휴텍스제약, 한독이 각각 제네릭 품목허가를 획득했다.기존 특허도전 시점으로부터 약 7년, 1심 승리 시점으로부터 약 5년 만에 제네릭사들의 특허도전이 재개된 셈이다.제약업계에선 릭시아나의 물질특허 만료 시점이 가까워졌기 때문이라는 분석이 나온다. 식품의약품안전처 특허목록집에 등재된 릭시아나 특허는 2개로, 2026년 11월 만료되는 물질특허와 2028년 8월 만료되는 제제특허다.제네릭사들은 제제특허를 회피한 상태로 내년 11월 물질특허 만료 시점에 맞춰 릭시아나 제네릭을 조기 발매한다는 계획이다. 기존에 릭시아나 제네릭을 허가받은 12개 업체뿐 아니라, 최근 도전에 나선 4개 업체들도 내년 말 릭시아나 제네릭 발매에 나설 것으로 전망된다.릭시아나, 7년 전과 달라진 위상…시장 1위 독주에 제네릭사 특허도전 관심↑7년 전과 릭시아나의 위상이 달라진 점도 제네릭사들의 늦깎이 특허도전 이유로 설명된다.릭시아나는 DOAC 계열 약물 가운데 가장 늦게 출시됐다. 국내에선 2009년 자렐토(리바록사반)에 이어 2011년 프라닥사(다비가트란)와 엘리퀴스(아픽사반)가, 2015년 릭시아나가 차례로 허가됐다. 발매 초기엔 자렐토·릭시아나에 밀려 힘을 쓰지 못했다.특히 제네릭사의 특허 도전이 잇따르던 2018년의 경우 자렐토와 릭시아나에 이어 DOAC 시장 3위에 자리하던 상황이었다. 그러나 이듬해 릭시아나는 시장 1위로 올라섰다. 국내 공동판매 파트너사로 대웅제약과 손을 잡은 점이 후발주자임에도 빠르게 처방실적을 늘릴 수 있었던 원인 중 하나로 꼽힌다.자렐토와 릭시아나의 물질특허가 잇달아 만료되면서 관련 제네릭이 시장에 가세한 이후론 독주체제를 더욱 굳히는 모습이다. 의약품 시장조사기관 유비스트에 따르면 릭시아나의 지난해 처방실적은 전년대비 12% 증가한 1175억원에 달한다. 전체 DOAC 시장에서의 점유율은 2023년 33%에서 지난해 45%로 확대됐다. 반면 자렐토와 릭시아나는 제네릭 진입과 약가 인하의 여파로 처방실적이 전년대비 감소했다. 연 1200억원에 가까운 처방실적으로 릭시아나의 독주체제가 굳어지는 상황에서 제네릭사들의 관심도 덩달아 커졌다는 분석이다.제약업계에선 향후 릭시아나 제제특허에 대한 도전이 더욱 늘어날 가능성에 주목한다. 이미 씨엠지제약과 한림제약, 비보존제약은 릭시아나 제네릭 허가를 위한 생동성시험을 진행 중이다. 이들이 제네릭을 조기 발매하려면 릭시아나 제제특허를 회피해야 한다. 이들 외에도 1~2개 업체가 릭시아나 제제특허 회피 도전에 나설 것이란 전망이 나온다.DOAC은 혈액 응고인자에 직접 작용하는 기전으로 혈전을 예방하는 항응고제다. 비타민K의 대사를 억제하는 기전의 와파린을 대체하며 처방현장에서 쓰임새가 확대되고 있다. 제품이 처음 등장했을 땐 새로운 경구용 항응고제라는 의미의 NOAC(New Oral Anti-Coagulant)이란 용어로 통용됐으나, 첫 허가 후 10년 넘게 지난 최근엔 응고인자에 직접 작용한다는 의미의 DOAC(Direct Oral Anti-Coagulant)이란 용어로 대체되는 중이다.2025-06-11 06:19:05김진구 -
 "심방세동 조기치료, 웨어러블 심전도+NOAC 효과"최상웅 원장. [데일리팜=노병철 기자] 고령화로 인해 급증하는 심방세동(AF) 환자에 대한 조기 진단과 효과적인 치료가 1차 의료 현장에서 더욱 중요해지고 있다. 특히 증상이 불규칙하게 나타나는 부정맥 특성상, 간헐적인 이상을 포착하고 항응고 치료로 연결하는 시스템 마련이 필수다.특히 최상웅 심튼튼내과 원장은 웨어러블 심전도 기기 ‘모비케어(mobiCARE)’와 항응고제 ‘릭시아나(에독사반)’의 임상적 활용 등을 비롯한 최신지견을 가진 전문의로 관련 치료분야 발전에 상당한 기여를 하고 있어 학계의 주목을 받고 있다.최상웅 원장은 “심방세동 환자 2명 중 1명은 진단 후 6개월 이내 항응고 치료를 받지 못한다”며 “이들 중 다수는 무증상 상태로 병을 지나치고, 결국 치명적인 뇌졸중으로 이어지게 된다”고 설명했다.심방세동 동반 뇌졸중은 일반 뇌졸중 대비 사망률과 후유증 위험이 훨씬 높아, 조기 진단과 치료가 핵심 과제로 떠오르고 있다.모비케어와 같은 웨어러블 심전도 기기를 활용하면 무증상 또는 간헐성 부정맥 환자의 조기 진단 가능성이 높아진다.최 원장은 “기존의 10초짜리 심전도나 홀터(Holter) 검사로는 포착되지 않던 부정맥이, 장기간 모니터링으로 명확히 드러난 사례가 많았다”고 전했다.한 사례로, 운동 중 두근거림을 느껴 내원한 한 50대 남성 환자의 경우 기본 심전도 검사에서는 정상 소견이었으나, 간단한 운동 시에도 불편함 없이 착용 가능한 모비케어 부착을 통해 심방세동 소견이 포착되었고 적절한 치료로 연계될 수 있었다.1차 의료기관에서 진단 이후 치료로 이어지지 않는 사례가 많다. 그 이유는 심방세동 치료는 ▲항응고제 치료 시작 유무 ▲맥박(rate) 조절 ▲동율동 전환(rhythm control) ▲기저질환 및 합병증 관리 등 네 가지 목표가 있고 이들이 동시에 관리돼야하는데 ,실제 진료 현장에서는 처방 약제가 생소하거나 처방 기준에 대한 경험과 확신이 부족하고, 항응고제에 따른 출혈이나 서맥, 저혈압 같은 부작용에 대한 우려가 있어 의사 입장에서 치료에 대한 허들이 존재하기 때문이다. 또한 환자 스스로 질환의 심각성을 인지하지 못하는 경우도 많다.이를 극복하기 위한 방안으로는 최 원장은 “진단 기기 사용에 대한 경험 공유, 치료 적응증에 대한 명확한 가이드라인, 실제 사례 중심의 교육 등이 필요하다”며 “건강보험 급여 적용 확대 등 제도적 지원도 병행되어야 한다”고 말했다.웨어러블 기기의 진료 현장 효과에 대해 그는 “기존 홀터보다 환자의 거부감이 적고, 탈부착이 쉬워 순응도가 높다. 데이터 분석도 AI 기반으로 정확해진 만큼, 진단 결과에 대한 신뢰도도 향상됐다”고 밝혔다. 또한 “모비케어 도입 후부터 진단에서 항응고 치료로 이어지는 전환율이 실제로 높아졌다”며 “이런 흐름이 1차 의료기관의 진료 패러다임을 바꾸고 있다”고 덧붙였다.항응고 치료 약제 선택과 관련해 최 원장은 “환자의 기저질환, 심장 상태,환자의 복약 순응도, 안전성, 생활 패턴 등을 종합적으로 고려해 처방한다”며 “릭시아나는 하루 한 번, 식사와 관계없이 복용할 수 있어 고령 환자나 만성 질환자에게 비교적 편리하고 안전한 옵션이 될 수 있다”고 설명했다.이어 “복약 편의성은 치료 지속률과 직결되는 만큼 중요하다”며 “혼자 생활하시는 어르신이나 복용 약이 많은 분들에게는 투약 스케줄이 단순한 게 큰 장점”이라고 강조했다.덧붙여 “심방세동 환자 중에는 약을 하루 한번만 복용할 수 있도록 조정해 달라는 요청이 많고,실제로 하루한번 투약으로 변경한 후에는 ‘복약 부담이 줄어 좋다’는 반응을 자주 듣는다”고 말했다.또 다른 고려 요소로는 고령, 신기능 저하 등이 있는데 이런 환자들의 경우 체중, 나이, 신장 상태 등을 종합적으로 판단해 처방해야 하지만 릭시아나는 용량 조정 기준이 명확하고 다양한 환자군에서 안전성과 효과가 검증돼 있어 진료 현장에서 예측 가능한 선택지다.기존에 아스피린(aspirin)이나 클로피도그렐(clopidogrel) 등 항혈소판제를 복용하던 환자에서 항응고제 처방이 필요한 경우에도 릭시아나가 유용하다는 입장이다.최 원장은 “병용이 필요한 경우라도 최소 기간 사용 후에는 단일 항응고제로 정리하는 것이 원칙이며, 복약 이행률이나 용량 조절의 편의성을 고려해 릭시아나를 우선 고려한다”고 말했다.최 원장은 항응고제 처방에 부담을 느끼는 1차 의료기관 의료진들에게하고 싶은 말이 있다고 전했다.그는 “처음에는 누구나 항응고제를 쓰는 데 부담을 느낀다. 출혈에 대한 걱정이 크기 때문이다. 하지만 CHA₂DS₂-VASc 점수를 기준으로 환자 상태를 정확히 설명드리면, 대부분의 환자분들도 치료 필요성을 잘 이해하고 따라오신다. 너무 어렵게 접근하지 마시고, 표준화된 진료 절차와 데이터를 기반으로 설명하시면 충분히 설득이 된다”고 전했다.이어 “1차 의료기관은 심방세동 관리의 가장 앞단에 있는 접점”이라며 “단순 진단을 넘어 치료 결정, 약제 선택, 순응도 관리까지 전반을 책임지는 역할을 할 수 있어야 한다. 웨어러블 기기나 데이터 기반 치료 전략이 이를 뒷받침해줄 수 있는 시대이기 때문에, 의료진이 보다 능동적으로 접근할 필요가 있다”고 제언했다.2025-06-04 06:00:04노병철
"심방세동 조기치료, 웨어러블 심전도+NOAC 효과"최상웅 원장. [데일리팜=노병철 기자] 고령화로 인해 급증하는 심방세동(AF) 환자에 대한 조기 진단과 효과적인 치료가 1차 의료 현장에서 더욱 중요해지고 있다. 특히 증상이 불규칙하게 나타나는 부정맥 특성상, 간헐적인 이상을 포착하고 항응고 치료로 연결하는 시스템 마련이 필수다.특히 최상웅 심튼튼내과 원장은 웨어러블 심전도 기기 ‘모비케어(mobiCARE)’와 항응고제 ‘릭시아나(에독사반)’의 임상적 활용 등을 비롯한 최신지견을 가진 전문의로 관련 치료분야 발전에 상당한 기여를 하고 있어 학계의 주목을 받고 있다.최상웅 원장은 “심방세동 환자 2명 중 1명은 진단 후 6개월 이내 항응고 치료를 받지 못한다”며 “이들 중 다수는 무증상 상태로 병을 지나치고, 결국 치명적인 뇌졸중으로 이어지게 된다”고 설명했다.심방세동 동반 뇌졸중은 일반 뇌졸중 대비 사망률과 후유증 위험이 훨씬 높아, 조기 진단과 치료가 핵심 과제로 떠오르고 있다.모비케어와 같은 웨어러블 심전도 기기를 활용하면 무증상 또는 간헐성 부정맥 환자의 조기 진단 가능성이 높아진다.최 원장은 “기존의 10초짜리 심전도나 홀터(Holter) 검사로는 포착되지 않던 부정맥이, 장기간 모니터링으로 명확히 드러난 사례가 많았다”고 전했다.한 사례로, 운동 중 두근거림을 느껴 내원한 한 50대 남성 환자의 경우 기본 심전도 검사에서는 정상 소견이었으나, 간단한 운동 시에도 불편함 없이 착용 가능한 모비케어 부착을 통해 심방세동 소견이 포착되었고 적절한 치료로 연계될 수 있었다.1차 의료기관에서 진단 이후 치료로 이어지지 않는 사례가 많다. 그 이유는 심방세동 치료는 ▲항응고제 치료 시작 유무 ▲맥박(rate) 조절 ▲동율동 전환(rhythm control) ▲기저질환 및 합병증 관리 등 네 가지 목표가 있고 이들이 동시에 관리돼야하는데 ,실제 진료 현장에서는 처방 약제가 생소하거나 처방 기준에 대한 경험과 확신이 부족하고, 항응고제에 따른 출혈이나 서맥, 저혈압 같은 부작용에 대한 우려가 있어 의사 입장에서 치료에 대한 허들이 존재하기 때문이다. 또한 환자 스스로 질환의 심각성을 인지하지 못하는 경우도 많다.이를 극복하기 위한 방안으로는 최 원장은 “진단 기기 사용에 대한 경험 공유, 치료 적응증에 대한 명확한 가이드라인, 실제 사례 중심의 교육 등이 필요하다”며 “건강보험 급여 적용 확대 등 제도적 지원도 병행되어야 한다”고 말했다.웨어러블 기기의 진료 현장 효과에 대해 그는 “기존 홀터보다 환자의 거부감이 적고, 탈부착이 쉬워 순응도가 높다. 데이터 분석도 AI 기반으로 정확해진 만큼, 진단 결과에 대한 신뢰도도 향상됐다”고 밝혔다. 또한 “모비케어 도입 후부터 진단에서 항응고 치료로 이어지는 전환율이 실제로 높아졌다”며 “이런 흐름이 1차 의료기관의 진료 패러다임을 바꾸고 있다”고 덧붙였다.항응고 치료 약제 선택과 관련해 최 원장은 “환자의 기저질환, 심장 상태,환자의 복약 순응도, 안전성, 생활 패턴 등을 종합적으로 고려해 처방한다”며 “릭시아나는 하루 한 번, 식사와 관계없이 복용할 수 있어 고령 환자나 만성 질환자에게 비교적 편리하고 안전한 옵션이 될 수 있다”고 설명했다.이어 “복약 편의성은 치료 지속률과 직결되는 만큼 중요하다”며 “혼자 생활하시는 어르신이나 복용 약이 많은 분들에게는 투약 스케줄이 단순한 게 큰 장점”이라고 강조했다.덧붙여 “심방세동 환자 중에는 약을 하루 한번만 복용할 수 있도록 조정해 달라는 요청이 많고,실제로 하루한번 투약으로 변경한 후에는 ‘복약 부담이 줄어 좋다’는 반응을 자주 듣는다”고 말했다.또 다른 고려 요소로는 고령, 신기능 저하 등이 있는데 이런 환자들의 경우 체중, 나이, 신장 상태 등을 종합적으로 판단해 처방해야 하지만 릭시아나는 용량 조정 기준이 명확하고 다양한 환자군에서 안전성과 효과가 검증돼 있어 진료 현장에서 예측 가능한 선택지다.기존에 아스피린(aspirin)이나 클로피도그렐(clopidogrel) 등 항혈소판제를 복용하던 환자에서 항응고제 처방이 필요한 경우에도 릭시아나가 유용하다는 입장이다.최 원장은 “병용이 필요한 경우라도 최소 기간 사용 후에는 단일 항응고제로 정리하는 것이 원칙이며, 복약 이행률이나 용량 조절의 편의성을 고려해 릭시아나를 우선 고려한다”고 말했다.최 원장은 항응고제 처방에 부담을 느끼는 1차 의료기관 의료진들에게하고 싶은 말이 있다고 전했다.그는 “처음에는 누구나 항응고제를 쓰는 데 부담을 느낀다. 출혈에 대한 걱정이 크기 때문이다. 하지만 CHA₂DS₂-VASc 점수를 기준으로 환자 상태를 정확히 설명드리면, 대부분의 환자분들도 치료 필요성을 잘 이해하고 따라오신다. 너무 어렵게 접근하지 마시고, 표준화된 진료 절차와 데이터를 기반으로 설명하시면 충분히 설득이 된다”고 전했다.이어 “1차 의료기관은 심방세동 관리의 가장 앞단에 있는 접점”이라며 “단순 진단을 넘어 치료 결정, 약제 선택, 순응도 관리까지 전반을 책임지는 역할을 할 수 있어야 한다. 웨어러블 기기나 데이터 기반 치료 전략이 이를 뒷받침해줄 수 있는 시대이기 때문에, 의료진이 보다 능동적으로 접근할 필요가 있다”고 제언했다.2025-06-04 06:00:04노병철 -
 "이건 찍어야 돼"...약사들 카메라 들게 한 약제부 탐방방문한 약사들이 시운행 중인 약품검수시스템에 대한 설명을 듣고 있다. [데일리팜=정흥준 기자] "국내 최고 수준의 병원 약제부는 어떤 시스템으로 운영되는 지 궁금했어요."ATC 조제 후 자동검수시스템, 항암제조제로봇, 환자별 1회 용량 단위 조제인 UDS(Unit Dose System)까지 서울대병원 약제부의 선진 시스템이 약사들의 눈길을 사로잡았다.한국병원약사회는 올해 처음으로 전국 약제부 중간관리자급 약사들을 대상으로 병원 견학프로그램을 운영했다. 서울대병원과 용인세브란스병원, 삼성서울병원으로 나뉘어 각 10여명의 약사들이 참여했다.서울대병원 약제부는 16일 오후 전국에서 모인 11명의 약사들이 방문했다. 고대안산병원, 공단일산병원, 강남차병원, 강북삼성병원, 건대병원, 영남대병원, 길병원, 동강병원, 명지병원, 창원파티마병원, 한림대성심병원 약제부에서 각 1명씩 참석했다.서울대병원 약제부는 전공약사 포함 130여명의 약사들이 근무하고 있다. 약사들은 약품관리파트와 정보기획팀, 약물안전센터, 항생제관리팀, 핵의학과, 임상시험센터 등 원내 곳곳에서 활동하고 있다.견학에 앞서 백진희 약제부장과 정애희 약무과장이 약제부 시설과 인력, 운영 모토에 대한 설명으로 약사들을 맞이했다.이날 견학은 약 2시간에 걸쳐 진행됐다. ▲약품관리 ▲주사조제 ▲입원조제 ▲소아조제 ▲외래조제 ▲암진료조제 ▲임상시험센터를 함께 돌아다니며 내부 시설과 업무 방식을 직접 살펴볼 수 있었다.약품관리실에 들어가 적재된 약들을 보며, 재고 관리 방안 등에 대한 설명을 들었다. 제제실 내부에서 칭량실과 원료보관실 등 각종 시설들을 살펴보고 있다. 11명의 약사들은 장소를 옮길 때마다 수시로 핸드폰을 꺼내 조제실에 보관된 약의 라벨링, UDS를 위한 카트 장비, 자동검수시스템, 소아를 위한 산제 조제시설까지 하나하나 촬영하며 사진으로 남겼다.약사들은 각 파트별 담당 약사에게 업무 관련 질문을 하며 견학 도중 생기는 궁금증을 바로 해결할 수 있었다.“적정 재고량은 어느 정도 기간으로 계산하나요, 주사제 조제 내부 공조는 어떻게 관리하나요. 병동약 불출과 반납약 관리는 어떻게 하나요. 소아조제 클린벤치는 어떤 식으로 설치돼있나요.”특히 서울대병원을 비롯해 일부 병원들이 도입하고 있는 UDS 시스템에 대한 궁금증도 많았다. 환자에게 맞는 1회 용량 단일포장으로 병동에 약을 공급하고, 이를 활용해 반납약도 관리하는 업무 구조에 대해 실무적인 질의응답이 오갔다.또 항암조제로봇에 많은 관심이 집중됐다. 약사들은 로봇팔에 의해 조제되는 과정을 함께 지켜보면서, 조제에 걸리는 소요 시간부터 남은 바이알은 어떻게 관리되는지, 수액에도 활용할 수 있는지 등 다양한 질문이 쏟아졌다.항암제 조제로봇의 작동 모습을 함께 살펴보고 있는 약사들. 소아 산제 중 다빈도 처방되는 일부 예비조제 관리가 어떻게 이뤄지는지 공유하고 있다. 성인외래조제 파트에서는 조제, 검수 방식뿐만 아니라 병원형 다제약물관리사업이 어떻게 운영되고 있는지 소개했다. 이외에도 항응고상담을 하는 공용상담실, 식별정보와 의료진 질의사항 등에서 역할을 의약정보 파트를 둘러보기도 했다.약사 업무 공간이 병원 곳곳에 배치돼있기 때문에 지하와 지상을 오가며 약 2시간에 걸친 견학을 마쳤다. 마무리 질의로 남아있는 궁금증들을 해소하며 견학 프로그램은 종료됐다.정애희 약무과장은 “우리 병원은 ADC를 13개 도입하고, 올해 어린이병원에 2대 추가될 예정이다. 2020년 응급실 2대로 시작해 2024년까지 꾸준히 늘어났다”면서 “환자안전 고취를 위해 교육실무위원회, 안전관리위원회, 임상약료위원회 활동을 하며 정기적인 교육을 하고 있다”고 설명했다.또 지난 2020년 약제부 환자상담&미래위원회를 시작으로 매년 확대하면서, 약사를 대상으로 멘토클라스(마음처방사) 활동을 이어가고 있다고 덧붙였다.백진희 약제부장은 “자신을 돌아보면서 병원에서 생활하는 동안 성장하고, 타인을 존중 배려하는 조직 문화에 신경 쓰고 있다”면서 “또 업무를 표준화하려고 하고 있다. 신입 직원들은 환자 상담에 대한 커뮤니케이션 스킬을 강화하기 위해 환자 역할을 맡아보는 롤플레잉식 교육도 진행하고 있다”고 했다.환자 항응고제 상담이 이뤄지는 공용상담실 내부도 들여다보고 있다. 서울대병원의 다제약물관리사업 병원모형 운영 현황에 대해서도 소개했다. 견학에 참석하기 위해 지방에서 올라온 약사들은 “견학 시간이 짧게 느껴졌다”며 높은 만족도를 보였다.동강병원 주지은 약사는 “병원 곳곳을 둘러볼 수 있도록 준비해줘서 감사하다. 참고할 만한 내용들이 많았다. 물론 병원 여건에 따라 도입하기 어려운 시스템도 있겠지만, 발전할 수 있는 방향에 대해 생각해볼 수 있는 시간이었다”고 했다.창원파티마병원 최현지 약사는 “장비도 눈에 들어왔지만 그보다는 UDS(Unit Dose System)을 통한 개별약 포장, 반납약 관리 등 환자안전을 위해 도입한 업무 방식들이 인상 깊었다”면서 “각 파트별로 궁금한 것들이 많았다. 다음에는 파트별로 나눠 세부 프로그램을 만들어주시면 좋겠다. 국내 최고 병원에 대한 관심으로 왔는데 둘러보면서 의욕이 생겨 돌아간다”고 참여 소감을 밝혔다.2025-05-18 15:27:08정흥준
"이건 찍어야 돼"...약사들 카메라 들게 한 약제부 탐방방문한 약사들이 시운행 중인 약품검수시스템에 대한 설명을 듣고 있다. [데일리팜=정흥준 기자] "국내 최고 수준의 병원 약제부는 어떤 시스템으로 운영되는 지 궁금했어요."ATC 조제 후 자동검수시스템, 항암제조제로봇, 환자별 1회 용량 단위 조제인 UDS(Unit Dose System)까지 서울대병원 약제부의 선진 시스템이 약사들의 눈길을 사로잡았다.한국병원약사회는 올해 처음으로 전국 약제부 중간관리자급 약사들을 대상으로 병원 견학프로그램을 운영했다. 서울대병원과 용인세브란스병원, 삼성서울병원으로 나뉘어 각 10여명의 약사들이 참여했다.서울대병원 약제부는 16일 오후 전국에서 모인 11명의 약사들이 방문했다. 고대안산병원, 공단일산병원, 강남차병원, 강북삼성병원, 건대병원, 영남대병원, 길병원, 동강병원, 명지병원, 창원파티마병원, 한림대성심병원 약제부에서 각 1명씩 참석했다.서울대병원 약제부는 전공약사 포함 130여명의 약사들이 근무하고 있다. 약사들은 약품관리파트와 정보기획팀, 약물안전센터, 항생제관리팀, 핵의학과, 임상시험센터 등 원내 곳곳에서 활동하고 있다.견학에 앞서 백진희 약제부장과 정애희 약무과장이 약제부 시설과 인력, 운영 모토에 대한 설명으로 약사들을 맞이했다.이날 견학은 약 2시간에 걸쳐 진행됐다. ▲약품관리 ▲주사조제 ▲입원조제 ▲소아조제 ▲외래조제 ▲암진료조제 ▲임상시험센터를 함께 돌아다니며 내부 시설과 업무 방식을 직접 살펴볼 수 있었다.약품관리실에 들어가 적재된 약들을 보며, 재고 관리 방안 등에 대한 설명을 들었다. 제제실 내부에서 칭량실과 원료보관실 등 각종 시설들을 살펴보고 있다. 11명의 약사들은 장소를 옮길 때마다 수시로 핸드폰을 꺼내 조제실에 보관된 약의 라벨링, UDS를 위한 카트 장비, 자동검수시스템, 소아를 위한 산제 조제시설까지 하나하나 촬영하며 사진으로 남겼다.약사들은 각 파트별 담당 약사에게 업무 관련 질문을 하며 견학 도중 생기는 궁금증을 바로 해결할 수 있었다.“적정 재고량은 어느 정도 기간으로 계산하나요, 주사제 조제 내부 공조는 어떻게 관리하나요. 병동약 불출과 반납약 관리는 어떻게 하나요. 소아조제 클린벤치는 어떤 식으로 설치돼있나요.”특히 서울대병원을 비롯해 일부 병원들이 도입하고 있는 UDS 시스템에 대한 궁금증도 많았다. 환자에게 맞는 1회 용량 단일포장으로 병동에 약을 공급하고, 이를 활용해 반납약도 관리하는 업무 구조에 대해 실무적인 질의응답이 오갔다.또 항암조제로봇에 많은 관심이 집중됐다. 약사들은 로봇팔에 의해 조제되는 과정을 함께 지켜보면서, 조제에 걸리는 소요 시간부터 남은 바이알은 어떻게 관리되는지, 수액에도 활용할 수 있는지 등 다양한 질문이 쏟아졌다.항암제 조제로봇의 작동 모습을 함께 살펴보고 있는 약사들. 소아 산제 중 다빈도 처방되는 일부 예비조제 관리가 어떻게 이뤄지는지 공유하고 있다. 성인외래조제 파트에서는 조제, 검수 방식뿐만 아니라 병원형 다제약물관리사업이 어떻게 운영되고 있는지 소개했다. 이외에도 항응고상담을 하는 공용상담실, 식별정보와 의료진 질의사항 등에서 역할을 의약정보 파트를 둘러보기도 했다.약사 업무 공간이 병원 곳곳에 배치돼있기 때문에 지하와 지상을 오가며 약 2시간에 걸친 견학을 마쳤다. 마무리 질의로 남아있는 궁금증들을 해소하며 견학 프로그램은 종료됐다.정애희 약무과장은 “우리 병원은 ADC를 13개 도입하고, 올해 어린이병원에 2대 추가될 예정이다. 2020년 응급실 2대로 시작해 2024년까지 꾸준히 늘어났다”면서 “환자안전 고취를 위해 교육실무위원회, 안전관리위원회, 임상약료위원회 활동을 하며 정기적인 교육을 하고 있다”고 설명했다.또 지난 2020년 약제부 환자상담&미래위원회를 시작으로 매년 확대하면서, 약사를 대상으로 멘토클라스(마음처방사) 활동을 이어가고 있다고 덧붙였다.백진희 약제부장은 “자신을 돌아보면서 병원에서 생활하는 동안 성장하고, 타인을 존중 배려하는 조직 문화에 신경 쓰고 있다”면서 “또 업무를 표준화하려고 하고 있다. 신입 직원들은 환자 상담에 대한 커뮤니케이션 스킬을 강화하기 위해 환자 역할을 맡아보는 롤플레잉식 교육도 진행하고 있다”고 했다.환자 항응고제 상담이 이뤄지는 공용상담실 내부도 들여다보고 있다. 서울대병원의 다제약물관리사업 병원모형 운영 현황에 대해서도 소개했다. 견학에 참석하기 위해 지방에서 올라온 약사들은 “견학 시간이 짧게 느껴졌다”며 높은 만족도를 보였다.동강병원 주지은 약사는 “병원 곳곳을 둘러볼 수 있도록 준비해줘서 감사하다. 참고할 만한 내용들이 많았다. 물론 병원 여건에 따라 도입하기 어려운 시스템도 있겠지만, 발전할 수 있는 방향에 대해 생각해볼 수 있는 시간이었다”고 했다.창원파티마병원 최현지 약사는 “장비도 눈에 들어왔지만 그보다는 UDS(Unit Dose System)을 통한 개별약 포장, 반납약 관리 등 환자안전을 위해 도입한 업무 방식들이 인상 깊었다”면서 “각 파트별로 궁금한 것들이 많았다. 다음에는 파트별로 나눠 세부 프로그램을 만들어주시면 좋겠다. 국내 최고 병원에 대한 관심으로 왔는데 둘러보면서 의욕이 생겨 돌아간다”고 참여 소감을 밝혔다.2025-05-18 15:27:08정흥준 -
 뇌졸중학회, 이동식 뇌졸중집중치료실 도입 필요성 논의[데일리팜=손형민 기자] 대한뇌졸중학회(회장 한림의대 황성희, 이사장 성균관의대 김경문)는 4월 25일 그랜드 하얏트 서울에서 2025년 춘계학술대회를 개최한다고 밝혔다.이번 학술대회에서는 뇌졸중 환자의 골든타임 내 치료와 국내 급성기 뇌졸중 치료의 지역별 격차를 감소시키는데 도움이 될 수 있는 이동식 뇌졸중집중치료실(mobile stroke unit) 관련 강연을 통해 국내 이동식 뇌졸중집중치료실 도입의 필요성과 중요성에 대해서 논의할 예정이다.이동식 집중치료실은 2008년 독일에서 먼저 설치되었으며, 현재 미국, 호주, 유럽에서 운영되고 있다. 아시아에서는 인도와 태국에서 운영 중이다. 이번 학술대회에서는 태국 마히돌 대학교 시리라즈 병원의 용차이 닐라논(Yongchai Nilanont) 교수가 태국에서의 이동식 뇌졸중집중치료실 현황에 대한 강연을 진행할 계획이다.뇌졸중 정밀의료 세션에서는 디지털 혁신 시대에 유전체와 인공지능을 기반으로 한 뇌졸중 맞춤형 치료의 가능성에 대해서 논의하고 이를 기반으로 한 뇌졸중 정밀의료향상 방안에 대해서도 논의할 예정이다. 또 이번 학술대회에서는 뇌졸중 주요 위험인자인 대사증후군에 대해서 논의하고 최근 임상에 도입된 고지혈증 및 당뇨 조절 약물의 뇌졸중 환자에서의 효과와 부작용에 대해서도 다양한 방향으로 논의하는 자리도 마련된다.필수중증응급질환인 뇌졸중의 80%를 차지하는 ‘수술이나 시술을 받지 않는 뇌졸중 환자’는 여전히 일반진료질병군으로 분류되고 있다. 이에 학회는 ‘골든타임 내 치료가 필수적인 초응급질환인 뇌졸중 환자’의 50% 이상이 응급실에서 응급환자 분류 체계(KTAS) 3으로 분류되어 골든타임을 놓칠 위기에 있다는 점에 대해 문제 제기하고 이를 해결하기 위해 다양한 방향으로 논의하겠다는 계획이다.또 재관류치료연구회에서는 동맥내 혈전제거술에 대한 최신 지견을 공유하고 논의할 예정이며, 뇌졸중 환자에서 환자 맞춤형 항혈소판제와 항응고제 치료에 대해서도 논의한다. 뇌졸중 환자들의 신경학적 평가, 뇌졸중 집중치료실에서의 전문 간호와 혈압 및 혈당 관리에 대한 내용을 주제로 한 뇌졸중 전문간호사를 위한 프로그램도 마련돼 있다.대한뇌졸중학회는 매년 춘계학술대회를 개최하고 있으며, 이를 기반으로 국내외 뇌졸중 치료의 최신 지견을 공유하고 국내 뇌졸중 치료 현황에 대해 논의하는 자리를 마련, 국내외 유수의 연구팀이 활발한 교류를 이어가고 있다.김경문 이사장(성균관의대 신경과)은 “대한뇌졸중학회는 학술대회를 지속적으로 개최함으로써, 뇌졸중 전문 의료진과 연구팀의 활발한 교류를 통한 국내 뇌졸중 시스템 구축, 뇌졸중 환자 대상 최고의 치료 제공을 위한 활발한 연구를 통해 세계 뇌졸중 분야에서 중추적인 역할을 지속해 나갈 것"이라고 포부를 밝혔다.2025-04-23 15:39:29손형민
뇌졸중학회, 이동식 뇌졸중집중치료실 도입 필요성 논의[데일리팜=손형민 기자] 대한뇌졸중학회(회장 한림의대 황성희, 이사장 성균관의대 김경문)는 4월 25일 그랜드 하얏트 서울에서 2025년 춘계학술대회를 개최한다고 밝혔다.이번 학술대회에서는 뇌졸중 환자의 골든타임 내 치료와 국내 급성기 뇌졸중 치료의 지역별 격차를 감소시키는데 도움이 될 수 있는 이동식 뇌졸중집중치료실(mobile stroke unit) 관련 강연을 통해 국내 이동식 뇌졸중집중치료실 도입의 필요성과 중요성에 대해서 논의할 예정이다.이동식 집중치료실은 2008년 독일에서 먼저 설치되었으며, 현재 미국, 호주, 유럽에서 운영되고 있다. 아시아에서는 인도와 태국에서 운영 중이다. 이번 학술대회에서는 태국 마히돌 대학교 시리라즈 병원의 용차이 닐라논(Yongchai Nilanont) 교수가 태국에서의 이동식 뇌졸중집중치료실 현황에 대한 강연을 진행할 계획이다.뇌졸중 정밀의료 세션에서는 디지털 혁신 시대에 유전체와 인공지능을 기반으로 한 뇌졸중 맞춤형 치료의 가능성에 대해서 논의하고 이를 기반으로 한 뇌졸중 정밀의료향상 방안에 대해서도 논의할 예정이다. 또 이번 학술대회에서는 뇌졸중 주요 위험인자인 대사증후군에 대해서 논의하고 최근 임상에 도입된 고지혈증 및 당뇨 조절 약물의 뇌졸중 환자에서의 효과와 부작용에 대해서도 다양한 방향으로 논의하는 자리도 마련된다.필수중증응급질환인 뇌졸중의 80%를 차지하는 ‘수술이나 시술을 받지 않는 뇌졸중 환자’는 여전히 일반진료질병군으로 분류되고 있다. 이에 학회는 ‘골든타임 내 치료가 필수적인 초응급질환인 뇌졸중 환자’의 50% 이상이 응급실에서 응급환자 분류 체계(KTAS) 3으로 분류되어 골든타임을 놓칠 위기에 있다는 점에 대해 문제 제기하고 이를 해결하기 위해 다양한 방향으로 논의하겠다는 계획이다.또 재관류치료연구회에서는 동맥내 혈전제거술에 대한 최신 지견을 공유하고 논의할 예정이며, 뇌졸중 환자에서 환자 맞춤형 항혈소판제와 항응고제 치료에 대해서도 논의한다. 뇌졸중 환자들의 신경학적 평가, 뇌졸중 집중치료실에서의 전문 간호와 혈압 및 혈당 관리에 대한 내용을 주제로 한 뇌졸중 전문간호사를 위한 프로그램도 마련돼 있다.대한뇌졸중학회는 매년 춘계학술대회를 개최하고 있으며, 이를 기반으로 국내외 뇌졸중 치료의 최신 지견을 공유하고 국내 뇌졸중 치료 현황에 대해 논의하는 자리를 마련, 국내외 유수의 연구팀이 활발한 교류를 이어가고 있다.김경문 이사장(성균관의대 신경과)은 “대한뇌졸중학회는 학술대회를 지속적으로 개최함으로써, 뇌졸중 전문 의료진과 연구팀의 활발한 교류를 통한 국내 뇌졸중 시스템 구축, 뇌졸중 환자 대상 최고의 치료 제공을 위한 활발한 연구를 통해 세계 뇌졸중 분야에서 중추적인 역할을 지속해 나갈 것"이라고 포부를 밝혔다.2025-04-23 15:39:29손형민 -
 애브비↑·MSD↓...다국적제약, 사업재편에 직원 수 급변[데일리팜=손형민 기자] 의약품 판권 매각, 희망퇴직프로그램(ERP), 신약 출시 등 다양한 요인들이 다국적제약사 한국법인의 직원 수 변화에 영향을 미쳤다. 한국애브비는 앨러간 합병을 통해 4년새 직원 수가 2배로 늘었다. 또 한국BMS제약, 머크, 노보노디스크 한국법인 등은 혁신신약의 등장과 사업 확대로 직원 수가 크게 증가했다.한국MSD는 지난해 기준 가장 많은 직원 수를 보유하고 있지만 자누비아 판권 매각과 ERP 실시 등으로 4년새 직원 수가 200명 줄었다. 한국화이자, 한국얀센, 한구아스트라제네카, 한국노바티스 등도 ERP 실시로 인해 직원 수가 줄어들게 됐다.23일 금융감독원 전자공시시스템에 공시된 다국적제약사 한국법인 30곳의 감사보고서를 분석한 결과, 지난해 직원 수는 7389명으로 전년 7321명 대비 68명 늘었다. 지난 2020년 7192명과 비교하면 4년새 197명 증가한 수치다. 2020년과 비교했을 때 직원 수가 가장 많이 늘어난 회사는 한국애브비다. 한국애브비의 지난해 임직원 수는 340명으로 전년 대비 17명 늘었다. 이 회사의 직원 수는 2020년 170명이었으나 2023년 323명으로 크게 올랐다.한국애브비는 지난 2023년 2월 1일자로 한국엘러간 지분 100%를 양수했다. 같은해 4월 30일엔 한국엘러간을 흡수합병했고, 이튿날부터 기존 한국엘러간 실적 등이 한국애브비에 반영되기 시작했다.본사 차원의 인수합병은 지난 2019년 단행됐다. 2019년 6월 25일 애브비는 630억 달러(약 73조원)에 엘러간을 인수한 바 있다. 엘러간은 보툴리눔톡신 제제의 오리지널 품목 ‘보톡스’를 보유하고 있다.한국BMS제약, 머크, 노보노디스크 등은 혁신신약의 출시와 함께 직원 수가 크게 늘었다.한국BMS제약은 지난해 처음으로 직원 수 200명을 넘어섰다. 이 회사의 작년 직원 수는 209명으로 전년보다 24명 늘었다. 이 회사는 면역항암제 옵디보와 심근병증 치료제 캄지오스, 항응고제 엘리퀴스, 백혈병 치료제 스프라이셀 등을 국내 공급하며 직원 수를 지속적으로 늘려왔다.또 한국BMS제약은 지난해 유한양행과 건선 치료제 소틱투와 궤양성대장염 치료제 제포시아에 대한 공동 프로모션 계약을 체결했다. 이에 따라 면역학(Immunology) 영업부서를 신설하고 임상팀 직원들을 충원하며 직원 수가 늘어났다.머크 한국법인의 직원 수는 2020년 345명에서 지난해 481명으로 39.4% 증가했다. 4년 새 136명을 추가 고용한 셈이다. 연도별로 보면 2021년 360명, 2022년 409명, 2023년 444명으로 꾸준히 증가세를 유지했다.머크는 난임 치료제, 항암제 등 여러 분야에서 성과를 거뒀다. 지난해 4월 머크는 난임 분야에서 과배란 유도 주사제 ‘퍼고베리스’의 보험급여가 적용됐다. 또 비소세포폐암 치료제 텝메코와 방광암 치료제 바벤시오를 국내 공급하며 사업을 확장하고 있다.노보노디스크도 2020년 169명에서 2024년 291명으로 72명 늘어나며 뚜렷한 상승세를 보였다. 이는 글루카곤 유사 펩타이드(GLP-1) 계열 비만·당뇨병 치료제의 국내 성장세와 무관치 않다는 분석이다.노보노디스크는 삭센다, 빅토자 등 리라글루타이드 성분 GLP-1 신약뿐만 아니라 세마글루타이드 성분 당뇨병약 오젬픽과 비만약 위고비를 국내 시장에 내놓았다. 지난해 4분기 시장에 등장한 위고비는 1분기 만에 매출 600억원 이상을 돌파했다.판권매각·한국 시장철수·ERP 영향…감원으로 이어져이와 반대로 판권매각, 한국 시장철수, ERP 등의 영향으로 직원 수가 줄어든 회사들도 있다.한국MSD의 지난해 임직원 수는 505명으로 지난 2020년과 비교하면 201명이 줄었다. 직원 수 감소에 가장 큰 영향을 미친 부분은 오가논 분사다. 오가논은 지난 2021년 한국MSD로부터 분사해 같은해 6월 공식 출범했다. 오가논은 기존 MSD의 탈모치료제 프로페시아, 고혈압치료제 코자, 이상지질혈증 아토젯 등 만성질환 치료제들을 판매하고 있다. 한국MSD는 자누비아패밀리를 종근당에 넘기며 만성질환 사업부를 다시 정리했다. 이 회사는 지난 2023년 5월 종근당에 자누비아(시타글립틴)와 자누메트(시타글립틴·메트포르민), 자누메트엑스알(시타글립틴·메트포르민) 등 자누비아 패밀리와 스테글라트로, 스테글루잔 등 당뇨병 치료제의 판권을 넘겼다. 동시에 제너럴메디슨(GM) 사업부를 폐지했다.한국화이자제약의 임직원 수는 2023년 454명에서 지난해 404명으로 50명 줄어들었다. 지난해 이 회사의 위로 명목으로 지급된 명예퇴직금은 53억3526억원으로 전년 14억453만원보다 279.9% 늘었다.화이자는 2023년과 지난해에 걸쳐 글로벌 차원에서의 구조조정을 단행했다. 코로나19 엔데믹 이후 코미나티, 팍스로비드 등 백신과 치료제 매출이 큰 폭으로 줄어들었기 때문이다. 이 같은 결정은 한국지사의 감원에도 영향을 미쳤다.한국노바티스의 직원 수는 작년 466명을 기록하며 지난 4년새 68명이 줄어들었다. 노바티스는 지난 2022년 본사 차원에서 대규모 구조조정을 단행했다.이에 한국노바티스는 지난 2022년 호흡기사업부를 정리했다. 한국노바티스 호흡기 치료제로는 3제 복합 천식 치료제 에너제어와 1일 1회 고정용량 복합제 어택트라 등이 있다. 천식에서 한국노바티스가 가장 많은 매출을 내고 있는 졸레어는 기전 상 면역질환부서로 구분돼 구조조정 대상에 포함되지 않았다.또 한국노바티스의 제네릭 사업부 산도즈는 분사와 함께 지난 2023년 한국 시장에서 철수했다. 같은해 한국노바티스는 안과사업부를 대상으로 ERP를 실시하며 포트폴리오 재편에 나섰다.한국아스트라제네카는 직원 수의 등락이 심했던 회사 중 하나다. 이 회사의 직원 수는 2020년 393명에서 지난해 411명으로 18명 늘었다. 다만 2023년의 직원 수 439명과 비교하면 지난해는 28명 줄어든 수치다.한국아스트라제네카의 직원 수가 늘어난 배경은 사업 확장에 있다. 아스트라제네카는 지난 2020년 희귀질환 치료제 개발 전문 기업 알렉시온을 인수했다. 알렉시온은 야간발작성혈색소뇨증, 중증근무력증 등에 활용되는 희귀질환 신약 솔리리스와 울토미리스를 보유하고 있다. 이에 한국아스트라제네카도 2023년 2월부터 국내 판매에 나서고 있다. 이에 희귀질환 사업부의 직원 수가 증가하게 됐다.반면 한국아스트라제네카의 지난해 직원 수가 줄어든 가장 큰 이유는 SGLT-2 억제제 계열 당뇨병 치료제 포시가의 한국 시장 철수다. 이 회사는 기존 포시가 판매 부서가 속한 CVRM(Cardio Vascular Renal Metabolism) 사업부를 대상으로 ERP를 실시했다.2025-04-23 12:06:18손형민
애브비↑·MSD↓...다국적제약, 사업재편에 직원 수 급변[데일리팜=손형민 기자] 의약품 판권 매각, 희망퇴직프로그램(ERP), 신약 출시 등 다양한 요인들이 다국적제약사 한국법인의 직원 수 변화에 영향을 미쳤다. 한국애브비는 앨러간 합병을 통해 4년새 직원 수가 2배로 늘었다. 또 한국BMS제약, 머크, 노보노디스크 한국법인 등은 혁신신약의 등장과 사업 확대로 직원 수가 크게 증가했다.한국MSD는 지난해 기준 가장 많은 직원 수를 보유하고 있지만 자누비아 판권 매각과 ERP 실시 등으로 4년새 직원 수가 200명 줄었다. 한국화이자, 한국얀센, 한구아스트라제네카, 한국노바티스 등도 ERP 실시로 인해 직원 수가 줄어들게 됐다.23일 금융감독원 전자공시시스템에 공시된 다국적제약사 한국법인 30곳의 감사보고서를 분석한 결과, 지난해 직원 수는 7389명으로 전년 7321명 대비 68명 늘었다. 지난 2020년 7192명과 비교하면 4년새 197명 증가한 수치다. 2020년과 비교했을 때 직원 수가 가장 많이 늘어난 회사는 한국애브비다. 한국애브비의 지난해 임직원 수는 340명으로 전년 대비 17명 늘었다. 이 회사의 직원 수는 2020년 170명이었으나 2023년 323명으로 크게 올랐다.한국애브비는 지난 2023년 2월 1일자로 한국엘러간 지분 100%를 양수했다. 같은해 4월 30일엔 한국엘러간을 흡수합병했고, 이튿날부터 기존 한국엘러간 실적 등이 한국애브비에 반영되기 시작했다.본사 차원의 인수합병은 지난 2019년 단행됐다. 2019년 6월 25일 애브비는 630억 달러(약 73조원)에 엘러간을 인수한 바 있다. 엘러간은 보툴리눔톡신 제제의 오리지널 품목 ‘보톡스’를 보유하고 있다.한국BMS제약, 머크, 노보노디스크 등은 혁신신약의 출시와 함께 직원 수가 크게 늘었다.한국BMS제약은 지난해 처음으로 직원 수 200명을 넘어섰다. 이 회사의 작년 직원 수는 209명으로 전년보다 24명 늘었다. 이 회사는 면역항암제 옵디보와 심근병증 치료제 캄지오스, 항응고제 엘리퀴스, 백혈병 치료제 스프라이셀 등을 국내 공급하며 직원 수를 지속적으로 늘려왔다.또 한국BMS제약은 지난해 유한양행과 건선 치료제 소틱투와 궤양성대장염 치료제 제포시아에 대한 공동 프로모션 계약을 체결했다. 이에 따라 면역학(Immunology) 영업부서를 신설하고 임상팀 직원들을 충원하며 직원 수가 늘어났다.머크 한국법인의 직원 수는 2020년 345명에서 지난해 481명으로 39.4% 증가했다. 4년 새 136명을 추가 고용한 셈이다. 연도별로 보면 2021년 360명, 2022년 409명, 2023년 444명으로 꾸준히 증가세를 유지했다.머크는 난임 치료제, 항암제 등 여러 분야에서 성과를 거뒀다. 지난해 4월 머크는 난임 분야에서 과배란 유도 주사제 ‘퍼고베리스’의 보험급여가 적용됐다. 또 비소세포폐암 치료제 텝메코와 방광암 치료제 바벤시오를 국내 공급하며 사업을 확장하고 있다.노보노디스크도 2020년 169명에서 2024년 291명으로 72명 늘어나며 뚜렷한 상승세를 보였다. 이는 글루카곤 유사 펩타이드(GLP-1) 계열 비만·당뇨병 치료제의 국내 성장세와 무관치 않다는 분석이다.노보노디스크는 삭센다, 빅토자 등 리라글루타이드 성분 GLP-1 신약뿐만 아니라 세마글루타이드 성분 당뇨병약 오젬픽과 비만약 위고비를 국내 시장에 내놓았다. 지난해 4분기 시장에 등장한 위고비는 1분기 만에 매출 600억원 이상을 돌파했다.판권매각·한국 시장철수·ERP 영향…감원으로 이어져이와 반대로 판권매각, 한국 시장철수, ERP 등의 영향으로 직원 수가 줄어든 회사들도 있다.한국MSD의 지난해 임직원 수는 505명으로 지난 2020년과 비교하면 201명이 줄었다. 직원 수 감소에 가장 큰 영향을 미친 부분은 오가논 분사다. 오가논은 지난 2021년 한국MSD로부터 분사해 같은해 6월 공식 출범했다. 오가논은 기존 MSD의 탈모치료제 프로페시아, 고혈압치료제 코자, 이상지질혈증 아토젯 등 만성질환 치료제들을 판매하고 있다. 한국MSD는 자누비아패밀리를 종근당에 넘기며 만성질환 사업부를 다시 정리했다. 이 회사는 지난 2023년 5월 종근당에 자누비아(시타글립틴)와 자누메트(시타글립틴·메트포르민), 자누메트엑스알(시타글립틴·메트포르민) 등 자누비아 패밀리와 스테글라트로, 스테글루잔 등 당뇨병 치료제의 판권을 넘겼다. 동시에 제너럴메디슨(GM) 사업부를 폐지했다.한국화이자제약의 임직원 수는 2023년 454명에서 지난해 404명으로 50명 줄어들었다. 지난해 이 회사의 위로 명목으로 지급된 명예퇴직금은 53억3526억원으로 전년 14억453만원보다 279.9% 늘었다.화이자는 2023년과 지난해에 걸쳐 글로벌 차원에서의 구조조정을 단행했다. 코로나19 엔데믹 이후 코미나티, 팍스로비드 등 백신과 치료제 매출이 큰 폭으로 줄어들었기 때문이다. 이 같은 결정은 한국지사의 감원에도 영향을 미쳤다.한국노바티스의 직원 수는 작년 466명을 기록하며 지난 4년새 68명이 줄어들었다. 노바티스는 지난 2022년 본사 차원에서 대규모 구조조정을 단행했다.이에 한국노바티스는 지난 2022년 호흡기사업부를 정리했다. 한국노바티스 호흡기 치료제로는 3제 복합 천식 치료제 에너제어와 1일 1회 고정용량 복합제 어택트라 등이 있다. 천식에서 한국노바티스가 가장 많은 매출을 내고 있는 졸레어는 기전 상 면역질환부서로 구분돼 구조조정 대상에 포함되지 않았다.또 한국노바티스의 제네릭 사업부 산도즈는 분사와 함께 지난 2023년 한국 시장에서 철수했다. 같은해 한국노바티스는 안과사업부를 대상으로 ERP를 실시하며 포트폴리오 재편에 나섰다.한국아스트라제네카는 직원 수의 등락이 심했던 회사 중 하나다. 이 회사의 직원 수는 2020년 393명에서 지난해 411명으로 18명 늘었다. 다만 2023년의 직원 수 439명과 비교하면 지난해는 28명 줄어든 수치다.한국아스트라제네카의 직원 수가 늘어난 배경은 사업 확장에 있다. 아스트라제네카는 지난 2020년 희귀질환 치료제 개발 전문 기업 알렉시온을 인수했다. 알렉시온은 야간발작성혈색소뇨증, 중증근무력증 등에 활용되는 희귀질환 신약 솔리리스와 울토미리스를 보유하고 있다. 이에 한국아스트라제네카도 2023년 2월부터 국내 판매에 나서고 있다. 이에 희귀질환 사업부의 직원 수가 증가하게 됐다.반면 한국아스트라제네카의 지난해 직원 수가 줄어든 가장 큰 이유는 SGLT-2 억제제 계열 당뇨병 치료제 포시가의 한국 시장 철수다. 이 회사는 기존 포시가 판매 부서가 속한 CVRM(Cardio Vascular Renal Metabolism) 사업부를 대상으로 ERP를 실시했다.2025-04-23 12:06:18손형민 -
 국내 허가 앞둔 폐동맥 고혈압 항체치료제 '윈레브에어'2편: First-in-class 액티빈A 수용체 IIA 억제제, 원레브에어윈레브에어는(Winrevair& 9415;, WIN-reh-vair, 소타터셉트, Sotatercept-csrk, MSD)는 2024년 3월 미국 FDA와 2024년 8월 유럽 EMA에서 '성인 폐동맥 고혈압(Pulmonary Artery Hypertensin, PAH) 환자의 운동 능력 향상, WHO 기능 등급 개선, 임상 악화 사건 위험 감소를 위한 치료제'로 승인됐다.국내에서는 2024년 12월 '허가신청-급여평가-약가협상 병행 시범사업'의 2호 대상으로 지정돼 품목 허가 신청이 이루어질 경우, 허가 절차가 신속하게 진행될 것으로 예상된다.이 약제는 재조합 'activin receptor IIA-Fc 융합 단백질(fusion protein)'로, 'activin A' 및 기타 'TGF-β 슈퍼패밀리 리간드'에 결합하여 혈관 증식을 조절하도록 설계된 약제이다. 기존 PAH 치료제가 주로 혈관 이완 및 혈류 역학적 개선에 초점을 맞췄다면, 이 약제는 병적 폐혈관 리모델링과 평활근 세포 증식 억제를 통해 PAH의 근본적 병태생리를 타겟팅하는 기전을 가진다.폐동맥 고혈압(Pulmonary Artery Hypertensin, PAH)의 현재 치료 방법은?폐혈관 재형성 및 기능 이상(Pulmonary vascular remodelling and dysfunction)은 PAH의 특징적 병리 소견으로, PAH는 희귀하고 중증의 전모세혈관성 폐고혈압(pre-capillary pulmonary hypertension)의 일종이며, 호흡곤란, 피로, 흉통, 운동 능력 저하, 삶의 질 변화 및 현저히 감소된 기대 수명을 초래한다. 이는 권고 지침에 따른 치료제 사용에도 불구하고 나타나는 현상이다.지난 30년 동안 PAH 치료를 위해 주로 혈관 이완 작용을 나타내는 여러 약제가 개발됐으며, 이들은 NO-sGC-cGMP 경로, prostacycline 경로 및 endothelin-1 경로를 표적으로 한다. 이에는 sGC 자극제, PDE5 억제제, prostacycline 유사체, IP(Iprostanoid) 수용체 작용제, ETA 수용체 길항제, ETA와 ETB수용체 길항제 등이 있다.치료 지침에 따르면, 초기 또는 순차적 병합 요법(2제 또는 3제 병합)은 운동 능력을 향상시키고 임상적 악화까지의 시간을 지연시키는 것으로 나타났으나, 이러한 치료는 질병을 근본적으로 변형하는(disease-modifying) 치료법으로 간주되지는 않는다. 따라서 폐혈관 재형성의 주요 기전을 직접적으로 표적하는 새로운 치료 접근법이 필요하다.폐혈관 재형성(Pulmonary vascular remodeling, PVR)이란 무엇인가?PAH은 혈관벽의 모든 층이 병변에 관여하는 범혈관병증(panvasculopathy)으로, 이는 유전-환경 상호작용의 결과물이며, 필수적인 유전적 및 후생유전학적 기전에서 비롯된다. PAH의 발병 기전은 복합적이며, 폐혈관 재형성이 핵심 병리학적 특징이다.PVR은 중막(media)에 해당하는 폐동맥 내피세포(pulmonary artery endothelial cells, PAECs) 및 폐동맥 평활근세포(pulmonary artery smooth muscle cells, PASMCs)의 증식과 표현형 전환(phenotypic transformation)을 포함하며, 더 나아가 외막(adventitia)에 존재하는 폐동맥 섬유아세포(pulmonary artery fibroblasts, PAFs)와 세포외기질(extracellular matrix, ECM) 간의 복합적 상호작용이 수반되는 병태생리적 과정이다. 이러한 병태생리적 과정에는 염증 반응, 세포자멸사(apoptosis), 그리고 기타 다양한 분자 인자들이 관여하며, 이들은 서로 다른 신호 경로를 통해 혈관벽 내에서 정교하게 조절된다. 이들 경로 간의 상호작용은 폐혈관 재형성(PVR)에서 폐동맥고혈압(PAH)으로의 병태 전환을 촉진하는 데 중요한 역할을 한다.내막(Intima)은 중막(media)과 혈류 사이에서 흐름을 매개하는 두꺼운 내피세포층(endothelial cells, ECs)으로 구성된다. 내피세포는 광범위하고 연속적인 유동 표면을 제공하여, 정상적인 폐순환(pulmonary circulation)에 필수적인 적절한 관류 압력(perfusion pressure)을 유지하는 데 기여한다. 중증 폐동맥고혈압(PAH) 환자에서는 내막 두께가 약 3배 증가하는 것으로 보고되었으나, 이러한 내막 손상의 정확한 병태생리학적 기전은 아직 명확히 규명되지 않았다.중막(Media)은 주로 폐동맥 평활근세포(pulmonary artery smooth muscle cells, PASMCs)로 구성되며, 이들은 저산소성 폐혈관 수축(hypoxic pulmonary vasoconstriction)을 매개하는 특성으로 인해 PAH 병태생리의 핵심적인 역할을 수행한다. 그러나 PASMCs가 폐혈관 재형성에 기여하는 기전은 단순하지 않으며, 다양한 병리적 변화가 복합적으로 작용하는 것으로 보인다. 병리적 상태에서 PASMCs는 과도한 증식과 세포자멸사(apoptosis)에 대한 저항성을 획득하며, 이러한 변화는 혈관벽의 비후와 구조적 리모델링을 초래한다.외막(Adventitia)은 폐동맥을 둘러싸는 결합조직(connective tissue sheath)으로 구성되어 있으며, 이 층에 존재하는 폐동맥 섬유아세포(pulmonary artery fibroblasts, PAFs)는 폐동맥고혈압 병태생리에서 중심적인 역할을 수행하는 세포군이다. 외막에서는 면역세포의 활성화 및 섬유화 과정이 주요한 병리 기전으로 작용하며, 특히 저산소 환경에서 유도되는 인터루킨-6(IL-6)은 대식세포의 M2형 극화를 촉진한다. 이들 M2 대식세포가 분비하는 다양한 사이토카인 및 성장인자는 PASMC의 증식을 유도하여 중막과 내막의 병변 형성을 가속화한다.이에 따라, 내막층에서는 내피세포 손상과 함께 내피세포의 간엽세포화 전환(Endothelial-to-Mesenchymal Transition, EndMT)이 진행되어 혈관 내강의 협착을 초래하며, 중막층에서는 평활근세포의 비대 및 과도한 증식이 혈류 저항을 증가시킨다. 한편, 외막층에서는 면역세포의 활성화와 섬유화가 지속적인 염증 반응 및 구조적 혈관 리모델링을 매개함으로써 병태생리적 변화를 더욱 심화시킨다.액티빈(Activin)은 어떤 물질인가?액티빈은 변형 성장 인자 β(transforming growth factor-β, TGF-β) 계열에 속하는 펩타이드로, 배아 발생과 성체 조직의 항상성 유지에 필수적인 다기능성 성장인자(pluripotent growth factor)이다. 처음에는 난소 여포액(ovarian follicular fluid)에서 분리되었으며, 난포자극호르몬(follicle-stimulating hormone, FSH)의 분비를 유도하는 뇌하수체 자극 인자로 처음 기능이 규명되었다.액티빈은 구조적으로 유사한 인히빈(inhibin)과 함께 하나의 하위 분류를 이루며, 두 인자는 공통의 β 서브유닛을 공유하는 시스테인 매듭 단백질(cysteine knot proteins)로 구성되어 있다. 이들 단백질은 β 서브유닛 간의 결합 형태에 따라 호모다이머 또는 헤테로다이머를 형성하며, 인간에서 확인된 네 가지 β 서브유닛 유전자(βA, βB, βC, βE) 중 특히 βA/βA(액티빈 A), βB/βB(액티빈 B), βA/βB(액티빈 AB)에 대한 연구가 활발히 이루어져 있다.이 중 액티빈 A는 생리학적으로 여러 조절인자에 의해 정밀하게 조절된다. 폴리스타틴(follistatin)은 액티빈 A에 고친화도로 결합하여 생물학적 활성을 억제하는 대표적인 자연적 길항인자이며, 인히빈 α(INHA)와 β 서브유닛(INHB)으로 이루어진 인히빈도 액티빈 A와 직접 결합하거나 type II 수용체에 대한 경쟁적 결합을 통해 액티빈 A의 신호전달을 저해할 수 있다. 액티빈 A는 세포의 증식과 분화, 섬유화, 염증 반응을 포함한 다양한 생리 및 병리학적 과정에 관여하는 다기능성 사이토카인으로 다음과 같은 작용을 한다.첫째, 염증성 사이토카인(예: IL-6, TNF-α 등)의 발현을 증가시켜 염증성 미세환경을 조성하며, 이러한 염증 반응은 폐혈관 리모델링을 유도하는 주요 촉진 인자로 작용한다. 둘째, 섬유아세포를 활성화하여 콜라겐과 세포외기질(extracellular matrix, ECM)의 생합성을 촉진함으로써, 혈관벽 비후 및 조직 섬유화를 야기한다. 셋째, 폐동맥 평활근세포(PASMCs)의 증식과 이동을 유도하여 혈관벽의 비후를 초래하고, 결과적으로 폐혈관 저항을 증가시킨다. 넷째, 내피세포의 항상성을 저해하고 산화 스트레스를 유도하는 동시에, 세포자멸사(apoptosis)를 촉진함으로써 내피 기능을 손상시키고 혈관 재생능력을 약화시킨다. 다섯째, PAH 병태생리에서 보호적 역할을 하는 bone morphogenetic protein receptor type 2 (BMPR2) 경로를 억제함으로써, 증식 억제 및 항염증 신호 전달이 감소하게 된다. 여섯째, SMAD2/3 경로를 선택적으로 활성화하여 세포 증식 촉진 신호를 강화하는 반면, 항염증 및 항섬유화 관련 신호전달을 억제함으로써 폐혈관 병변을 심화시킨다.액티빈 신호 전달 결로는?액티빈 신호 전달 경로(Activin Pathway)는 폐혈관 세포의 증식, 분화, 생존을 촉진하는 반면, bone morphogenetic protein (BMP) 경로(BMP Pathway)는 세포자멸사를 유도하고 세포의 증식 및 분화를 억제하는 작용을 한다. 생리적으로는 이 두 경로 간의 정교한 균형이 유지되며, 이는 폐혈관의 구조적 및 기능적 항상성 유지에 필수적이다.그러나 이러한 신호 간 균형이 파괴될 경우 PAH의 병태생리적 진행에 핵심적인 역할을 하게 된다. 특히 액티빈 및 성장분화인자(growth differentiation factors, GDFs)는 액티빈 수용체 II형 A (activin receptor type IIA, ActRIIA)에 결합하여 SMAD2/3 신호전달 경로를 활성화시키며, 이를 통해 세포 증식 및 리모델링을 유도하는 하위 반응이 촉진된다. 반대로, BMP는 BMP 수용체 II형(BMPR2)을 통해 SMAD1/5/8 경로를 활성화하고, 이를 통해 세포 증식을 억제하고 항증식성 신호를 매개한다. 이러한 두 경로 간의 기능적 불균형은 PAH에서 관찰되는 병리적 혈관 재형성의 주요 분자 기전 중 하나로 간주된다.폐동맥 고혈압(PAH)에서는 BMP/SMAD 1/5/8 경로에 비해 activin/SMAD 2/3 신호 전달이 상대적으로 우세하게 활성화되는 경향을 보이며, 이에는 BMPR2의 기능 상실(loss-of-function)이 관여하는 것으로 알려져 있다. BMPR2 유전자의 기능 상실 돌연변이는 유전성 PAH의 주요 원인 중 하나로, 특발성 PAH(idiopathic PAH) 환자의 약 25%에서도 이러한 변이가 보고되고 있다.소타터셉트는 어떤 약제인가?소타터셉트(Sotatercept-csrk, 제품명: 윈레베어주, Winrevair& 9415;, MSD)는 2024년 3월 미국 FDA과 2024년 8월 유럽의약품청(EMA)으로부터 ‘성인 폐동맥고혈압(PAH) 환자의 운동 능력 개선, WHO 기능 등급 향상, 및 임상 악화 사건 위험 감소’를 적응증으로 승인받은 약제이다.이 약제는 액티빈 수용체 II형 A(ActRIIA)의 세포외 도메인 유전자와 사람 IgG1 Fc 도메인을 융합하여 제조된 재조합 단백질로, TGF-β 슈퍼패밀리의 리간드인 액티빈 A 및 기타 관련 인자에 선택적으로 결합함으로써 액티빈 신호를 억제하는 최초의 약제이다.PAH 동물 모델(랫드 모델)에서 소타터셉트는 염증 반응을 억제하고, 병변 혈관 내 내피세포 및 평활근세포의 증식을 감소시키는 효과를 보였다. 이러한 세포 수준의 변화는 혈관벽 비후의 완화, 우심실 재형성의 부분적 역전, 그리고 혈역학적 개선과 밀접한 관련이 있었다.이 약제는 3주 간격으로 피하 투여되며, 초기 5회 투여까지는 헤모글로빈 및 혈소판 수치를 면밀히 모니터링해야 한다. 초기 모니터링 결과가 불안정한 경우, 모니터링 기간과 횟수를 연장해야 하며, 이후에도 용량 조정 필요성 평가를 위해 주기적인 모니터링이 요구된다.이 약제는 헤모글로빈 수치를 상승시켜 적혈구증가증(polycythemia)을 유발할 수 있으며, 중증의 경우 혈전색전성 사건(thromboembolic events) 또는 과점도증후군(hyperviscosity syndrome)의 위험을 증가시킬 수 있다. 또한 혈소판 수치를 감소시켜 중증 혈소판감소증(thrombocytopenia) 및 관련 출혈 위험을 초래할 수 있으므로, 혈소판 수치가 50,000/mm³ 미만인 경우에는 투여를 시작해서는 안 된다.소타터셉트의 약리기전은?소타터셉트(Sotatercept)의 치료 개념은 증식 촉진(pro-proliferative) 신호와 증식 억제(anti-proliferative) 신호 간의 균형 회복에 근거한다. PAH은 폐혈관 평활근세포 및 내피세포에서의 뼈형성 단백질 수용체 II형(BMPR-II)& 8211;Smad1/5/8 경로의 기능 저하와 관련이 있으며, 이로 인해 세포 증식 억제 신호가 감소하고 증식 촉진 신호가 상대적으로 우세해지는 병태적 불균형이 발생한다. BMPR-II& 8211;Smad1/5/8 경로의 하향 조절은 액티빈 A, GDF8, GDF11 등 액티빈 계열 리간드의 발현 증가로 이어지며, 이는 ActRIIA을 통한 Smad2/3 경로의 과활성화를 유도한다. 이로 인해 인산화된 Smad2/3(pSmad2/3)의 활성도가 증가하고, 그 결과 내인성 BMP 신호 길항제인 gremlin-1 및 noggin의 발현이 촉진된다. Gremlin-1과 noggin은 BMP& 8211;Smad1/5/8 경로를 추가로 억제함으로써 증식 억제 신호를 더욱 약화시키는 이차적 효과를 유발한다.이러한 일련의 과정은 액티빈& 8211;Smad2/3 기반의 증식 촉진 신호가 병적으로 우세해지도록 만들며, 이는 폐혈관 리모델링(PVR)을 유도하는 핵심 병태기전으로 작용한다.소타터셉트는 과잉 발현된 ActRIIA 리간드들을 포획(sequestration)함으로써 ActRIIA& 8211;Smad2/3 경로의 활성화를 저해하고, 이를 통해 증식 촉진 신호와 억제 신호 간의 균형 회복을 도모한다.결과적으로, 소타터셉트는 액티빈 및 GDFs와 선제적으로 결합하여 ActRIIA& 8211;Smad2/3 매개 증식 신호를 차단함으로써 폐혈관벽 비후를 감소시키고, 리모델링된 혈관 구조의 역전 및 우심실 기능 개선에 기여한다. 이는 기존 치료제들과 달리 질환의 구조적·세포학적 병태생리에 직접적으로 개입하는 새로운 약리 기전을 보여준다.소타터셉트의 주요 임상연구는 어떻게 진행되었나?1. STELLAR 연구 2020년 10월에 시작된 본 연구는 다기관, 이중 눈가림, 무작위배정, 제3상 임상시험으로, 안정적인 기저 치료를 받고 있는 WHO 기능분류 II 또는 III의 폐동맥고혈압(PAH) 성인 환자를 대상으로 수행되었다.총 323명의 환자가 1:1 비율로 무작위 배정되어, 소타터셉트군(목표 용량 0.7 mg/kg, n=163) 또는 위약군(n=160)으로 분류되었으며, 피하 주사 방식으로 3주 간격으로 투여되었다. 대부분의 환자는 3제 병용요법(61%) 또는 2제 요법(35%)을 기저 치료로 받고 있었으며, 약 40%는 프로스타사이클린 주입 치료를 병행하고 있었다. 등록 당시 WHO 기능 등급은 II(49%) 및 III(51%)로 분포되었다.본 연구의 주요 평가 변수(primary endpoint)는 24주 시점에서의 6분 보행 거리(6-minute walk distance, 6MWD)의 기저치 대비 변화량이었으며, 총 9가지의 이차 평가 변수(secondary endpoints)는 계층적(hierarchical) 방식으로 분석되었다. 이 모든 평가는 24주 시점에서 수행되었으며, 사망 또는 임상적 악화까지의 시간(time to clinical worsening)은 마지막 환자의 24주 방문까지 추적되었다.24주 시점에서 6MWD의 중앙값 변화량은 소타터셉트군에서 34.4m(95% CI, 33.0 to 35.5), 위약군에서는 1.0m(95% CI, & 8722;0.3 to 3.5)로 나타났으며, 두 군 간 변화량 차이에 대한 Hodges& 8211;Lehmann 추정치는 40.8m (95% CI, 27.5 to 54.1)로 통계적으로 유의하였다.이차 평가 변수 중 8가지 지표는 소타터셉트군에서 위약군 대비 모두 유의한 개선을 보였으나, PAH-SYMPACT 도구에 기반한 인지/정서적 영향(Cognitive/Emotional Impacts) 영역 점수는 두 군 간 통계적으로 유의한 차이를 보이지 않았다.소타터셉트군에서 위약군에 비해 더 높은 빈도로 보고된 이상반응(adverse events)은 비출혈(epistaxis), 어지럼증(dizziness), 모세혈관 확장증(telangiectasia), 헤모글로빈 수치 상승, 혈소판감소증(thrombocytopenia), 그리고 혈압 상승 등이었다.2. Hyperion 연구 2021년 6월부터 전 세계적으로 시행된 본 연구는 새롭게 진단된 중등도 또는 고위험 폐동맥고혈압(PAH) 환자 약 300명을 대상으로 진행된 무작위배정, 이중 눈가림, 위약 대조 제3상 임상시험이다. 참가자는 소타터셉트와 기존 PAH 치료제를 병용 투여받는 군과 위약 + 기존 치료 병용군으로 1:1 무작위 배정되었다.본 연구의 주요 평가변수는 임상적 악화까지의 시간으로 정의되었으며, 이는 무작위배정 시점부터 최초의 이환 사건(clinical worsening event) 또는 사망 발생까지의 기간을 측정하여 평가되었다. 임상적 악화(clinical worsening) 사건은 다음 중 하나 이상을 포함하는 복합 평가 지표로 정의되었다: 모든 원인의 사망, 24시간 이상 지속된 비계획적 PAH 관련 입원, 심방 중격 절개술(atrial septostomy), 폐 이식(lung transplantation), 또는 기저치 대비 6MWD 감소와 함께 WHO 기능분류(WHO FC) 악화, 우심부전(right heart failure)의 임상적 증상 또는 징후, 기존 PAH 치료제의 추가 사용 또는 정맥 주사형(parenteral) 치료제로의 전환 등이 이에 해당된다.Merck 측은 2024년 초, ZENITH 연구에서 도출된 긍정적인 중간 분석 결과 및 소타터셉트에 대한 누적 데이터를 바탕으로, HYPERION 연구를 지속하는 것이 더 이상 윤리적으로 적절하지 않다고 판단하여 해당 임상시험을 조기 종료하였다.3. ZENITH 연구 2021년 7월에 시작된 ZENITH 연구는 세계보건기구(WHO) 분류상 그룹 1에 해당하는 폐동맥 고혈압(PAH) 환자 중 기능적 분류(WHO FC) III 또는 IV 등급이며, 사망 위험이 높은 성인을 대상으로 소타터셉트의 유효성을 평가하였다. 본 연구에서 소타터셉트는 기존 표준 치료제와 병용 투여 시 위약 대비 이환 또는 사망 사건의 위험을 통계적으로 유의하고 임상적으로도 유의미하게 감소시키는 것으로 나타났으며, 이에 따라 탁월한 효능 결과를 바탕으로 2023년 말 조기 종료되었다.이어 2025년 3월 말에 발표된 3상 ZENITH 연구 결과에 따르면, WHO 기능 등급 III 또는 IV에 해당하는 성인 PAH 환자에서 소타터셉트는 주요 이환 및 사망 사건의 발생 위험을 유의하게 감소시켰다. 본 연구 결과는 미국심장학회 연례 학술대회(ACC Scientific Session)에서 발표되었으며, New England Journal of Medicine에 게재되었다. 분석 결과에 따르면, 소타터셉트는 위약 대비 주요 임상 사건의 위험을 76%까지 감소시킨 것으로 보고되었다.기존의 폐동맥 수축, 이완 및 증식에 관여하는 약제는?폐동맥은 높은 혈류 압력과 벽 긴장(wall stress)을 견딜 수 있도록 구조적으로 특화되어 있으며, 상당한 혈액량을 수용할 수 있는 용적 탄력성을 지닌 혈관이다. 그러나 폐동맥 고혈압(PAH)에서는 광범위한 혈관 리모델링이 유도되며, 이로 인해 동맥 중막에 위치한 소평활근세포(small smooth muscle fibers)가 비정상적으로 증식하거나 확장되어 혈관 수축을 초래한다.이러한 평활근세포의 증식은 내막 비후와 섬유화의 병리적 연쇄반응을 유발하는데, 이는 ‘평활근세포 증식 → 내막 비후 → 섬유화 → 혈관 협착 → 조직 자극 → 재증식’이라는 자가 증폭적 순환을 통해 진행된다. 일단 이러한 병적 순환이 시작되면, 그 진행 속도는 점차 가속화되고 비가역적으로 전개되어, 폐동맥 내강을 점차 폐쇄시키는 병변을 형성하며, 결국 폐혈관 저항의 지속적인 증가로 이어진다. 1995년 이전까지 PAH 치료에 사용 가능한 약제는 칼슘채널차단제(calcium channel blockers)와 항응고제(anticoagulants) 등에 국한되었다. 이후 PAH의 병태생리에서 세 가지 주요 경로인 NO-sGC-cGMP 경로, Prostacyclin 경로 그리고 Endothelin-1(ET-1) 경로의 중요성이 규명되면서, 각 경로를 표적으로 하는 치료 전략이 개발되어 PAH 치료의 새로운 전기를 마련하게 되었다.1. NO-sGC-cGMP 경로 일산화질소(Nitric oxide, NO)는 혈관 평활근 세포 내의 용해성 구아닐산 고리화효소(soluble guanylate cyclase, sGC)를 활성화시켜, 구아노신 삼인산(GTP)을 고리형 구아노신 일인산(cyclic guanosine monophosphate, cGMP)으로 전환시키며, 이는 혈관 이완 및 세포 증식 억제 작용을 유도한다. 그러나 cGMP는 PDE5(phosphodiesterase type 5)에 의해 비활성 형태인 GMP로 분해되어, 이와 같은 혈관 이완 작용이 소실된다.NO-sGC-cGMP 경로와 관련되는 약제에는 NO의 흡입, 아질산염 또는 질산염의 투여, sGC 자극제 Riociguat(리오시구앗, 아뎀파스 정, Adempas& 9415;), PDE5 억제제 Sidenafil 및 Tadanafil 등이 있다.2. Prostacyclin 경로 프로스타사이클린(Prostaglandin I₂, PGI₂)은 혈관 평활근 세포의 수용체에 결합하여 아데닐산 고리화효소(adenylyl cyclase, AC)를 활성화시킨다. 이로 인해 아데노신 삼인산(ATP)이 고리형 아데노신 일인산(cyclic adenosine monophosphate, cAMP)으로 전환되며, 이는 혈관 이완 및 세포 증식 억제 효과를 유도한다.Prostacyclin 경로와 관련되는 약제에는 Prostacyclin 유사체 Epoprostenol, Trepostinil(트레포스티닐, 레모둘린 주, Remodulin& 9415;), Iloprost(일로프로스트, 벤타비스 흡입액, Ventavis& 9415;), 그리고 Beraprost와 IP(Iprostanoid) 수용체 작용제 Selexipag(셀레씨파그, 업트라비 정, Uptravi& 9415;)가 있다.3. Endothelin-1(ET-1) 경로 전구물질인 Big ET-1은 엔도텔린 전환효소(endothelin-converting enzyme, ECE)에 의해 활성형 펩타이드인 엔도텔린-1(ET-1)로 전환된다. ET-1은 21개의 아미노산으로 구성된 강력한 혈관 수축 펩타이드로, 혈관 내피세포에서 주로 생성되며, 평활근 세포의 ETA 및 ETB 수용체에 결합하여 혈관 수축 및 세포 증식을 유도한다.Endothelin-1(ET-1) 경로와 관련되는 약제에는 ETA 수용체 길항제 Ambrisentan(암브리산탄, 볼리브리스 정, Volibris& 9415;)과 ETA와 ETB수용체 길항제 Bosentan(보센탄, 트라클리어 정, Tracleer& 9415;) 및 Macitentan(마시텐탄, 옵서미트 정, Opsumit& 9415;) 등이 있다.기존 PAH 치료제 vs. 소타터셉트를 비교하면?기존의 PAH 치료제들은 주로 폐혈관의 수축 및 이완의 불균형, 내피 기능 장애, 그리고 혈관 리모델링과 같은 병태생리적 현상을 조절하는 데 중점을 두고 있다. 이들 약제는 주로 폐혈관의 평활근 긴장을 완화하거나 혈관 확장을 유도함으로써 폐혈관 저항을 감소시키고 우심실의 후부하를 완화하는 데 기여한다. 그러나 이러한 약물들은 혈관 확장 작용에 기반한 기능적 개선에 초점을 두고 있으며, 혈관벽의 병적 리모델링이나 세포 수준의 병태생리 기전을 근본적으로 교정하는 데는 한계가 있다. 이와 대조적으로, 소타터셉트는 TGF-β 슈퍼패밀리 리간드(예: activin A 등)에 결합함으로써 ActRIIA를 매개로 한 신호전달을 차단하는 새로운 작용 기전을 지닌 약제로, 병적 혈관 리모델링을 표적하는 질병 조절적 접근을 가능하게 한다. 구체적으로, 소타터셉트는 증식 촉진 및 염증 유발성 경로인 ActRIIA/Smad2/3 신호를 억제하고, 동시에 증식 억제 경로인 BMPRII/Smad1/5/8 경로의 활성을 상대적으로 회복시킴으로써, 폐혈관 내피세포 및 평활근세포의 이상 증식, 염증 및 구조적 변화를 효과적으로 억제하는 것으로 나타났다.소타터셉트의 앞으로의 전망은소타터셉트는 기존 폐동맥 고혈압(PAH) 표준 치료제와 병용 시 운동 능력 개선 및 임상적 악화 위험 감소에 기여하는 치료제로, STELLAR 임상시험의 긍정적인 결과를 기반으로 현재까지 40개국 이상에서 승인을 획득하였다. 국내에서는 2024년 12월 '허가신청-급여평가-약가협상 병행 시범사업'의 제2호 대상으로 지정되어, 조만간 국내 도입이 예상된다.ZENITH 임상시험은 탁월한 치료 효과로 인해 조기 종료되었으며, 참여 환자들은 이후 SOTERIA 공개 라벨 연장 연구에 등록되었다. 해당 연구에서 소타터셉트의 안전성 프로파일은 기존 임상시험 결과와 일관되었고, 약물 관련 이상 반응으로 인한 치료 중단 사례는 보고되지 않았다. 또한, 3상 HYPERION 연구 역시 ZENITH 시험의 긍정적 중간 분석 결과를 근거로 조기 종료되어 최종 분석에 돌입하였다.결론적으로, 소타터셉트는 기존 PAH 치료제들과는 차별화된 작용 기전을 통해 폐혈관 구조의 병태생리에 직접적으로 작용하는 질병 조절제로 평가받고 있다. 임상 2상(PULSAR) 연구에서의 유망한 결과를 바탕으로, 임상 3상(STELLAR 및 ZENITH) 연구에서 확립된 유효성과 안전성은 PAH 치료의 새로운 치료 패러다임으로 자리매김할 가능성을 시사한다.참고문헌1. Zhuangzhuang Jia, Shuai Wang, Haifeng Yan, et al. “Pulmonary Vascular Remodeling in Pulmonary Hypertension” J. Pers. Med. 2023, 13(2), 366. 2. Tanvirul Hyea, Riajul Hossainb, Dipongkor Sahac et al. “ Emerging biologics for the treatment of pulmonary arterial hypertension” Journal of Drug Targeting 2023, Vol. 31, no. 5, 471& 8211;485. 3. Marc Humbert, Vallerie McLaughlin, J. Simon R. Gibbs, et al, “Sotatercept for the Treatment of Pulmonary Arterial Hypertension” N Engl J Med 2021;384:1204-1215) 4. Yen-Chun Lai, Karin C. Potoka, Hunter C. et al, “Pulmonary Arterial Hypertension: The Clinical Syndrome” Circulation Research Volume 115, Issue 1, 20 June 2014; Pages 115-130.) 5. Aimon C. Miranda, Cyrille K. Cornelio, Bao Anh C. Tran, and Joel Fernandez, “Sotatercept: A First-In-Class Activin Signaling Inhibitor for Pulmonary Arterial Hypertension” J Pharm Technol. 2025 Feb 22:87551225251317957 6. 2020년 폐고혈압 진료지침 대한심장학회, 대한결핵 및 호흡기학회, 2020 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-04-21 11:18:06최병철 박사
국내 허가 앞둔 폐동맥 고혈압 항체치료제 '윈레브에어'2편: First-in-class 액티빈A 수용체 IIA 억제제, 원레브에어윈레브에어는(Winrevair& 9415;, WIN-reh-vair, 소타터셉트, Sotatercept-csrk, MSD)는 2024년 3월 미국 FDA와 2024년 8월 유럽 EMA에서 '성인 폐동맥 고혈압(Pulmonary Artery Hypertensin, PAH) 환자의 운동 능력 향상, WHO 기능 등급 개선, 임상 악화 사건 위험 감소를 위한 치료제'로 승인됐다.국내에서는 2024년 12월 '허가신청-급여평가-약가협상 병행 시범사업'의 2호 대상으로 지정돼 품목 허가 신청이 이루어질 경우, 허가 절차가 신속하게 진행될 것으로 예상된다.이 약제는 재조합 'activin receptor IIA-Fc 융합 단백질(fusion protein)'로, 'activin A' 및 기타 'TGF-β 슈퍼패밀리 리간드'에 결합하여 혈관 증식을 조절하도록 설계된 약제이다. 기존 PAH 치료제가 주로 혈관 이완 및 혈류 역학적 개선에 초점을 맞췄다면, 이 약제는 병적 폐혈관 리모델링과 평활근 세포 증식 억제를 통해 PAH의 근본적 병태생리를 타겟팅하는 기전을 가진다.폐동맥 고혈압(Pulmonary Artery Hypertensin, PAH)의 현재 치료 방법은?폐혈관 재형성 및 기능 이상(Pulmonary vascular remodelling and dysfunction)은 PAH의 특징적 병리 소견으로, PAH는 희귀하고 중증의 전모세혈관성 폐고혈압(pre-capillary pulmonary hypertension)의 일종이며, 호흡곤란, 피로, 흉통, 운동 능력 저하, 삶의 질 변화 및 현저히 감소된 기대 수명을 초래한다. 이는 권고 지침에 따른 치료제 사용에도 불구하고 나타나는 현상이다.지난 30년 동안 PAH 치료를 위해 주로 혈관 이완 작용을 나타내는 여러 약제가 개발됐으며, 이들은 NO-sGC-cGMP 경로, prostacycline 경로 및 endothelin-1 경로를 표적으로 한다. 이에는 sGC 자극제, PDE5 억제제, prostacycline 유사체, IP(Iprostanoid) 수용체 작용제, ETA 수용체 길항제, ETA와 ETB수용체 길항제 등이 있다.치료 지침에 따르면, 초기 또는 순차적 병합 요법(2제 또는 3제 병합)은 운동 능력을 향상시키고 임상적 악화까지의 시간을 지연시키는 것으로 나타났으나, 이러한 치료는 질병을 근본적으로 변형하는(disease-modifying) 치료법으로 간주되지는 않는다. 따라서 폐혈관 재형성의 주요 기전을 직접적으로 표적하는 새로운 치료 접근법이 필요하다.폐혈관 재형성(Pulmonary vascular remodeling, PVR)이란 무엇인가?PAH은 혈관벽의 모든 층이 병변에 관여하는 범혈관병증(panvasculopathy)으로, 이는 유전-환경 상호작용의 결과물이며, 필수적인 유전적 및 후생유전학적 기전에서 비롯된다. PAH의 발병 기전은 복합적이며, 폐혈관 재형성이 핵심 병리학적 특징이다.PVR은 중막(media)에 해당하는 폐동맥 내피세포(pulmonary artery endothelial cells, PAECs) 및 폐동맥 평활근세포(pulmonary artery smooth muscle cells, PASMCs)의 증식과 표현형 전환(phenotypic transformation)을 포함하며, 더 나아가 외막(adventitia)에 존재하는 폐동맥 섬유아세포(pulmonary artery fibroblasts, PAFs)와 세포외기질(extracellular matrix, ECM) 간의 복합적 상호작용이 수반되는 병태생리적 과정이다. 이러한 병태생리적 과정에는 염증 반응, 세포자멸사(apoptosis), 그리고 기타 다양한 분자 인자들이 관여하며, 이들은 서로 다른 신호 경로를 통해 혈관벽 내에서 정교하게 조절된다. 이들 경로 간의 상호작용은 폐혈관 재형성(PVR)에서 폐동맥고혈압(PAH)으로의 병태 전환을 촉진하는 데 중요한 역할을 한다.내막(Intima)은 중막(media)과 혈류 사이에서 흐름을 매개하는 두꺼운 내피세포층(endothelial cells, ECs)으로 구성된다. 내피세포는 광범위하고 연속적인 유동 표면을 제공하여, 정상적인 폐순환(pulmonary circulation)에 필수적인 적절한 관류 압력(perfusion pressure)을 유지하는 데 기여한다. 중증 폐동맥고혈압(PAH) 환자에서는 내막 두께가 약 3배 증가하는 것으로 보고되었으나, 이러한 내막 손상의 정확한 병태생리학적 기전은 아직 명확히 규명되지 않았다.중막(Media)은 주로 폐동맥 평활근세포(pulmonary artery smooth muscle cells, PASMCs)로 구성되며, 이들은 저산소성 폐혈관 수축(hypoxic pulmonary vasoconstriction)을 매개하는 특성으로 인해 PAH 병태생리의 핵심적인 역할을 수행한다. 그러나 PASMCs가 폐혈관 재형성에 기여하는 기전은 단순하지 않으며, 다양한 병리적 변화가 복합적으로 작용하는 것으로 보인다. 병리적 상태에서 PASMCs는 과도한 증식과 세포자멸사(apoptosis)에 대한 저항성을 획득하며, 이러한 변화는 혈관벽의 비후와 구조적 리모델링을 초래한다.외막(Adventitia)은 폐동맥을 둘러싸는 결합조직(connective tissue sheath)으로 구성되어 있으며, 이 층에 존재하는 폐동맥 섬유아세포(pulmonary artery fibroblasts, PAFs)는 폐동맥고혈압 병태생리에서 중심적인 역할을 수행하는 세포군이다. 외막에서는 면역세포의 활성화 및 섬유화 과정이 주요한 병리 기전으로 작용하며, 특히 저산소 환경에서 유도되는 인터루킨-6(IL-6)은 대식세포의 M2형 극화를 촉진한다. 이들 M2 대식세포가 분비하는 다양한 사이토카인 및 성장인자는 PASMC의 증식을 유도하여 중막과 내막의 병변 형성을 가속화한다.이에 따라, 내막층에서는 내피세포 손상과 함께 내피세포의 간엽세포화 전환(Endothelial-to-Mesenchymal Transition, EndMT)이 진행되어 혈관 내강의 협착을 초래하며, 중막층에서는 평활근세포의 비대 및 과도한 증식이 혈류 저항을 증가시킨다. 한편, 외막층에서는 면역세포의 활성화와 섬유화가 지속적인 염증 반응 및 구조적 혈관 리모델링을 매개함으로써 병태생리적 변화를 더욱 심화시킨다.액티빈(Activin)은 어떤 물질인가?액티빈은 변형 성장 인자 β(transforming growth factor-β, TGF-β) 계열에 속하는 펩타이드로, 배아 발생과 성체 조직의 항상성 유지에 필수적인 다기능성 성장인자(pluripotent growth factor)이다. 처음에는 난소 여포액(ovarian follicular fluid)에서 분리되었으며, 난포자극호르몬(follicle-stimulating hormone, FSH)의 분비를 유도하는 뇌하수체 자극 인자로 처음 기능이 규명되었다.액티빈은 구조적으로 유사한 인히빈(inhibin)과 함께 하나의 하위 분류를 이루며, 두 인자는 공통의 β 서브유닛을 공유하는 시스테인 매듭 단백질(cysteine knot proteins)로 구성되어 있다. 이들 단백질은 β 서브유닛 간의 결합 형태에 따라 호모다이머 또는 헤테로다이머를 형성하며, 인간에서 확인된 네 가지 β 서브유닛 유전자(βA, βB, βC, βE) 중 특히 βA/βA(액티빈 A), βB/βB(액티빈 B), βA/βB(액티빈 AB)에 대한 연구가 활발히 이루어져 있다.이 중 액티빈 A는 생리학적으로 여러 조절인자에 의해 정밀하게 조절된다. 폴리스타틴(follistatin)은 액티빈 A에 고친화도로 결합하여 생물학적 활성을 억제하는 대표적인 자연적 길항인자이며, 인히빈 α(INHA)와 β 서브유닛(INHB)으로 이루어진 인히빈도 액티빈 A와 직접 결합하거나 type II 수용체에 대한 경쟁적 결합을 통해 액티빈 A의 신호전달을 저해할 수 있다. 액티빈 A는 세포의 증식과 분화, 섬유화, 염증 반응을 포함한 다양한 생리 및 병리학적 과정에 관여하는 다기능성 사이토카인으로 다음과 같은 작용을 한다.첫째, 염증성 사이토카인(예: IL-6, TNF-α 등)의 발현을 증가시켜 염증성 미세환경을 조성하며, 이러한 염증 반응은 폐혈관 리모델링을 유도하는 주요 촉진 인자로 작용한다. 둘째, 섬유아세포를 활성화하여 콜라겐과 세포외기질(extracellular matrix, ECM)의 생합성을 촉진함으로써, 혈관벽 비후 및 조직 섬유화를 야기한다. 셋째, 폐동맥 평활근세포(PASMCs)의 증식과 이동을 유도하여 혈관벽의 비후를 초래하고, 결과적으로 폐혈관 저항을 증가시킨다. 넷째, 내피세포의 항상성을 저해하고 산화 스트레스를 유도하는 동시에, 세포자멸사(apoptosis)를 촉진함으로써 내피 기능을 손상시키고 혈관 재생능력을 약화시킨다. 다섯째, PAH 병태생리에서 보호적 역할을 하는 bone morphogenetic protein receptor type 2 (BMPR2) 경로를 억제함으로써, 증식 억제 및 항염증 신호 전달이 감소하게 된다. 여섯째, SMAD2/3 경로를 선택적으로 활성화하여 세포 증식 촉진 신호를 강화하는 반면, 항염증 및 항섬유화 관련 신호전달을 억제함으로써 폐혈관 병변을 심화시킨다.액티빈 신호 전달 결로는?액티빈 신호 전달 경로(Activin Pathway)는 폐혈관 세포의 증식, 분화, 생존을 촉진하는 반면, bone morphogenetic protein (BMP) 경로(BMP Pathway)는 세포자멸사를 유도하고 세포의 증식 및 분화를 억제하는 작용을 한다. 생리적으로는 이 두 경로 간의 정교한 균형이 유지되며, 이는 폐혈관의 구조적 및 기능적 항상성 유지에 필수적이다.그러나 이러한 신호 간 균형이 파괴될 경우 PAH의 병태생리적 진행에 핵심적인 역할을 하게 된다. 특히 액티빈 및 성장분화인자(growth differentiation factors, GDFs)는 액티빈 수용체 II형 A (activin receptor type IIA, ActRIIA)에 결합하여 SMAD2/3 신호전달 경로를 활성화시키며, 이를 통해 세포 증식 및 리모델링을 유도하는 하위 반응이 촉진된다. 반대로, BMP는 BMP 수용체 II형(BMPR2)을 통해 SMAD1/5/8 경로를 활성화하고, 이를 통해 세포 증식을 억제하고 항증식성 신호를 매개한다. 이러한 두 경로 간의 기능적 불균형은 PAH에서 관찰되는 병리적 혈관 재형성의 주요 분자 기전 중 하나로 간주된다.폐동맥 고혈압(PAH)에서는 BMP/SMAD 1/5/8 경로에 비해 activin/SMAD 2/3 신호 전달이 상대적으로 우세하게 활성화되는 경향을 보이며, 이에는 BMPR2의 기능 상실(loss-of-function)이 관여하는 것으로 알려져 있다. BMPR2 유전자의 기능 상실 돌연변이는 유전성 PAH의 주요 원인 중 하나로, 특발성 PAH(idiopathic PAH) 환자의 약 25%에서도 이러한 변이가 보고되고 있다.소타터셉트는 어떤 약제인가?소타터셉트(Sotatercept-csrk, 제품명: 윈레베어주, Winrevair& 9415;, MSD)는 2024년 3월 미국 FDA과 2024년 8월 유럽의약품청(EMA)으로부터 ‘성인 폐동맥고혈압(PAH) 환자의 운동 능력 개선, WHO 기능 등급 향상, 및 임상 악화 사건 위험 감소’를 적응증으로 승인받은 약제이다.이 약제는 액티빈 수용체 II형 A(ActRIIA)의 세포외 도메인 유전자와 사람 IgG1 Fc 도메인을 융합하여 제조된 재조합 단백질로, TGF-β 슈퍼패밀리의 리간드인 액티빈 A 및 기타 관련 인자에 선택적으로 결합함으로써 액티빈 신호를 억제하는 최초의 약제이다.PAH 동물 모델(랫드 모델)에서 소타터셉트는 염증 반응을 억제하고, 병변 혈관 내 내피세포 및 평활근세포의 증식을 감소시키는 효과를 보였다. 이러한 세포 수준의 변화는 혈관벽 비후의 완화, 우심실 재형성의 부분적 역전, 그리고 혈역학적 개선과 밀접한 관련이 있었다.이 약제는 3주 간격으로 피하 투여되며, 초기 5회 투여까지는 헤모글로빈 및 혈소판 수치를 면밀히 모니터링해야 한다. 초기 모니터링 결과가 불안정한 경우, 모니터링 기간과 횟수를 연장해야 하며, 이후에도 용량 조정 필요성 평가를 위해 주기적인 모니터링이 요구된다.이 약제는 헤모글로빈 수치를 상승시켜 적혈구증가증(polycythemia)을 유발할 수 있으며, 중증의 경우 혈전색전성 사건(thromboembolic events) 또는 과점도증후군(hyperviscosity syndrome)의 위험을 증가시킬 수 있다. 또한 혈소판 수치를 감소시켜 중증 혈소판감소증(thrombocytopenia) 및 관련 출혈 위험을 초래할 수 있으므로, 혈소판 수치가 50,000/mm³ 미만인 경우에는 투여를 시작해서는 안 된다.소타터셉트의 약리기전은?소타터셉트(Sotatercept)의 치료 개념은 증식 촉진(pro-proliferative) 신호와 증식 억제(anti-proliferative) 신호 간의 균형 회복에 근거한다. PAH은 폐혈관 평활근세포 및 내피세포에서의 뼈형성 단백질 수용체 II형(BMPR-II)& 8211;Smad1/5/8 경로의 기능 저하와 관련이 있으며, 이로 인해 세포 증식 억제 신호가 감소하고 증식 촉진 신호가 상대적으로 우세해지는 병태적 불균형이 발생한다. BMPR-II& 8211;Smad1/5/8 경로의 하향 조절은 액티빈 A, GDF8, GDF11 등 액티빈 계열 리간드의 발현 증가로 이어지며, 이는 ActRIIA을 통한 Smad2/3 경로의 과활성화를 유도한다. 이로 인해 인산화된 Smad2/3(pSmad2/3)의 활성도가 증가하고, 그 결과 내인성 BMP 신호 길항제인 gremlin-1 및 noggin의 발현이 촉진된다. Gremlin-1과 noggin은 BMP& 8211;Smad1/5/8 경로를 추가로 억제함으로써 증식 억제 신호를 더욱 약화시키는 이차적 효과를 유발한다.이러한 일련의 과정은 액티빈& 8211;Smad2/3 기반의 증식 촉진 신호가 병적으로 우세해지도록 만들며, 이는 폐혈관 리모델링(PVR)을 유도하는 핵심 병태기전으로 작용한다.소타터셉트는 과잉 발현된 ActRIIA 리간드들을 포획(sequestration)함으로써 ActRIIA& 8211;Smad2/3 경로의 활성화를 저해하고, 이를 통해 증식 촉진 신호와 억제 신호 간의 균형 회복을 도모한다.결과적으로, 소타터셉트는 액티빈 및 GDFs와 선제적으로 결합하여 ActRIIA& 8211;Smad2/3 매개 증식 신호를 차단함으로써 폐혈관벽 비후를 감소시키고, 리모델링된 혈관 구조의 역전 및 우심실 기능 개선에 기여한다. 이는 기존 치료제들과 달리 질환의 구조적·세포학적 병태생리에 직접적으로 개입하는 새로운 약리 기전을 보여준다.소타터셉트의 주요 임상연구는 어떻게 진행되었나?1. STELLAR 연구 2020년 10월에 시작된 본 연구는 다기관, 이중 눈가림, 무작위배정, 제3상 임상시험으로, 안정적인 기저 치료를 받고 있는 WHO 기능분류 II 또는 III의 폐동맥고혈압(PAH) 성인 환자를 대상으로 수행되었다.총 323명의 환자가 1:1 비율로 무작위 배정되어, 소타터셉트군(목표 용량 0.7 mg/kg, n=163) 또는 위약군(n=160)으로 분류되었으며, 피하 주사 방식으로 3주 간격으로 투여되었다. 대부분의 환자는 3제 병용요법(61%) 또는 2제 요법(35%)을 기저 치료로 받고 있었으며, 약 40%는 프로스타사이클린 주입 치료를 병행하고 있었다. 등록 당시 WHO 기능 등급은 II(49%) 및 III(51%)로 분포되었다.본 연구의 주요 평가 변수(primary endpoint)는 24주 시점에서의 6분 보행 거리(6-minute walk distance, 6MWD)의 기저치 대비 변화량이었으며, 총 9가지의 이차 평가 변수(secondary endpoints)는 계층적(hierarchical) 방식으로 분석되었다. 이 모든 평가는 24주 시점에서 수행되었으며, 사망 또는 임상적 악화까지의 시간(time to clinical worsening)은 마지막 환자의 24주 방문까지 추적되었다.24주 시점에서 6MWD의 중앙값 변화량은 소타터셉트군에서 34.4m(95% CI, 33.0 to 35.5), 위약군에서는 1.0m(95% CI, & 8722;0.3 to 3.5)로 나타났으며, 두 군 간 변화량 차이에 대한 Hodges& 8211;Lehmann 추정치는 40.8m (95% CI, 27.5 to 54.1)로 통계적으로 유의하였다.이차 평가 변수 중 8가지 지표는 소타터셉트군에서 위약군 대비 모두 유의한 개선을 보였으나, PAH-SYMPACT 도구에 기반한 인지/정서적 영향(Cognitive/Emotional Impacts) 영역 점수는 두 군 간 통계적으로 유의한 차이를 보이지 않았다.소타터셉트군에서 위약군에 비해 더 높은 빈도로 보고된 이상반응(adverse events)은 비출혈(epistaxis), 어지럼증(dizziness), 모세혈관 확장증(telangiectasia), 헤모글로빈 수치 상승, 혈소판감소증(thrombocytopenia), 그리고 혈압 상승 등이었다.2. Hyperion 연구 2021년 6월부터 전 세계적으로 시행된 본 연구는 새롭게 진단된 중등도 또는 고위험 폐동맥고혈압(PAH) 환자 약 300명을 대상으로 진행된 무작위배정, 이중 눈가림, 위약 대조 제3상 임상시험이다. 참가자는 소타터셉트와 기존 PAH 치료제를 병용 투여받는 군과 위약 + 기존 치료 병용군으로 1:1 무작위 배정되었다.본 연구의 주요 평가변수는 임상적 악화까지의 시간으로 정의되었으며, 이는 무작위배정 시점부터 최초의 이환 사건(clinical worsening event) 또는 사망 발생까지의 기간을 측정하여 평가되었다. 임상적 악화(clinical worsening) 사건은 다음 중 하나 이상을 포함하는 복합 평가 지표로 정의되었다: 모든 원인의 사망, 24시간 이상 지속된 비계획적 PAH 관련 입원, 심방 중격 절개술(atrial septostomy), 폐 이식(lung transplantation), 또는 기저치 대비 6MWD 감소와 함께 WHO 기능분류(WHO FC) 악화, 우심부전(right heart failure)의 임상적 증상 또는 징후, 기존 PAH 치료제의 추가 사용 또는 정맥 주사형(parenteral) 치료제로의 전환 등이 이에 해당된다.Merck 측은 2024년 초, ZENITH 연구에서 도출된 긍정적인 중간 분석 결과 및 소타터셉트에 대한 누적 데이터를 바탕으로, HYPERION 연구를 지속하는 것이 더 이상 윤리적으로 적절하지 않다고 판단하여 해당 임상시험을 조기 종료하였다.3. ZENITH 연구 2021년 7월에 시작된 ZENITH 연구는 세계보건기구(WHO) 분류상 그룹 1에 해당하는 폐동맥 고혈압(PAH) 환자 중 기능적 분류(WHO FC) III 또는 IV 등급이며, 사망 위험이 높은 성인을 대상으로 소타터셉트의 유효성을 평가하였다. 본 연구에서 소타터셉트는 기존 표준 치료제와 병용 투여 시 위약 대비 이환 또는 사망 사건의 위험을 통계적으로 유의하고 임상적으로도 유의미하게 감소시키는 것으로 나타났으며, 이에 따라 탁월한 효능 결과를 바탕으로 2023년 말 조기 종료되었다.이어 2025년 3월 말에 발표된 3상 ZENITH 연구 결과에 따르면, WHO 기능 등급 III 또는 IV에 해당하는 성인 PAH 환자에서 소타터셉트는 주요 이환 및 사망 사건의 발생 위험을 유의하게 감소시켰다. 본 연구 결과는 미국심장학회 연례 학술대회(ACC Scientific Session)에서 발표되었으며, New England Journal of Medicine에 게재되었다. 분석 결과에 따르면, 소타터셉트는 위약 대비 주요 임상 사건의 위험을 76%까지 감소시킨 것으로 보고되었다.기존의 폐동맥 수축, 이완 및 증식에 관여하는 약제는?폐동맥은 높은 혈류 압력과 벽 긴장(wall stress)을 견딜 수 있도록 구조적으로 특화되어 있으며, 상당한 혈액량을 수용할 수 있는 용적 탄력성을 지닌 혈관이다. 그러나 폐동맥 고혈압(PAH)에서는 광범위한 혈관 리모델링이 유도되며, 이로 인해 동맥 중막에 위치한 소평활근세포(small smooth muscle fibers)가 비정상적으로 증식하거나 확장되어 혈관 수축을 초래한다.이러한 평활근세포의 증식은 내막 비후와 섬유화의 병리적 연쇄반응을 유발하는데, 이는 ‘평활근세포 증식 → 내막 비후 → 섬유화 → 혈관 협착 → 조직 자극 → 재증식’이라는 자가 증폭적 순환을 통해 진행된다. 일단 이러한 병적 순환이 시작되면, 그 진행 속도는 점차 가속화되고 비가역적으로 전개되어, 폐동맥 내강을 점차 폐쇄시키는 병변을 형성하며, 결국 폐혈관 저항의 지속적인 증가로 이어진다. 1995년 이전까지 PAH 치료에 사용 가능한 약제는 칼슘채널차단제(calcium channel blockers)와 항응고제(anticoagulants) 등에 국한되었다. 이후 PAH의 병태생리에서 세 가지 주요 경로인 NO-sGC-cGMP 경로, Prostacyclin 경로 그리고 Endothelin-1(ET-1) 경로의 중요성이 규명되면서, 각 경로를 표적으로 하는 치료 전략이 개발되어 PAH 치료의 새로운 전기를 마련하게 되었다.1. NO-sGC-cGMP 경로 일산화질소(Nitric oxide, NO)는 혈관 평활근 세포 내의 용해성 구아닐산 고리화효소(soluble guanylate cyclase, sGC)를 활성화시켜, 구아노신 삼인산(GTP)을 고리형 구아노신 일인산(cyclic guanosine monophosphate, cGMP)으로 전환시키며, 이는 혈관 이완 및 세포 증식 억제 작용을 유도한다. 그러나 cGMP는 PDE5(phosphodiesterase type 5)에 의해 비활성 형태인 GMP로 분해되어, 이와 같은 혈관 이완 작용이 소실된다.NO-sGC-cGMP 경로와 관련되는 약제에는 NO의 흡입, 아질산염 또는 질산염의 투여, sGC 자극제 Riociguat(리오시구앗, 아뎀파스 정, Adempas& 9415;), PDE5 억제제 Sidenafil 및 Tadanafil 등이 있다.2. Prostacyclin 경로 프로스타사이클린(Prostaglandin I₂, PGI₂)은 혈관 평활근 세포의 수용체에 결합하여 아데닐산 고리화효소(adenylyl cyclase, AC)를 활성화시킨다. 이로 인해 아데노신 삼인산(ATP)이 고리형 아데노신 일인산(cyclic adenosine monophosphate, cAMP)으로 전환되며, 이는 혈관 이완 및 세포 증식 억제 효과를 유도한다.Prostacyclin 경로와 관련되는 약제에는 Prostacyclin 유사체 Epoprostenol, Trepostinil(트레포스티닐, 레모둘린 주, Remodulin& 9415;), Iloprost(일로프로스트, 벤타비스 흡입액, Ventavis& 9415;), 그리고 Beraprost와 IP(Iprostanoid) 수용체 작용제 Selexipag(셀레씨파그, 업트라비 정, Uptravi& 9415;)가 있다.3. Endothelin-1(ET-1) 경로 전구물질인 Big ET-1은 엔도텔린 전환효소(endothelin-converting enzyme, ECE)에 의해 활성형 펩타이드인 엔도텔린-1(ET-1)로 전환된다. ET-1은 21개의 아미노산으로 구성된 강력한 혈관 수축 펩타이드로, 혈관 내피세포에서 주로 생성되며, 평활근 세포의 ETA 및 ETB 수용체에 결합하여 혈관 수축 및 세포 증식을 유도한다.Endothelin-1(ET-1) 경로와 관련되는 약제에는 ETA 수용체 길항제 Ambrisentan(암브리산탄, 볼리브리스 정, Volibris& 9415;)과 ETA와 ETB수용체 길항제 Bosentan(보센탄, 트라클리어 정, Tracleer& 9415;) 및 Macitentan(마시텐탄, 옵서미트 정, Opsumit& 9415;) 등이 있다.기존 PAH 치료제 vs. 소타터셉트를 비교하면?기존의 PAH 치료제들은 주로 폐혈관의 수축 및 이완의 불균형, 내피 기능 장애, 그리고 혈관 리모델링과 같은 병태생리적 현상을 조절하는 데 중점을 두고 있다. 이들 약제는 주로 폐혈관의 평활근 긴장을 완화하거나 혈관 확장을 유도함으로써 폐혈관 저항을 감소시키고 우심실의 후부하를 완화하는 데 기여한다. 그러나 이러한 약물들은 혈관 확장 작용에 기반한 기능적 개선에 초점을 두고 있으며, 혈관벽의 병적 리모델링이나 세포 수준의 병태생리 기전을 근본적으로 교정하는 데는 한계가 있다. 이와 대조적으로, 소타터셉트는 TGF-β 슈퍼패밀리 리간드(예: activin A 등)에 결합함으로써 ActRIIA를 매개로 한 신호전달을 차단하는 새로운 작용 기전을 지닌 약제로, 병적 혈관 리모델링을 표적하는 질병 조절적 접근을 가능하게 한다. 구체적으로, 소타터셉트는 증식 촉진 및 염증 유발성 경로인 ActRIIA/Smad2/3 신호를 억제하고, 동시에 증식 억제 경로인 BMPRII/Smad1/5/8 경로의 활성을 상대적으로 회복시킴으로써, 폐혈관 내피세포 및 평활근세포의 이상 증식, 염증 및 구조적 변화를 효과적으로 억제하는 것으로 나타났다.소타터셉트의 앞으로의 전망은소타터셉트는 기존 폐동맥 고혈압(PAH) 표준 치료제와 병용 시 운동 능력 개선 및 임상적 악화 위험 감소에 기여하는 치료제로, STELLAR 임상시험의 긍정적인 결과를 기반으로 현재까지 40개국 이상에서 승인을 획득하였다. 국내에서는 2024년 12월 '허가신청-급여평가-약가협상 병행 시범사업'의 제2호 대상으로 지정되어, 조만간 국내 도입이 예상된다.ZENITH 임상시험은 탁월한 치료 효과로 인해 조기 종료되었으며, 참여 환자들은 이후 SOTERIA 공개 라벨 연장 연구에 등록되었다. 해당 연구에서 소타터셉트의 안전성 프로파일은 기존 임상시험 결과와 일관되었고, 약물 관련 이상 반응으로 인한 치료 중단 사례는 보고되지 않았다. 또한, 3상 HYPERION 연구 역시 ZENITH 시험의 긍정적 중간 분석 결과를 근거로 조기 종료되어 최종 분석에 돌입하였다.결론적으로, 소타터셉트는 기존 PAH 치료제들과는 차별화된 작용 기전을 통해 폐혈관 구조의 병태생리에 직접적으로 작용하는 질병 조절제로 평가받고 있다. 임상 2상(PULSAR) 연구에서의 유망한 결과를 바탕으로, 임상 3상(STELLAR 및 ZENITH) 연구에서 확립된 유효성과 안전성은 PAH 치료의 새로운 치료 패러다임으로 자리매김할 가능성을 시사한다.참고문헌1. Zhuangzhuang Jia, Shuai Wang, Haifeng Yan, et al. “Pulmonary Vascular Remodeling in Pulmonary Hypertension” J. Pers. Med. 2023, 13(2), 366. 2. Tanvirul Hyea, Riajul Hossainb, Dipongkor Sahac et al. “ Emerging biologics for the treatment of pulmonary arterial hypertension” Journal of Drug Targeting 2023, Vol. 31, no. 5, 471& 8211;485. 3. Marc Humbert, Vallerie McLaughlin, J. Simon R. Gibbs, et al, “Sotatercept for the Treatment of Pulmonary Arterial Hypertension” N Engl J Med 2021;384:1204-1215) 4. Yen-Chun Lai, Karin C. Potoka, Hunter C. et al, “Pulmonary Arterial Hypertension: The Clinical Syndrome” Circulation Research Volume 115, Issue 1, 20 June 2014; Pages 115-130.) 5. Aimon C. Miranda, Cyrille K. Cornelio, Bao Anh C. Tran, and Joel Fernandez, “Sotatercept: A First-In-Class Activin Signaling Inhibitor for Pulmonary Arterial Hypertension” J Pharm Technol. 2025 Feb 22:87551225251317957 6. 2020년 폐고혈압 진료지침 대한심장학회, 대한결핵 및 호흡기학회, 2020 7. 기타 인터넷 자료(보도 자료, 제품 설명서 등)2025-04-21 11:18:06최병철 박사
오늘의 TOP 10
- 1동성제약, 새 주인 '유암코'…경영권 분쟁 종결 국면
- 2에버엑스, 무릎 통증 디지털치료기기 '모라 큐어' 허가 획득
- 3복지부 "2040년 부족한 의사 수 최대 1만1136명"
- 4프리클리나, 'GvHD 없는' 인간화 폐섬유증 모델 상용화
- 5셀메드-매경헬스 ‘앎멘토링학교’ 내달 17일 부산서 개최
- 6보정심, 의대정원 증원 논의 시작...의사단체 또 쓴소리
- 7약무직 14만원, 간호직 10만원...업무수당 100% 인상
- 8서대문구약, 하반기 자체 감사 수감…정기총회 일정 확정도
- 9로그싱크, 약준모와 약국 맞춤 '정밀영양 상담 서비스' 협력
- 10내년 간병 급여화 본 사업…"간호사 중심 관리체계 필수"
-
상품명최고최저평균
-
케토톱플라스타(34매)13,00013,00013,000
-
게보린(10정)4,0003,0003,620
-
노스카나겔(20g)22,00018,00020,703
-
베나치오에프액(75ml)1,0008001,000
-
비코그린에스(20정)5,0004,0004,417














![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[위고비] 직거래 최저가](https://cdn.platpharm.co.kr/2025/12/2512020211090000013.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)










![[신규 리뉴얼] 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
