총 152건
-
 '알부민' 음료는 상술ᆢ"혈중 알부민 수치와 관계 없다"[데일리팜=황병우 기자]'알부민 식품'에 대한 관심이 신장 질환 등 알부민 수치가 낮아진 환자들 사이에서도 늘어나면서 전문가들의 우려가 커지고 있다. 제약사와 식품업체들이 앞다퉈 출시한 이 제품들은 시중에서 많게는 수십만 원을 호가하는 상황에서 환자들이 누릴 수 있는 알부민 수치 상승의 효과는 미미하다는 지적이다. 그럼에도 알부민 식품이 교묘히 효과를 위장해 다가오면서 지푸라기라도 잡고 싶은 환자들까지 불러 모으고 있다. 이 같은 논란을 확인하기 위해 데일리팜은 다수의 대학병원 전문의들에게 취재를 요청했으나, '민감한 사안' 등을 이유로 인터뷰를 고사하는 경우가 적지 않았다. 다만 일부 교수들은 환자 혼란을 바로잡아야 한다는 취지에 공감해 익명을 전제로 취재에 응했다. 이에 데일리팜은 주요 대학병원 신장내과 교수들과의 익명을 전제로 한 취재를 통해 식품 알부민의 대사적 한계와 환자들이 반드시 알아야 할 주의사항을 짚어봤다. '알부민'이라는 이름이 만든 착각…식품과 의약품의 간극 알부민 수치 저하는 간질환, 신장질환 등 다양한 질환에서 나타난다. 문제는 이 지점에서 난백알부민 등 알부민이라는 단어가 붙은 식품이 환자와 보호자의 불안을 정면으로 파고든다는 점이다. "알부민 농도가 떨어졌다고 들었는데, 알부민이 들어간 제품을 먹으면 올라가지 않겠느냐"는 기대가 자연스럽게 형성되는 것이다. 현재 인터넷 포털에 알부민이라는 키워드를 검색해보면 알부민 수치가 줄어들었거나 간과 관련된 질환이 있는데 '알부민 영양제', '먹는 알부민'을 복용해도 괜찮은지에 대한 글을 쉽게 찾아볼 수 있다. 이 같은 문의는 환우회 등 커뮤니티 내 질문을 넘어 실제 환자들이 방문하는 임상현장에서도 관련 문의가 부쩍 늘고 있는 상황이다. 환자들이 가장 오해하는 부분은 '알부민 식품을 먹으면 혈액 속 알부민이 바로 채워질 것'이라는 기대다. 하지만 정맥주사로 투여하는 혈청 알부민과 비교할 때 섭취를 통한 알부민은 일반적인 단백질 섭취와 차이가 없다는 게 전문가의 의견이다. 익명 인터뷰에 응한 서울 소재 상급종합병원 신장내과 A 교수는 "식품으로 섭취한 알부민은 장에서 완전히 분해되어 아미노산 형태로 흡수된다"며 "이 아미노산들이 간으로 이동해 다시 알부민으로 합성되는 재료로 쓰일 수는 있지만, 먹은 알부민이 직접 혈청 알부민으로 작동하는 것은 절대 아니다"고 선을 그었다. 반면 병원에서 처방하는 의약품인 혈청 알부민은 혈액에서 추출한 성분을 고도로 정제해 혈관에 직접 투여한다. 소화 및 분해 과정을 거치지 않고 혈액 내에서 즉각적인 삼투압 조절 등의 기능을 수행하는 것과 식품은 근본적으로 차원이 다르다는 설명이다. 또 다른 경기도 소재 종합병원 신장내과 B 교수는 "알부민을 식품으로 섭취했을 때 혈중 알부민 수치가 상승했다는 데이터를 거의 본 적이 없다"며 "신뢰할 수 있는 자료도 부족한 상황에서 간접적으로 현 시점에서 '혈중 알부민 개선'이라는 기대를 뒷받침할 만한 임상 근거가 취약하다는 판단은 내릴 수 있다"고 강조했다. 여기에는 일부 업체들이 '나노 공법'이나 '액상화'를 통해 흡수율을 크게 높였다고 표현하는 광고 문구도 오해를 더할 수 있다는 평가다. 실제로 식품 알부민 제품 광고를 살펴보면 '흡수 빠른 액상형', '식약처 인증' 등의 타이틀을 전면에 제시하는 경우가 많다. 여기에 간건강과 면역기능 및 에너지 대사 등 효과를 강조하면서 활력이 증가되는 등의 효과가 있다고 선전한다. 이 때문에 환자들 뿐만 아니라 고령의 소비자에게도 효과를 어필 중이다. 하지만 식품 알부민의 경우 의약품이 아닌 만큼 별도의 식약처의 검증 없이 신고를 통해 판매가 가능하다. 즉, 인체에서 어떤 효과를 내는지는 검증할 필요가 없는 구조다. 이 때문에 현재 식품안전나라에 등록되는 품목 유형도 혼합음료, 기타가공품, 당류가공품, 액상차, 인삼·홍삼음료, 고형차, 음료베이스 등 다양하게 등록돼 있다. 특히 알부민 식품이 유행하면서 90% 이상의 제품이 최근 2년에 품목보고 돼 판매가 이뤄졌다. 이런 상황에서 일부 방송에서도 식품이 아닌 알부민이 건강에 미치는 영향을 제시하면서 마치 식품 알부민을 마시면 해당 질환에 효과를 볼 수 있는 것처럼 별개의 사안을 연결해 소비자를 헷갈리게 하고 있다. 이에 대해 A 교수는 "결국 단백질을 섭취하는 것이기 때문에 아미노산으로 분해돼 흡수된 다음 (알부민이) 만들어지는 것이기 때문에 흡수의 속도가 무슨 차이가 있을지 잘 모르겠다"며 "광고 문구로서는 적절할지 모르나 의학적으로는 큰 의미가 없다"고 전했다. 또 그는 "단백질이 조금 빨리 흡수된다고 해서 먹자마자 효과가 나타나지는 않는다"며 "포도당처럼 즉각적으로 에너지원으로 쓰이는 탄수화물과 달리, 단백질은 대사 과정을 거쳐야 하므로 흡수 속도가 피로 해소 속도로 이어지지 않는다"고 지적했다. "혈청 알부민은 환자 맞춤 대응…만성 투여 대상 아냐" 보다 본질적인 관점에서 접근해보면 식품 알부민의 오류는 신장질환 등 환자들 역시 알부민 수치가 떨어졌다고 해서 혈청 알부민을 지속적으로 투여하지 않는다는 점이다. 알부민을 생성하는 유일한 장기는 간으로, 간 기능이 저하되면 알부민 생성이 저하된다. 정상범위인 3.5~5.2g/dL 수치보다 농도가 적어지면 혈관 밖으로 체액이 빠져나가 혈액량이 줄어들어 혈압이 떨어지고 어지럼증, 부종, 복수 등이 발생할 수 있다. B 교수는 "보통 알부민 수치가 많이 떨어지면 부종이 심해지는데 이때 혈청 알부민 등을 투여하면 삼투압으로 물을 끌어들여 부종을 빼주게 된다"며 "다만 환자 상태의 급격한 변화 등 필요에 따라 잠깐씩 사용하는 것이지 만성질환 약처럼 정기적으로 혈청 알부민을 투여하는 개념이 아니다"고 밝혔다. 또 식품 알부민은 일반인이 아닌 특정 환자의 경우 효과가 없는 것을 넘어 위험 요소도 존재할 수 있다. 신부전 환자처럼 신장 기능이 떨어진 경우 단백질 대사 과정에서 발생하는 '질소 노폐물'이 문제가 될 수 있기 때문이다. 이에 대해 A교수는 "단백질을 과도하게 섭취하면 노폐물이 쌓여 요독증이 심해질 이론적 여지가 있다"며 "알부민 식품에 포함된 단백질 양이 적어 치명적이지 않을 수 있지만, 굳이 리스크를 안고 비싼 비용을 지불할 이유가 없다"고 경고했다. 이와 함께 임상 현장에서 우려하는 대목은 경제성이다. 시중의 알부민 식품은 구성에 따라 5만원 대부터 수십만 원 등 다양하게 형성되어 있다. A 교수는 "임상현장에서 문의하는 환자들에게도 비싼 돈을 들이기 보다 질 좋은 소고기나 돼지고기, 생선을 사 먹는 것이 훨씬 이득이라고 조언한다고 있다"고 언급했다. 결국 '먹는 알부민'은 실질적인 혜택보다는 현재 유행에 가까운 만큼 독보적인 해결책이 아니라는 게 A 교수의 의견이다. 끝으로 두 전문가는 "알부민 식품은 현재 독보적인 치료 영역이라기보다 마케팅에 의해 돌아가는 유행에 가깝다고 본다"며 "균형 잡힌 건강한 식단을 하는 게 건강식품을 찾아다니는 것보다 더 안전하고, 길게 보면 더 좋다는 생각이다"고 덧붙였다.2026-01-14 06:00:59황병우 기자
'알부민' 음료는 상술ᆢ"혈중 알부민 수치와 관계 없다"[데일리팜=황병우 기자]'알부민 식품'에 대한 관심이 신장 질환 등 알부민 수치가 낮아진 환자들 사이에서도 늘어나면서 전문가들의 우려가 커지고 있다. 제약사와 식품업체들이 앞다퉈 출시한 이 제품들은 시중에서 많게는 수십만 원을 호가하는 상황에서 환자들이 누릴 수 있는 알부민 수치 상승의 효과는 미미하다는 지적이다. 그럼에도 알부민 식품이 교묘히 효과를 위장해 다가오면서 지푸라기라도 잡고 싶은 환자들까지 불러 모으고 있다. 이 같은 논란을 확인하기 위해 데일리팜은 다수의 대학병원 전문의들에게 취재를 요청했으나, '민감한 사안' 등을 이유로 인터뷰를 고사하는 경우가 적지 않았다. 다만 일부 교수들은 환자 혼란을 바로잡아야 한다는 취지에 공감해 익명을 전제로 취재에 응했다. 이에 데일리팜은 주요 대학병원 신장내과 교수들과의 익명을 전제로 한 취재를 통해 식품 알부민의 대사적 한계와 환자들이 반드시 알아야 할 주의사항을 짚어봤다. '알부민'이라는 이름이 만든 착각…식품과 의약품의 간극 알부민 수치 저하는 간질환, 신장질환 등 다양한 질환에서 나타난다. 문제는 이 지점에서 난백알부민 등 알부민이라는 단어가 붙은 식품이 환자와 보호자의 불안을 정면으로 파고든다는 점이다. "알부민 농도가 떨어졌다고 들었는데, 알부민이 들어간 제품을 먹으면 올라가지 않겠느냐"는 기대가 자연스럽게 형성되는 것이다. 현재 인터넷 포털에 알부민이라는 키워드를 검색해보면 알부민 수치가 줄어들었거나 간과 관련된 질환이 있는데 '알부민 영양제', '먹는 알부민'을 복용해도 괜찮은지에 대한 글을 쉽게 찾아볼 수 있다. 이 같은 문의는 환우회 등 커뮤니티 내 질문을 넘어 실제 환자들이 방문하는 임상현장에서도 관련 문의가 부쩍 늘고 있는 상황이다. 환자들이 가장 오해하는 부분은 '알부민 식품을 먹으면 혈액 속 알부민이 바로 채워질 것'이라는 기대다. 하지만 정맥주사로 투여하는 혈청 알부민과 비교할 때 섭취를 통한 알부민은 일반적인 단백질 섭취와 차이가 없다는 게 전문가의 의견이다. 익명 인터뷰에 응한 서울 소재 상급종합병원 신장내과 A 교수는 "식품으로 섭취한 알부민은 장에서 완전히 분해되어 아미노산 형태로 흡수된다"며 "이 아미노산들이 간으로 이동해 다시 알부민으로 합성되는 재료로 쓰일 수는 있지만, 먹은 알부민이 직접 혈청 알부민으로 작동하는 것은 절대 아니다"고 선을 그었다. 반면 병원에서 처방하는 의약품인 혈청 알부민은 혈액에서 추출한 성분을 고도로 정제해 혈관에 직접 투여한다. 소화 및 분해 과정을 거치지 않고 혈액 내에서 즉각적인 삼투압 조절 등의 기능을 수행하는 것과 식품은 근본적으로 차원이 다르다는 설명이다. 또 다른 경기도 소재 종합병원 신장내과 B 교수는 "알부민을 식품으로 섭취했을 때 혈중 알부민 수치가 상승했다는 데이터를 거의 본 적이 없다"며 "신뢰할 수 있는 자료도 부족한 상황에서 간접적으로 현 시점에서 '혈중 알부민 개선'이라는 기대를 뒷받침할 만한 임상 근거가 취약하다는 판단은 내릴 수 있다"고 강조했다. 여기에는 일부 업체들이 '나노 공법'이나 '액상화'를 통해 흡수율을 크게 높였다고 표현하는 광고 문구도 오해를 더할 수 있다는 평가다. 실제로 식품 알부민 제품 광고를 살펴보면 '흡수 빠른 액상형', '식약처 인증' 등의 타이틀을 전면에 제시하는 경우가 많다. 여기에 간건강과 면역기능 및 에너지 대사 등 효과를 강조하면서 활력이 증가되는 등의 효과가 있다고 선전한다. 이 때문에 환자들 뿐만 아니라 고령의 소비자에게도 효과를 어필 중이다. 하지만 식품 알부민의 경우 의약품이 아닌 만큼 별도의 식약처의 검증 없이 신고를 통해 판매가 가능하다. 즉, 인체에서 어떤 효과를 내는지는 검증할 필요가 없는 구조다. 이 때문에 현재 식품안전나라에 등록되는 품목 유형도 혼합음료, 기타가공품, 당류가공품, 액상차, 인삼·홍삼음료, 고형차, 음료베이스 등 다양하게 등록돼 있다. 특히 알부민 식품이 유행하면서 90% 이상의 제품이 최근 2년에 품목보고 돼 판매가 이뤄졌다. 이런 상황에서 일부 방송에서도 식품이 아닌 알부민이 건강에 미치는 영향을 제시하면서 마치 식품 알부민을 마시면 해당 질환에 효과를 볼 수 있는 것처럼 별개의 사안을 연결해 소비자를 헷갈리게 하고 있다. 이에 대해 A 교수는 "결국 단백질을 섭취하는 것이기 때문에 아미노산으로 분해돼 흡수된 다음 (알부민이) 만들어지는 것이기 때문에 흡수의 속도가 무슨 차이가 있을지 잘 모르겠다"며 "광고 문구로서는 적절할지 모르나 의학적으로는 큰 의미가 없다"고 전했다. 또 그는 "단백질이 조금 빨리 흡수된다고 해서 먹자마자 효과가 나타나지는 않는다"며 "포도당처럼 즉각적으로 에너지원으로 쓰이는 탄수화물과 달리, 단백질은 대사 과정을 거쳐야 하므로 흡수 속도가 피로 해소 속도로 이어지지 않는다"고 지적했다. "혈청 알부민은 환자 맞춤 대응…만성 투여 대상 아냐" 보다 본질적인 관점에서 접근해보면 식품 알부민의 오류는 신장질환 등 환자들 역시 알부민 수치가 떨어졌다고 해서 혈청 알부민을 지속적으로 투여하지 않는다는 점이다. 알부민을 생성하는 유일한 장기는 간으로, 간 기능이 저하되면 알부민 생성이 저하된다. 정상범위인 3.5~5.2g/dL 수치보다 농도가 적어지면 혈관 밖으로 체액이 빠져나가 혈액량이 줄어들어 혈압이 떨어지고 어지럼증, 부종, 복수 등이 발생할 수 있다. B 교수는 "보통 알부민 수치가 많이 떨어지면 부종이 심해지는데 이때 혈청 알부민 등을 투여하면 삼투압으로 물을 끌어들여 부종을 빼주게 된다"며 "다만 환자 상태의 급격한 변화 등 필요에 따라 잠깐씩 사용하는 것이지 만성질환 약처럼 정기적으로 혈청 알부민을 투여하는 개념이 아니다"고 밝혔다. 또 식품 알부민은 일반인이 아닌 특정 환자의 경우 효과가 없는 것을 넘어 위험 요소도 존재할 수 있다. 신부전 환자처럼 신장 기능이 떨어진 경우 단백질 대사 과정에서 발생하는 '질소 노폐물'이 문제가 될 수 있기 때문이다. 이에 대해 A교수는 "단백질을 과도하게 섭취하면 노폐물이 쌓여 요독증이 심해질 이론적 여지가 있다"며 "알부민 식품에 포함된 단백질 양이 적어 치명적이지 않을 수 있지만, 굳이 리스크를 안고 비싼 비용을 지불할 이유가 없다"고 경고했다. 이와 함께 임상 현장에서 우려하는 대목은 경제성이다. 시중의 알부민 식품은 구성에 따라 5만원 대부터 수십만 원 등 다양하게 형성되어 있다. A 교수는 "임상현장에서 문의하는 환자들에게도 비싼 돈을 들이기 보다 질 좋은 소고기나 돼지고기, 생선을 사 먹는 것이 훨씬 이득이라고 조언한다고 있다"고 언급했다. 결국 '먹는 알부민'은 실질적인 혜택보다는 현재 유행에 가까운 만큼 독보적인 해결책이 아니라는 게 A 교수의 의견이다. 끝으로 두 전문가는 "알부민 식품은 현재 독보적인 치료 영역이라기보다 마케팅에 의해 돌아가는 유행에 가깝다고 본다"며 "균형 잡힌 건강한 식단을 하는 게 건강식품을 찾아다니는 것보다 더 안전하고, 길게 보면 더 좋다는 생각이다"고 덧붙였다.2026-01-14 06:00:59황병우 기자 -
 "미래 먹거리 잡아라"…M&A로 보는 글로벌 R&D 방향성[데일리팜=손형민 기자] 제약업계에서 M&A는 생존을 좌우하는 전략이 됐다. 2025년 한 해 동안 글로벌 제약사의 인수합병(M&A) 흐름은 단순한 인수·합병이 아닌 미래 성장 축을 선점하기 위한 연구개발(R&D) 방향성 그 자체를 보여줬다. 파이프라인 확보, 플랫폼 기술 흡수, 신속한 임상 역량 구축이 M&A의 중심에 자리 잡으면서 연구개발 전략은 구조적 변화를 맞이하고 있다. 2026년 현시점에서는 이러한 변화가 더욱 뚜렷해지고 있다. 항암 신약 개발에서는 방사성의약품, 항체약물접합체(ADC), 다중항체 등 신규 메커니즘이 급부상하며 기존 표준 치료영역을 빠르게 대체하고 있다. 또 하나의 중심축은 대사질환이다. 비만 치료제 시장을 주도해 온 GLP-1 계열 신약은 이제 단순 체중 감량을 넘어 심혈관·신장·간질환까지 포괄하는 대사 플랫폼 치료제로 진화하고 있다. 비만 치료 패러다임의 변화는 결국 대사질환 전반의 치료전략을 재정의하며 글로벌 시장의 확장성을 다시 쓰고 있다. 데일리팜은 ▲2025년 M&A 흐름에서 드러난 연구개발 전략 ▲항암제 개발 지형의 급속한 재편 ▲GLP-1 기반 대사질환 치료 혁신의 확장세를 차례로 짚어보며 향후 글로벌 R&D 패러다임이 어떤 방향으로 이어질지 전망하고자 한다. 대형 딜의 귀환…규모보다 방향성 강조한 2025년 지난해 체결된 주요 M&A를 보면 가장 큰 규모는 존슨앤드존슨의 미국 제약바이오기업 인트라셀룰러 인수 시 지불했던 146억 달러(약 21조원)였다. 이 회사는 이번 인수로 미국에서 승인된 조현병, 양극성 장애 치료제 '캐플리타(루마테페론)'를 파이프라인에 추가했다. 캐플리타는 세로토닌 5-HT2A 수용체 점유율이 높고 도파민 D2 수용체 점유율은 낮다는 특징을 갖고 있다. 이 같은 특징은 신경전달물질의 선택적 작용과 약물 개발에서 중요한 기준으로 활용된다. 존슨앤드존슨은 캐플리타의 연간 매출액이 50억 달러 이상을 기록할 것으로 내다봤다. 노바티스의 RNA 치료제 기업 어비디티 바이오사이언스 인수(120억달러), 화이자의 GLP-1 계열 신약 확보를 위한 맷세라 인수(100억달러) 등 100억 달러 이상의 대형 딜도 잇따랐다. 이들 거래의 공통점은 단기 매출 확대보다는 차세대 플랫폼과 파이프라인 확장성에 초점이 맞춰졌다는 점이다. CNS, RNA 치료제, GLP-1 계열 신약, 대사 이상 관련 지방간염(MASH) 등은 모두 임상 성공 시 파급력이 크고 적응증 확장이 용이한 영역으로 평가받는다. 이는 불확실성이 커진 글로벌 환경 속에서 빅파마들이 확실한 미래 시장에 선택과 집중을 하고 있음을 보여주는 신호로 해석된다. 질환별 투자 흐름을 살펴보면 항암제 분야는 여전히 최대 비중을 차지하지만 성장세는 둔화됐다. 시장조사기관 EY 자료에 따르면 2023년 항암제 관련 M&A 규모는 약 1090억 달러에 달했지만 2024년에는 680억 달러로 급감했다. 지난해에는 글로벌제약사들이 새로운 기전의 신약들을 도입하는 데 힘입어 950억 달러로 증가했다. 투자 현황을 살펴보면, 항암신약 개발이 위축됐기 때문이라기보다 ADC·방사성의약품·다중항체 등 신규 기전이 이미 대형 기업 내부 파이프라인으로 상당 부분 흡수된 영향이 크다. 즉, 항암 영역에서는 개별 후보물질 인수보다는 기술 플랫폼 단위의 전략적 제휴나 공동개발이 보다 선호되는 국면으로 접어들었다는 분석이다. 반면 CNS 영역은 상대적으로 안정적인 투자 흐름을 보였다. 존슨앤드존슨의 대형 딜을 포함해 중추신경계 질환이 여전히 장기 성장성과 미충족 수요가 공존하는 영역으로 인식되고 있음을 보여준다. 다수 글로벌제약사들이 희귀면역질환에 초점을 맞춰 포트폴리오를 전환하는 추세다. 2025년 M&A에서 가장 눈에 띄는 변화는 면역질환과 대사질환 분야의 재부상이다. 면역질환 관련 딜 규모는 2024년 460억달러에서 2025년 650억달러로 다시 증가했고 대사질환은 같은 기간 310억달러에서 510억달러로 확대됐다. 특히 노보노디스크의 아케로 인수(52억달러), 로슈의 89bio 인수(35억달러)는 모두 MASH를 포함한 대사질환 파이프라인 확보를 겨냥한 거래다. 이는 GLP-1 계열 비만 치료제가 단순 체중 감량을 넘어 심혈관·간·신장 질환으로 확장되는 플랫폼 치료 전략으로 진화하고 있음을 단적으로 보여준다. 비만 치료제 경쟁의 다음 무대는 대사질환 전체를 아우르는 포트폴리오 경쟁이라는 평가도 나오는 상황이다. 연속되는 불확실성 속 정교해진 신약개발 전략 2025년 글로벌 제약업계의 인수·합병(M&A)은 단순한 외형 확장이 아닌 중장기 연구개발(R&D) 전략의 방향성을 선명하게 드러낸 한 해로 평가된다. 딜 규모와 대상 질환 포트폴리오를 종합해 보면 글로벌 제약사들은 개별 파이프라인 보강을 넘어 플랫폼 기술과 미래 치료 영역을 선점하기 위한 구조적 재편에 나섰다. 다만 과거처럼 항암제 중심의 공격적 인수보다는 대사질환·CNS·희귀질환 등 비교적 장기 성장성이 확실한 영역으로 무게중심이 이동했다는 점이 2025년 체결된 M&A의 가장 큰 특징이다. 또 지난해 M&A 흐름은 직전 연도와 비교했을 때 전략적 대비가 더욱 분명해진다. 지난 2024년 글로벌 제약업계에서 성사된 가장 큰 계약은 버텍스파마슈티컬스가 알파인 이뮨 사이언스를 인수하며 체결한 49억달러(약 7조300억원) 규모였다. 이는 100억달러 이상 대형 딜이 여러 건 등장했던 2023년과 비교하면 확연히 낮아진 수치다. 2024년 M&A 시장은 전반적으로 대형 인수에 대한 신중론이 지배한 해로 평가된다. 글로벌 제약사들은 과거와 같은 빅 베팅 대신 상대적으로 규모가 작은 기업을 선별적으로 인수한 뒤 내부 역량을 통해 기업가치를 키우는 전략을 택했다. 이른바 '볼트온(bolt-on) 전략'이다. 핵심 플랫폼이나 유망 파이프라인을 보유한 중소형 바이오텍을 인수한 뒤, 기존 연구개발·임상·상업화 역량을 결합해 리스크는 분산하고 성공 가능성은 단계적으로 끌어올리는 방식이다. 이 같은 흐름 속에서 2025년 다시 100억달러 이상 대형 딜이 다수 등장했다는 점은 글로벌 제약사들이 불확실성 국면을 지나 선택적 확신의 단계로 이동하고 있음을 시사한다는 해석도 나온다. 다만 2023년과 달리 무차별적 대형 인수가 아닌 질환·기전·플랫폼이 명확히 검증된 영역에만 자본이 집중되고 있다는 점에서 M&A의 성격 자체는 한층 정교해졌다는 평가다.2026-01-14 06:00:58손형민 기자
"미래 먹거리 잡아라"…M&A로 보는 글로벌 R&D 방향성[데일리팜=손형민 기자] 제약업계에서 M&A는 생존을 좌우하는 전략이 됐다. 2025년 한 해 동안 글로벌 제약사의 인수합병(M&A) 흐름은 단순한 인수·합병이 아닌 미래 성장 축을 선점하기 위한 연구개발(R&D) 방향성 그 자체를 보여줬다. 파이프라인 확보, 플랫폼 기술 흡수, 신속한 임상 역량 구축이 M&A의 중심에 자리 잡으면서 연구개발 전략은 구조적 변화를 맞이하고 있다. 2026년 현시점에서는 이러한 변화가 더욱 뚜렷해지고 있다. 항암 신약 개발에서는 방사성의약품, 항체약물접합체(ADC), 다중항체 등 신규 메커니즘이 급부상하며 기존 표준 치료영역을 빠르게 대체하고 있다. 또 하나의 중심축은 대사질환이다. 비만 치료제 시장을 주도해 온 GLP-1 계열 신약은 이제 단순 체중 감량을 넘어 심혈관·신장·간질환까지 포괄하는 대사 플랫폼 치료제로 진화하고 있다. 비만 치료 패러다임의 변화는 결국 대사질환 전반의 치료전략을 재정의하며 글로벌 시장의 확장성을 다시 쓰고 있다. 데일리팜은 ▲2025년 M&A 흐름에서 드러난 연구개발 전략 ▲항암제 개발 지형의 급속한 재편 ▲GLP-1 기반 대사질환 치료 혁신의 확장세를 차례로 짚어보며 향후 글로벌 R&D 패러다임이 어떤 방향으로 이어질지 전망하고자 한다. 대형 딜의 귀환…규모보다 방향성 강조한 2025년 지난해 체결된 주요 M&A를 보면 가장 큰 규모는 존슨앤드존슨의 미국 제약바이오기업 인트라셀룰러 인수 시 지불했던 146억 달러(약 21조원)였다. 이 회사는 이번 인수로 미국에서 승인된 조현병, 양극성 장애 치료제 '캐플리타(루마테페론)'를 파이프라인에 추가했다. 캐플리타는 세로토닌 5-HT2A 수용체 점유율이 높고 도파민 D2 수용체 점유율은 낮다는 특징을 갖고 있다. 이 같은 특징은 신경전달물질의 선택적 작용과 약물 개발에서 중요한 기준으로 활용된다. 존슨앤드존슨은 캐플리타의 연간 매출액이 50억 달러 이상을 기록할 것으로 내다봤다. 노바티스의 RNA 치료제 기업 어비디티 바이오사이언스 인수(120억달러), 화이자의 GLP-1 계열 신약 확보를 위한 맷세라 인수(100억달러) 등 100억 달러 이상의 대형 딜도 잇따랐다. 이들 거래의 공통점은 단기 매출 확대보다는 차세대 플랫폼과 파이프라인 확장성에 초점이 맞춰졌다는 점이다. CNS, RNA 치료제, GLP-1 계열 신약, 대사 이상 관련 지방간염(MASH) 등은 모두 임상 성공 시 파급력이 크고 적응증 확장이 용이한 영역으로 평가받는다. 이는 불확실성이 커진 글로벌 환경 속에서 빅파마들이 확실한 미래 시장에 선택과 집중을 하고 있음을 보여주는 신호로 해석된다. 질환별 투자 흐름을 살펴보면 항암제 분야는 여전히 최대 비중을 차지하지만 성장세는 둔화됐다. 시장조사기관 EY 자료에 따르면 2023년 항암제 관련 M&A 규모는 약 1090억 달러에 달했지만 2024년에는 680억 달러로 급감했다. 지난해에는 글로벌제약사들이 새로운 기전의 신약들을 도입하는 데 힘입어 950억 달러로 증가했다. 투자 현황을 살펴보면, 항암신약 개발이 위축됐기 때문이라기보다 ADC·방사성의약품·다중항체 등 신규 기전이 이미 대형 기업 내부 파이프라인으로 상당 부분 흡수된 영향이 크다. 즉, 항암 영역에서는 개별 후보물질 인수보다는 기술 플랫폼 단위의 전략적 제휴나 공동개발이 보다 선호되는 국면으로 접어들었다는 분석이다. 반면 CNS 영역은 상대적으로 안정적인 투자 흐름을 보였다. 존슨앤드존슨의 대형 딜을 포함해 중추신경계 질환이 여전히 장기 성장성과 미충족 수요가 공존하는 영역으로 인식되고 있음을 보여준다. 다수 글로벌제약사들이 희귀면역질환에 초점을 맞춰 포트폴리오를 전환하는 추세다. 2025년 M&A에서 가장 눈에 띄는 변화는 면역질환과 대사질환 분야의 재부상이다. 면역질환 관련 딜 규모는 2024년 460억달러에서 2025년 650억달러로 다시 증가했고 대사질환은 같은 기간 310억달러에서 510억달러로 확대됐다. 특히 노보노디스크의 아케로 인수(52억달러), 로슈의 89bio 인수(35억달러)는 모두 MASH를 포함한 대사질환 파이프라인 확보를 겨냥한 거래다. 이는 GLP-1 계열 비만 치료제가 단순 체중 감량을 넘어 심혈관·간·신장 질환으로 확장되는 플랫폼 치료 전략으로 진화하고 있음을 단적으로 보여준다. 비만 치료제 경쟁의 다음 무대는 대사질환 전체를 아우르는 포트폴리오 경쟁이라는 평가도 나오는 상황이다. 연속되는 불확실성 속 정교해진 신약개발 전략 2025년 글로벌 제약업계의 인수·합병(M&A)은 단순한 외형 확장이 아닌 중장기 연구개발(R&D) 전략의 방향성을 선명하게 드러낸 한 해로 평가된다. 딜 규모와 대상 질환 포트폴리오를 종합해 보면 글로벌 제약사들은 개별 파이프라인 보강을 넘어 플랫폼 기술과 미래 치료 영역을 선점하기 위한 구조적 재편에 나섰다. 다만 과거처럼 항암제 중심의 공격적 인수보다는 대사질환·CNS·희귀질환 등 비교적 장기 성장성이 확실한 영역으로 무게중심이 이동했다는 점이 2025년 체결된 M&A의 가장 큰 특징이다. 또 지난해 M&A 흐름은 직전 연도와 비교했을 때 전략적 대비가 더욱 분명해진다. 지난 2024년 글로벌 제약업계에서 성사된 가장 큰 계약은 버텍스파마슈티컬스가 알파인 이뮨 사이언스를 인수하며 체결한 49억달러(약 7조300억원) 규모였다. 이는 100억달러 이상 대형 딜이 여러 건 등장했던 2023년과 비교하면 확연히 낮아진 수치다. 2024년 M&A 시장은 전반적으로 대형 인수에 대한 신중론이 지배한 해로 평가된다. 글로벌 제약사들은 과거와 같은 빅 베팅 대신 상대적으로 규모가 작은 기업을 선별적으로 인수한 뒤 내부 역량을 통해 기업가치를 키우는 전략을 택했다. 이른바 '볼트온(bolt-on) 전략'이다. 핵심 플랫폼이나 유망 파이프라인을 보유한 중소형 바이오텍을 인수한 뒤, 기존 연구개발·임상·상업화 역량을 결합해 리스크는 분산하고 성공 가능성은 단계적으로 끌어올리는 방식이다. 이 같은 흐름 속에서 2025년 다시 100억달러 이상 대형 딜이 다수 등장했다는 점은 글로벌 제약사들이 불확실성 국면을 지나 선택적 확신의 단계로 이동하고 있음을 시사한다는 해석도 나온다. 다만 2023년과 달리 무차별적 대형 인수가 아닌 질환·기전·플랫폼이 명확히 검증된 영역에만 자본이 집중되고 있다는 점에서 M&A의 성격 자체는 한층 정교해졌다는 평가다.2026-01-14 06:00:58손형민 기자 -
 '혼합음료 알부민' 1병당 단백질 1g뿐…"무늬만 알부민"[데일리팜=강혜경 기자] '우리 몸의 건강을 좌우하는 천연 단백질 알부민.' TV홈쇼핑은 물론 종합편성채널 건강관련 코너에서 조차 알부민의 중요성을 강조하면서 약국으로도 관련 수요가 분산되고 있다. 병의원에서 주사제로 맞던 알부민을 손쉽게 마심으로써 활력은 물론 체력관리에까지 도움이 된다는 게 알부민 열풍의 배경이다. 하지만 전문가인 약사들의 의견은 다르다. '누가, 왜 섭취하는지'에 대한 최소한의 질문이나 검증 없이 알부민이라는 세 글자에 기대거나, 주사 방식 혈청 알부민과 동일한 효능·효과를 기대해서는 안 된다는 것이다. '같은' 알부민, '다른' 알부민 알부민은 세포의 기본 물질을 구성하는 단백질의 하나로 혈관 속에서 체액이 머물게 해 혈관과 조직 사이의 삼투압 유지에 중요한 역할을 한다. 알부민을 생성하는 유일한 장기는 간으로, 간 기능이 저하되면 알부민 생성이 저하된다. 정상범위인 3.5~5.2g/dL 수치보다 농도가 적어지면 혈관 밖으로 체액이 빠져나가 혈액량이 줄어들어 혈압이 떨어지고 어지럼증, 부종, 복수 등이 발생할 수 있다. 즉, 간경화, 만성 간질환, 영양장애, 신증후군, 만성 소모성질환 등에서 저알부민혈증이 나타날 확률이 높아 주기적으로 혈액검사 등을 통해 수치를 확인하고 혈청 알부민을 주사형태로 주입하는 것이다. 혈청 알부민은 말 그대로 '사람혈청 알부민'을 주성분으로 하는데, 에스케이플라즈마와 녹십자가 시장을 양분하고 있다. 사람혈청 알부민에 N-아세틸트립토판, 수산화나트륨, 염화나트륨 등을 혼합해 주사하는 방식으로, 알부민의 상실(화상, 신증후군 등) 및 알부민 합성저하(간경변증 등)에 의한 저알부민혈증, 출형석 쇽 등에 효능·효과가 있다. 2024년 혈청 알부민 생산실적은 약 2000억원(에스케이플라즈마 1003억, 녹십자 926억원)규모다. 반면 홈쇼핑 등에서 판매되는 알부민은 계란 흰자위에서 주로 추출한 '난백(卵白)알부민'을 주성분으로 한다. 우유 단백질을 원료로 한 락토알부민, 콩·곡물 단백질을 원료로 한 가공 식물성 단백질 등도 있지만 난백 알부민이 시장을 주도하는 상황이다. 의사의 처방이 있어야 하는 혈청알부민과 달리 난백알부민은 일반식품에 해당해 '혼합음료' 내지 '액상차', '과채가공품', '기타가공품' 등으로 판매되고 있다. 즉, 같은 '알부민'이라는 이름을 사용하고 있지만 글루타치온, 콜라겐 등이 그렇듯 의약품, 식품으로 각각 사용되고 있는 것이다. 난백 알부민으로 체력관리, 활력증진? "효과 미미" 실제 TV홈쇼핑이나 라디오 광고에서 소비자를 현혹하는 소구 포인트는 체력관리와 활력증진이다. 그렇다면 난백 알부민을 섭취할 경우 이들이 말하는 체력관리, 활력증진이 가능할까? 전문가들은 '그렇지 않다'는 입장이다. 오성곤 약학박사는 '알부민 99% 프리미엄 골드'라는 이름이 붙은 실제 제품을 예로 들어 설명했다. 오성곤 박사는 "영양정보를 살펴보면 총 내용량인 30병의 단백질이 총 28g으로, 한 병당 1g에 불과하다. 이외 나트륨, 탄수화물, 당류 등으로 구성돼 있다"면서 "하루에 1g도 채 되지 않는 알부민 액제를 먹는다고 가정할 때 비용대비 효과는 크지 않다는 계산이 나온다"고 지적했다. 정맥 주사하는 혈청 알부민의 경우 25~75g(20%로서 125~375ml)를 주사하는 것과 비교할 때 흡수량으로 환산할 경우 차이가 크다는 것. 뿐만 아니라 제품에 따라서는 당류가 포함돼 있어 당뇨환자들에게는 독이될 수 있다는 것도 그의 주장이다. 33g 한 병당 6g의 당류가 포함돼 있어 자칫 식사 후, 혹은 공복에 알부민을 섭취할 경우 건강에 독이 될 수도 있다는 설명이다. 5만명의 구독자를 보유한 유튜브 채널 '간보는 의사언니 유정주'의 유정주 순천향병원 소화기내과 교수는 "주사 알부민은 소화과정을 거치지 않기 때문에 직접적으로 농도가 올라가 수치 보충에 도움이 될 수 있지만 흡수·분해과정을 거쳐야 하는 먹는 알부민은 혈중 알부민 수치를 직접적으로 올리지 못한다. 알부민을 먹는다고 혈중수치가 오른다는 연구는 제한적"이라고 말했다. 유 교수는 "충분한 단백질을 섭취하고, 운동을 병행하는 것이 좋다"며 "기저 간 질환이 있는 경우라면 연구와 근거를 가진 BCAA 제제를 복용하는 게 효과적"이라고 조언했다. 오원식 약사 역시 양질의 단백질 섭취가 비용대비 효과적이라고 강조했다. 오원식 약사는 "식이가 부족하거나, 알부민이 잘 생성되지 않을 때 필요한 게 알부민이다. 개당 3000~5000원이라는 마시는 알부민 가격을 감안할 때 개당 700원짜리 방목계란을 그만큼 먹는 게 더 효과적이라는 예시를 들곤 한다"며 "먼저 알부민을 추천하지는 않는다"고 설명했다. L-아르기닌, L-아스파트산, 실크펩타이드, 로얄제리까지 '조합' 전문가들의 조언과 달리 그럼에도 알부민 섭취 후 '효과를 봤다'는 소비자들 후기도 심심치 않게 찾아볼 수 있다. 제품을 협찬받고 쓰여진 광고성 후기 이외에도 알부민 섭취가 도움이 됐다는 의견이 존재하는 것도 사실이다. 전문가들은 그 이유로 알부민복합물 이외 '부원료'를 주목했다. 제품에 따라 부원료 구성이 달라지기는 하나 대체로 프리미엄을 내세우는 제품들의 경우 L-아르기닌, L-아스파트산, 타우린, 로얄제리, 영묘사향, 비타민B·C 등을 함께 조합하고 있기 때문이다. 이 같은 배합 차이가 제품 가격에도 고스란히 반영된다. 부원료 가격이 제품의 프리미엄 등급을 결정하는 기준이 되는 것이다. 데일리팜 전문가 칼럼 '건강기능식품, 원료부터 상담까지'를 게재하고 있는 남태환 약사는 "L-아르기닌을 포함해 여러가지를 혼합해 혼합액으로 만든 것이 최근 출시되는 알부민 제제"라며 "단백질을 섭취한다는 것 자체로 영양소적인 의미를 갖는 것은 맞다. 하지만 알부민으로 인한 효과인지, 그외 다른 원료들에 의한 효과인지를 구분하기는 쉽지 않다. 약사로서 난백 알부민이 체력증진 등에 효과를 볼 수 있다고 말할 수는 없을 것 같다"고 말했다. 오원식 약사는 "알부민이 유행하는 이유는 '팔아야 할 사람이 있기 때문'이다. 피로회복제를 추천한다면 약국에서 일반의약품이나 건강기능식품으로 쓸 수 있는 보다 많은 활용지가 있다"면서 "누구한테, 왜 좋은지 등을 따져보지 않은 채 유행만 쫓으며 감정으로 건강을 소비하는 시대상에 대해 우려하지 않을 수 없다"고 지적했다. 그는 "아무리 식품이라고 하더라도 연령에 따라, 성별에 따라, 수면 시간에 따라, 식이 습관에 따라 차이를 둬야 한다"며 "이 같은 역할은 전문가만이 할 수 있는 영역이기도 하다"고 강조했다.2026-01-13 07:00:30강혜경 기자
'혼합음료 알부민' 1병당 단백질 1g뿐…"무늬만 알부민"[데일리팜=강혜경 기자] '우리 몸의 건강을 좌우하는 천연 단백질 알부민.' TV홈쇼핑은 물론 종합편성채널 건강관련 코너에서 조차 알부민의 중요성을 강조하면서 약국으로도 관련 수요가 분산되고 있다. 병의원에서 주사제로 맞던 알부민을 손쉽게 마심으로써 활력은 물론 체력관리에까지 도움이 된다는 게 알부민 열풍의 배경이다. 하지만 전문가인 약사들의 의견은 다르다. '누가, 왜 섭취하는지'에 대한 최소한의 질문이나 검증 없이 알부민이라는 세 글자에 기대거나, 주사 방식 혈청 알부민과 동일한 효능·효과를 기대해서는 안 된다는 것이다. '같은' 알부민, '다른' 알부민 알부민은 세포의 기본 물질을 구성하는 단백질의 하나로 혈관 속에서 체액이 머물게 해 혈관과 조직 사이의 삼투압 유지에 중요한 역할을 한다. 알부민을 생성하는 유일한 장기는 간으로, 간 기능이 저하되면 알부민 생성이 저하된다. 정상범위인 3.5~5.2g/dL 수치보다 농도가 적어지면 혈관 밖으로 체액이 빠져나가 혈액량이 줄어들어 혈압이 떨어지고 어지럼증, 부종, 복수 등이 발생할 수 있다. 즉, 간경화, 만성 간질환, 영양장애, 신증후군, 만성 소모성질환 등에서 저알부민혈증이 나타날 확률이 높아 주기적으로 혈액검사 등을 통해 수치를 확인하고 혈청 알부민을 주사형태로 주입하는 것이다. 혈청 알부민은 말 그대로 '사람혈청 알부민'을 주성분으로 하는데, 에스케이플라즈마와 녹십자가 시장을 양분하고 있다. 사람혈청 알부민에 N-아세틸트립토판, 수산화나트륨, 염화나트륨 등을 혼합해 주사하는 방식으로, 알부민의 상실(화상, 신증후군 등) 및 알부민 합성저하(간경변증 등)에 의한 저알부민혈증, 출형석 쇽 등에 효능·효과가 있다. 2024년 혈청 알부민 생산실적은 약 2000억원(에스케이플라즈마 1003억, 녹십자 926억원)규모다. 반면 홈쇼핑 등에서 판매되는 알부민은 계란 흰자위에서 주로 추출한 '난백(卵白)알부민'을 주성분으로 한다. 우유 단백질을 원료로 한 락토알부민, 콩·곡물 단백질을 원료로 한 가공 식물성 단백질 등도 있지만 난백 알부민이 시장을 주도하는 상황이다. 의사의 처방이 있어야 하는 혈청알부민과 달리 난백알부민은 일반식품에 해당해 '혼합음료' 내지 '액상차', '과채가공품', '기타가공품' 등으로 판매되고 있다. 즉, 같은 '알부민'이라는 이름을 사용하고 있지만 글루타치온, 콜라겐 등이 그렇듯 의약품, 식품으로 각각 사용되고 있는 것이다. 난백 알부민으로 체력관리, 활력증진? "효과 미미" 실제 TV홈쇼핑이나 라디오 광고에서 소비자를 현혹하는 소구 포인트는 체력관리와 활력증진이다. 그렇다면 난백 알부민을 섭취할 경우 이들이 말하는 체력관리, 활력증진이 가능할까? 전문가들은 '그렇지 않다'는 입장이다. 오성곤 약학박사는 '알부민 99% 프리미엄 골드'라는 이름이 붙은 실제 제품을 예로 들어 설명했다. 오성곤 박사는 "영양정보를 살펴보면 총 내용량인 30병의 단백질이 총 28g으로, 한 병당 1g에 불과하다. 이외 나트륨, 탄수화물, 당류 등으로 구성돼 있다"면서 "하루에 1g도 채 되지 않는 알부민 액제를 먹는다고 가정할 때 비용대비 효과는 크지 않다는 계산이 나온다"고 지적했다. 정맥 주사하는 혈청 알부민의 경우 25~75g(20%로서 125~375ml)를 주사하는 것과 비교할 때 흡수량으로 환산할 경우 차이가 크다는 것. 뿐만 아니라 제품에 따라서는 당류가 포함돼 있어 당뇨환자들에게는 독이될 수 있다는 것도 그의 주장이다. 33g 한 병당 6g의 당류가 포함돼 있어 자칫 식사 후, 혹은 공복에 알부민을 섭취할 경우 건강에 독이 될 수도 있다는 설명이다. 5만명의 구독자를 보유한 유튜브 채널 '간보는 의사언니 유정주'의 유정주 순천향병원 소화기내과 교수는 "주사 알부민은 소화과정을 거치지 않기 때문에 직접적으로 농도가 올라가 수치 보충에 도움이 될 수 있지만 흡수·분해과정을 거쳐야 하는 먹는 알부민은 혈중 알부민 수치를 직접적으로 올리지 못한다. 알부민을 먹는다고 혈중수치가 오른다는 연구는 제한적"이라고 말했다. 유 교수는 "충분한 단백질을 섭취하고, 운동을 병행하는 것이 좋다"며 "기저 간 질환이 있는 경우라면 연구와 근거를 가진 BCAA 제제를 복용하는 게 효과적"이라고 조언했다. 오원식 약사 역시 양질의 단백질 섭취가 비용대비 효과적이라고 강조했다. 오원식 약사는 "식이가 부족하거나, 알부민이 잘 생성되지 않을 때 필요한 게 알부민이다. 개당 3000~5000원이라는 마시는 알부민 가격을 감안할 때 개당 700원짜리 방목계란을 그만큼 먹는 게 더 효과적이라는 예시를 들곤 한다"며 "먼저 알부민을 추천하지는 않는다"고 설명했다. L-아르기닌, L-아스파트산, 실크펩타이드, 로얄제리까지 '조합' 전문가들의 조언과 달리 그럼에도 알부민 섭취 후 '효과를 봤다'는 소비자들 후기도 심심치 않게 찾아볼 수 있다. 제품을 협찬받고 쓰여진 광고성 후기 이외에도 알부민 섭취가 도움이 됐다는 의견이 존재하는 것도 사실이다. 전문가들은 그 이유로 알부민복합물 이외 '부원료'를 주목했다. 제품에 따라 부원료 구성이 달라지기는 하나 대체로 프리미엄을 내세우는 제품들의 경우 L-아르기닌, L-아스파트산, 타우린, 로얄제리, 영묘사향, 비타민B·C 등을 함께 조합하고 있기 때문이다. 이 같은 배합 차이가 제품 가격에도 고스란히 반영된다. 부원료 가격이 제품의 프리미엄 등급을 결정하는 기준이 되는 것이다. 데일리팜 전문가 칼럼 '건강기능식품, 원료부터 상담까지'를 게재하고 있는 남태환 약사는 "L-아르기닌을 포함해 여러가지를 혼합해 혼합액으로 만든 것이 최근 출시되는 알부민 제제"라며 "단백질을 섭취한다는 것 자체로 영양소적인 의미를 갖는 것은 맞다. 하지만 알부민으로 인한 효과인지, 그외 다른 원료들에 의한 효과인지를 구분하기는 쉽지 않다. 약사로서 난백 알부민이 체력증진 등에 효과를 볼 수 있다고 말할 수는 없을 것 같다"고 말했다. 오원식 약사는 "알부민이 유행하는 이유는 '팔아야 할 사람이 있기 때문'이다. 피로회복제를 추천한다면 약국에서 일반의약품이나 건강기능식품으로 쓸 수 있는 보다 많은 활용지가 있다"면서 "누구한테, 왜 좋은지 등을 따져보지 않은 채 유행만 쫓으며 감정으로 건강을 소비하는 시대상에 대해 우려하지 않을 수 없다"고 지적했다. 그는 "아무리 식품이라고 하더라도 연령에 따라, 성별에 따라, 수면 시간에 따라, 식이 습관에 따라 차이를 둬야 한다"며 "이 같은 역할은 전문가만이 할 수 있는 영역이기도 하다"고 강조했다.2026-01-13 07:00:30강혜경 기자 -
 "계란 흰자가 약으로 둔갑?"…알부민 음료 열풍의 허상[데일리팜=김지은 기자] 최근 알부민을 내세운 각종 제품이 온라인과 홈쇼핑, SNS를 중심으로 빠르게 확산되고 있다. ‘기력 회복’, ‘컨디션 관리’, ‘영양 보충’, '간 기능 개선', '식약처 인증' 등을 강조한 광고가 잇따르면서 식품 알부민이 소비자들 사이에서는 마치 의학적으로 검증된 고급 치료 성분처럼 인식되는 분위기다. 그러나 약사 등 의약품 전문가들은 이 같은 알부민 열풍에 대해 “식품과 의약품의 경계를 흐리는 위험한 신호”라며 우려를 표명하고 있다. 온라인·홈쇼핑·SNS까지…광고 시장은 식품 알부민 열풍 경구 알부민 시장은 최근 몇 년 사이 눈에 띄게 성장했다. 일부 제품은 광고 문구나 이미지에서 ‘병원’, ‘수액’, ‘영양 보충’, ‘혈청’ 등의 표현을 사용하며 마치 의약품에 준하는 효과가 있는 것처럼 홍보되는 실정이다. 특히 홈쇼핑, 온라인, SNS 광고에서는 혈청 알부민의 생리적 역할을 나열하며 면역력, 간 건강, 체력 회복과의 연관성을 강조하는 사례도 적지 않다. 이 같은 광고 흐름 속 소비자들은 경구 알부민을 단순한 식품이 아닌 건강을 빠르게 회복시켜 주는 성분으로 받아들이는 경향이다. 약국에서도 “알부민 음료를 마시면 링거 맞은 것과 같은 효과가 있냐”, “병원에서 쓰는 알부민과 같은 성분 아니냐”는 문의가 늘었다는 것이 약사들의 말이다. 이혜정 약사(대한약사회 학술이사)는 “고령 환자는 TV나 유튜브 정보에 의존하는 경향이 크다보니 알부민 구매를 염두에 두고 방문하는 경우가 많다”며 “경구 알부민 광고나 관련 정보를 보면 일반 식품임에도 의약품으로 오인하게 하거나, 알부민이 그대로 흡수될 수 없는 사실을 무시한 방식으로 제품을 홍보하고 있다. 관련 광고나 정보에 노출된 소비자들은 먹는 알부민이 주사제 알부민과 같은 효과가 있을 것이라고 믿고 구매하고 있다는 점이 문제”라고 지적했다. 이 약사는 “이 제품을 찾는 대상은 고령층이 많은데 시중에 경구 알부민들이 효능 효과 대비 가격이 저렴하지 않고 반복 구매하도록 유도하고 있다"며 "기본적으로 성분 자체가 가격에 준하는 효과나 광고하는 효능으로 이어질 수 없다는 것이 전문가로서 가장 답답한 부분이다. 약국에서는 이런 부분을 최소한 설명할 수 있겠지만 다른 채널에서는 구매할 수 밖에 없는 게 현실"이라고 말했다. “달걀, 소고기 먹는 게 낫다?”…전문가가 보는 경구 알부민 전문가들이 가장 먼저 지적하는 부분은 소비자들이 흔히 접하는 알부민은 의약품도, 건강기능식품도 아닌 일반식품이라는 점이다. 일반 식품에 사용되는 알부민과 병원에서 사용하는 혈청 알부민 제제는 본질적으로 다르다는 점에서 약사들은 문제가 출발한다고 입을 모은다. 경구용 알부민 제품은 식품 원료로 허용된 단백질 성분을 활용한 제품으로, 일반적인 영양 섭취 범주에 속한다. 약사들이 달걀이나 소고기를 제대로 섭취한다면 시중에 판매하는 알부민을 굳이 복용하지 않아도 된다고 지적하는 이유도 거기에 있다. 반면 혈청 알부민은 인체 혈장에서 분획·정제한 전문의약품으로, 중증 저알부민혈증이나 대량 출혈, 간질환 등 특정 적응증에서 의사의 판단에 따라 투여된다. 제조 과정과 안전 관리, 사용 목적 모두가 엄격히 관리되는 의약품이다. 약국가에서는 이 두 개념이 혼재 된 채 알부민이라는 단어만 부각되는 현상이 소비자의 오해를 키우고 있다고 보고 있다. 오인석 대한약사회 부회장은 “경구 알부민은 어디까지나 식품인데 의약품 알부민의 이미지를 차용해 홍보되는 경우가 많다”며 “시중에 판매되는 난백 알부민은 계란 흰자를 건조해 가루로 만든 것이다. 사실상 우리가 흔히 먹는 프로틴 파우더와 유사하다고도 볼 수 있다. 더욱이 경구로 섭취하면 위장관에서 아미노산 단위로 분해되는 만큼 혈장 알부민으로 전환될 가능성은 거의 희박하다고 봐야 한다”고 말했다. 오 부회장은 “그럼에도 소비자들은 혈청 알부민 효능효과를 차용한 광고에 속아 제품을 구매하고, 또 그에 맞는 효능효과를 기대하게 된다”면서 “시중 알부민 제품들이 내세우는 광고나 관련 정보가 대국민 사기에 가깝다고도 보는 이유도 거기에 있다”고 지적했다. “음료가 왜 피로회복 치료제로?”…소비자 오인 부추겨 전문가들이 우려하는 지점은 알부민이 ‘즉각적인 피로 회복제’처럼 소비되고 있다는 점이다. 알부민은 체내에서 삼투압 유지와 영양 상태를 반영하는 지표로 활용되는 단백질이지 단기간 섭취 만으로 체력이나 컨디션을 끌어올리는 성분은 아니라는 설명이다. 특히 건강한 일반인의 경우 알부민을 추가로 섭취한다고 해서 체내 알부민 수치가 의미 있게 개선되거나 임상적으로 유의미한 효과를 기대하기는 어렵다는 것이 전문가들의 공통된 견해다. 피로의 원인이 수면 부족, 스트레스, 기저질환 등 다양한 요인에 있을 수 있음에도 특정 성분에 기대는 소비 행태가 오히려 문제를 단순화시킨다는 지적도 나온다. 전문가들은 알부민의 범람을 단순 소비 트렌드로만 볼 수 없다고 지적한다. 의약품 이미지를 연상시키는 성분이 식품 시장으로 이동하면서 발생하는 구조적 문제라는 것. 이는 곧 단순 유행을 넘어 식품과 의약품의 경계를 흐리는 현상으로 이어질 수 있다는 지적이다. 약국가에서는 이 같은 흐름이 지속될 경우 소비자 보호와 올바른 정보 제공 측면에서 문제가 될 수 있다고 보고 있다. 오 부회장은 “실제 알부민이 필요하다고 판단되는 경우는 대부분 의료진의 진단과 처방이 필요한 상황”이라며 “일상적인 건강 관리 차원에서 알부민 음료에 과도한 기대를 거는 것은 경계해야 한다”고 말했다. 나아가 약사들은 이 같은 과대, 허위 광고가 소비자 안전에 직접적인 위협이 될 수 있다는 점에서 경계하할 필요가 있다고 강조한다. 이혜정 약사는 “저알부민혈증인 고객이 알부민 광고를 보고 제품을 찾는 경우가 있었다”며 “암 환자로 대사 기능이 떨어져 소화 흡수력이 거의 없어 오히려 가공식품인 경구 알부민을 복용하면 독으로 작용할 수 있는 상태였다. 상담을 통해 이런 부분을 설명하고 복용을 만류했지만, 전문가와의 상담없이 수많은 광고에 현혹돼 구매해 복용하는 환자 중 이런 경우가 얼마든지 발생할 수 있다는 점이 우려되는 지점”이라고 강조했다.2026-01-12 06:00:59김지은 기자
"계란 흰자가 약으로 둔갑?"…알부민 음료 열풍의 허상[데일리팜=김지은 기자] 최근 알부민을 내세운 각종 제품이 온라인과 홈쇼핑, SNS를 중심으로 빠르게 확산되고 있다. ‘기력 회복’, ‘컨디션 관리’, ‘영양 보충’, '간 기능 개선', '식약처 인증' 등을 강조한 광고가 잇따르면서 식품 알부민이 소비자들 사이에서는 마치 의학적으로 검증된 고급 치료 성분처럼 인식되는 분위기다. 그러나 약사 등 의약품 전문가들은 이 같은 알부민 열풍에 대해 “식품과 의약품의 경계를 흐리는 위험한 신호”라며 우려를 표명하고 있다. 온라인·홈쇼핑·SNS까지…광고 시장은 식품 알부민 열풍 경구 알부민 시장은 최근 몇 년 사이 눈에 띄게 성장했다. 일부 제품은 광고 문구나 이미지에서 ‘병원’, ‘수액’, ‘영양 보충’, ‘혈청’ 등의 표현을 사용하며 마치 의약품에 준하는 효과가 있는 것처럼 홍보되는 실정이다. 특히 홈쇼핑, 온라인, SNS 광고에서는 혈청 알부민의 생리적 역할을 나열하며 면역력, 간 건강, 체력 회복과의 연관성을 강조하는 사례도 적지 않다. 이 같은 광고 흐름 속 소비자들은 경구 알부민을 단순한 식품이 아닌 건강을 빠르게 회복시켜 주는 성분으로 받아들이는 경향이다. 약국에서도 “알부민 음료를 마시면 링거 맞은 것과 같은 효과가 있냐”, “병원에서 쓰는 알부민과 같은 성분 아니냐”는 문의가 늘었다는 것이 약사들의 말이다. 이혜정 약사(대한약사회 학술이사)는 “고령 환자는 TV나 유튜브 정보에 의존하는 경향이 크다보니 알부민 구매를 염두에 두고 방문하는 경우가 많다”며 “경구 알부민 광고나 관련 정보를 보면 일반 식품임에도 의약품으로 오인하게 하거나, 알부민이 그대로 흡수될 수 없는 사실을 무시한 방식으로 제품을 홍보하고 있다. 관련 광고나 정보에 노출된 소비자들은 먹는 알부민이 주사제 알부민과 같은 효과가 있을 것이라고 믿고 구매하고 있다는 점이 문제”라고 지적했다. 이 약사는 “이 제품을 찾는 대상은 고령층이 많은데 시중에 경구 알부민들이 효능 효과 대비 가격이 저렴하지 않고 반복 구매하도록 유도하고 있다"며 "기본적으로 성분 자체가 가격에 준하는 효과나 광고하는 효능으로 이어질 수 없다는 것이 전문가로서 가장 답답한 부분이다. 약국에서는 이런 부분을 최소한 설명할 수 있겠지만 다른 채널에서는 구매할 수 밖에 없는 게 현실"이라고 말했다. “달걀, 소고기 먹는 게 낫다?”…전문가가 보는 경구 알부민 전문가들이 가장 먼저 지적하는 부분은 소비자들이 흔히 접하는 알부민은 의약품도, 건강기능식품도 아닌 일반식품이라는 점이다. 일반 식품에 사용되는 알부민과 병원에서 사용하는 혈청 알부민 제제는 본질적으로 다르다는 점에서 약사들은 문제가 출발한다고 입을 모은다. 경구용 알부민 제품은 식품 원료로 허용된 단백질 성분을 활용한 제품으로, 일반적인 영양 섭취 범주에 속한다. 약사들이 달걀이나 소고기를 제대로 섭취한다면 시중에 판매하는 알부민을 굳이 복용하지 않아도 된다고 지적하는 이유도 거기에 있다. 반면 혈청 알부민은 인체 혈장에서 분획·정제한 전문의약품으로, 중증 저알부민혈증이나 대량 출혈, 간질환 등 특정 적응증에서 의사의 판단에 따라 투여된다. 제조 과정과 안전 관리, 사용 목적 모두가 엄격히 관리되는 의약품이다. 약국가에서는 이 두 개념이 혼재 된 채 알부민이라는 단어만 부각되는 현상이 소비자의 오해를 키우고 있다고 보고 있다. 오인석 대한약사회 부회장은 “경구 알부민은 어디까지나 식품인데 의약품 알부민의 이미지를 차용해 홍보되는 경우가 많다”며 “시중에 판매되는 난백 알부민은 계란 흰자를 건조해 가루로 만든 것이다. 사실상 우리가 흔히 먹는 프로틴 파우더와 유사하다고도 볼 수 있다. 더욱이 경구로 섭취하면 위장관에서 아미노산 단위로 분해되는 만큼 혈장 알부민으로 전환될 가능성은 거의 희박하다고 봐야 한다”고 말했다. 오 부회장은 “그럼에도 소비자들은 혈청 알부민 효능효과를 차용한 광고에 속아 제품을 구매하고, 또 그에 맞는 효능효과를 기대하게 된다”면서 “시중 알부민 제품들이 내세우는 광고나 관련 정보가 대국민 사기에 가깝다고도 보는 이유도 거기에 있다”고 지적했다. “음료가 왜 피로회복 치료제로?”…소비자 오인 부추겨 전문가들이 우려하는 지점은 알부민이 ‘즉각적인 피로 회복제’처럼 소비되고 있다는 점이다. 알부민은 체내에서 삼투압 유지와 영양 상태를 반영하는 지표로 활용되는 단백질이지 단기간 섭취 만으로 체력이나 컨디션을 끌어올리는 성분은 아니라는 설명이다. 특히 건강한 일반인의 경우 알부민을 추가로 섭취한다고 해서 체내 알부민 수치가 의미 있게 개선되거나 임상적으로 유의미한 효과를 기대하기는 어렵다는 것이 전문가들의 공통된 견해다. 피로의 원인이 수면 부족, 스트레스, 기저질환 등 다양한 요인에 있을 수 있음에도 특정 성분에 기대는 소비 행태가 오히려 문제를 단순화시킨다는 지적도 나온다. 전문가들은 알부민의 범람을 단순 소비 트렌드로만 볼 수 없다고 지적한다. 의약품 이미지를 연상시키는 성분이 식품 시장으로 이동하면서 발생하는 구조적 문제라는 것. 이는 곧 단순 유행을 넘어 식품과 의약품의 경계를 흐리는 현상으로 이어질 수 있다는 지적이다. 약국가에서는 이 같은 흐름이 지속될 경우 소비자 보호와 올바른 정보 제공 측면에서 문제가 될 수 있다고 보고 있다. 오 부회장은 “실제 알부민이 필요하다고 판단되는 경우는 대부분 의료진의 진단과 처방이 필요한 상황”이라며 “일상적인 건강 관리 차원에서 알부민 음료에 과도한 기대를 거는 것은 경계해야 한다”고 말했다. 나아가 약사들은 이 같은 과대, 허위 광고가 소비자 안전에 직접적인 위협이 될 수 있다는 점에서 경계하할 필요가 있다고 강조한다. 이혜정 약사는 “저알부민혈증인 고객이 알부민 광고를 보고 제품을 찾는 경우가 있었다”며 “암 환자로 대사 기능이 떨어져 소화 흡수력이 거의 없어 오히려 가공식품인 경구 알부민을 복용하면 독으로 작용할 수 있는 상태였다. 상담을 통해 이런 부분을 설명하고 복용을 만류했지만, 전문가와의 상담없이 수많은 광고에 현혹돼 구매해 복용하는 환자 중 이런 경우가 얼마든지 발생할 수 있다는 점이 우려되는 지점”이라고 강조했다.2026-01-12 06:00:59김지은 기자 -
 "아보메드 기술력 입증 첫 성과...임상 후 더 큰 딜 가능"[데일리팜=차지현 기자] 희귀·난치성 질환 치료제 개발 바이오벤처 아보메드가 임상 진입 전 단계에서 기술수출 계약을 성사시키며 올해 국내 바이오 기술수출의 포문을 열었다. 이번 계약은 유럽 지역을 대상으로 체결된 만큼, 미국 등 다른 주요 시장을 겨냥한 추가 글로벌 기술수출 가능성도 남아 있다. 윤강석 아보메드 이사(경영본부장)는 5일 데일리팜과의 통화에서 "이번 계약은 아보메드 기술력을 입증한 첫 결과물"이라며 "임상 진입 이후에는 더 큰 글로벌 딜도 충분히 가능하다고 본다"고 말했다. 아보메드는 희귀·난치성 질환 중심 혁신 치료제 개발에 주력하는 국내 바이오벤처다. 신약 개발과 함께 콤플렉스 제네릭(고난도 복제의약품) 사업을 병행해 안정적인 수익 기반을 구축 중이다. 콤플렉스 제네릭은 제형과 제조공정이 복잡해 추가 임상과 기술 검증이 필요한 복제약으로, 허가를 받으면 비교적 빠른 시장 진입과 안정적인 현금 창출이 가능하다. 아보메드는 이 같은 콤플렉스 제네릭을 신약 연구개발의 재원으로 활용하는 투트랙 전략을 구사하고 있다. 이날 아보메드는 벨기에 소재 상장 제약사 하이로리스(Hyloris Pharmaceuticals SA)와 희귀질환 신약 후보물질 'ARBM-101'의 유럽 지역 권리에 대한 기술수출 계약을 체결했다고 밝혔다. 하이로리스는 기존 의약품의 제형 개선·적응증 확장·투여 방식 변경 등을 통해 의료적·상업적 가치를 높이는 데 특화한 업체다. 이번 계약은 윌슨병, 철 과부하(유전성 혈색소 침착증 포함), 원발성 담즙성 담관염(PBC) 등 희귀·난치성 간과 대사질환을 치료 적응증으로 포함한다. 개발 단계에 따른 경상 기술료(마일스톤)를 포함한 총 계약 규모는 최대 1억6000만 달러(약 2300억원)다. 반환 의무가 없는 선급금(업프론트) 규모는 공개하지 않았다. ARBM-101은 체내에 축적된 금속 이온을 선택적으로 결합·배출하는 신규 기전의 저분자 펩타이드 기반 치료제다. 기존 치료제가 구리 배출을 요로에 의존해 부작용 위험이 컸던 것과 달리, 이 물질은 장(腸)을 통한 배출을 유도해 효능과 안전성을 동시에 개선하는 것이 특징이다. 앞서 아보메드는 전임상 단계에서 윌슨병 등 희귀 간질환 동물 모델을 통해 유의미한 구리 제거 효과와 안전성을 확인했다. 또 회사는 2024년 ARBM-101에 대해 미국 식품의약국(FDA)으로부터 희귀의약품 지정(ODD)을 받았다. FDA ODD는 희귀질환의 약물 개발과 허가를 원활하게 진행하도록 하기 위해 마련된 제도로 OOD 의약품은 임상 개발비 세액 공제와 허가심사 수수료 감면 등 혜택이 주어진다. 윤 이사에 따르면 회사는 연내 ARBM-101 임상 1상에 돌입할 계획이다. 그는 "올 4월께 ARBM-101 임상 1상 임상시험계획(IND)을 제출할 것"이라면서 "임상 1a는 국내에서 진행할 예정인데 통상 6개월 내외면 결과를 수령할 수 있다"고 설명했다. 아보메드는 ARBM-101 임상 1a상 결과를 토대로 후속 글로벌 기술수출 논의에 속도를 낼 방침이다. 이번 계약이 유럽 지역에 한정된 기술이전인 만큼, 임상 데이터가 확보되면 미국 등 주요 시장을 대상으로 더 큰 규모의 추가 파트너링 가능성도 열려 있다는 평가다. 윤 이사는 "당초 ARBM-101의 기술수출 딜 사이즈를 1조원 수준으로 봤다"면서 "이번 유럽 계약은 전체 사업 가치의 약 30%를 차지하는 규모"라고 말했다. 이어 "유럽 계약만 놓고 보면 이번 계약 규모가 다소 아쉬울 수 있지만, 나머지 약 7000억원 규모로 추산되는 미국 시장에 대해서도 추가 파트너링을 검토 중"이라고 덧붙였다. 특히 ODD를 확보한 데 따라 상업화 속도도 비교적 빠를 것으로 내다봤다. 윤 이사는 "유럽의 경우 임상 2a 종료 시점에서 상업화가 가능하고 미국은 임상 2상 종료 이후 상업화가 가능할 것으로 전망한다"면서 "빠르면 2028년, 늦어도 2030년 이전에는 출시가 가능할 것으로 예상한다"고 했다. 아보메드는 신약 발과 함께 또 다른 축인 콤플렉스 제네릭 사업도 계획대로 추진하고 있다는 입장이다. 윤 이사는 "이번주 펜믹스와 공동 개발 중인 제네릭 주사제 슈가마덱스에 대해 FDA 콤플렉스 제네릭 허가(ANDA) 신청을 진행할 것"이라며 "허가까지는 약 9~10개월이 소요될 것으로 예상된다"고 했다. 이어 그는 "허가가 이뤄지면 올해 하반기에는 의미 있는 매출이 발생할 가능성이 있다"면서 "콤플렉스 제네릭을 캐시카우로 활용해 신약개발을 안정적으로 이어가는 전략"이라고 강조했다. 윤 이사는 아보메드의 성장 로드맵도 제시했다. 회사는 2026년 올해 상장 전 투자(Pre-IPO) 유치를 완료해 내년 코스닥 상장을 목표로 하고 있다. 이후에는 임상 개발과 글로벌 파트너링을 병행하며 성장을 더욱 가속화한다는 포부다.2026-01-06 06:46:26차지현 기자
"아보메드 기술력 입증 첫 성과...임상 후 더 큰 딜 가능"[데일리팜=차지현 기자] 희귀·난치성 질환 치료제 개발 바이오벤처 아보메드가 임상 진입 전 단계에서 기술수출 계약을 성사시키며 올해 국내 바이오 기술수출의 포문을 열었다. 이번 계약은 유럽 지역을 대상으로 체결된 만큼, 미국 등 다른 주요 시장을 겨냥한 추가 글로벌 기술수출 가능성도 남아 있다. 윤강석 아보메드 이사(경영본부장)는 5일 데일리팜과의 통화에서 "이번 계약은 아보메드 기술력을 입증한 첫 결과물"이라며 "임상 진입 이후에는 더 큰 글로벌 딜도 충분히 가능하다고 본다"고 말했다. 아보메드는 희귀·난치성 질환 중심 혁신 치료제 개발에 주력하는 국내 바이오벤처다. 신약 개발과 함께 콤플렉스 제네릭(고난도 복제의약품) 사업을 병행해 안정적인 수익 기반을 구축 중이다. 콤플렉스 제네릭은 제형과 제조공정이 복잡해 추가 임상과 기술 검증이 필요한 복제약으로, 허가를 받으면 비교적 빠른 시장 진입과 안정적인 현금 창출이 가능하다. 아보메드는 이 같은 콤플렉스 제네릭을 신약 연구개발의 재원으로 활용하는 투트랙 전략을 구사하고 있다. 이날 아보메드는 벨기에 소재 상장 제약사 하이로리스(Hyloris Pharmaceuticals SA)와 희귀질환 신약 후보물질 'ARBM-101'의 유럽 지역 권리에 대한 기술수출 계약을 체결했다고 밝혔다. 하이로리스는 기존 의약품의 제형 개선·적응증 확장·투여 방식 변경 등을 통해 의료적·상업적 가치를 높이는 데 특화한 업체다. 이번 계약은 윌슨병, 철 과부하(유전성 혈색소 침착증 포함), 원발성 담즙성 담관염(PBC) 등 희귀·난치성 간과 대사질환을 치료 적응증으로 포함한다. 개발 단계에 따른 경상 기술료(마일스톤)를 포함한 총 계약 규모는 최대 1억6000만 달러(약 2300억원)다. 반환 의무가 없는 선급금(업프론트) 규모는 공개하지 않았다. ARBM-101은 체내에 축적된 금속 이온을 선택적으로 결합·배출하는 신규 기전의 저분자 펩타이드 기반 치료제다. 기존 치료제가 구리 배출을 요로에 의존해 부작용 위험이 컸던 것과 달리, 이 물질은 장(腸)을 통한 배출을 유도해 효능과 안전성을 동시에 개선하는 것이 특징이다. 앞서 아보메드는 전임상 단계에서 윌슨병 등 희귀 간질환 동물 모델을 통해 유의미한 구리 제거 효과와 안전성을 확인했다. 또 회사는 2024년 ARBM-101에 대해 미국 식품의약국(FDA)으로부터 희귀의약품 지정(ODD)을 받았다. FDA ODD는 희귀질환의 약물 개발과 허가를 원활하게 진행하도록 하기 위해 마련된 제도로 OOD 의약품은 임상 개발비 세액 공제와 허가심사 수수료 감면 등 혜택이 주어진다. 윤 이사에 따르면 회사는 연내 ARBM-101 임상 1상에 돌입할 계획이다. 그는 "올 4월께 ARBM-101 임상 1상 임상시험계획(IND)을 제출할 것"이라면서 "임상 1a는 국내에서 진행할 예정인데 통상 6개월 내외면 결과를 수령할 수 있다"고 설명했다. 아보메드는 ARBM-101 임상 1a상 결과를 토대로 후속 글로벌 기술수출 논의에 속도를 낼 방침이다. 이번 계약이 유럽 지역에 한정된 기술이전인 만큼, 임상 데이터가 확보되면 미국 등 주요 시장을 대상으로 더 큰 규모의 추가 파트너링 가능성도 열려 있다는 평가다. 윤 이사는 "당초 ARBM-101의 기술수출 딜 사이즈를 1조원 수준으로 봤다"면서 "이번 유럽 계약은 전체 사업 가치의 약 30%를 차지하는 규모"라고 말했다. 이어 "유럽 계약만 놓고 보면 이번 계약 규모가 다소 아쉬울 수 있지만, 나머지 약 7000억원 규모로 추산되는 미국 시장에 대해서도 추가 파트너링을 검토 중"이라고 덧붙였다. 특히 ODD를 확보한 데 따라 상업화 속도도 비교적 빠를 것으로 내다봤다. 윤 이사는 "유럽의 경우 임상 2a 종료 시점에서 상업화가 가능하고 미국은 임상 2상 종료 이후 상업화가 가능할 것으로 전망한다"면서 "빠르면 2028년, 늦어도 2030년 이전에는 출시가 가능할 것으로 예상한다"고 했다. 아보메드는 신약 발과 함께 또 다른 축인 콤플렉스 제네릭 사업도 계획대로 추진하고 있다는 입장이다. 윤 이사는 "이번주 펜믹스와 공동 개발 중인 제네릭 주사제 슈가마덱스에 대해 FDA 콤플렉스 제네릭 허가(ANDA) 신청을 진행할 것"이라며 "허가까지는 약 9~10개월이 소요될 것으로 예상된다"고 했다. 이어 그는 "허가가 이뤄지면 올해 하반기에는 의미 있는 매출이 발생할 가능성이 있다"면서 "콤플렉스 제네릭을 캐시카우로 활용해 신약개발을 안정적으로 이어가는 전략"이라고 강조했다. 윤 이사는 아보메드의 성장 로드맵도 제시했다. 회사는 2026년 올해 상장 전 투자(Pre-IPO) 유치를 완료해 내년 코스닥 상장을 목표로 하고 있다. 이후에는 임상 개발과 글로벌 파트너링을 병행하며 성장을 더욱 가속화한다는 포부다.2026-01-06 06:46:26차지현 기자 -
 GC녹십자, 알라질증후군 치료제 국내 첫 급여[데일리팜=이석준 기자] GC녹십자(대표 허은철)는 알라질증후군(Alagille syndrome, ALGS) 치료제 ‘리브말리액(성분명 마라릭시뱃)’이 건강보험 급여목록에 등재됐다고 밝혔다. 급여 적용은 1월 1일부터 시행됐다. 리브말리액은 국내서 알라질증후군 적응증에 대해 건강보험이 적용되는 첫 치료 옵션이 됐다. 그동안 치료 선택지가 제한적이었던 소아 희귀질환 영역에서 의미 있는 전환점이 될 것으로 평가된다. 리브말리액은 담즙산의 장내 재흡수를 억제하는 기전의 혁신적 치료제로, 알라질증후군 환자에게 나타나는 담즙정체성 소양증을 개선하는 데 사용된다. 리브말리액 임상시험군과 외부 자연사 코호트(GALA)를 비교분석한 결과, 리브말리액 치료군은 비교군 대비 간이식이나 사망과 같은 중대한 사건 발생 위험을 약 70% 감소한 것으로 나타났다. 알라질증후군은 소아기에 발병해 만성 간질환을 유발하는 희귀 유전질환으로, 극심한 소양증과 성장 장애 등을 동반한다. 증상이 악화될 경우 간이식과 같은 고위험 수술에 의존할 수밖에 없어 환자와 보호자 모두에게 돌봄·경제·정신적 부담이 매우 큰 질환이다. 이번 급여 적용으로 보다 이른 시점부터 질환 조절이 가능해지면서, 환자와 보호자 모두의 치료 부담이 실질적으로 완화될 것으로 기대된다. 서울대학교병원 소아청소년과 고재성 교수는 “알라질증후군은 소아기에 발병해 환자뿐 아니라 보호자에게도 장기간 큰 부담을 주는 질환이다. 그동안 증상이 악화되면 간이식을 고려할 수밖에 없었던 치료 환경에서, 리브말리액을 통해 혈중 담즙산 농도를 조절함으로써 일부 환자에서는 간이식을 늦추거나 피할 수 있을 것으로 기대된다는 점은 임상적으로 매우 중요한 의미를 갖는다”고 설명했다. GC녹십자 SC본부 박진영 본부장은 “리브말리액은 허가 후 공익차원으로 한국희귀필〮수의약품 센터를 통해 알라질증후군 환자 중 소양증 치료가 필요한 환자를 대상으로 약제 무상지원 프로그램을 운영했다. 이번 급여 적용은 알라질증후군 환자들의 치료 접근성을 획기적으로 개선했다는 점에서 의미가 크다. 앞으로도 희귀·난치 질환 영역에서 환자와 보호자에게 실질적인 도움이 되는 치료 옵션을 지속적으로 확대해 나가겠다”고 말했다.2026-01-02 09:41:36이석준 기자
GC녹십자, 알라질증후군 치료제 국내 첫 급여[데일리팜=이석준 기자] GC녹십자(대표 허은철)는 알라질증후군(Alagille syndrome, ALGS) 치료제 ‘리브말리액(성분명 마라릭시뱃)’이 건강보험 급여목록에 등재됐다고 밝혔다. 급여 적용은 1월 1일부터 시행됐다. 리브말리액은 국내서 알라질증후군 적응증에 대해 건강보험이 적용되는 첫 치료 옵션이 됐다. 그동안 치료 선택지가 제한적이었던 소아 희귀질환 영역에서 의미 있는 전환점이 될 것으로 평가된다. 리브말리액은 담즙산의 장내 재흡수를 억제하는 기전의 혁신적 치료제로, 알라질증후군 환자에게 나타나는 담즙정체성 소양증을 개선하는 데 사용된다. 리브말리액 임상시험군과 외부 자연사 코호트(GALA)를 비교분석한 결과, 리브말리액 치료군은 비교군 대비 간이식이나 사망과 같은 중대한 사건 발생 위험을 약 70% 감소한 것으로 나타났다. 알라질증후군은 소아기에 발병해 만성 간질환을 유발하는 희귀 유전질환으로, 극심한 소양증과 성장 장애 등을 동반한다. 증상이 악화될 경우 간이식과 같은 고위험 수술에 의존할 수밖에 없어 환자와 보호자 모두에게 돌봄·경제·정신적 부담이 매우 큰 질환이다. 이번 급여 적용으로 보다 이른 시점부터 질환 조절이 가능해지면서, 환자와 보호자 모두의 치료 부담이 실질적으로 완화될 것으로 기대된다. 서울대학교병원 소아청소년과 고재성 교수는 “알라질증후군은 소아기에 발병해 환자뿐 아니라 보호자에게도 장기간 큰 부담을 주는 질환이다. 그동안 증상이 악화되면 간이식을 고려할 수밖에 없었던 치료 환경에서, 리브말리액을 통해 혈중 담즙산 농도를 조절함으로써 일부 환자에서는 간이식을 늦추거나 피할 수 있을 것으로 기대된다는 점은 임상적으로 매우 중요한 의미를 갖는다”고 설명했다. GC녹십자 SC본부 박진영 본부장은 “리브말리액은 허가 후 공익차원으로 한국희귀필〮수의약품 센터를 통해 알라질증후군 환자 중 소양증 치료가 필요한 환자를 대상으로 약제 무상지원 프로그램을 운영했다. 이번 급여 적용은 알라질증후군 환자들의 치료 접근성을 획기적으로 개선했다는 점에서 의미가 크다. 앞으로도 희귀·난치 질환 영역에서 환자와 보호자에게 실질적인 도움이 되는 치료 옵션을 지속적으로 확대해 나가겠다”고 말했다.2026-01-02 09:41:36이석준 기자 -
 GIFT 지정된 PBC 새로운 치료제 '셀라델파'리브델지(LivdelziⓇ, 성분명: 셀라델파, Seladelpar, Gilead Sciences)는 PPAR-δ(peroxisome proliferator-activated receptor-δ) 작용제로 2024년 미국 FDA, 2025년 유럽 EMA에서 우르소데옥시콜산(Ursodeoxycholic acid, UDCA)에 불내성이 있거나 기존 치료에 충분히 반응하지 않는 원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC) 환자를 대상으로 가속 승인(accelerated approval)을 받았다. 국내에서는 2025년 6월, ‘우르소데옥시콜산에 대한 반응이 부적절하거나 불내성인 성인의 원발성 담즙성 담관염(PBC) 치료제’로 글로벌 혁신제품 신속심사(GIFT, Global Innovative products on Fast Track) 대상에 지정됐다. PBC는 간 내 담관의 만성 염증과 파괴로 인해 담즙 정체 및 진행성 간 손상을 유발하며, 궁극적으로 간경변증과 간부전으로 이어질 수 있는 희귀 난치성 자가면역 질환이다. 현재 우르소데옥시콜산(UDCA)이 1차 치료제로 사용되고 있으나, 일부 환자에서는 치료 반응이 불충분하거나 내약성 문제로 인해 새로운 치료 전략에 대한 미충족 의료 수요가 지속적으로 제기돼 왔다. 셀라델파는 과산화소체 증식 활성화 수용체(peroxisome proliferator-activated receptor, PPAR) 델타(PPAR-δ)를 선택적으로 활성화하는 경구 치료제로, PBC 환자에서 담즙 정체와 관련된 간 효소 수치(특히 ALP)를 개선하고 가려움증 완화를 목표로 한다. 이 약제의 가속 승인은 3상 임상시험인 RESPONSE 연구 결과를 근거로 이뤄졌다. RESPONSE 연구는 12개월간 진행된 이중눈가림, 무작위배정, 위약 대조 임상시험으로, UDCA 치료에 반응하지 않거나 심각한 이상반응으로 치료 지속이 어려웠던 193명의 PBC 환자가 등록되었다. 대상자는 셀라델파 10mg 경구 투여군 또는 위약군으로 무작위 배정되어, 12개월 동안 하루 1회 투여를 받았다. 1차 평가변수는 12개월 시점의 복합 생화학적 반응(composite biochemical response)이었다. 주요 2차 평가변수로는 알칼리성 인산분해효소(alkaline phosphatase, ALP)의 정상화 여부와, 6개월 시점에서 기저치 대비 가려움증 수치 평가 척도(pruritus numerical rating scale, NRS) 점수 변화가 포함되었다. ALP는 담즙 정체를 반영하는 대표적 지표로, 간이식 및 사망 위험을 예측하는 인자로 알려져 있다. 연구 결과, 셀라델파 투여군의 62%가 12개월 차에 1차 평가변수인 복합 생화학적 반응(ALP 및 총 빌리루빈 수치 개선)에 도달해, 위약군의 20% 대비 통계적으로 유의미한 우월성을 입증하였다. 특히 셀라델파 투여군의 25%에서는 ALP 수치가 정상화되는 유의한 결과가 관찰되었다. 주요 2차 평가변수였던 가려움증 개선에서도 셀라델파의 효과가 확인되었다. 연구 시작 시점 대비 6개월 차에 중등도–중증 가려움증을 호소하던 환자군에서, 셀라델파 치료군은 평균 3.2점의 가려움증 점수 감소를 보였으며, 이는 위약군의 1.7점 감소 대비 통계적으로 유의미한 개선 효과였다. 이와 같이 RESPONSE 연구에서 셀라델파는 단독요법 또는 UDCA 병용요법으로 하루 1회 경구 투여 시, PBC의 주요 생화학적 지표를 개선하고 가려움증 완화에 기여하는 것으로 나타났다. 가장 흔하게 보고된 이상반응은 두통, 복통 및 복부 팽만, 오심, 어지럼증이었다. 담즙산 대사 장애(Bile acid metabolism disorder)란 무엇인가? 담즙산(bile acid)은 간에서 합성되는 콜레스테롤 유도체로, 양친매성 계면활성제이자 전신 내분비 호르몬으로 작용한다. 담즙산은 자체 합성과 장–간 순환을 조절할 뿐 아니라, 지질·탄수화물·단백질 등 다량 영양소 대사와 전신 염증–항염증 균형을 강력하게 조절하는 역할을 한다. 담즙산 대사 장애는 담즙산의 합성, 변환, 수송, 분비 또는 재흡수 과정 중 하나 이상에 이상이 발생해 담즙산 항상성이 붕괴된 상태를 의미한다. 정상적으로 담즙산은 간에서 콜레스테롤로부터 합성된 후 담관을 통해 담즙으로 분비되며, 장 내에서 지방의 소화와 흡수를 돕는다. 이후 회장 말단에서 대부분 재흡수되어 다시 간으로 돌아오는 장–간 순환(enterohepatic circulation)을 유지한다. 그러나 이러한 조절 과정에 이상이 발생하면 간 내 담즙산이 과도하게 축적되거나 담즙 배출이 저해되어 담즙정체(cholestasis)가 발생한다. 그 결과 간세포 및 담관 세포의 손상, 염증 반응, 산화 스트레스 증가, 섬유화가 유발될 수 있다. 담즙산 대사 장애는 담즙산 합성의 과도한 증가 또는 감소, 담즙산 수송체 기능 이상, 담즙 분비 장애, 장–간 순환 이상 등 다양한 기전에 의해 발생하며, 이러한 변화는 단독 또는 복합적으로 나타날 수 있다. 임상적으로는 간효소 수치 이상, 황달, 소양감, 지방 흡수 장애 등의 증상이 동반되며, 장기적으로는 만성 간질환으로 진행할 수 있다. 이러한 담즙산 대사 장애는 여러 간·담도 질환의 핵심적인 병태생리로 작용한다. 원발성 담즙성 담관염(primary biliary cholangitis, PBC)은 자가면역 기전에 의해 간 내 소담관이 점진적으로 파괴되면서 담즙 배출이 저해되는 질환으로, 담즙산 축적과 담즙정체가 질환의 중심 병태생리를 이룬다. 원발성 경화성 담관염(Primary sclerosing cholangitis, PSC) 역시 담관의 만성 염증과 섬유화로 인해 담즙 흐름이 차단되며, 진행성 담즙정체와 담즙산 대사 장애가 특징적으로 나타난다. 또한 진행성 가족성 간내 담즙정체(progressive familial intrahepatic cholestasis, PFIC)는 담즙산 수송체 관련 유전자의 이상으로 발생하는 선천성 질환으로, 소아기부터 중증의 담즙산 대사 장애와 간 손상을 초래한다. 이 외에도 담즙산 수송체나 담즙 분비 경로를 억제하는 특정 약물로 인한 약물 유발 담즙정체, 임신 중 호르몬 변화와 연관된 임신성 담즙정체, 담석이나 종양에 의한 담도 폐쇄, 비알코올성 지방간질환과 같은 대사성 간질환에서도 이차적으로 담즙산 대사 장애가 동반될 수 있다. 이처럼 담즙산 대사 장애는 단순한 담즙 분비 이상을 넘어, 다양한 간질환의 발생과 진행에 깊이 관여하는 핵심 병태생리로 인식되고 있다. 원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC)란 무엇인가? 원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC)은 담관에 만성 염증이 발생해 소구경 담관이 점진적으로 파괴되는 자가면역 질환이다. 과거에는 원발성 담즙성 간경변증(Primary Biliary Cirrhosis)으로 불렸으나, 질환의 초기 및 중기 단계에서는 간경변이 동반되지 않는 경우가 많아 현재는 원발성 담즙성 담관염이라는 명칭이 공식적으로 사용되고 있다. 담즙은 간에서 생성되는 액체로, 지방의 소화와 지용성 비타민의 흡수를 돕고 콜레스테롤, 독소, 노화된 적혈구의 대사산물을 배출하는 역할을 한다. 간에 지속적인 염증이 발생하면 담관의 염증과 손상, 즉 담관염이 나타나며, 질환이 진행될 경우 간 조직에 영구적인 섬유화가 형성되어 간경변으로 이어질 수 있다. 심한 경우에는 간부전으로 진행하기도 한다(Figure 1). PBC는 남녀 모두에서 발생할 수 있으나 여성에서 더 흔하게 나타난다. 자가면역 질환의 하나로, 면역 체계가 정상적인 담관 상피세포를 비정상적으로 공격하는 것이 특징이다. 현재까지의 연구에 따르면 유전적 소인과 환경적 요인이 복합적으로 작용해 발병하는 것으로 알려져 있다. 질환은 대체로 서서히 진행되며, 완치할 수 있는 치료법은 아직 없으나 조기에 진단하고 치료를 시작하면 약물 치료를 통해 간 손상의 진행 속도를 효과적으로 늦출 수 있다. PBC는 조기에 적절한 치료가 이루어지지 않을 경우 간경변 및 간부전으로 진행할 수 있다. 임상적으로는 알칼리성 인산분해효소(alkaline phosphatase, ALP)와 감마-글루타밀 전이효소(γ-glutamyl transferase, GGT)를 포함한 담즙정체성 간효소의 지속적인 상승과, 항미토콘드리아 항체(antimitochondrial antibody, AMA) 또는 PBC 특이 항핵항체인 anti-sp100 및 anti-gp210의 검출이 특징적이다. ALP와 GGT는 모두 담즙정체성 간질환에서 상승하는 혈청 효소로, 간·담도계 손상을 평가하는 데 널리 사용된다. 그러나 두 효소는 기원 조직과 생리적 역할, 임상적 활용 측면에서 차이를 보인다. ALP는 간 내 담관 상피세포와 조골세포에 풍부하게 존재하는 효소로, 인산에스터 결합의 가수분해에 관여한다. 담즙정체가 발생하면 담관 압력 상승과 담관 상피세포 손상으로 인해 혈청 ALP 수치가 현저히 증가한다. 이러한 특성으로 인해 ALP는 담즙정체의 정도를 반영하는 대표적인 생화학적 지표로 활용된다. 다만 ALP는 뼈, 태반, 소장 등 다양한 조직에서도 발현되므로, 수치 상승 시 간 유래 여부에 대한 감별이 필요하다. 반면 GGT는 세포막에 결합된 효소로, 주로 간세포와 담관 세포의 미소체막에 존재하며 글루타티온 대사와 아미노산 수송에 관여한다. GGT는 뼈 조직에서는 발현되지 않기 때문에, ALP 상승이 간담도계 기원인지 여부를 판단하는 보조 지표로 유용하다. 담즙정체성 간질환에서 GGT 역시 상승하지만, 질환 특이성보다는 간담도계 침범의 존재를 확인하는 데 주로 활용된다. 임상적으로 ALP와 GGT는 상호 보완적으로 해석된다. 혈청 ALP 상승과 함께 GGT가 동반 상승하는 경우 간담도계 기원의 담즙정체를 강하게 시사하는 반면, ALP만 상승하고 GGT가 정상인 경우에는 뼈 질환 등 비간성 원인을 고려해야 한다. 이러한 이유로 PBC를 포함한 만성 담즙정체성 간질환의 진단 및 치료 반응 평가에서 ALP는 주요 지표로, GGT는 감별 진단을 위한 보조 지표로 활용된다. 또한 PBC의 특징적인 조직병리학적 소견인 만성 비화농성 파괴성 담관염(chronic nonsuppurative destructive cholangitis)은 소구경에서 중간구경의 소엽간 담관 상피에 대한 림프구 침윤과 담관 파괴를 특징으로 하며, 이는 궁극적으로 담관 소실(ductopenia)과 담즙정체로 이어진다. PBC에서 가려움증(pruritus)과 피로(fatigue)는 흔히 나타나는 증상이지만 질환 특이적이지 않아 초기에는 질환과의 연관성이 간과되기 쉽다. 그러나 이러한 증상과 더불어 쇼그렌 증후군과 같은 동반 자가면역 질환에서 나타나는 안구 및 구강 건조 증상은 환자의 건강 관련 삶의 질(health-related quality of life, HRQOL)을 현저히 저하시킬 수 있다. 따라서 임상의는 이러한 증상의 임상적 중요성을 인식하고 적극적으로 평가해야 한다. 과산화소체 증식자 활성화 수용체-델타(Peroxisome proliferator-activated receptor delta, PPAR-δ)는 무엇인가? 과산화소체 증식자 활성화 수용체-델타(peroxisome proliferator-activated receptor-δ, PPAR-δ)는 세포의 대사와 염증 반응을 조절하는 리간드 의존적 핵수용체의 한 아형이다. 과산화소체(Peroxisome)는 세포 내에 존재하는 소형 소기관으로, 지방산 분해, 독성 물질 해독, 과산화수소(H₂O₂) 처리 등의 기능을 수행한다. 이러한 작용을 통해 과산화소체는 세포 대사 과정에서 생성되는 유해 물질을 제거하고 지방 대사를 조절하며, 세포의 대사 처리와 항상성 유지에 핵심적인 역할을 한다. 과산화소체 증식자(Peroxisome proliferator)는 과산화소체의 수와 기능을 증가시키는 물질을 의미한다. 이들 물질이 세포 내로 유입되면 과산화소체의 형성이 촉진되고 지방산 분해 능력이 향상되며, 대사 관련 효소의 발현이 증가한다. 초기 연구에서는 이러한 물질이 과산화소체 증식을 유도한다는 현상이 관찰되었고, 이후 그 작용이 특정 수용체를 통해 매개된다는 사실이 밝혀졌다. 이 수용체가 바로 과산화소체 증식자 활성화 수용체(peroxisome proliferator-activated receptor, PPAR)이다. PPAR는 과산화소체 증식자에 의해 활성화되는 리간드 의존적 핵수용체로, 주로 세포핵 내에서 전사 조절 인자로 기능한다. 간세포, 지방세포, 근육세포, 면역세포 등 다양한 조직에서 발현되며, 아형에 따라 조직 분포와 생리적 기능에 차이를 보인다. 이러한 특성으로 인해 PPAR는 전신 에너지 대사와 염증 반응 조절에 중요한 역할을 수행한다. PPAR는 내인성 지방산 및 지방산 유도체와 같은 생체 내 신호물질이나 합성 리간드와 결합해야 활성화된다. 리간드 결합 후 PPAR는 구조적 변화를 거쳐 활성화되며, 활성화된 PPAR는 retinoid X receptor(RXR)와 이합체(heterodimer)를 형성한다. 이 PPAR–RXR 이합체는 세포핵 내에서 표적 유전자의 프로모터 영역에 존재하는 PPAR response element(PPRE)에 결합해 유전자 전사의 활성 또는 억제를 조절한다(Figure 2). 이러한 기전을 통해 PPAR는 지방산 산화, 포도당 대사, 에너지 소비, 염증 반응, 담즙산 대사와 관련된 다양한 유전자들의 발현을 전사 수준에서 조절한다. 특히 내인성 지방산 유도체는 세포의 대사 상태를 반영하는 신호 분자로 작용해 PPAR 활성도를 조절함으로써, 세포가 환경 변화에 적응하도록 돕는다. PPAR는 구조적·기능적 특성에 따라 PPAR-α, PPAR-γ, PPAR-δ(β/δ)의 세 가지 아형으로 구분된다. PPAR-α는 주로 간에서 지방산 β-산화를 촉진해 지질 대사를 조절하며, PPAR-γ는 지방조직에서 지방세포 분화와 인슐린 감수성 조절에 관여한다. 이에 비해 PPAR-δ는 다양한 조직에 광범위하게 발현되며, 에너지 대사 조절과 항염증 반응에 관여할 뿐 아니라 간 내 담즙산 항상성 유지와 담즙정체 관련 경로 조절에도 중요한 역할을 수행하는 것으로 보고되고 있다. 최근 연구들에서는 PPAR-δ가 담즙산 합성 및 수송 경로 조절, 간 내 염증 반응 억제, 담관 손상 완화와 연관된 신호전달 경로에 관여함으로써 담즙산 항상성 유지와 담즙정체(cholestasis) 조절에 핵심적인 역할을 한다는 점이 제시되고 있다. 이러한 특성으로 인해 PPAR-δ는 원발성 담즙성 담관염(PBC)과 같은 만성 담즙정체성 간질환에서 유망한 치료 표적으로 주목받고 있다. 이러한 생물학적 특성에 근거해, 셀라델파(seladelpar)는 PPAR 아형 중 PPAR-δ에 선택적으로 결합하는 경구용 작용제로 개발되었다. 셀라델파는 PPAR-δ 신호전달 경로를 활성화함으로써 담즙정체와 염증 반응을 조절하고, 간 내 대사 이상을 개선하는 것을 치료 전략의 핵심 기전으로 한다. PPAR(Peroxisome proliferator-activated receptor) 기능 저하의 원인은 무엇인가? PPAR는 정상적인 대사 항상성과 항염증 반응 유지에 중요한 전사 조절 인자이나, 다양한 병리적 조건에서 그 발현이나 활성도가 감소할 수 있다. 이러한 PPAR 기능 저하는 단일 기전에 의해 발생하기보다는, 여러 내·외적 요인이 복합적으로 작용한 결과로 나타난다. 첫째, 만성 염증 상태는 PPAR 기능 저하의 주요 원인으로 알려져 있다. 염증성 사이토카인(예: TNF-α, IL-1β, IL-6)은 PPAR 유전자 발현을 억제하거나 PPAR의 전사 활성 능력을 감소시키는 신호전달 경로를 활성화한다. 특히 NF-κB와 같은 염증 신호 경로는 PPAR와 상호 억제 관계를 형성해, 염증이 지속될수록 PPAR의 항염증 기능이 점차 약화되는 악순환을 초래한다. 둘째, 리간드 결핍 또는 리간드 환경의 변화 역시 PPAR 기능 저하에 기여한다. PPAR는 내인성 지방산 및 지방산 유도체와 결합해야 활성화되므로, 대사 이상이나 영양 상태 변화로 적절한 리간드 공급이 감소할 경우 PPAR 활성은 저하된다. 또한 산화 스트레스 환경에서는 정상적인 리간드가 변형돼 PPAR 결합 친화도가 감소할 수 있다. 셋째, 산화 스트레스와 미토콘드리아 또는 과산화소체 기능 이상은 PPAR 신호 전달을 간접적으로 억제한다. 활성산소의 과도한 축적은 PPAR 단백질의 구조적 안정성을 저해하거나, 전사 공조절인자(coactivator)의 기능을 손상시켜 PPAR 매개 유전자 발현을 감소시킨다. 넷째, 후성유전학적(Epigenetic) 조절 변화 역시 중요한 기전으로 제시된다. DNA 메틸화 증가, 히스톤 변형 변화, microRNA에 의한 억제 등은 PPAR 유전자 발현을 장기적으로 감소시킬 수 있으며, 이러한 변화는 만성 간질환이나 대사성 질환에서 흔히 관찰된다. 다섯째, 질환 특이적 조직 손상도 PPAR 기능 저하와 밀접하게 연관된다. 예를 들어, 원발성 담즙성 담관염(PBC)과 같은 만성 담즙정체성 간질환에서는 담관 손상과 간세포 스트레스가 지속되며, 이로 인해 PPAR 발현 감소 또는 신호 전달 효율 저하가 동반되는 것으로 보고되고 있다. 이 경우 PPAR 기능 저하는 질환의 직접적인 원인이라기보다는 질병 진행 과정에서 나타나는 이차적 변화로 작용해, 담즙정체와 염증 반응을 더욱 악화시키는 요인이 될 수 있다. 원발성 담즙성 담관염(PBC)의 기존 치료약제는 무엇인가? 원발성 담즙성 담관염(PBC)의 치료는 질병의 진행을 억제하고 간 기능 악화를 지연시키는 것을 목표로 하며, 오랫동안 제한된 약물 옵션에 의존해 왔다. 현재까지 임상적으로 확립된 치료 전략의 중심에는 우르소데옥시콜산(UDCA)이 있다. UDCA는 모든 PBC 환자에서 1차 표준 치료제로 권고되며, 담즙의 친수성을 증가시켜 독성을 감소시키고 담즙 흐름을 개선함으로써 담관 상피세포 손상을 완화한다. 다수의 장기 추적 연구에서 UDCA는 혈청 알칼리성 인산분해효소(ALP)와 빌리루빈 수치를 감소시키고, 간이식 없는 생존율을 향상시키는 것으로 입증되었다. 그러나 전체 환자의 약 30–40%에서는 UDCA 치료에도 불구하고 생화학적 반응이 불충분하거나, 위장관 증상 등의 부작용으로 인해 약물 내약성에 문제가 발생한다. 이러한 UDCA 불충분 반응 또는 불내성 환자를 대상으로 개발된 대표적인 2차 치료제가 오베티콜산(obeticholic acid, OCA)이다. OCA는 파네소이드 X 수용체(farnesoid X receptor, FXR) 작용제로, 담즙산 합성을 억제하고 담즙정체를 완화하는 기전을 통해 ALP 감소 효과를 나타낸다. 임상시험에서 OCA는 UDCA 단독요법 대비 추가적인 생화학적 개선 효과를 입증했으며, 이를 근거로 UDCA 불충분 반응 환자에서 승인되었다. 그러나 OCA는 소양증을 악화시키는 부작용이 흔하고, 비대상성 간경변 환자에서는 중대한 안전성 문제로 인해 사용이 제한되는 한계를 지닌다. 이러한 점은 실제 임상 현장에서 OCA의 활용을 제약하는 주요 요인으로 작용해 왔다. 한편, 공식 허가 적응증은 아니지만 피브레이트 계열 약물이 오프라벨(off-label) 치료로 사용돼 왔다. 대표적으로 베자피브레이트(bezafibrate)와 페노피브레이트(fenofibrate)는 PPAR 계열 수용체를 활성화해 담즙산 대사와 염증 반응을 조절하는 것으로 알려져 있다. 여러 연구에서 UDCA 병용 시 ALP, GGT, 면역글로불린 M(IgM) 감소 효과가 보고됐으며, 일부 관찰 연구에서는 예후 개선 가능성도 제시되었다. 그러나 근육 독성, 신기능 악화 등의 안전성 우려와 함께 장기 임상 근거가 제한적이라는 점에서 표준 치료로 확립되지는 못했다. 질병 조절 치료와는 별도로, PBC 환자의 삶의 질에 큰 영향을 미치는 소양증에 대한 대증 치료 역시 중요한 치료 축을 이뤄 왔다. 콜레스티라민(cholestyramine), 리팜피신(rifampicin), 날트렉손(naltrexone), 설트랄린(sertraline) 등은 담즙산 결합이나 신경전달 조절 등의 기전을 통해 소양증 완화에 사용돼 왔으나, 질병의 병태생리를 근본적으로 조절하지는 못한다는 한계를 지닌다. 요약하면, PBC의 기존 치료는 UDCA를 중심으로 한 제한적인 치료 전략에 기반해 왔으며, UDCA 불충분 반응 환자에서는 OCA나 피브레이트 계열 약물이 보조적으로 사용돼 왔다. 그러나 이러한 치료제들은 효과의 한계와 안전성 문제를 동시에 안고 있어, 상당수 환자에서 미충족 의료 수요(unmet medical need)가 지속돼 왔다. 이러한 배경 속에서 PPAR 계열을 포함한 새로운 핵수용체 표적 치료제들이 등장하게 되었으며, 이는 기존 치료 패러다임을 보완하거나 대체할 가능성을 제시하고 있다. PPAR(Peroxisome proliferator-activated receptor) 작용제에는 어떤 약제들이 있는가? PPAR-α 작용제로는 페노피브레이트(fenofibrate)와 베자피브레이트(bezafibrate)와 같은 피브레이트 계열 약물이 있으며, 이들은 트리글리세리드(triglyceride, TG)와 유리 지방산(free fatty acid, FFA)을 감소시키고 고밀도 지단백(high-density lipoprotein, HDL) 수치를 증가시켜 이상지질혈증 치료에 사용된다. 한편 PPAR-γ 작용제로는 로시글리타존(rosiglitazone)과 피오글리타존(pioglitazone) 등 티아졸리디네디온(thiazolidinedione, glitazone) 계열 약물이 대표적이다. 이들 약물은 인슐린 민감도를 개선하고 혈장 포도당, TG 및 FFA 수치를 감소시키는 동시에 HDL 수치를 증가시켜 제2형 당뇨병 치료에 활용되고 있다. 이중 PPAR 작용제(dual PPAR agonists)는 두 가지 이상의 PPAR 아형을 동시에 활성화하도록 설계된 약제로, 주로 PPAR-α/γ 또는 PPAR-α/δ를 표적으로 하여 지질 대사, 에너지 대사 및 염증 반응을 복합적으로 조절하는 것을 목표로 개발돼 왔다. 이러한 약제는 각 PPAR 아형이 담당하는 생리적 기능을 동시에 활용함으로써, 단일 PPAR 작용제에 비해 보다 광범위한 대사 개선 효과를 기대할 수 있다는 이론적 장점을 지닌다. 기전적으로는 지방산 β-산화 촉진, 중성지방 감소, 에너지 소비 증가 및 항염증 효과를 동시에 유도해 전신 대사 항상성 조절에 기여한다. 그러나 이중 PPAR 작용제 가운데 미국 FDA 승인을 받은 약제는 아직 제한적인 상황이며, 최근까지 임상적으로 의미 있는 성과를 보인 사례도 많지 않았다. 이러한 가운데 PPAR-α/δ 이중 작용제인 엘라피브라노르(elafibranor)가 원발성 담즙성 담관염(PBC)을 적응증으로 FDA 가속 승인을 받으면서, 이중 PPAR 작용제가 간질환 영역에서도 임상적 가치를 가질 수 있음을 보여주는 사례로 평가되고 있다. 엘라피브라노르는 PPAR-α를 통한 지질 대사 개선 효과와 PPAR-δ를 통한 항염증 및 담즙산 대사 조절 효과를 동시에 유도함으로써, 담즙정체와 간 내 염증을 완화하는 기전을 갖는 것으로 설명된다. 반면 선택적 PPAR-δ 작용제는 PPAR 아형 중 PPAR-δ만을 표적으로 활성화하는 약제로, 보다 제한된 신호 경로를 정밀하게 조절하는 전략을 취한다. PPAR-δ는 다양한 조직에 광범위하게 발현되며 에너지 대사 촉진, 지방산 산화 증가, 항염증 반응 조절과 더불어 간 내 담즙산 항상성 유지 및 담즙정체 관련 경로 조절에 관여하는 것으로 알려져 있다. 이러한 특성을 바탕으로 선택적 PPAR-δ 작용제는 불필요한 대사 경로의 과도한 활성화를 최소화하면서 치료 효과를 유도하는 것을 목표로 개발돼 왔다. 선택적 PPAR-δ 작용제의 대표적인 예로는 셀라델파(seladelpar)가 있으며, 이는 우르소데옥시콜산(UDCA)에 불충분한 반응을 보이거나 UDCA를 사용할 수 없는 PBC 환자를 대상으로 FDA 가속 승인을 받았다. 셀라델파는 담즙정체의 주요 생화학적 지표인 알칼리성 인산분해효소(ALP)를 감소시키고, 환자의 삶의 질을 저해하는 소양감을 완화하는 효과를 보여 PPAR-δ 선택적 활성화의 임상적 유용성을 입증했다. 종합하면, 이중 PPAR 작용제는 두 가지 경로를 동시에 조절함으로써 보다 폭넓은 대사 및 항염증 효과를 기대할 수 있다는 장점을 지니는 반면, 활성화 범위가 넓은 만큼 안전성과 내약성에 대한 면밀한 평가가 요구된다. 이에 비해 선택적 PPAR-δ 작용제는 표적 특이성이 높아 비교적 안전성이 우수하며, 특히 담즙정체성 간질환과 같이 특정 병태생리를 중심으로 한 치료에 적합한 특성을 가진다. 결론적으로 FDA 승인 사례를 기준으로 볼 때, 이중 PPAR 작용제는 아직 임상 적용이 제한적인 단계에 있으나 엘라피브라노르의 승인으로 그 가능성이 확장되고 있다. 동시에 선택적 PPAR-δ 작용제는 질환 특이적 기전을 정밀하게 표적하는 전략으로서, 원발성 담즙성 담관염과 같은 만성 담즙정체성 간질환에서 중요한 치료 옵션으로 자리매김하고 있다. 셀라델파(Seladelpar)는 어떤 약제인가? 원발성 담즙성 담관염(PBC)은 자가면역 기전에 의해 간 내 소담관이 점진적으로 파괴되는 만성 담즙정체성 간질환으로, 이로 인해 담즙 배설 장애, 간 내 담즙산 축적, 염증 반응 및 섬유화가 점차 진행된다. 현재 PBC의 표준 1차 치료는 우르소데옥시콜산(UDCA)이지만, 상당수 환자에서 불충분한 생화학적 반응을 보이거나 약물 불내성이 관찰돼 추가적인 치료 옵션에 대한 필요성이 지속적으로 제기돼 왔다. 셀라델파(Seladelpar)는 선택적 PPAR-δ 작용제로, UDCA에 불충분한 반응을 보이는 성인 PBC 환자에서는 UDCA와의 병용요법으로, UDCA를 견딜 수 없는 환자에서는 단독요법으로 사용하도록 적응증이 승인되었다. 이 적응증은 알칼리성 인산분해효소(ALP) 감소를 근거로 승인되었으며, 현재까지 생존율 개선이나 간 대상부전 사건 예방에 대한 효과는 입증되지 않았다. 따라서 해당 적응증의 지속적인 승인은 확인 임상시험을 통해 임상적 유익성이 검증되고 충분히 설명되는 것을 조건으로 한다. 또한 비대상성 간경변, 즉 복수, 정맥류 출혈 또는 간성 뇌병증이 있거나 치료 중 이러한 상태가 발생한 환자에서는 셀라델파의 사용이 권장되지 않는다. 임상시험 및 기전 연구에 따르면, 셀라델파는 PBC의 병태생리에 관여하는 여러 경로를 조절함으로써 치료 효과를 나타내는 것으로 보고되고 있다. 특히 셀라델파 투여 시 담즙정체와 관련된 주요 생화학적 지표가 유의하게 개선되며, ALP 감소와 함께 총 빌리루빈을 포함한 담즙정체 지표의 개선이 일관되게 관찰되었다. 이러한 생화학적 반응은 임상적 예후를 반영하는 대리지표(surrogate marker)로 간주돼 규제 당국의 승인 근거로 활용되었다. 아울러 셀라델파는 PBC 환자에서 흔히 나타나며 삶의 질을 현저히 저해하는 증상인 소양감(pruritus)을 유의하게 완화시키는 효과를 보였다. 여러 임상 연구에서 셀라델파 투여군은 위약 대비 소양감 점수의 의미 있는 감소를 나타냈으며, 이는 단순한 간수치 개선을 넘어 증상 조절 측면에서도 임상적 가치를 지님을 시사한다. 기전적으로 PPAR-δ의 활성화는 항염증 및 면역조절 작용과 더불어 담즙산 대사 경로 조절에 관여하는 것으로 알려져 있다. 선행 연구 및 문헌 고찰에 따르면, PPAR-δ 활성화는 섬유아세포 성장인자 21(fibroblast growth factor 21, FGF21)에 의존적인 방식으로 담즙산 합성의 핵심 효소인 cholesterol 7α-hydroxylase(CYP7A1)를 포함한 관련 경로의 발현을 조절한다. 이를 통해 간 내 담즙산 축적을 완화하고, 담즙정체로 인한 간세포 손상을 감소시키는 것으로 제안된다. 이러한 다면적 작용 기전은 셀라델파가 PBC의 핵심 병태생리인 담즙정체, 염증 반응 및 증상 부담을 동시에 조절할 수 있는 치료제로 주목받는 근거가 된다(Figure 2). 셀라델파(LIVDELZIⓇ)의 허가임상은 어떻게 진행되었나? LIVDELZI의 유효성은 12개월 동안 진행된 무작위배정, 이중눈가림, 위약 대조 임상시험인 Trial 1 (NCT04620733)에서 평가되었다. 이 연구에는 우르소데옥시콜산(UDCA)에 대해 반응이 불충분하거나 내약성이 없는 원발성 담즙성 담관염(PBC) 성인 환자 193명이 포함되었다. 환자는 알칼리성 인산분해효소(ALP)가 정상 상한치(ULN)의 1.67배 이상이고, 총 빌리루빈(TB)이 ULN의 2배 이하인 경우에만 시험에 포함되었다. 다른 만성 간질환이 있거나, 합병증을 동반한 문맥고혈압을 포함한 임상적으로 중요한 간 대상부전이 있는 경우, 또는 합병증을 동반한 간경변(예: 말기 간질환 평가 점수[Model for End Stage Liver Disease, MELD]가 12 이상이거나, 식도정맥류가 알려져 있거나 정맥류 출혈 병력이 있는 경우, 간신증후군 병력 등)이 있는 환자는 시험에서 제외되었다. 환자들은 LIVDELZI 10 mg군(N=128) 또는 위약군(N=65)으로 무작위 배정되어 12개월 동안 1일 1회 투여받았다. 시험 기간 동안 181명(94%)의 환자는 UDCA와 병용하여 LIVDELZI 또는 위약을 투여받았으며, UDCA를 견딜 수 없는 12명(6%)의 환자는 단독요법으로 LIVDELZI 또는 위약을 투여받았다. 환자들의 평균 연령은 57세(범위: 28~75세)였으며, 95%가 여성이었다. 인종 분포는 백인 88%, 아시아인 6%, 흑인 또는 아프리카계 미국인 2%, 아메리칸 인디언 또는 알래스카 원주민 3%였다. 전체 환자의 29%가 히스패닉/라티노로 확인되었으며, LIVDELZI 10 mg 투여군에서는 23%, 위약군에서는 42%였다. 전체 환자의 32%가 미국에서 등록되었고, LIVDELZI 10 mg군에서는 38%, 위약군에서는 20%였다. 기저 시점에서 LIVDELZI 투여 환자 18명(14%)과 위약 투여 환자 9명(14%)가 다음 기준 중 최소 하나를 충족하였다: FibroScan 결과가 16.9 kPa 초과 / 과거 생검 또는 영상의학적 검사에서 간경변을 시사하는 소견 / 혈소판 수가 140,000/μL 미만이면서 혈청 알부민 < 3.5 g/dL, 국제정상화비율(INR) > 1.3, 또는 총 빌리루빈(TB) > ULN의 1배 초과 중 최소 하나의 추가 검사 이상 소견이 있는 경우 / 연구자가 임상적으로 간경변으로 판단한 경우 기저 시점의 평균 알칼리성 인산분해효소(ALP) 농도는 리터당 314 단위(U/L)(범위: 161~786)로, 정상 상한치(ULN)의 2.7배에 해당하였다. 평균 총 빌리루빈(TB) 농도는 0.8 mg/dL(범위: 0.3~1.9)이었으며, 환자의 87%에서 ULN 이하였다. 기타 간 생화학 검사 수치의 기저 평균값은 알라닌 아미노전이효소(ALT) 48 U/L(범위: 9~115), 아스파르테이트 아미노전이효소(AST) 40 U/L(범위: 16~94)였다. 1차 평가변수는 12개월 시점의 생화학적 반응으로, 생화학적 반응은 다음 세 가지 기준을 모두 충족하는 것으로 정의되었다: - ALP가 정상 상한치(ULN)의 1.67배 미만일 것 - 기저치 대비 ALP가 15% 이상 감소할 것 - 총 빌리루빈(TB)이 ULN 이하일 것 12개월 시점에서의 ALP 정상화(즉, ALP가 ULN 이하)는 주요 2차 평가변수였다. ALP의 ULN는 116 U/L로 정의되었고, TB의 ULN는 1.1 mg/dL로 정의되었다. Table 3에는 12개월 시점에서 생화학적 반응을 달성한 환자의 비율, 생화학적 반응을 구성하는 각 요소를 달성한 비율, 그리고 ALP 정상화를 달성한 비율에 대한 결과가 제시되어 있다. LIVDELZI는 위약과 비교하여 12개월 시점에서 생화학적 반응과 ALP 정상화 모두에서 더 큰 개선 효과를 보였다. 전체 환자의 87%는 기저 시점에서 TB 농도가 ULN 이하였으므로, 12개월 시점의 생화학적 반응률 결과는 주로 ALP 개선에 의해 좌우되었다. Figure 1은 12개월 동안의 ALP 평균값(95% 신뢰구간)을 보여준다. 1개월 시점부터 12개월 시점까지, LIVDELZI 투여군에서 위약군에 비해 ALP 수치가 더 낮은 경향이 지속적으로 관찰되었다. LIVDELZI 단독요법과 위약을 비교한 3개월 시점의 생화학적 반응은, Trial 1과 유사한 환자군을 대상으로 한 또 다른 무작위배정, 이중눈가림, 위약 대조 임상시험에서 선별된 환자 하위집단을 통합(pooled) 분석하여 평가되었다. 그 결과, 3개월 시점에서 LIVDELZI 단독요법군은 위약군에 비해 생화학적 반응의 개선 경향을 보였다. Trial 1에서는 단일 항목 환자 보고 결과(patient-reported outcome, PRO) 지표인 소양증 수치평가척도(pruritus Numerical Rating Scale, NRS)를 사용하여 환자의 일일 최대 가려움 강도를 평가하였다. 소양증 NRS는 0점(“가려움 없음”)부터 10점(“상상할 수 있는 가장 심한 가려움”)까지의 11점 척도로 구성되었다. 이 평가는 무작위 배정 이전 14일간의 런인(run-in) 기간부터 6개월 시점까지 매일 시행되었다. Table 4에는 기저 평균 소양증 점수가 4점 이상인 환자들을 대상으로, 6개월 시점에서 기저 대비 소양증 점수 변화에 대해 LIVDELZI와 위약을 비교한 주요 2차 평가변수의 결과가 제시되어 있다. 각 환자의 기저 평균 소양증 점수는 런인 기간 동안과 치료 시작 전 1일차(Day 1)에 측정된 소양증 NRS 점수의 평균으로 산출되었다. 6개월 시점의 소양증 점수는 해당 월의 마지막 1주일 동안 측정된 소양증 NRS 점수의 평균으로 계산되었다. LIVDELZI로 치료받은 환자들은 위약군에 비해 소양증에서 더 큰 개선을 보였다. 셀라델파는 추후 어떤 쟁점이 예상되는가? 셀라델파(Seladelpar)는 선택적 PPAR-δ 작용제로서 원발성 담즙성 담관염(PBC) 치료 분야에서 새로운 기전 기반 치료제로 주목받고 있다. 특히 알칼리성 인산분해효소(ALP)의 유의한 감소와 소양증 개선 효과를 근거로 가속 승인을 획득하며, 기존 치료 옵션이 제한적이었던 PBC 영역에서 중요한 치료적 진전을 제시했다. 그러나 이러한 성과에도 불구하고 셀라델파의 장기적인 임상적 위치를 확립하기 위해서는 여전히 해결해야 할 여러 쟁점이 남아 있다. 가장 핵심적인 쟁점은 임상적 유익성의 최종 입증 여부이다. 현재 셀라델파의 승인 근거는 ALP 감소라는 대리지표에 기반하고 있으며, 이는 질병 활성도와 예후를 반영하는 중요한 생화학적 지표이지만 환자의 생존율 개선이나 간 대상부전 발생 감소와 같은 직접적인 임상 결과를 대변하지는 않는다. 따라서 향후 확증 임상시험에서 간이식 필요성 감소, 간 대상부전 예방, 장기 생존 개선과 같은 하드 엔드포인트에 대한 효과가 입증되지 않을 경우, 적응증의 유지 또는 확대에 제한이 발생할 가능성이 있다. 이는 가속 승인 제도의 본질적인 한계이자, 셀라델파가 반드시 넘어야 할 가장 중요한 관문이라 할 수 있다. 또 다른 중요한 과제는 장기 안전성이다. PBC는 만성적이고 진행성인 질환으로, 환자들은 수년에서 수십 년에 걸쳐 지속적인 약물 치료가 필요하다. PPAR-δ는 간뿐 아니라 다양한 조직에서 발현되는 핵수용체이므로, 장기간의 지속적 활성화가 지질 대사, 근육 대사, 심혈관계 또는 종양 발생 위험에 어떠한 영향을 미칠 수 있는지에 대해서는 아직 충분한 장기 데이터가 축적되지 않았다. 특히 현재 진행 중인 장기 안전성 연구의 결과는 셀라델파가 실제 임상에서 신뢰할 수 있는 만성 치료제로 자리매김할 수 있는지를 판단하는 데 중요한 근거가 될 것이다. 간경변 환자에서의 사용 범위 또한 중요한 논점이다. 현재 셀라델파는 비대상성 간경변 환자에서 사용이 권장되지 않으며, 이는 주로 안전성 우려에 따른 제한이다. 그러나 실제 임상 현장에서는 보상성 간경변과 비대상성 간경변의 경계에 있는 환자들이 적지 않으며, 이러한 환자군에서 셀라델파를 어느 시점까지 사용할 수 있는지에 대한 명확한 기준은 아직 확립되지 않았다. 향후 보상성 간경변 환자를 대상으로 한 추가 임상 연구 결과에 따라 사용 범위가 확대되거나, 반대로 제한이 강화될 가능성도 존재한다. 치료 전략 내에서의 위치 설정 역시 향후 중요한 쟁점으로 남아 있다. 셀라델파는 대부분의 임상시험에서 UDCA와의 병용요법으로 평가되었으며, UDCA 불내성 환자에서는 단독요법이라는 잠재적 장점을 가진다. 그러나 단독요법 환자군의 규모는 제한적이었고, 장기적인 효과와 안전성에 대한 근거는 상대적으로 부족하다. 이에 따라 UDCA 불내성 환자에서 셀라델파가 표준 치료로 자리 잡을 수 있을지는 추가적인 임상 근거의 축적에 달려 있다. 한편 셀라델파의 차별적 강점으로 평가되는 소양증 개선 효과의 지속성 또한 중요한 평가 대상이다. 소양증은 PBC 환자의 삶의 질을 현저히 저하시키는 주요 증상으로, 기존 치료제들이 충분히 해결하지 못한 영역이었다. 셀라델파가 보여준 소양증 개선 효과가 장기적으로 유지되는지, 그리고 다른 치료제 대비 임상적으로 의미 있는 우월성을 지속적으로 입증할 수 있는지는 실제 처방 환경에서 약물 선택에 중요한 영향을 미칠 것이다. 마지막으로 기전적 측면에서도 아직 해결되지 않은 과제가 존재한다. 셀라델파는 FGF21 유도를 통한 담즙산 합성 억제, 항염증 및 면역조절 효과를 통해 PBC의 병태생리에 관여하는 것으로 제시되고 있으나, 담관 상피세포 사멸 과정이나 자가면역 반응의 핵심 단계에서 PPAR-δ가 수행하는 직접적인 역할은 아직 명확히 규명되지 않았다. 이러한 기전적 불확실성은 향후 기초 및 중개 연구를 통해 보완돼야 할 영역이다. 종합하면, 셀라델파는 PBC 치료에서 유망한 치료제로 부상했으나, 그 장기적 가치는 ALP 감소를 넘어 실제 환자 예후를 개선할 수 있는지, 장기간 안전하게 사용 가능한지, 그리고 기존 치료 옵션 대비 명확한 임상적 우위를 확보할 수 있는지에 의해 최종적으로 결정될 것이다. 이러한 쟁점들에 대한 답은 현재 진행 중인 확증 임상시험과 장기 안전성 연구의 결과를 통해 점진적으로 명확해질 것으로 기대된다. 참고문헌 1. Anna Skoczy ´nska et al. “PPARs in Clinical Experimental Medicine after 35 Years of Worldwide Scientific Investigations and Medical Experiments” Biomolecules 2024, 14, 786). 2. Tetsuya Kouno et al. “Selective PPARδ agonist seladelpar suppresses bile acid synthesis by reducing hepatocyte CYP7A1 via the fibroblast growth factor 21 signaling pathway” J. Biol. Chem. (2022) 298(7) 102056. 3. Chang Yin “The Potential of Bile Acids as Biomarkers for Metabolic Disorders” Int. J. Mol. Sci. 2023, 24, 12123. 4. Abigail Medford “Emerging Therapeutic Strategies in The Fight Against Primary Biliary Cholangitis” Journal of Clinical and Translational Hepatology 2023 vol. 11(4) | 949–957. 5. Ji Hye Roh and Jeong-Hyun Yoon “Bile Acids and the Metabolic Disorders” Korean J Clin Pharm, Vol. 28, No. 4, 2018. 6. 6. 기타 인터넷 자료(보도 자료, 제품 설명서 등.2026-01-02 06:00:53최병철 박사
GIFT 지정된 PBC 새로운 치료제 '셀라델파'리브델지(LivdelziⓇ, 성분명: 셀라델파, Seladelpar, Gilead Sciences)는 PPAR-δ(peroxisome proliferator-activated receptor-δ) 작용제로 2024년 미국 FDA, 2025년 유럽 EMA에서 우르소데옥시콜산(Ursodeoxycholic acid, UDCA)에 불내성이 있거나 기존 치료에 충분히 반응하지 않는 원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC) 환자를 대상으로 가속 승인(accelerated approval)을 받았다. 국내에서는 2025년 6월, ‘우르소데옥시콜산에 대한 반응이 부적절하거나 불내성인 성인의 원발성 담즙성 담관염(PBC) 치료제’로 글로벌 혁신제품 신속심사(GIFT, Global Innovative products on Fast Track) 대상에 지정됐다. PBC는 간 내 담관의 만성 염증과 파괴로 인해 담즙 정체 및 진행성 간 손상을 유발하며, 궁극적으로 간경변증과 간부전으로 이어질 수 있는 희귀 난치성 자가면역 질환이다. 현재 우르소데옥시콜산(UDCA)이 1차 치료제로 사용되고 있으나, 일부 환자에서는 치료 반응이 불충분하거나 내약성 문제로 인해 새로운 치료 전략에 대한 미충족 의료 수요가 지속적으로 제기돼 왔다. 셀라델파는 과산화소체 증식 활성화 수용체(peroxisome proliferator-activated receptor, PPAR) 델타(PPAR-δ)를 선택적으로 활성화하는 경구 치료제로, PBC 환자에서 담즙 정체와 관련된 간 효소 수치(특히 ALP)를 개선하고 가려움증 완화를 목표로 한다. 이 약제의 가속 승인은 3상 임상시험인 RESPONSE 연구 결과를 근거로 이뤄졌다. RESPONSE 연구는 12개월간 진행된 이중눈가림, 무작위배정, 위약 대조 임상시험으로, UDCA 치료에 반응하지 않거나 심각한 이상반응으로 치료 지속이 어려웠던 193명의 PBC 환자가 등록되었다. 대상자는 셀라델파 10mg 경구 투여군 또는 위약군으로 무작위 배정되어, 12개월 동안 하루 1회 투여를 받았다. 1차 평가변수는 12개월 시점의 복합 생화학적 반응(composite biochemical response)이었다. 주요 2차 평가변수로는 알칼리성 인산분해효소(alkaline phosphatase, ALP)의 정상화 여부와, 6개월 시점에서 기저치 대비 가려움증 수치 평가 척도(pruritus numerical rating scale, NRS) 점수 변화가 포함되었다. ALP는 담즙 정체를 반영하는 대표적 지표로, 간이식 및 사망 위험을 예측하는 인자로 알려져 있다. 연구 결과, 셀라델파 투여군의 62%가 12개월 차에 1차 평가변수인 복합 생화학적 반응(ALP 및 총 빌리루빈 수치 개선)에 도달해, 위약군의 20% 대비 통계적으로 유의미한 우월성을 입증하였다. 특히 셀라델파 투여군의 25%에서는 ALP 수치가 정상화되는 유의한 결과가 관찰되었다. 주요 2차 평가변수였던 가려움증 개선에서도 셀라델파의 효과가 확인되었다. 연구 시작 시점 대비 6개월 차에 중등도–중증 가려움증을 호소하던 환자군에서, 셀라델파 치료군은 평균 3.2점의 가려움증 점수 감소를 보였으며, 이는 위약군의 1.7점 감소 대비 통계적으로 유의미한 개선 효과였다. 이와 같이 RESPONSE 연구에서 셀라델파는 단독요법 또는 UDCA 병용요법으로 하루 1회 경구 투여 시, PBC의 주요 생화학적 지표를 개선하고 가려움증 완화에 기여하는 것으로 나타났다. 가장 흔하게 보고된 이상반응은 두통, 복통 및 복부 팽만, 오심, 어지럼증이었다. 담즙산 대사 장애(Bile acid metabolism disorder)란 무엇인가? 담즙산(bile acid)은 간에서 합성되는 콜레스테롤 유도체로, 양친매성 계면활성제이자 전신 내분비 호르몬으로 작용한다. 담즙산은 자체 합성과 장–간 순환을 조절할 뿐 아니라, 지질·탄수화물·단백질 등 다량 영양소 대사와 전신 염증–항염증 균형을 강력하게 조절하는 역할을 한다. 담즙산 대사 장애는 담즙산의 합성, 변환, 수송, 분비 또는 재흡수 과정 중 하나 이상에 이상이 발생해 담즙산 항상성이 붕괴된 상태를 의미한다. 정상적으로 담즙산은 간에서 콜레스테롤로부터 합성된 후 담관을 통해 담즙으로 분비되며, 장 내에서 지방의 소화와 흡수를 돕는다. 이후 회장 말단에서 대부분 재흡수되어 다시 간으로 돌아오는 장–간 순환(enterohepatic circulation)을 유지한다. 그러나 이러한 조절 과정에 이상이 발생하면 간 내 담즙산이 과도하게 축적되거나 담즙 배출이 저해되어 담즙정체(cholestasis)가 발생한다. 그 결과 간세포 및 담관 세포의 손상, 염증 반응, 산화 스트레스 증가, 섬유화가 유발될 수 있다. 담즙산 대사 장애는 담즙산 합성의 과도한 증가 또는 감소, 담즙산 수송체 기능 이상, 담즙 분비 장애, 장–간 순환 이상 등 다양한 기전에 의해 발생하며, 이러한 변화는 단독 또는 복합적으로 나타날 수 있다. 임상적으로는 간효소 수치 이상, 황달, 소양감, 지방 흡수 장애 등의 증상이 동반되며, 장기적으로는 만성 간질환으로 진행할 수 있다. 이러한 담즙산 대사 장애는 여러 간·담도 질환의 핵심적인 병태생리로 작용한다. 원발성 담즙성 담관염(primary biliary cholangitis, PBC)은 자가면역 기전에 의해 간 내 소담관이 점진적으로 파괴되면서 담즙 배출이 저해되는 질환으로, 담즙산 축적과 담즙정체가 질환의 중심 병태생리를 이룬다. 원발성 경화성 담관염(Primary sclerosing cholangitis, PSC) 역시 담관의 만성 염증과 섬유화로 인해 담즙 흐름이 차단되며, 진행성 담즙정체와 담즙산 대사 장애가 특징적으로 나타난다. 또한 진행성 가족성 간내 담즙정체(progressive familial intrahepatic cholestasis, PFIC)는 담즙산 수송체 관련 유전자의 이상으로 발생하는 선천성 질환으로, 소아기부터 중증의 담즙산 대사 장애와 간 손상을 초래한다. 이 외에도 담즙산 수송체나 담즙 분비 경로를 억제하는 특정 약물로 인한 약물 유발 담즙정체, 임신 중 호르몬 변화와 연관된 임신성 담즙정체, 담석이나 종양에 의한 담도 폐쇄, 비알코올성 지방간질환과 같은 대사성 간질환에서도 이차적으로 담즙산 대사 장애가 동반될 수 있다. 이처럼 담즙산 대사 장애는 단순한 담즙 분비 이상을 넘어, 다양한 간질환의 발생과 진행에 깊이 관여하는 핵심 병태생리로 인식되고 있다. 원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC)란 무엇인가? 원발성 담즙성 담관염(Primary Biliary Cholangitis, PBC)은 담관에 만성 염증이 발생해 소구경 담관이 점진적으로 파괴되는 자가면역 질환이다. 과거에는 원발성 담즙성 간경변증(Primary Biliary Cirrhosis)으로 불렸으나, 질환의 초기 및 중기 단계에서는 간경변이 동반되지 않는 경우가 많아 현재는 원발성 담즙성 담관염이라는 명칭이 공식적으로 사용되고 있다. 담즙은 간에서 생성되는 액체로, 지방의 소화와 지용성 비타민의 흡수를 돕고 콜레스테롤, 독소, 노화된 적혈구의 대사산물을 배출하는 역할을 한다. 간에 지속적인 염증이 발생하면 담관의 염증과 손상, 즉 담관염이 나타나며, 질환이 진행될 경우 간 조직에 영구적인 섬유화가 형성되어 간경변으로 이어질 수 있다. 심한 경우에는 간부전으로 진행하기도 한다(Figure 1). PBC는 남녀 모두에서 발생할 수 있으나 여성에서 더 흔하게 나타난다. 자가면역 질환의 하나로, 면역 체계가 정상적인 담관 상피세포를 비정상적으로 공격하는 것이 특징이다. 현재까지의 연구에 따르면 유전적 소인과 환경적 요인이 복합적으로 작용해 발병하는 것으로 알려져 있다. 질환은 대체로 서서히 진행되며, 완치할 수 있는 치료법은 아직 없으나 조기에 진단하고 치료를 시작하면 약물 치료를 통해 간 손상의 진행 속도를 효과적으로 늦출 수 있다. PBC는 조기에 적절한 치료가 이루어지지 않을 경우 간경변 및 간부전으로 진행할 수 있다. 임상적으로는 알칼리성 인산분해효소(alkaline phosphatase, ALP)와 감마-글루타밀 전이효소(γ-glutamyl transferase, GGT)를 포함한 담즙정체성 간효소의 지속적인 상승과, 항미토콘드리아 항체(antimitochondrial antibody, AMA) 또는 PBC 특이 항핵항체인 anti-sp100 및 anti-gp210의 검출이 특징적이다. ALP와 GGT는 모두 담즙정체성 간질환에서 상승하는 혈청 효소로, 간·담도계 손상을 평가하는 데 널리 사용된다. 그러나 두 효소는 기원 조직과 생리적 역할, 임상적 활용 측면에서 차이를 보인다. ALP는 간 내 담관 상피세포와 조골세포에 풍부하게 존재하는 효소로, 인산에스터 결합의 가수분해에 관여한다. 담즙정체가 발생하면 담관 압력 상승과 담관 상피세포 손상으로 인해 혈청 ALP 수치가 현저히 증가한다. 이러한 특성으로 인해 ALP는 담즙정체의 정도를 반영하는 대표적인 생화학적 지표로 활용된다. 다만 ALP는 뼈, 태반, 소장 등 다양한 조직에서도 발현되므로, 수치 상승 시 간 유래 여부에 대한 감별이 필요하다. 반면 GGT는 세포막에 결합된 효소로, 주로 간세포와 담관 세포의 미소체막에 존재하며 글루타티온 대사와 아미노산 수송에 관여한다. GGT는 뼈 조직에서는 발현되지 않기 때문에, ALP 상승이 간담도계 기원인지 여부를 판단하는 보조 지표로 유용하다. 담즙정체성 간질환에서 GGT 역시 상승하지만, 질환 특이성보다는 간담도계 침범의 존재를 확인하는 데 주로 활용된다. 임상적으로 ALP와 GGT는 상호 보완적으로 해석된다. 혈청 ALP 상승과 함께 GGT가 동반 상승하는 경우 간담도계 기원의 담즙정체를 강하게 시사하는 반면, ALP만 상승하고 GGT가 정상인 경우에는 뼈 질환 등 비간성 원인을 고려해야 한다. 이러한 이유로 PBC를 포함한 만성 담즙정체성 간질환의 진단 및 치료 반응 평가에서 ALP는 주요 지표로, GGT는 감별 진단을 위한 보조 지표로 활용된다. 또한 PBC의 특징적인 조직병리학적 소견인 만성 비화농성 파괴성 담관염(chronic nonsuppurative destructive cholangitis)은 소구경에서 중간구경의 소엽간 담관 상피에 대한 림프구 침윤과 담관 파괴를 특징으로 하며, 이는 궁극적으로 담관 소실(ductopenia)과 담즙정체로 이어진다. PBC에서 가려움증(pruritus)과 피로(fatigue)는 흔히 나타나는 증상이지만 질환 특이적이지 않아 초기에는 질환과의 연관성이 간과되기 쉽다. 그러나 이러한 증상과 더불어 쇼그렌 증후군과 같은 동반 자가면역 질환에서 나타나는 안구 및 구강 건조 증상은 환자의 건강 관련 삶의 질(health-related quality of life, HRQOL)을 현저히 저하시킬 수 있다. 따라서 임상의는 이러한 증상의 임상적 중요성을 인식하고 적극적으로 평가해야 한다. 과산화소체 증식자 활성화 수용체-델타(Peroxisome proliferator-activated receptor delta, PPAR-δ)는 무엇인가? 과산화소체 증식자 활성화 수용체-델타(peroxisome proliferator-activated receptor-δ, PPAR-δ)는 세포의 대사와 염증 반응을 조절하는 리간드 의존적 핵수용체의 한 아형이다. 과산화소체(Peroxisome)는 세포 내에 존재하는 소형 소기관으로, 지방산 분해, 독성 물질 해독, 과산화수소(H₂O₂) 처리 등의 기능을 수행한다. 이러한 작용을 통해 과산화소체는 세포 대사 과정에서 생성되는 유해 물질을 제거하고 지방 대사를 조절하며, 세포의 대사 처리와 항상성 유지에 핵심적인 역할을 한다. 과산화소체 증식자(Peroxisome proliferator)는 과산화소체의 수와 기능을 증가시키는 물질을 의미한다. 이들 물질이 세포 내로 유입되면 과산화소체의 형성이 촉진되고 지방산 분해 능력이 향상되며, 대사 관련 효소의 발현이 증가한다. 초기 연구에서는 이러한 물질이 과산화소체 증식을 유도한다는 현상이 관찰되었고, 이후 그 작용이 특정 수용체를 통해 매개된다는 사실이 밝혀졌다. 이 수용체가 바로 과산화소체 증식자 활성화 수용체(peroxisome proliferator-activated receptor, PPAR)이다. PPAR는 과산화소체 증식자에 의해 활성화되는 리간드 의존적 핵수용체로, 주로 세포핵 내에서 전사 조절 인자로 기능한다. 간세포, 지방세포, 근육세포, 면역세포 등 다양한 조직에서 발현되며, 아형에 따라 조직 분포와 생리적 기능에 차이를 보인다. 이러한 특성으로 인해 PPAR는 전신 에너지 대사와 염증 반응 조절에 중요한 역할을 수행한다. PPAR는 내인성 지방산 및 지방산 유도체와 같은 생체 내 신호물질이나 합성 리간드와 결합해야 활성화된다. 리간드 결합 후 PPAR는 구조적 변화를 거쳐 활성화되며, 활성화된 PPAR는 retinoid X receptor(RXR)와 이합체(heterodimer)를 형성한다. 이 PPAR–RXR 이합체는 세포핵 내에서 표적 유전자의 프로모터 영역에 존재하는 PPAR response element(PPRE)에 결합해 유전자 전사의 활성 또는 억제를 조절한다(Figure 2). 이러한 기전을 통해 PPAR는 지방산 산화, 포도당 대사, 에너지 소비, 염증 반응, 담즙산 대사와 관련된 다양한 유전자들의 발현을 전사 수준에서 조절한다. 특히 내인성 지방산 유도체는 세포의 대사 상태를 반영하는 신호 분자로 작용해 PPAR 활성도를 조절함으로써, 세포가 환경 변화에 적응하도록 돕는다. PPAR는 구조적·기능적 특성에 따라 PPAR-α, PPAR-γ, PPAR-δ(β/δ)의 세 가지 아형으로 구분된다. PPAR-α는 주로 간에서 지방산 β-산화를 촉진해 지질 대사를 조절하며, PPAR-γ는 지방조직에서 지방세포 분화와 인슐린 감수성 조절에 관여한다. 이에 비해 PPAR-δ는 다양한 조직에 광범위하게 발현되며, 에너지 대사 조절과 항염증 반응에 관여할 뿐 아니라 간 내 담즙산 항상성 유지와 담즙정체 관련 경로 조절에도 중요한 역할을 수행하는 것으로 보고되고 있다. 최근 연구들에서는 PPAR-δ가 담즙산 합성 및 수송 경로 조절, 간 내 염증 반응 억제, 담관 손상 완화와 연관된 신호전달 경로에 관여함으로써 담즙산 항상성 유지와 담즙정체(cholestasis) 조절에 핵심적인 역할을 한다는 점이 제시되고 있다. 이러한 특성으로 인해 PPAR-δ는 원발성 담즙성 담관염(PBC)과 같은 만성 담즙정체성 간질환에서 유망한 치료 표적으로 주목받고 있다. 이러한 생물학적 특성에 근거해, 셀라델파(seladelpar)는 PPAR 아형 중 PPAR-δ에 선택적으로 결합하는 경구용 작용제로 개발되었다. 셀라델파는 PPAR-δ 신호전달 경로를 활성화함으로써 담즙정체와 염증 반응을 조절하고, 간 내 대사 이상을 개선하는 것을 치료 전략의 핵심 기전으로 한다. PPAR(Peroxisome proliferator-activated receptor) 기능 저하의 원인은 무엇인가? PPAR는 정상적인 대사 항상성과 항염증 반응 유지에 중요한 전사 조절 인자이나, 다양한 병리적 조건에서 그 발현이나 활성도가 감소할 수 있다. 이러한 PPAR 기능 저하는 단일 기전에 의해 발생하기보다는, 여러 내·외적 요인이 복합적으로 작용한 결과로 나타난다. 첫째, 만성 염증 상태는 PPAR 기능 저하의 주요 원인으로 알려져 있다. 염증성 사이토카인(예: TNF-α, IL-1β, IL-6)은 PPAR 유전자 발현을 억제하거나 PPAR의 전사 활성 능력을 감소시키는 신호전달 경로를 활성화한다. 특히 NF-κB와 같은 염증 신호 경로는 PPAR와 상호 억제 관계를 형성해, 염증이 지속될수록 PPAR의 항염증 기능이 점차 약화되는 악순환을 초래한다. 둘째, 리간드 결핍 또는 리간드 환경의 변화 역시 PPAR 기능 저하에 기여한다. PPAR는 내인성 지방산 및 지방산 유도체와 결합해야 활성화되므로, 대사 이상이나 영양 상태 변화로 적절한 리간드 공급이 감소할 경우 PPAR 활성은 저하된다. 또한 산화 스트레스 환경에서는 정상적인 리간드가 변형돼 PPAR 결합 친화도가 감소할 수 있다. 셋째, 산화 스트레스와 미토콘드리아 또는 과산화소체 기능 이상은 PPAR 신호 전달을 간접적으로 억제한다. 활성산소의 과도한 축적은 PPAR 단백질의 구조적 안정성을 저해하거나, 전사 공조절인자(coactivator)의 기능을 손상시켜 PPAR 매개 유전자 발현을 감소시킨다. 넷째, 후성유전학적(Epigenetic) 조절 변화 역시 중요한 기전으로 제시된다. DNA 메틸화 증가, 히스톤 변형 변화, microRNA에 의한 억제 등은 PPAR 유전자 발현을 장기적으로 감소시킬 수 있으며, 이러한 변화는 만성 간질환이나 대사성 질환에서 흔히 관찰된다. 다섯째, 질환 특이적 조직 손상도 PPAR 기능 저하와 밀접하게 연관된다. 예를 들어, 원발성 담즙성 담관염(PBC)과 같은 만성 담즙정체성 간질환에서는 담관 손상과 간세포 스트레스가 지속되며, 이로 인해 PPAR 발현 감소 또는 신호 전달 효율 저하가 동반되는 것으로 보고되고 있다. 이 경우 PPAR 기능 저하는 질환의 직접적인 원인이라기보다는 질병 진행 과정에서 나타나는 이차적 변화로 작용해, 담즙정체와 염증 반응을 더욱 악화시키는 요인이 될 수 있다. 원발성 담즙성 담관염(PBC)의 기존 치료약제는 무엇인가? 원발성 담즙성 담관염(PBC)의 치료는 질병의 진행을 억제하고 간 기능 악화를 지연시키는 것을 목표로 하며, 오랫동안 제한된 약물 옵션에 의존해 왔다. 현재까지 임상적으로 확립된 치료 전략의 중심에는 우르소데옥시콜산(UDCA)이 있다. UDCA는 모든 PBC 환자에서 1차 표준 치료제로 권고되며, 담즙의 친수성을 증가시켜 독성을 감소시키고 담즙 흐름을 개선함으로써 담관 상피세포 손상을 완화한다. 다수의 장기 추적 연구에서 UDCA는 혈청 알칼리성 인산분해효소(ALP)와 빌리루빈 수치를 감소시키고, 간이식 없는 생존율을 향상시키는 것으로 입증되었다. 그러나 전체 환자의 약 30–40%에서는 UDCA 치료에도 불구하고 생화학적 반응이 불충분하거나, 위장관 증상 등의 부작용으로 인해 약물 내약성에 문제가 발생한다. 이러한 UDCA 불충분 반응 또는 불내성 환자를 대상으로 개발된 대표적인 2차 치료제가 오베티콜산(obeticholic acid, OCA)이다. OCA는 파네소이드 X 수용체(farnesoid X receptor, FXR) 작용제로, 담즙산 합성을 억제하고 담즙정체를 완화하는 기전을 통해 ALP 감소 효과를 나타낸다. 임상시험에서 OCA는 UDCA 단독요법 대비 추가적인 생화학적 개선 효과를 입증했으며, 이를 근거로 UDCA 불충분 반응 환자에서 승인되었다. 그러나 OCA는 소양증을 악화시키는 부작용이 흔하고, 비대상성 간경변 환자에서는 중대한 안전성 문제로 인해 사용이 제한되는 한계를 지닌다. 이러한 점은 실제 임상 현장에서 OCA의 활용을 제약하는 주요 요인으로 작용해 왔다. 한편, 공식 허가 적응증은 아니지만 피브레이트 계열 약물이 오프라벨(off-label) 치료로 사용돼 왔다. 대표적으로 베자피브레이트(bezafibrate)와 페노피브레이트(fenofibrate)는 PPAR 계열 수용체를 활성화해 담즙산 대사와 염증 반응을 조절하는 것으로 알려져 있다. 여러 연구에서 UDCA 병용 시 ALP, GGT, 면역글로불린 M(IgM) 감소 효과가 보고됐으며, 일부 관찰 연구에서는 예후 개선 가능성도 제시되었다. 그러나 근육 독성, 신기능 악화 등의 안전성 우려와 함께 장기 임상 근거가 제한적이라는 점에서 표준 치료로 확립되지는 못했다. 질병 조절 치료와는 별도로, PBC 환자의 삶의 질에 큰 영향을 미치는 소양증에 대한 대증 치료 역시 중요한 치료 축을 이뤄 왔다. 콜레스티라민(cholestyramine), 리팜피신(rifampicin), 날트렉손(naltrexone), 설트랄린(sertraline) 등은 담즙산 결합이나 신경전달 조절 등의 기전을 통해 소양증 완화에 사용돼 왔으나, 질병의 병태생리를 근본적으로 조절하지는 못한다는 한계를 지닌다. 요약하면, PBC의 기존 치료는 UDCA를 중심으로 한 제한적인 치료 전략에 기반해 왔으며, UDCA 불충분 반응 환자에서는 OCA나 피브레이트 계열 약물이 보조적으로 사용돼 왔다. 그러나 이러한 치료제들은 효과의 한계와 안전성 문제를 동시에 안고 있어, 상당수 환자에서 미충족 의료 수요(unmet medical need)가 지속돼 왔다. 이러한 배경 속에서 PPAR 계열을 포함한 새로운 핵수용체 표적 치료제들이 등장하게 되었으며, 이는 기존 치료 패러다임을 보완하거나 대체할 가능성을 제시하고 있다. PPAR(Peroxisome proliferator-activated receptor) 작용제에는 어떤 약제들이 있는가? PPAR-α 작용제로는 페노피브레이트(fenofibrate)와 베자피브레이트(bezafibrate)와 같은 피브레이트 계열 약물이 있으며, 이들은 트리글리세리드(triglyceride, TG)와 유리 지방산(free fatty acid, FFA)을 감소시키고 고밀도 지단백(high-density lipoprotein, HDL) 수치를 증가시켜 이상지질혈증 치료에 사용된다. 한편 PPAR-γ 작용제로는 로시글리타존(rosiglitazone)과 피오글리타존(pioglitazone) 등 티아졸리디네디온(thiazolidinedione, glitazone) 계열 약물이 대표적이다. 이들 약물은 인슐린 민감도를 개선하고 혈장 포도당, TG 및 FFA 수치를 감소시키는 동시에 HDL 수치를 증가시켜 제2형 당뇨병 치료에 활용되고 있다. 이중 PPAR 작용제(dual PPAR agonists)는 두 가지 이상의 PPAR 아형을 동시에 활성화하도록 설계된 약제로, 주로 PPAR-α/γ 또는 PPAR-α/δ를 표적으로 하여 지질 대사, 에너지 대사 및 염증 반응을 복합적으로 조절하는 것을 목표로 개발돼 왔다. 이러한 약제는 각 PPAR 아형이 담당하는 생리적 기능을 동시에 활용함으로써, 단일 PPAR 작용제에 비해 보다 광범위한 대사 개선 효과를 기대할 수 있다는 이론적 장점을 지닌다. 기전적으로는 지방산 β-산화 촉진, 중성지방 감소, 에너지 소비 증가 및 항염증 효과를 동시에 유도해 전신 대사 항상성 조절에 기여한다. 그러나 이중 PPAR 작용제 가운데 미국 FDA 승인을 받은 약제는 아직 제한적인 상황이며, 최근까지 임상적으로 의미 있는 성과를 보인 사례도 많지 않았다. 이러한 가운데 PPAR-α/δ 이중 작용제인 엘라피브라노르(elafibranor)가 원발성 담즙성 담관염(PBC)을 적응증으로 FDA 가속 승인을 받으면서, 이중 PPAR 작용제가 간질환 영역에서도 임상적 가치를 가질 수 있음을 보여주는 사례로 평가되고 있다. 엘라피브라노르는 PPAR-α를 통한 지질 대사 개선 효과와 PPAR-δ를 통한 항염증 및 담즙산 대사 조절 효과를 동시에 유도함으로써, 담즙정체와 간 내 염증을 완화하는 기전을 갖는 것으로 설명된다. 반면 선택적 PPAR-δ 작용제는 PPAR 아형 중 PPAR-δ만을 표적으로 활성화하는 약제로, 보다 제한된 신호 경로를 정밀하게 조절하는 전략을 취한다. PPAR-δ는 다양한 조직에 광범위하게 발현되며 에너지 대사 촉진, 지방산 산화 증가, 항염증 반응 조절과 더불어 간 내 담즙산 항상성 유지 및 담즙정체 관련 경로 조절에 관여하는 것으로 알려져 있다. 이러한 특성을 바탕으로 선택적 PPAR-δ 작용제는 불필요한 대사 경로의 과도한 활성화를 최소화하면서 치료 효과를 유도하는 것을 목표로 개발돼 왔다. 선택적 PPAR-δ 작용제의 대표적인 예로는 셀라델파(seladelpar)가 있으며, 이는 우르소데옥시콜산(UDCA)에 불충분한 반응을 보이거나 UDCA를 사용할 수 없는 PBC 환자를 대상으로 FDA 가속 승인을 받았다. 셀라델파는 담즙정체의 주요 생화학적 지표인 알칼리성 인산분해효소(ALP)를 감소시키고, 환자의 삶의 질을 저해하는 소양감을 완화하는 효과를 보여 PPAR-δ 선택적 활성화의 임상적 유용성을 입증했다. 종합하면, 이중 PPAR 작용제는 두 가지 경로를 동시에 조절함으로써 보다 폭넓은 대사 및 항염증 효과를 기대할 수 있다는 장점을 지니는 반면, 활성화 범위가 넓은 만큼 안전성과 내약성에 대한 면밀한 평가가 요구된다. 이에 비해 선택적 PPAR-δ 작용제는 표적 특이성이 높아 비교적 안전성이 우수하며, 특히 담즙정체성 간질환과 같이 특정 병태생리를 중심으로 한 치료에 적합한 특성을 가진다. 결론적으로 FDA 승인 사례를 기준으로 볼 때, 이중 PPAR 작용제는 아직 임상 적용이 제한적인 단계에 있으나 엘라피브라노르의 승인으로 그 가능성이 확장되고 있다. 동시에 선택적 PPAR-δ 작용제는 질환 특이적 기전을 정밀하게 표적하는 전략으로서, 원발성 담즙성 담관염과 같은 만성 담즙정체성 간질환에서 중요한 치료 옵션으로 자리매김하고 있다. 셀라델파(Seladelpar)는 어떤 약제인가? 원발성 담즙성 담관염(PBC)은 자가면역 기전에 의해 간 내 소담관이 점진적으로 파괴되는 만성 담즙정체성 간질환으로, 이로 인해 담즙 배설 장애, 간 내 담즙산 축적, 염증 반응 및 섬유화가 점차 진행된다. 현재 PBC의 표준 1차 치료는 우르소데옥시콜산(UDCA)이지만, 상당수 환자에서 불충분한 생화학적 반응을 보이거나 약물 불내성이 관찰돼 추가적인 치료 옵션에 대한 필요성이 지속적으로 제기돼 왔다. 셀라델파(Seladelpar)는 선택적 PPAR-δ 작용제로, UDCA에 불충분한 반응을 보이는 성인 PBC 환자에서는 UDCA와의 병용요법으로, UDCA를 견딜 수 없는 환자에서는 단독요법으로 사용하도록 적응증이 승인되었다. 이 적응증은 알칼리성 인산분해효소(ALP) 감소를 근거로 승인되었으며, 현재까지 생존율 개선이나 간 대상부전 사건 예방에 대한 효과는 입증되지 않았다. 따라서 해당 적응증의 지속적인 승인은 확인 임상시험을 통해 임상적 유익성이 검증되고 충분히 설명되는 것을 조건으로 한다. 또한 비대상성 간경변, 즉 복수, 정맥류 출혈 또는 간성 뇌병증이 있거나 치료 중 이러한 상태가 발생한 환자에서는 셀라델파의 사용이 권장되지 않는다. 임상시험 및 기전 연구에 따르면, 셀라델파는 PBC의 병태생리에 관여하는 여러 경로를 조절함으로써 치료 효과를 나타내는 것으로 보고되고 있다. 특히 셀라델파 투여 시 담즙정체와 관련된 주요 생화학적 지표가 유의하게 개선되며, ALP 감소와 함께 총 빌리루빈을 포함한 담즙정체 지표의 개선이 일관되게 관찰되었다. 이러한 생화학적 반응은 임상적 예후를 반영하는 대리지표(surrogate marker)로 간주돼 규제 당국의 승인 근거로 활용되었다. 아울러 셀라델파는 PBC 환자에서 흔히 나타나며 삶의 질을 현저히 저해하는 증상인 소양감(pruritus)을 유의하게 완화시키는 효과를 보였다. 여러 임상 연구에서 셀라델파 투여군은 위약 대비 소양감 점수의 의미 있는 감소를 나타냈으며, 이는 단순한 간수치 개선을 넘어 증상 조절 측면에서도 임상적 가치를 지님을 시사한다. 기전적으로 PPAR-δ의 활성화는 항염증 및 면역조절 작용과 더불어 담즙산 대사 경로 조절에 관여하는 것으로 알려져 있다. 선행 연구 및 문헌 고찰에 따르면, PPAR-δ 활성화는 섬유아세포 성장인자 21(fibroblast growth factor 21, FGF21)에 의존적인 방식으로 담즙산 합성의 핵심 효소인 cholesterol 7α-hydroxylase(CYP7A1)를 포함한 관련 경로의 발현을 조절한다. 이를 통해 간 내 담즙산 축적을 완화하고, 담즙정체로 인한 간세포 손상을 감소시키는 것으로 제안된다. 이러한 다면적 작용 기전은 셀라델파가 PBC의 핵심 병태생리인 담즙정체, 염증 반응 및 증상 부담을 동시에 조절할 수 있는 치료제로 주목받는 근거가 된다(Figure 2). 셀라델파(LIVDELZIⓇ)의 허가임상은 어떻게 진행되었나? LIVDELZI의 유효성은 12개월 동안 진행된 무작위배정, 이중눈가림, 위약 대조 임상시험인 Trial 1 (NCT04620733)에서 평가되었다. 이 연구에는 우르소데옥시콜산(UDCA)에 대해 반응이 불충분하거나 내약성이 없는 원발성 담즙성 담관염(PBC) 성인 환자 193명이 포함되었다. 환자는 알칼리성 인산분해효소(ALP)가 정상 상한치(ULN)의 1.67배 이상이고, 총 빌리루빈(TB)이 ULN의 2배 이하인 경우에만 시험에 포함되었다. 다른 만성 간질환이 있거나, 합병증을 동반한 문맥고혈압을 포함한 임상적으로 중요한 간 대상부전이 있는 경우, 또는 합병증을 동반한 간경변(예: 말기 간질환 평가 점수[Model for End Stage Liver Disease, MELD]가 12 이상이거나, 식도정맥류가 알려져 있거나 정맥류 출혈 병력이 있는 경우, 간신증후군 병력 등)이 있는 환자는 시험에서 제외되었다. 환자들은 LIVDELZI 10 mg군(N=128) 또는 위약군(N=65)으로 무작위 배정되어 12개월 동안 1일 1회 투여받았다. 시험 기간 동안 181명(94%)의 환자는 UDCA와 병용하여 LIVDELZI 또는 위약을 투여받았으며, UDCA를 견딜 수 없는 12명(6%)의 환자는 단독요법으로 LIVDELZI 또는 위약을 투여받았다. 환자들의 평균 연령은 57세(범위: 28~75세)였으며, 95%가 여성이었다. 인종 분포는 백인 88%, 아시아인 6%, 흑인 또는 아프리카계 미국인 2%, 아메리칸 인디언 또는 알래스카 원주민 3%였다. 전체 환자의 29%가 히스패닉/라티노로 확인되었으며, LIVDELZI 10 mg 투여군에서는 23%, 위약군에서는 42%였다. 전체 환자의 32%가 미국에서 등록되었고, LIVDELZI 10 mg군에서는 38%, 위약군에서는 20%였다. 기저 시점에서 LIVDELZI 투여 환자 18명(14%)과 위약 투여 환자 9명(14%)가 다음 기준 중 최소 하나를 충족하였다: FibroScan 결과가 16.9 kPa 초과 / 과거 생검 또는 영상의학적 검사에서 간경변을 시사하는 소견 / 혈소판 수가 140,000/μL 미만이면서 혈청 알부민 < 3.5 g/dL, 국제정상화비율(INR) > 1.3, 또는 총 빌리루빈(TB) > ULN의 1배 초과 중 최소 하나의 추가 검사 이상 소견이 있는 경우 / 연구자가 임상적으로 간경변으로 판단한 경우 기저 시점의 평균 알칼리성 인산분해효소(ALP) 농도는 리터당 314 단위(U/L)(범위: 161~786)로, 정상 상한치(ULN)의 2.7배에 해당하였다. 평균 총 빌리루빈(TB) 농도는 0.8 mg/dL(범위: 0.3~1.9)이었으며, 환자의 87%에서 ULN 이하였다. 기타 간 생화학 검사 수치의 기저 평균값은 알라닌 아미노전이효소(ALT) 48 U/L(범위: 9~115), 아스파르테이트 아미노전이효소(AST) 40 U/L(범위: 16~94)였다. 1차 평가변수는 12개월 시점의 생화학적 반응으로, 생화학적 반응은 다음 세 가지 기준을 모두 충족하는 것으로 정의되었다: - ALP가 정상 상한치(ULN)의 1.67배 미만일 것 - 기저치 대비 ALP가 15% 이상 감소할 것 - 총 빌리루빈(TB)이 ULN 이하일 것 12개월 시점에서의 ALP 정상화(즉, ALP가 ULN 이하)는 주요 2차 평가변수였다. ALP의 ULN는 116 U/L로 정의되었고, TB의 ULN는 1.1 mg/dL로 정의되었다. Table 3에는 12개월 시점에서 생화학적 반응을 달성한 환자의 비율, 생화학적 반응을 구성하는 각 요소를 달성한 비율, 그리고 ALP 정상화를 달성한 비율에 대한 결과가 제시되어 있다. LIVDELZI는 위약과 비교하여 12개월 시점에서 생화학적 반응과 ALP 정상화 모두에서 더 큰 개선 효과를 보였다. 전체 환자의 87%는 기저 시점에서 TB 농도가 ULN 이하였으므로, 12개월 시점의 생화학적 반응률 결과는 주로 ALP 개선에 의해 좌우되었다. Figure 1은 12개월 동안의 ALP 평균값(95% 신뢰구간)을 보여준다. 1개월 시점부터 12개월 시점까지, LIVDELZI 투여군에서 위약군에 비해 ALP 수치가 더 낮은 경향이 지속적으로 관찰되었다. LIVDELZI 단독요법과 위약을 비교한 3개월 시점의 생화학적 반응은, Trial 1과 유사한 환자군을 대상으로 한 또 다른 무작위배정, 이중눈가림, 위약 대조 임상시험에서 선별된 환자 하위집단을 통합(pooled) 분석하여 평가되었다. 그 결과, 3개월 시점에서 LIVDELZI 단독요법군은 위약군에 비해 생화학적 반응의 개선 경향을 보였다. Trial 1에서는 단일 항목 환자 보고 결과(patient-reported outcome, PRO) 지표인 소양증 수치평가척도(pruritus Numerical Rating Scale, NRS)를 사용하여 환자의 일일 최대 가려움 강도를 평가하였다. 소양증 NRS는 0점(“가려움 없음”)부터 10점(“상상할 수 있는 가장 심한 가려움”)까지의 11점 척도로 구성되었다. 이 평가는 무작위 배정 이전 14일간의 런인(run-in) 기간부터 6개월 시점까지 매일 시행되었다. Table 4에는 기저 평균 소양증 점수가 4점 이상인 환자들을 대상으로, 6개월 시점에서 기저 대비 소양증 점수 변화에 대해 LIVDELZI와 위약을 비교한 주요 2차 평가변수의 결과가 제시되어 있다. 각 환자의 기저 평균 소양증 점수는 런인 기간 동안과 치료 시작 전 1일차(Day 1)에 측정된 소양증 NRS 점수의 평균으로 산출되었다. 6개월 시점의 소양증 점수는 해당 월의 마지막 1주일 동안 측정된 소양증 NRS 점수의 평균으로 계산되었다. LIVDELZI로 치료받은 환자들은 위약군에 비해 소양증에서 더 큰 개선을 보였다. 셀라델파는 추후 어떤 쟁점이 예상되는가? 셀라델파(Seladelpar)는 선택적 PPAR-δ 작용제로서 원발성 담즙성 담관염(PBC) 치료 분야에서 새로운 기전 기반 치료제로 주목받고 있다. 특히 알칼리성 인산분해효소(ALP)의 유의한 감소와 소양증 개선 효과를 근거로 가속 승인을 획득하며, 기존 치료 옵션이 제한적이었던 PBC 영역에서 중요한 치료적 진전을 제시했다. 그러나 이러한 성과에도 불구하고 셀라델파의 장기적인 임상적 위치를 확립하기 위해서는 여전히 해결해야 할 여러 쟁점이 남아 있다. 가장 핵심적인 쟁점은 임상적 유익성의 최종 입증 여부이다. 현재 셀라델파의 승인 근거는 ALP 감소라는 대리지표에 기반하고 있으며, 이는 질병 활성도와 예후를 반영하는 중요한 생화학적 지표이지만 환자의 생존율 개선이나 간 대상부전 발생 감소와 같은 직접적인 임상 결과를 대변하지는 않는다. 따라서 향후 확증 임상시험에서 간이식 필요성 감소, 간 대상부전 예방, 장기 생존 개선과 같은 하드 엔드포인트에 대한 효과가 입증되지 않을 경우, 적응증의 유지 또는 확대에 제한이 발생할 가능성이 있다. 이는 가속 승인 제도의 본질적인 한계이자, 셀라델파가 반드시 넘어야 할 가장 중요한 관문이라 할 수 있다. 또 다른 중요한 과제는 장기 안전성이다. PBC는 만성적이고 진행성인 질환으로, 환자들은 수년에서 수십 년에 걸쳐 지속적인 약물 치료가 필요하다. PPAR-δ는 간뿐 아니라 다양한 조직에서 발현되는 핵수용체이므로, 장기간의 지속적 활성화가 지질 대사, 근육 대사, 심혈관계 또는 종양 발생 위험에 어떠한 영향을 미칠 수 있는지에 대해서는 아직 충분한 장기 데이터가 축적되지 않았다. 특히 현재 진행 중인 장기 안전성 연구의 결과는 셀라델파가 실제 임상에서 신뢰할 수 있는 만성 치료제로 자리매김할 수 있는지를 판단하는 데 중요한 근거가 될 것이다. 간경변 환자에서의 사용 범위 또한 중요한 논점이다. 현재 셀라델파는 비대상성 간경변 환자에서 사용이 권장되지 않으며, 이는 주로 안전성 우려에 따른 제한이다. 그러나 실제 임상 현장에서는 보상성 간경변과 비대상성 간경변의 경계에 있는 환자들이 적지 않으며, 이러한 환자군에서 셀라델파를 어느 시점까지 사용할 수 있는지에 대한 명확한 기준은 아직 확립되지 않았다. 향후 보상성 간경변 환자를 대상으로 한 추가 임상 연구 결과에 따라 사용 범위가 확대되거나, 반대로 제한이 강화될 가능성도 존재한다. 치료 전략 내에서의 위치 설정 역시 향후 중요한 쟁점으로 남아 있다. 셀라델파는 대부분의 임상시험에서 UDCA와의 병용요법으로 평가되었으며, UDCA 불내성 환자에서는 단독요법이라는 잠재적 장점을 가진다. 그러나 단독요법 환자군의 규모는 제한적이었고, 장기적인 효과와 안전성에 대한 근거는 상대적으로 부족하다. 이에 따라 UDCA 불내성 환자에서 셀라델파가 표준 치료로 자리 잡을 수 있을지는 추가적인 임상 근거의 축적에 달려 있다. 한편 셀라델파의 차별적 강점으로 평가되는 소양증 개선 효과의 지속성 또한 중요한 평가 대상이다. 소양증은 PBC 환자의 삶의 질을 현저히 저하시키는 주요 증상으로, 기존 치료제들이 충분히 해결하지 못한 영역이었다. 셀라델파가 보여준 소양증 개선 효과가 장기적으로 유지되는지, 그리고 다른 치료제 대비 임상적으로 의미 있는 우월성을 지속적으로 입증할 수 있는지는 실제 처방 환경에서 약물 선택에 중요한 영향을 미칠 것이다. 마지막으로 기전적 측면에서도 아직 해결되지 않은 과제가 존재한다. 셀라델파는 FGF21 유도를 통한 담즙산 합성 억제, 항염증 및 면역조절 효과를 통해 PBC의 병태생리에 관여하는 것으로 제시되고 있으나, 담관 상피세포 사멸 과정이나 자가면역 반응의 핵심 단계에서 PPAR-δ가 수행하는 직접적인 역할은 아직 명확히 규명되지 않았다. 이러한 기전적 불확실성은 향후 기초 및 중개 연구를 통해 보완돼야 할 영역이다. 종합하면, 셀라델파는 PBC 치료에서 유망한 치료제로 부상했으나, 그 장기적 가치는 ALP 감소를 넘어 실제 환자 예후를 개선할 수 있는지, 장기간 안전하게 사용 가능한지, 그리고 기존 치료 옵션 대비 명확한 임상적 우위를 확보할 수 있는지에 의해 최종적으로 결정될 것이다. 이러한 쟁점들에 대한 답은 현재 진행 중인 확증 임상시험과 장기 안전성 연구의 결과를 통해 점진적으로 명확해질 것으로 기대된다. 참고문헌 1. Anna Skoczy ´nska et al. “PPARs in Clinical Experimental Medicine after 35 Years of Worldwide Scientific Investigations and Medical Experiments” Biomolecules 2024, 14, 786). 2. Tetsuya Kouno et al. “Selective PPARδ agonist seladelpar suppresses bile acid synthesis by reducing hepatocyte CYP7A1 via the fibroblast growth factor 21 signaling pathway” J. Biol. Chem. (2022) 298(7) 102056. 3. Chang Yin “The Potential of Bile Acids as Biomarkers for Metabolic Disorders” Int. J. Mol. Sci. 2023, 24, 12123. 4. Abigail Medford “Emerging Therapeutic Strategies in The Fight Against Primary Biliary Cholangitis” Journal of Clinical and Translational Hepatology 2023 vol. 11(4) | 949–957. 5. Ji Hye Roh and Jeong-Hyun Yoon “Bile Acids and the Metabolic Disorders” Korean J Clin Pharm, Vol. 28, No. 4, 2018. 6. 6. 기타 인터넷 자료(보도 자료, 제품 설명서 등.2026-01-02 06:00:53최병철 박사 -
 베링거, '오페브' 유사상표 법적 대응...제네릭에 견제구[데일리팜=김진구 기자] 베링거인겔하임이 닌테다닙 성분 폐섬유증 치료제 '오페브(닌테다닙·Ofev)'와 유사한 상표를 문제 삼아, 대웅제약을 상대로 상표 등록 무효 심판을 청구했다. 제약업계에선 제네릭 제품명이 이미 변경된 이후 이뤄진 법적 분쟁이라는 점에서 오리지널 브랜드 보호와 후발 제네릭 견제 목적의 심판이라는 해석이 나온다. 30일 특허심판원에 따르면 베링거인겔하임은 지난 29일 대웅제약이 보유한 ‘오페비아’와 ‘Ofevia’ 상표를 상대로 등록 무효 심판을 청구했다. 대웅제약은 지난해 10월 오페비아 상표를 출원했다. 올해 1월엔 제네릭 허가를 받았다. 11월엔 해당 상표가 공식 등록됐다. 상표 등록이 완료되자, 베링거인겔하임은 오리지널 제품인 오페브와 발음·표기상 유사하다는 점을 문제 삼아 법적 대응에 나섰다. 다만 대웅제약은 이미 올해 6월 해당 제네릭의 제품명을 ‘오필드(Ofild)’로 변경한 상태다. 현재 오페비아라는 이름의 제품은 시장에서 사용되지 않지만, 상표권 자체는 여전히 등록 상태로 유지되고 있다. 제약업계에선 베링거인겔하임의 대응에 대해 오리지널 브랜드 보호와 후발 제네릭 견제라는 전략적 목적이 반영된 것이란 해석이 나온다. 실제 상표 사용 여부와 관계없이 살아있는 상표권을 무효화해 오리지널 브랜드의 식별력을 공고히 하려는 의도가 반영됐다는 분석이다. 또한 대웅제약이 오페비아를 제품명으로 사용하지 않더라도 상표가 등록된 상태로 남아 있을 경우, 후발 제네릭사의 명칭 선택에 영향을 미칠 수 있다는 점도 고려됐다는 분석도 제기된다. 향후 유사 상표의 재등장을 원천 차단하려는 목적이라는 해석이다. 베링거인겔하임이 오페비아에 유일하게 상표 등록 무효 심판을 청구한 것도 비슷한 맥락에서 설명된다. 현재 오페브 제네릭으로는 대웅제약 오필드 외에 ▲영진약품 ‘닌테브로’ ▲코오롱제약 ‘에피다닙’ ▲일동제약 ‘큐닌타’ 등이 허가받았다. 오리지널 오페브와 직접적인 유사성이 낮은 상표로 평가된다. 오페브는 ▲특발성폐섬유증 치료 ▲전신경화증 연관 간질성폐질환 환자의 폐기능 감소 지연 ▲진행성 표현형을 나타내는 만성 섬유성 간질성폐질환의 치료에 쓰인다. 다만 급여는 특발성폐섬유증을 제외한 나머지 2개 적응증에만 적용된다. 식품의약품안전처에 따르면 오페브의 지난해 수입실적은 357만 달러(약 53억원) 규모다. 제네릭사들은 올해 1월 오페브 물질특허 만료를 전후로 품목허가를 획득한 바 있다. 이어 올해 5월 오페브가 급여 등재되자, 두 달 뒤엔 7월에 제네릭을 급여 발매했다.2025-12-30 12:04:47김진구 기자
베링거, '오페브' 유사상표 법적 대응...제네릭에 견제구[데일리팜=김진구 기자] 베링거인겔하임이 닌테다닙 성분 폐섬유증 치료제 '오페브(닌테다닙·Ofev)'와 유사한 상표를 문제 삼아, 대웅제약을 상대로 상표 등록 무효 심판을 청구했다. 제약업계에선 제네릭 제품명이 이미 변경된 이후 이뤄진 법적 분쟁이라는 점에서 오리지널 브랜드 보호와 후발 제네릭 견제 목적의 심판이라는 해석이 나온다. 30일 특허심판원에 따르면 베링거인겔하임은 지난 29일 대웅제약이 보유한 ‘오페비아’와 ‘Ofevia’ 상표를 상대로 등록 무효 심판을 청구했다. 대웅제약은 지난해 10월 오페비아 상표를 출원했다. 올해 1월엔 제네릭 허가를 받았다. 11월엔 해당 상표가 공식 등록됐다. 상표 등록이 완료되자, 베링거인겔하임은 오리지널 제품인 오페브와 발음·표기상 유사하다는 점을 문제 삼아 법적 대응에 나섰다. 다만 대웅제약은 이미 올해 6월 해당 제네릭의 제품명을 ‘오필드(Ofild)’로 변경한 상태다. 현재 오페비아라는 이름의 제품은 시장에서 사용되지 않지만, 상표권 자체는 여전히 등록 상태로 유지되고 있다. 제약업계에선 베링거인겔하임의 대응에 대해 오리지널 브랜드 보호와 후발 제네릭 견제라는 전략적 목적이 반영된 것이란 해석이 나온다. 실제 상표 사용 여부와 관계없이 살아있는 상표권을 무효화해 오리지널 브랜드의 식별력을 공고히 하려는 의도가 반영됐다는 분석이다. 또한 대웅제약이 오페비아를 제품명으로 사용하지 않더라도 상표가 등록된 상태로 남아 있을 경우, 후발 제네릭사의 명칭 선택에 영향을 미칠 수 있다는 점도 고려됐다는 분석도 제기된다. 향후 유사 상표의 재등장을 원천 차단하려는 목적이라는 해석이다. 베링거인겔하임이 오페비아에 유일하게 상표 등록 무효 심판을 청구한 것도 비슷한 맥락에서 설명된다. 현재 오페브 제네릭으로는 대웅제약 오필드 외에 ▲영진약품 ‘닌테브로’ ▲코오롱제약 ‘에피다닙’ ▲일동제약 ‘큐닌타’ 등이 허가받았다. 오리지널 오페브와 직접적인 유사성이 낮은 상표로 평가된다. 오페브는 ▲특발성폐섬유증 치료 ▲전신경화증 연관 간질성폐질환 환자의 폐기능 감소 지연 ▲진행성 표현형을 나타내는 만성 섬유성 간질성폐질환의 치료에 쓰인다. 다만 급여는 특발성폐섬유증을 제외한 나머지 2개 적응증에만 적용된다. 식품의약품안전처에 따르면 오페브의 지난해 수입실적은 357만 달러(약 53억원) 규모다. 제네릭사들은 올해 1월 오페브 물질특허 만료를 전후로 품목허가를 획득한 바 있다. 이어 올해 5월 오페브가 급여 등재되자, 두 달 뒤엔 7월에 제네릭을 급여 발매했다.2025-12-30 12:04:47김진구 기자 -
 "1차 치료 전면에 선 ADC…'엔허투·다트로웨이' 두각"[싱가포르=손형민 기자] "전이 단계에서는 여전히 절반 가까운 유방암 환자의 생존기간이 5년을 넘기지 못합니다. HER2 과발현 환자의 상당수는 1차 치료 후 2년 안에 질병이 진행되고, 삼중음성유방암에는 표적치료제가 부재해 더 빨리 재발합니다. 결국 더 앞선 치료에서 더 강력한 옵션을 제공하는 것이 환자 생존의 핵심입니다." 김성배 서울아산병원 종양내과 교수와 박경화 고려대 안암병원 종양내과 교수는 최근 싱가포르에서 열린 ESMO ASIA 2025 현장에서 기자들과 만나 전이성 유방암의 가장 큰 미충족 수요는 효과적인 1차 치료 전략의 재정의라며 이렇게 강조했다. 전이성 유방암은 여전히 완치보다는 얼마나 오래, 잘 버티게 하느냐가 현실적인 목표로 거론된다. 조기 유방암의 5년 생존율이 99%를 넘는 반면, 전이 단계에서 진단된 유방암 환자의 5년 생존율은 약 49% 수준에 그치기 때문이다. 특히 전이성 유방암은 HER2, 호르몬 수용체(HR) 발현 여부에 따라 아형과 치료 전략이 완전히 갈리며, 각 아형마다 뚜렷한 미충족 수요가 남아 있다. HER2가 과발현된 HER2 양성 유방암의 경우 지난 10여 년간 1차 표준치료로 자리해 온 탁센계열 약물+허셉틴(트라스투주맙)+퍼제타(터투주맙) 등의 이른바 'THP 요법'으로 생존 연장은 이뤄졌지만, 실제로는 상당수 환자에서 2년 이내 질병이 진행되고 약 25%에서 뇌전이가 발생하는 한계가 있었다. HER2와 HR, 에스트로겐 모두 발현되지 않는 삼중음성유방암(TNBC)은 진단 5년 이내 원격 전이 빈도가 높고, 진단 후 1~3년 사이 재발 위험이 급격히 치솟는 가장 공격적인 아형이지만, 여전히 타깃 가능한 표적이 제한적이라는 점이 문제로 지적돼 왔다. 이에 앞단 치료의 중요성이 부각되고 있다. 전이성 유방암에서 약물치료는 치료 라인이 뒤로 갈수록 효과가 떨어지는 경향이 뚜렷하다. 환자 상태가 비교적 양호한 초반 시퀀스에 얼마나 효과적인 치료제를 배치하느냐가 전체 생존 곡선을 좌우할 수 있다는 의미다. 이런 상황에서 HER2 표적 항체약물접합체(ADC)인 '엔허투(트라스투주맙데룩스테칸)'는 DESTINY-Breast09 임상 3상 연구를 통해 지난 10년 이상 HER2 양성 전이성 유방암의 1차 표준으로 자리해 온 THP 요법보다 무진행생존기간(PFS)을 약 1.5배(40.7개월) 연장시키며 1차 치료 패러다임 변화를 예고했다. 특히 뇌전이나 PIK3CA 변이 등 고위험군에서도 일관된 혜택을 보인 점이 주목을 받고 있다. TNBC 영역에서도 변화의 조짐이 나타났다. 지금까지 면역항암제를 쓸 수 있는 PD-L1 양성 환자는 전체 TNBC의 일부에 그쳤고, 나머지 60~70% 환자는 독성이 높고 내성 발생이 잦은 세포독성항암제에 의존해야 했다. Trop-2 표적 ADC '다트로웨이(다토포테 데룩스테칸)'는 TROPION-Breast02 임상3상에서 면역치료가 불가능한 전이성 TNBC 1차 치료에서 기존 세포독성항암제 대비 PFS와 전체생존기간(OS_)모두를 유의하게 개선하며, 이 영역의 주요 ADC 기반 1차 옵션으로 부상했다. 김 교수와 박 교수는 주요 유방암 영역에서 ADC들이 좋은 효과를 나타내고 있다며 치료 전략을 다시 설계해야 하는 시점이라고 입을 모았다. Q. 엔허투가 DESTINY-Breast09 연구를 통해 1차 치료까지 앞당겨지게 되었는데, 해당 연구에는 어떠한 임상적 가치가 있는지 궁금하다. 박경화 교수: HER2 양성 전이성 유방암 환자의 약 25%에서는 뇌 전이가 발생하는데, THP 요법은 이를 막거나 치료하기는 다소 어려운 상황이다. 또 바이오마커 관련 임상 연구를 해보면 PIK3CA 변이와 같은 내성 유전자가 있는 경우에는 변이가 없는 환자들에 비해 PFS가 조금 더 짧게 나타난다. 이러한 상황에서 HER2 양성 전이성 유방암 2차 치료에서 큰 성공을 이루었던 엔허투가 1차 치료로 앞당겨지게 된 것이다. 번번 연구에서 엔허투는 1차 치료 시 PFS에 있어 40.7개월이라는 역사적인 결과를 나타냈다. 또 해당 연구에는 이미 뇌 전이가 있는 환자가 약 10% 정도 포함이 됐고, PIK3CA 변이가 있는 환자도 포함이 되었는데, 모든 환자에서 기존 1차 치료 대비 일관되게 우월한 효과를 보여줬다. 기존 의학적 미충족 요구가 있던 환자군에서 확실한 치료 이점이 있을 것으로 생각된다. Q. 엔허투가 실제 임상 현장에 1차 치료로 도입된다면, 치료 전략을 어떻게 수립해야 하는가? 김성배 교수: 효과가 증명된 치료제를 써야 하는 것이 맞다. 다만 THP 요법 또한 효과가 좋기도 하고, 엔허투는 약 10%의 환자에서 간질성폐질환(ILD)의 우려가 있기도 하다. 최대한 종양을 감소시키기 위한 목적으로는 세포독성항암제인 탁산이 포함된 THP 요법을 보통 6-8 사이클로 사용하는데, 6 사이클 치료 후 트라스투주맙과 퍼투주맙 치료만 유지되어도 생존기간이 12개월 이상은 더 유지가 된다. 그럼에도 기존 THP요법의 벽을 엔허투가 무너뜨렸다는 점에서는 의미가 크다. 또한 HER2 양성 유방암은 질환 자체가 공격적인 타입이기 때문에 일단 처음에는 엔허투를 사용하게 될 것이라고 본다. 그 이후 유지를 위한 치료 전략을 어떻게 수립할 것인지는 별개의 문제라고 생각한다. 박경화 교수: THP 요법의 효과가 좋은 환자에서는 삶의 질이 굉장히 좋게 나타난다. 국내에는 허가가 되어 있지 않지만, HER2 양성이면서 호르몬 수용체 양성인 경우에는 허셉틴과 퍼제타를 유지하면서 호르몬 치료를 추가할 수 있기 때문이다. 또 최근 발표된 PATINA 연구에서는 CDK4/6 억제제를 추가하면 굉장히 긴 PFS를 나타낼 수 있는 것으로 확인되면서 기대를 받고 있다. 반면 엔허투는 치료 효과가 좋지만, 삶의 질에 있어서는 약간의 우려도 존재한다. 만약 실제 임상 현장에 엔허투가 1차 치료 급여로 도입이 된다 하더라도, 꼭 모든 환자의 1차 치료에 엔허투가 필요하다고 보지 않을 수 있다. 결국 전략적으로 적용을 해야 될 것으로 생각된다. Q. 엔허투+퍼제타 병용요법을 어떤 환자에게 우선적으로 사용해야 할 지도 궁금하다. 박경화 교수: 처음부터 중추신경계 전이가 있거나 PIK3CA 변이가 있는 환자들은 반응이 더디거나 내성이 빨리 생기는 것으로 알려져 있는데, 이처럼 진단 시 전이가 여러 곳에 많이 되어서 종양 부담이 큰 환자들은 빠르게 종양을 줄여줄 필요가 있다. 따라서 이러한 경우 엔허투+퍼투주맙 병용요법이 기존 THP 요법 대비 더 빠른 종양 감소 효과를 볼 수 있기 때문에, 해당 환자군에서 좀 더 선호하는 요법이 될 것으로 생각한다. 김성배 교수: THP 요법의 피보탈 임상인 CLEOPATRA 연구에서는 참여자 중 보조요법으로 트라스투주맙을 이미 사용했던 환자가 전체의 약 10% 미만이었다. 기존 보조요법으로 허셉틴을 이미 사용했는데 재발을 했다면 질병의 성질이 더 공격적인 것으로 여길 수 있는데, DESTINY-Breast09연구는 이러한 환자군이 포함되고도 PFS가 40.7개월로 나타난 것이라 그 의미가 더 크다고 본다. Q. 엔허투 병용요법이 국내 허가·급여될 경우 1차 표준치료는 어떻게 바뀌게 될 지, 또한 급여 가능성은 어떻게 보는지 궁금하다. 박경화 교수: 만약 엔허투가 1차 치료로 인정이 된다면 결국 환자 상황에 따라 결정이 되어야 한다. 국내의 경우 엔허투가 1차 치료에서 보험이 된다면 모든 환자분들이 쓰지 않으면 손해를 본다고 생각하고 모두 사용 하고싶어 할 것 같다. 다만 1차에 THP 요법을 쓴다고 해서 엔허투를 사용할 기회가 사라지는 것은 아니기 때문에, 환자 그리고 보호자와 충분히 상의해서 어떤 치료제를 먼저 사용하는 것이 환자에게 유리할지, 기저질환 또는 삶의 질과 같은 요소들을 고려해 판단할 필요가 있다. 개인적으로는 뇌 전이나 PIK3CA 변이가 있거나 종양 부담이 큰 특수한 경우 외에는 HER2 양성이면서 호르몬 수용체 양성인 환자에서는 THP 요법을 먼저 사용할 것 같다. THP 요법이 효과가 있다면 입랜스(팔보시클립) 유지요법인 PATINA 요법까지 더해 상당히 오랜 기간 효과를 유지할 수 있기 때문이다. 그러나 HER2 양성이거나 종양 부담이 높아서 증상을 빠르게 경감시켜줘야 한다면 엔허투를 먼저 사용할 것 같다. 김성배 교수: 최근 DESTINY-Breast11 연구에서 수술 전 보조요법으로 엔허투 4사이클 이후 THP 요법 4사이클을 투약한 환자군과 세포독성항암제 4사이클 이후 THP 요법 4사이클을 투약한 환자군을 비교했더니, 엔허투를 사용한 환자군에서 병리학적 완전관해(PCR)가 높게 나타난 것으로 확인되었으며, 특히 호르몬 수용체 음성 유방암 환자군의 경우 83.1%로 보고됐다. 또 DESTINY-Breast05 연구에서는 수술 전 보조요법 이후 PCR에 도달하지 않은 환자들에게 엔허투를 14사이클 더 사용했더니 효과가 좋았다는 결과도 발표됐다. 이러한 경우 두 가지 모두 효과가 좋다면 실제로는 어떤 순서로 치료해야 할지 딜레마가 될 수 있다. 원칙은 환자 상황을 모두 고려해 결정하는 것이다. 일반적으로는 효과가 좋은 치료제라면 결국 앞 단계로 오게 되어 있다. Q. 다트로웨이의 질문을 이어나가려고 한다. TNBC 환자의 약 70%가 면역항암제를 사용할 수 없다고 하는데, 이렇게 많은 환자에서 면역항암제가 듣지 않는 이유가 무엇인가? 다른 암종도 면역항암제를 사용할 수 없는 비율이 비슷한지, 아니면 삼중 음성 유방암만의 특성인지 궁금하다. 박경화 교수: ADC 항암제라는 약물을 훨씬 정밀하게 전달하는 약제가 나오면서 상황이 완전히 바뀌었다. ADC에 실린 약물 자체도 기존 유방암 치료에서 쓰이지 않던 새로운 약물이었고, 기존 항암제보다 훨씬 효과적으로 암세포를 사멸하는 기전을 가지고 있다. 그래서 면역항암제와 ADC가 시너지를 일으키면서 유방암 치료 효과가 더 좋아졌다. 특히 PD-L1 음성 환자에서는 지금까지 세포독성항암제밖에 쓸 수 없었는데, 이 마저도 독성 때문에 오래 쓰지 못했고 PFS도 길어야 4-5개월 수준이었다. 그리고 2-3번 정도 치료하면 환자분들이 돌아가시는 경우도 많아서 OS도 1년 조금 넘는 정도였다. 그런데 ADC 항암제라는 혁신적인 치료제가 나오면서 이제는 확실하게 생존 연장 효과가 확인됐다. 특히 다트로웨이는 이번 TROPION-Breast02 연구에서 이러한 효과가 처음으로 증명된 것이다. 김성배 교수: 면역항암제는 PD-L1 발현에 의존한다. 삼중 음성 유방암 환자의 약 30-40% 정도만 PD-L1 양성이라서 면역항암제의 표적이 된다. PD-L1 발현이 없는 나머지 60-70% 환자들은 그냥 기존 세포독성항암제를 쓸 수밖에 없다. 기본적으로 ADC는 약물이 선택적으로 암세포를 타깃 한다는 특징이 있기 때문에 효과가 좋은 것으로 보인다. 기존에는 PD-L1 음성이어서 면역항암제를 사용하지 못하는 60-70%의 TNBC 환자가 문제가 됐다. 최근 개발된 ADC 항암제들이 타깃하는 TROP2 대부분의 암에서 발현되고, 특히 삼중 음성 유방암에서 상대적으로 더 많이 발현되고 있어 좋은 표적이 된 것 같다. 이러한 ADC 항암제가 나오면서 기존에 면역항암제를 사용하지 못했던 환자들도 치료 기회가 생기게 되었다. Q. 최근에는 HER2가 조금이라도 발현되면 엔허투를 사용하는 방향으로 논의가 되고 있다 알고 있는데, 다트로웨이가 사용이 가능해지면 이러한 논의는 어떻게 되는 것인지 궁금하다. 박경화 교수: 엔허투는 TNBC 환자 1차 치료에는 연구된 바가 없다. 이미 다른 항암제를 1개 정도 사용하고 HER2가 조금이라도 발현되었다면 DESTINY-Breast04 연구에 근거해 엔허투를 사용해 볼 수 있다. 현재 삼중 음성 유방암 1차 치료에서는 TROP2 ADC 항암제만이 임상연구 데이터에 기반한 근거가 있는 상황으로, 기존에 없던 새로운 치료 옵션이 생긴 것이다. 김성배 교수: DESTINY-Breast04 연구에 근거한다면 세포독성항암제를 사용한 상황에서 질병이 다시 진행되었을 때 HER2가 조금이라도 발현되면 아직 급여는 안되지만 엔허투를 쓸 수 있다. 또는 호르몬 치료 이후에도 세포독성항암제를 한 차례 한 후 사용할 수 있다. 호르몬 수용체 양성 유방암에서 호르몬 치료 이후 세포독성항암제를 사용하기 전에 먼저 엔허투를 사용하는 것은 DESTINY-Breast06 연구이다. Q. PD-L1 음성 환자에게는 두 가지 ADC 옵션이 가능해 보이는데, 한 약제는 OS 데이터를 갖고 있고 다른 약제는 PFS2만 있는 상황에서, OS 혜택이 있는 약제가 더 가치 있다고 봐야 하는가? 김성배 교수: 비슷한 예시로 보조요법에서의 키스칼리(리보시클립)와 버제니오(아베마시클립)을 들 수 있다. 키스칼리는 먼저 개발을 시작해서 OS 데이터까지 보여줄 수 있었고, 버제니오는 나중에 개발되면서 OS 데이터를 보기에는 어려움이 있었다. 그래서 PFS뿐 아니라 OS까지 이점을 보인 리보시클립이 골드 스탠다드(Gold Standard)라고 여겨졌고, 같은 비용이라면 전체생존기간OS에 근거가 확인된 치료제를 선택하는 것이 합리적이었다. 일단 암의 재발을 막는 것만으로 의미가 있기 때문에 주요 평가변수를 충족하면 의미가 있다고 보기도 하고, 나중에 결국 키스칼리와 버제니오의 OS가 유사한 수준으로 확인되긴 했다. 다만 OS가 가장 중요한 지표이기 때문에, 동일한 조건이라면 이 분이 개선의 확인된 치료제를 좀 더 선호한다. 또 OS에서 치료 혜택을 확인하면 급여를 받는 데에도 도움이 될 수 있다. 박경화 교수: 국내의 경우 급여 여부가 치료제를 선택할 때에 1차적인 조건이 된다. Q. 다트로웨이가 국내 도입된다면, TNBC 치료에 어떤 위치를 차지할 것이라 보는가? 김성배 교수: 다트로웨이는 치료 후 6개월 이내 또는 무질병 기간 12개월 이내에 재발한 환자에게 쓸 수 있다. TNBC 환자라면 1년 이내에 재발했는지를 먼저 확인해 보는 것이 필요하다. 기존 치료제와는 재발 시점에 대한 기준이 조금 다르다는 점이 다트로웨이의 장점이라고 할 수 있다. 박경화 교수: 말씀주신 상황이 ADC가 가장 절실하게 필요한 환자군이다. 그런데 현재 국내에서 삼중 음성 유방암에 사용할 수 있는 ADC 항암제인 사시투주맙 고비테칸는 해당 상황에서는 쓸 수 없다. 그래서 현재는 효과가 있을지 없을지 모르는 다른 치료를 먼저 한 후에 2차 치료로 사시투주맙 고비테칸을 사용하는 구조이다. 다트로웨이가 국내에 도입되면 이러한 치료 공백을 메울 수 있게 된다.2025-12-12 06:00:51손형민 기자
"1차 치료 전면에 선 ADC…'엔허투·다트로웨이' 두각"[싱가포르=손형민 기자] "전이 단계에서는 여전히 절반 가까운 유방암 환자의 생존기간이 5년을 넘기지 못합니다. HER2 과발현 환자의 상당수는 1차 치료 후 2년 안에 질병이 진행되고, 삼중음성유방암에는 표적치료제가 부재해 더 빨리 재발합니다. 결국 더 앞선 치료에서 더 강력한 옵션을 제공하는 것이 환자 생존의 핵심입니다." 김성배 서울아산병원 종양내과 교수와 박경화 고려대 안암병원 종양내과 교수는 최근 싱가포르에서 열린 ESMO ASIA 2025 현장에서 기자들과 만나 전이성 유방암의 가장 큰 미충족 수요는 효과적인 1차 치료 전략의 재정의라며 이렇게 강조했다. 전이성 유방암은 여전히 완치보다는 얼마나 오래, 잘 버티게 하느냐가 현실적인 목표로 거론된다. 조기 유방암의 5년 생존율이 99%를 넘는 반면, 전이 단계에서 진단된 유방암 환자의 5년 생존율은 약 49% 수준에 그치기 때문이다. 특히 전이성 유방암은 HER2, 호르몬 수용체(HR) 발현 여부에 따라 아형과 치료 전략이 완전히 갈리며, 각 아형마다 뚜렷한 미충족 수요가 남아 있다. HER2가 과발현된 HER2 양성 유방암의 경우 지난 10여 년간 1차 표준치료로 자리해 온 탁센계열 약물+허셉틴(트라스투주맙)+퍼제타(터투주맙) 등의 이른바 'THP 요법'으로 생존 연장은 이뤄졌지만, 실제로는 상당수 환자에서 2년 이내 질병이 진행되고 약 25%에서 뇌전이가 발생하는 한계가 있었다. HER2와 HR, 에스트로겐 모두 발현되지 않는 삼중음성유방암(TNBC)은 진단 5년 이내 원격 전이 빈도가 높고, 진단 후 1~3년 사이 재발 위험이 급격히 치솟는 가장 공격적인 아형이지만, 여전히 타깃 가능한 표적이 제한적이라는 점이 문제로 지적돼 왔다. 이에 앞단 치료의 중요성이 부각되고 있다. 전이성 유방암에서 약물치료는 치료 라인이 뒤로 갈수록 효과가 떨어지는 경향이 뚜렷하다. 환자 상태가 비교적 양호한 초반 시퀀스에 얼마나 효과적인 치료제를 배치하느냐가 전체 생존 곡선을 좌우할 수 있다는 의미다. 이런 상황에서 HER2 표적 항체약물접합체(ADC)인 '엔허투(트라스투주맙데룩스테칸)'는 DESTINY-Breast09 임상 3상 연구를 통해 지난 10년 이상 HER2 양성 전이성 유방암의 1차 표준으로 자리해 온 THP 요법보다 무진행생존기간(PFS)을 약 1.5배(40.7개월) 연장시키며 1차 치료 패러다임 변화를 예고했다. 특히 뇌전이나 PIK3CA 변이 등 고위험군에서도 일관된 혜택을 보인 점이 주목을 받고 있다. TNBC 영역에서도 변화의 조짐이 나타났다. 지금까지 면역항암제를 쓸 수 있는 PD-L1 양성 환자는 전체 TNBC의 일부에 그쳤고, 나머지 60~70% 환자는 독성이 높고 내성 발생이 잦은 세포독성항암제에 의존해야 했다. Trop-2 표적 ADC '다트로웨이(다토포테 데룩스테칸)'는 TROPION-Breast02 임상3상에서 면역치료가 불가능한 전이성 TNBC 1차 치료에서 기존 세포독성항암제 대비 PFS와 전체생존기간(OS_)모두를 유의하게 개선하며, 이 영역의 주요 ADC 기반 1차 옵션으로 부상했다. 김 교수와 박 교수는 주요 유방암 영역에서 ADC들이 좋은 효과를 나타내고 있다며 치료 전략을 다시 설계해야 하는 시점이라고 입을 모았다. Q. 엔허투가 DESTINY-Breast09 연구를 통해 1차 치료까지 앞당겨지게 되었는데, 해당 연구에는 어떠한 임상적 가치가 있는지 궁금하다. 박경화 교수: HER2 양성 전이성 유방암 환자의 약 25%에서는 뇌 전이가 발생하는데, THP 요법은 이를 막거나 치료하기는 다소 어려운 상황이다. 또 바이오마커 관련 임상 연구를 해보면 PIK3CA 변이와 같은 내성 유전자가 있는 경우에는 변이가 없는 환자들에 비해 PFS가 조금 더 짧게 나타난다. 이러한 상황에서 HER2 양성 전이성 유방암 2차 치료에서 큰 성공을 이루었던 엔허투가 1차 치료로 앞당겨지게 된 것이다. 번번 연구에서 엔허투는 1차 치료 시 PFS에 있어 40.7개월이라는 역사적인 결과를 나타냈다. 또 해당 연구에는 이미 뇌 전이가 있는 환자가 약 10% 정도 포함이 됐고, PIK3CA 변이가 있는 환자도 포함이 되었는데, 모든 환자에서 기존 1차 치료 대비 일관되게 우월한 효과를 보여줬다. 기존 의학적 미충족 요구가 있던 환자군에서 확실한 치료 이점이 있을 것으로 생각된다. Q. 엔허투가 실제 임상 현장에 1차 치료로 도입된다면, 치료 전략을 어떻게 수립해야 하는가? 김성배 교수: 효과가 증명된 치료제를 써야 하는 것이 맞다. 다만 THP 요법 또한 효과가 좋기도 하고, 엔허투는 약 10%의 환자에서 간질성폐질환(ILD)의 우려가 있기도 하다. 최대한 종양을 감소시키기 위한 목적으로는 세포독성항암제인 탁산이 포함된 THP 요법을 보통 6-8 사이클로 사용하는데, 6 사이클 치료 후 트라스투주맙과 퍼투주맙 치료만 유지되어도 생존기간이 12개월 이상은 더 유지가 된다. 그럼에도 기존 THP요법의 벽을 엔허투가 무너뜨렸다는 점에서는 의미가 크다. 또한 HER2 양성 유방암은 질환 자체가 공격적인 타입이기 때문에 일단 처음에는 엔허투를 사용하게 될 것이라고 본다. 그 이후 유지를 위한 치료 전략을 어떻게 수립할 것인지는 별개의 문제라고 생각한다. 박경화 교수: THP 요법의 효과가 좋은 환자에서는 삶의 질이 굉장히 좋게 나타난다. 국내에는 허가가 되어 있지 않지만, HER2 양성이면서 호르몬 수용체 양성인 경우에는 허셉틴과 퍼제타를 유지하면서 호르몬 치료를 추가할 수 있기 때문이다. 또 최근 발표된 PATINA 연구에서는 CDK4/6 억제제를 추가하면 굉장히 긴 PFS를 나타낼 수 있는 것으로 확인되면서 기대를 받고 있다. 반면 엔허투는 치료 효과가 좋지만, 삶의 질에 있어서는 약간의 우려도 존재한다. 만약 실제 임상 현장에 엔허투가 1차 치료 급여로 도입이 된다 하더라도, 꼭 모든 환자의 1차 치료에 엔허투가 필요하다고 보지 않을 수 있다. 결국 전략적으로 적용을 해야 될 것으로 생각된다. Q. 엔허투+퍼제타 병용요법을 어떤 환자에게 우선적으로 사용해야 할 지도 궁금하다. 박경화 교수: 처음부터 중추신경계 전이가 있거나 PIK3CA 변이가 있는 환자들은 반응이 더디거나 내성이 빨리 생기는 것으로 알려져 있는데, 이처럼 진단 시 전이가 여러 곳에 많이 되어서 종양 부담이 큰 환자들은 빠르게 종양을 줄여줄 필요가 있다. 따라서 이러한 경우 엔허투+퍼투주맙 병용요법이 기존 THP 요법 대비 더 빠른 종양 감소 효과를 볼 수 있기 때문에, 해당 환자군에서 좀 더 선호하는 요법이 될 것으로 생각한다. 김성배 교수: THP 요법의 피보탈 임상인 CLEOPATRA 연구에서는 참여자 중 보조요법으로 트라스투주맙을 이미 사용했던 환자가 전체의 약 10% 미만이었다. 기존 보조요법으로 허셉틴을 이미 사용했는데 재발을 했다면 질병의 성질이 더 공격적인 것으로 여길 수 있는데, DESTINY-Breast09연구는 이러한 환자군이 포함되고도 PFS가 40.7개월로 나타난 것이라 그 의미가 더 크다고 본다. Q. 엔허투 병용요법이 국내 허가·급여될 경우 1차 표준치료는 어떻게 바뀌게 될 지, 또한 급여 가능성은 어떻게 보는지 궁금하다. 박경화 교수: 만약 엔허투가 1차 치료로 인정이 된다면 결국 환자 상황에 따라 결정이 되어야 한다. 국내의 경우 엔허투가 1차 치료에서 보험이 된다면 모든 환자분들이 쓰지 않으면 손해를 본다고 생각하고 모두 사용 하고싶어 할 것 같다. 다만 1차에 THP 요법을 쓴다고 해서 엔허투를 사용할 기회가 사라지는 것은 아니기 때문에, 환자 그리고 보호자와 충분히 상의해서 어떤 치료제를 먼저 사용하는 것이 환자에게 유리할지, 기저질환 또는 삶의 질과 같은 요소들을 고려해 판단할 필요가 있다. 개인적으로는 뇌 전이나 PIK3CA 변이가 있거나 종양 부담이 큰 특수한 경우 외에는 HER2 양성이면서 호르몬 수용체 양성인 환자에서는 THP 요법을 먼저 사용할 것 같다. THP 요법이 효과가 있다면 입랜스(팔보시클립) 유지요법인 PATINA 요법까지 더해 상당히 오랜 기간 효과를 유지할 수 있기 때문이다. 그러나 HER2 양성이거나 종양 부담이 높아서 증상을 빠르게 경감시켜줘야 한다면 엔허투를 먼저 사용할 것 같다. 김성배 교수: 최근 DESTINY-Breast11 연구에서 수술 전 보조요법으로 엔허투 4사이클 이후 THP 요법 4사이클을 투약한 환자군과 세포독성항암제 4사이클 이후 THP 요법 4사이클을 투약한 환자군을 비교했더니, 엔허투를 사용한 환자군에서 병리학적 완전관해(PCR)가 높게 나타난 것으로 확인되었으며, 특히 호르몬 수용체 음성 유방암 환자군의 경우 83.1%로 보고됐다. 또 DESTINY-Breast05 연구에서는 수술 전 보조요법 이후 PCR에 도달하지 않은 환자들에게 엔허투를 14사이클 더 사용했더니 효과가 좋았다는 결과도 발표됐다. 이러한 경우 두 가지 모두 효과가 좋다면 실제로는 어떤 순서로 치료해야 할지 딜레마가 될 수 있다. 원칙은 환자 상황을 모두 고려해 결정하는 것이다. 일반적으로는 효과가 좋은 치료제라면 결국 앞 단계로 오게 되어 있다. Q. 다트로웨이의 질문을 이어나가려고 한다. TNBC 환자의 약 70%가 면역항암제를 사용할 수 없다고 하는데, 이렇게 많은 환자에서 면역항암제가 듣지 않는 이유가 무엇인가? 다른 암종도 면역항암제를 사용할 수 없는 비율이 비슷한지, 아니면 삼중 음성 유방암만의 특성인지 궁금하다. 박경화 교수: ADC 항암제라는 약물을 훨씬 정밀하게 전달하는 약제가 나오면서 상황이 완전히 바뀌었다. ADC에 실린 약물 자체도 기존 유방암 치료에서 쓰이지 않던 새로운 약물이었고, 기존 항암제보다 훨씬 효과적으로 암세포를 사멸하는 기전을 가지고 있다. 그래서 면역항암제와 ADC가 시너지를 일으키면서 유방암 치료 효과가 더 좋아졌다. 특히 PD-L1 음성 환자에서는 지금까지 세포독성항암제밖에 쓸 수 없었는데, 이 마저도 독성 때문에 오래 쓰지 못했고 PFS도 길어야 4-5개월 수준이었다. 그리고 2-3번 정도 치료하면 환자분들이 돌아가시는 경우도 많아서 OS도 1년 조금 넘는 정도였다. 그런데 ADC 항암제라는 혁신적인 치료제가 나오면서 이제는 확실하게 생존 연장 효과가 확인됐다. 특히 다트로웨이는 이번 TROPION-Breast02 연구에서 이러한 효과가 처음으로 증명된 것이다. 김성배 교수: 면역항암제는 PD-L1 발현에 의존한다. 삼중 음성 유방암 환자의 약 30-40% 정도만 PD-L1 양성이라서 면역항암제의 표적이 된다. PD-L1 발현이 없는 나머지 60-70% 환자들은 그냥 기존 세포독성항암제를 쓸 수밖에 없다. 기본적으로 ADC는 약물이 선택적으로 암세포를 타깃 한다는 특징이 있기 때문에 효과가 좋은 것으로 보인다. 기존에는 PD-L1 음성이어서 면역항암제를 사용하지 못하는 60-70%의 TNBC 환자가 문제가 됐다. 최근 개발된 ADC 항암제들이 타깃하는 TROP2 대부분의 암에서 발현되고, 특히 삼중 음성 유방암에서 상대적으로 더 많이 발현되고 있어 좋은 표적이 된 것 같다. 이러한 ADC 항암제가 나오면서 기존에 면역항암제를 사용하지 못했던 환자들도 치료 기회가 생기게 되었다. Q. 최근에는 HER2가 조금이라도 발현되면 엔허투를 사용하는 방향으로 논의가 되고 있다 알고 있는데, 다트로웨이가 사용이 가능해지면 이러한 논의는 어떻게 되는 것인지 궁금하다. 박경화 교수: 엔허투는 TNBC 환자 1차 치료에는 연구된 바가 없다. 이미 다른 항암제를 1개 정도 사용하고 HER2가 조금이라도 발현되었다면 DESTINY-Breast04 연구에 근거해 엔허투를 사용해 볼 수 있다. 현재 삼중 음성 유방암 1차 치료에서는 TROP2 ADC 항암제만이 임상연구 데이터에 기반한 근거가 있는 상황으로, 기존에 없던 새로운 치료 옵션이 생긴 것이다. 김성배 교수: DESTINY-Breast04 연구에 근거한다면 세포독성항암제를 사용한 상황에서 질병이 다시 진행되었을 때 HER2가 조금이라도 발현되면 아직 급여는 안되지만 엔허투를 쓸 수 있다. 또는 호르몬 치료 이후에도 세포독성항암제를 한 차례 한 후 사용할 수 있다. 호르몬 수용체 양성 유방암에서 호르몬 치료 이후 세포독성항암제를 사용하기 전에 먼저 엔허투를 사용하는 것은 DESTINY-Breast06 연구이다. Q. PD-L1 음성 환자에게는 두 가지 ADC 옵션이 가능해 보이는데, 한 약제는 OS 데이터를 갖고 있고 다른 약제는 PFS2만 있는 상황에서, OS 혜택이 있는 약제가 더 가치 있다고 봐야 하는가? 김성배 교수: 비슷한 예시로 보조요법에서의 키스칼리(리보시클립)와 버제니오(아베마시클립)을 들 수 있다. 키스칼리는 먼저 개발을 시작해서 OS 데이터까지 보여줄 수 있었고, 버제니오는 나중에 개발되면서 OS 데이터를 보기에는 어려움이 있었다. 그래서 PFS뿐 아니라 OS까지 이점을 보인 리보시클립이 골드 스탠다드(Gold Standard)라고 여겨졌고, 같은 비용이라면 전체생존기간OS에 근거가 확인된 치료제를 선택하는 것이 합리적이었다. 일단 암의 재발을 막는 것만으로 의미가 있기 때문에 주요 평가변수를 충족하면 의미가 있다고 보기도 하고, 나중에 결국 키스칼리와 버제니오의 OS가 유사한 수준으로 확인되긴 했다. 다만 OS가 가장 중요한 지표이기 때문에, 동일한 조건이라면 이 분이 개선의 확인된 치료제를 좀 더 선호한다. 또 OS에서 치료 혜택을 확인하면 급여를 받는 데에도 도움이 될 수 있다. 박경화 교수: 국내의 경우 급여 여부가 치료제를 선택할 때에 1차적인 조건이 된다. Q. 다트로웨이가 국내 도입된다면, TNBC 치료에 어떤 위치를 차지할 것이라 보는가? 김성배 교수: 다트로웨이는 치료 후 6개월 이내 또는 무질병 기간 12개월 이내에 재발한 환자에게 쓸 수 있다. TNBC 환자라면 1년 이내에 재발했는지를 먼저 확인해 보는 것이 필요하다. 기존 치료제와는 재발 시점에 대한 기준이 조금 다르다는 점이 다트로웨이의 장점이라고 할 수 있다. 박경화 교수: 말씀주신 상황이 ADC가 가장 절실하게 필요한 환자군이다. 그런데 현재 국내에서 삼중 음성 유방암에 사용할 수 있는 ADC 항암제인 사시투주맙 고비테칸는 해당 상황에서는 쓸 수 없다. 그래서 현재는 효과가 있을지 없을지 모르는 다른 치료를 먼저 한 후에 2차 치료로 사시투주맙 고비테칸을 사용하는 구조이다. 다트로웨이가 국내에 도입되면 이러한 치료 공백을 메울 수 있게 된다.2025-12-12 06:00:51손형민 기자 -
 희비 갈린 급여재평가, 약가인하-환급 후속조치 진행[데일리팜=정흥준 기자]올해 급여재평가에서 조건부로 급여 유지가 된 5개 성분에 대한 후속 조치가 진행된다. 식약처 임상재평가로 판단이 유보된 3개 성분은 입증 실패 시 급여 환급 계약을 체결한다. 또 약가인하가 되는 2개 성분은 안정 공급에 대한 협상을 이달 중순까지 마무리할 예정이다. 9일 업계에 따르면 건강보험공단은 복지부 협상명령에 따라 급여재평가 품목에 대한 후속 절차를 밟고 있다. 심평원 약제급여평가위원회에서 임상재평가 진행을 이유로 판단을 유예한 성분은 ▲간질환 치료제 L-아스파르트산-L-오르니틴 ▲위십이지장염 치료제인 설글리코타이드 ▲콜레스테롤담석증에 쓰는 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염 등 3개 성분이다. 이 성분들은 이달 건정심을 거쳐 유예가 확정될 예정이다. 내달에도 급여유지는 되지만 향후 임상재평가 결론에 따라 지급한 급여를 환급하는 내용의 협상이 진행되고 있다. 공단 관계자는 “환급 관련 제약사 협상이 진행 중이다. 급여재평가 결론이 내달 1일자로 고시될 것이기 때문에 협상은 연말까지 마무리가 될 것”이라고 설명했다. 이 관계자는 “(임상재평가 실패시)일정 비율로 환급이 이뤄질 것이다. 환급 계약을 거부하는 곳은 없을 것”이라고 했다. 비용효과성 조건이 붙어 대규모 약가인하가 이뤄지는 애엽 추출물과 구형흡착탄 등 2개 성분은 공급 계약 등의 공단 협상이 진행될 예정이다. 공단은 오는 15일까지 협상을 마무리할 계획이다. 안정적 공급과 품질관리에 대한 내용으로 전자체결 방식으로 협상이 이뤄진다. 애엽추출물의 협상 품목이 가장 많기 때문에 짧은 기간 동안 집중적으로 협의를 마무리해야 하는 상황이다. 제약사들은 이미 약가인하 수용 절차를 거쳤기 때문에 공급·품질관리 등 남은 합의 절차가 까다롭지는 않다. 다만, 이 절차까지 매듭을 지어야 1월 1일 복지부 고시와 함께 약가 조정 후 급여가 유지된다. 공단 관계자는 “다음 주까지 안정 공급 등에 대한 합의를 해서 복지부에 보고하고 이달 건정심을 거쳐 내달 고시될 예정”이라고 밝혔다.2025-12-09 06:00:56정흥준 기자
희비 갈린 급여재평가, 약가인하-환급 후속조치 진행[데일리팜=정흥준 기자]올해 급여재평가에서 조건부로 급여 유지가 된 5개 성분에 대한 후속 조치가 진행된다. 식약처 임상재평가로 판단이 유보된 3개 성분은 입증 실패 시 급여 환급 계약을 체결한다. 또 약가인하가 되는 2개 성분은 안정 공급에 대한 협상을 이달 중순까지 마무리할 예정이다. 9일 업계에 따르면 건강보험공단은 복지부 협상명령에 따라 급여재평가 품목에 대한 후속 절차를 밟고 있다. 심평원 약제급여평가위원회에서 임상재평가 진행을 이유로 판단을 유예한 성분은 ▲간질환 치료제 L-아스파르트산-L-오르니틴 ▲위십이지장염 치료제인 설글리코타이드 ▲콜레스테롤담석증에 쓰는 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염 등 3개 성분이다. 이 성분들은 이달 건정심을 거쳐 유예가 확정될 예정이다. 내달에도 급여유지는 되지만 향후 임상재평가 결론에 따라 지급한 급여를 환급하는 내용의 협상이 진행되고 있다. 공단 관계자는 “환급 관련 제약사 협상이 진행 중이다. 급여재평가 결론이 내달 1일자로 고시될 것이기 때문에 협상은 연말까지 마무리가 될 것”이라고 설명했다. 이 관계자는 “(임상재평가 실패시)일정 비율로 환급이 이뤄질 것이다. 환급 계약을 거부하는 곳은 없을 것”이라고 했다. 비용효과성 조건이 붙어 대규모 약가인하가 이뤄지는 애엽 추출물과 구형흡착탄 등 2개 성분은 공급 계약 등의 공단 협상이 진행될 예정이다. 공단은 오는 15일까지 협상을 마무리할 계획이다. 안정적 공급과 품질관리에 대한 내용으로 전자체결 방식으로 협상이 이뤄진다. 애엽추출물의 협상 품목이 가장 많기 때문에 짧은 기간 동안 집중적으로 협의를 마무리해야 하는 상황이다. 제약사들은 이미 약가인하 수용 절차를 거쳤기 때문에 공급·품질관리 등 남은 합의 절차가 까다롭지는 않다. 다만, 이 절차까지 매듭을 지어야 1월 1일 복지부 고시와 함께 약가 조정 후 급여가 유지된다. 공단 관계자는 “다음 주까지 안정 공급 등에 대한 합의를 해서 복지부에 보고하고 이달 건정심을 거쳐 내달 고시될 예정”이라고 밝혔다.2025-12-09 06:00:56정흥준 기자 -
 엔허투, HER2 양성 유방암서 적응증 확대 청신호[싱가포르=손형민 기자] 유방암 치료에서 엔허투의 영향력이 빠르게 확대되고 있다. 엔허투는 표적항암제 퍼제타 병용요법을 통해 HER2 양성 진이성 유방암 1차 치료제로서의 가능성을 확인했다. 또 엔허투는 수술 전 보조요법에서도 병리학적 관해율을 10% 이상 끌어올리는 데 성공했다. 8일 관련 업계에 따르면 최근 싱가포르에서 개최된 유럽종양학회 연례학술대회 아시아(ESMO ASIA 2025)에서 '엔허투(트라스투주맙데룩스테칸)'와 '퍼제타(퍼투주맙)' 병용요법의 임상 결과가 공개됐다. 항체약물접합체(ADC) 항암제인 엔허투는 HER2 양성 전이성 유방암에 2차 단독요법으로 허가된 상황이다. 이에 엔허투 개발사인 아스트라제네카와 다이이찌산쿄는 기존 THP요법에 활용되는 퍼제타 병용을 통해 1차 치료제로서의 가능성을 확인 중이다. DESTINY-Breast09는 치료 경험이 없는 HER2 양성 진행성 유방암 환자 1157명을 대상으로 한 임상3상 연구로, 이 중 한국을 비롯해 일본·중국·대만·필리핀 등 아시아 환자 346명이 포함됐다. 아시아 환자군은 무작위 배정에 따라 엔허투+퍼제타군, 엔허투+위약군(블라인드 유지), THP요법군으로 나뉘어 치료를 받았다. 엔허투+퍼제타군의 독립적 중앙 맹검 평가(BICR) 기준 PFS 중앙값은 40.7개월로 나타났다. 이는 THP요법군 24.7개월 대비 진행 위험을 45% 낮춘 것으로, 글로벌 분석에서 확인된 경향이 아시아 환자에서도 동일하게 재현됐다. 반응률 측면에서도 격차는 뚜렷했다. 엔허투+퍼제타군의 확인된 객관적 반응률(ORR)은 89.7%, THP군은 84.3%였으며, 완전관해(CR) 비율도 17.8%로 대조군 12.8% 대비 더 높았다. 반응 지속 기간(DOR)은 각각 39.2개월과 26.3개월로 엔허투 병용요법의 우월성이 유지됐다. 안전성 프로필은 기존과 유사했다. 3등급 이상 이상반응은 엔허투 병용군 63.4%, THP군 72.5%, 중대한 이상반응은 엔허투 병용군 22.9%, THP요법군이 22.8%로 나타났다. 다만 엔허투 병용군에서 약물 관련 간질성폐질환(ILD)/폐렴이 18.9% 발생해(대부분 1·2등급), 0.6%에서 5등급 사례가 보고됐다. THP군에서는 ILD 발생률이 1.8%로 상대적으로 낮았다. 연구진은 "이번 아시아 분석 결과는 엔허투+퍼제타 병용이 1차 치료의 새로운 표준이 될 수 있다는 가능성을 다시 한번 뒷받침한다는 점에서 의미가 크다"라며 "특히 HER2 양성 유방암은 퍼제타 기반 항체치료가 표준으로 자리잡아 왔지만, ADC인 엔허투가 이 영역까지 빠르게 세력을 확장하고 있다는 점에서 치료 지형 변화가 예상된다"라고 평가했다. 수술 전 보조요법서도 병리학적 관해율 개선 엔허투의 적응증 확대 가능성은 수술 전 보조요법 영역에서도 확인되고 있다. 진행성 유방암 치료에서 병리학적 완전관해(pCR)는 재발 위험을 낮추고 장기 생존을 높이는 핵심 지표지만, 현재 허셉틴·퍼제타·세포독성 항암제를 기반으로 한 표준치료에서도 환자의 절반은 pCR에 도달하지 못하는 한계가 있었다. DESTINY-Breast11로 명명된 임상3상 연구는 진행성 HER2 양성 유방암 환자 927명을 대상으로 기존 수술 전 보조요법의 한계를 넘기 위해 설계됐다. 임상 결과, 엔허투 병용군의 pCR 달성률은 67.3%로 표준 치료(용량집중 독소루비신, 시클로포스파미드 투여 후 THP 병용요법 투여(ddAC-THP)군 56.3%보다 11.2%p 높았다. 조기 유방암에서 두 자릿수 차이는 의미가 크다는 게 연구진의 설명이다. 세부 환자군에서도 일관된 개선 효과가 확인됐다. 호르몬수용체(HR) 양성 환자에서는 엔허투 병용군의 pCR이 61.4로, ddAC-THP군(52.3%) 대비 약 9.1%p 높았다. 특히 HR 음성 환자군에서는 차이가 더 벌어졌다. 연구진은 "pCR을 10% 이상 높일 수 있다는 건 엔허투의 수술 전 보조요법 활용도가 커질 수 있다는 걸 의미한다. 또 많은 용량을 투여하지 않을 수 있어 후속 치료에도 지장을 주지 않을 수 있다"라고 평가했다.2025-12-09 06:00:53손형민 기자
엔허투, HER2 양성 유방암서 적응증 확대 청신호[싱가포르=손형민 기자] 유방암 치료에서 엔허투의 영향력이 빠르게 확대되고 있다. 엔허투는 표적항암제 퍼제타 병용요법을 통해 HER2 양성 진이성 유방암 1차 치료제로서의 가능성을 확인했다. 또 엔허투는 수술 전 보조요법에서도 병리학적 관해율을 10% 이상 끌어올리는 데 성공했다. 8일 관련 업계에 따르면 최근 싱가포르에서 개최된 유럽종양학회 연례학술대회 아시아(ESMO ASIA 2025)에서 '엔허투(트라스투주맙데룩스테칸)'와 '퍼제타(퍼투주맙)' 병용요법의 임상 결과가 공개됐다. 항체약물접합체(ADC) 항암제인 엔허투는 HER2 양성 전이성 유방암에 2차 단독요법으로 허가된 상황이다. 이에 엔허투 개발사인 아스트라제네카와 다이이찌산쿄는 기존 THP요법에 활용되는 퍼제타 병용을 통해 1차 치료제로서의 가능성을 확인 중이다. DESTINY-Breast09는 치료 경험이 없는 HER2 양성 진행성 유방암 환자 1157명을 대상으로 한 임상3상 연구로, 이 중 한국을 비롯해 일본·중국·대만·필리핀 등 아시아 환자 346명이 포함됐다. 아시아 환자군은 무작위 배정에 따라 엔허투+퍼제타군, 엔허투+위약군(블라인드 유지), THP요법군으로 나뉘어 치료를 받았다. 엔허투+퍼제타군의 독립적 중앙 맹검 평가(BICR) 기준 PFS 중앙값은 40.7개월로 나타났다. 이는 THP요법군 24.7개월 대비 진행 위험을 45% 낮춘 것으로, 글로벌 분석에서 확인된 경향이 아시아 환자에서도 동일하게 재현됐다. 반응률 측면에서도 격차는 뚜렷했다. 엔허투+퍼제타군의 확인된 객관적 반응률(ORR)은 89.7%, THP군은 84.3%였으며, 완전관해(CR) 비율도 17.8%로 대조군 12.8% 대비 더 높았다. 반응 지속 기간(DOR)은 각각 39.2개월과 26.3개월로 엔허투 병용요법의 우월성이 유지됐다. 안전성 프로필은 기존과 유사했다. 3등급 이상 이상반응은 엔허투 병용군 63.4%, THP군 72.5%, 중대한 이상반응은 엔허투 병용군 22.9%, THP요법군이 22.8%로 나타났다. 다만 엔허투 병용군에서 약물 관련 간질성폐질환(ILD)/폐렴이 18.9% 발생해(대부분 1·2등급), 0.6%에서 5등급 사례가 보고됐다. THP군에서는 ILD 발생률이 1.8%로 상대적으로 낮았다. 연구진은 "이번 아시아 분석 결과는 엔허투+퍼제타 병용이 1차 치료의 새로운 표준이 될 수 있다는 가능성을 다시 한번 뒷받침한다는 점에서 의미가 크다"라며 "특히 HER2 양성 유방암은 퍼제타 기반 항체치료가 표준으로 자리잡아 왔지만, ADC인 엔허투가 이 영역까지 빠르게 세력을 확장하고 있다는 점에서 치료 지형 변화가 예상된다"라고 평가했다. 수술 전 보조요법서도 병리학적 관해율 개선 엔허투의 적응증 확대 가능성은 수술 전 보조요법 영역에서도 확인되고 있다. 진행성 유방암 치료에서 병리학적 완전관해(pCR)는 재발 위험을 낮추고 장기 생존을 높이는 핵심 지표지만, 현재 허셉틴·퍼제타·세포독성 항암제를 기반으로 한 표준치료에서도 환자의 절반은 pCR에 도달하지 못하는 한계가 있었다. DESTINY-Breast11로 명명된 임상3상 연구는 진행성 HER2 양성 유방암 환자 927명을 대상으로 기존 수술 전 보조요법의 한계를 넘기 위해 설계됐다. 임상 결과, 엔허투 병용군의 pCR 달성률은 67.3%로 표준 치료(용량집중 독소루비신, 시클로포스파미드 투여 후 THP 병용요법 투여(ddAC-THP)군 56.3%보다 11.2%p 높았다. 조기 유방암에서 두 자릿수 차이는 의미가 크다는 게 연구진의 설명이다. 세부 환자군에서도 일관된 개선 효과가 확인됐다. 호르몬수용체(HR) 양성 환자에서는 엔허투 병용군의 pCR이 61.4로, ddAC-THP군(52.3%) 대비 약 9.1%p 높았다. 특히 HR 음성 환자군에서는 차이가 더 벌어졌다. 연구진은 "pCR을 10% 이상 높일 수 있다는 건 엔허투의 수술 전 보조요법 활용도가 커질 수 있다는 걸 의미한다. 또 많은 용량을 투여하지 않을 수 있어 후속 치료에도 지장을 주지 않을 수 있다"라고 평가했다.2025-12-09 06:00:53손형민 기자 -
 급여재평가 파장 제한적...500억 손실 최소화 과제 남아[데일리팜=정흥준 기자]올해 급여적정성 재평가 후속 조치로 약 500억 규모의 구조조정이 예상된다. 재평가 대상 지정 당시 8개 성분의 청구액이 3500억 규모였던 걸 고려하면 업계 미칠 파장은 적을 것으로 보인다. 오히려 재평가 성분이었던 올로파타딘염산염 점안액은 급여 등재 품목이 늘어나고 있는 상황이다. 5일 업계에 따르면 올해 8개 성분의 급여재평가는 제약사들의 선방으로 피해액을 최소화했다는 평가다. 다만, 3개 성분은 여전히 퇴출 위험을 해소하지 못했다. 약평위는 식약처 임상재평가 중이라는 이유로 판단을 유보했다. 재평가 대상으로 지정될 당시 이들의 3년 평균 청구액은 총 315억원이다. 성분별로는 간질환 치료제 L-아스파르트산-L-오르니틴 64억원, 소화성궤양용제 설글리코타이드 100억원, 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염은 151억원이다. 순서대로 한화제약의 헤파멜즈주, 삼일제약의 글립타이드정, 명문제약의 씨앤유캡슐 등이 대표 품목이다. 이들 3개 성분은 2022~2023년에 차례대로 임상재평가 대상으로 지정됐다. 가장 먼저 씨앤유캡슐(케노데속시콜산-우르소데속시콜산삼수화물마그네슘염)이 내년 상반기까지 임상재평가를 진행하기 때문에 순차적으로 급여 퇴출 희비가 갈릴 것으로 보인다. 3년 평균 청구액이 1215억원으로 가장 높았던 애엽 추출물 성분은 10% 중반의 약가인하가 이뤄져 약 180억 매출 감소가 예상된다. 다만, 처방 확대로 매출 감소폭 일부를 만회할 여지는 충분하다. 앞선 재평가 결과에서 급여적정성을 인정받은 성분에서는 등재 품목이 늘어나는 추세를 보이고 있다. 이달 새롭게 등재된 올로파타딘염산염 점안액은 4개 제품이다. 광동제약의 올로닉스점안액0.7%, 유니메드제약의 파타딘점안액0.7%, 제뉴원사이언스의 파타젠점안액, 한미약품의 올로타딘점안액0.7%가 상한액 2492원으로 등재됐다. 지난 10월에는 휴온스의 휴로타딘점안액0.7%가 등재되는 등 재평가 결과 후 잇달아 진입 품목이 늘어나는 중이다.2025-12-06 06:00:57정흥준 기자
급여재평가 파장 제한적...500억 손실 최소화 과제 남아[데일리팜=정흥준 기자]올해 급여적정성 재평가 후속 조치로 약 500억 규모의 구조조정이 예상된다. 재평가 대상 지정 당시 8개 성분의 청구액이 3500억 규모였던 걸 고려하면 업계 미칠 파장은 적을 것으로 보인다. 오히려 재평가 성분이었던 올로파타딘염산염 점안액은 급여 등재 품목이 늘어나고 있는 상황이다. 5일 업계에 따르면 올해 8개 성분의 급여재평가는 제약사들의 선방으로 피해액을 최소화했다는 평가다. 다만, 3개 성분은 여전히 퇴출 위험을 해소하지 못했다. 약평위는 식약처 임상재평가 중이라는 이유로 판단을 유보했다. 재평가 대상으로 지정될 당시 이들의 3년 평균 청구액은 총 315억원이다. 성분별로는 간질환 치료제 L-아스파르트산-L-오르니틴 64억원, 소화성궤양용제 설글리코타이드 100억원, 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염은 151억원이다. 순서대로 한화제약의 헤파멜즈주, 삼일제약의 글립타이드정, 명문제약의 씨앤유캡슐 등이 대표 품목이다. 이들 3개 성분은 2022~2023년에 차례대로 임상재평가 대상으로 지정됐다. 가장 먼저 씨앤유캡슐(케노데속시콜산-우르소데속시콜산삼수화물마그네슘염)이 내년 상반기까지 임상재평가를 진행하기 때문에 순차적으로 급여 퇴출 희비가 갈릴 것으로 보인다. 3년 평균 청구액이 1215억원으로 가장 높았던 애엽 추출물 성분은 10% 중반의 약가인하가 이뤄져 약 180억 매출 감소가 예상된다. 다만, 처방 확대로 매출 감소폭 일부를 만회할 여지는 충분하다. 앞선 재평가 결과에서 급여적정성을 인정받은 성분에서는 등재 품목이 늘어나는 추세를 보이고 있다. 이달 새롭게 등재된 올로파타딘염산염 점안액은 4개 제품이다. 광동제약의 올로닉스점안액0.7%, 유니메드제약의 파타딘점안액0.7%, 제뉴원사이언스의 파타젠점안액, 한미약품의 올로타딘점안액0.7%가 상한액 2492원으로 등재됐다. 지난 10월에는 휴온스의 휴로타딘점안액0.7%가 등재되는 등 재평가 결과 후 잇달아 진입 품목이 늘어나는 중이다.2025-12-06 06:00:57정흥준 기자 -
 HER2 폐암 표적항암제, 아시아 임상서 나란히 성과[싱가포르=손형민 기자] HER2 변이 비소세포폐암 신약들이 아시아 환자에게 나란히 효과를 보였다. 바이엘과 베링거인겔하임은 각각 '하이어누오(세바버티닙)', '허넥세오스(존거티닙)'의 아시아 임상 데이터를 공개하며 경쟁 구도에 본격 합류했다. 기존 엔허투 이후 새로운 치료옵션들이 모두 아시아 환자에서 일관된 항종양 효과와 예측 가능한 안전성을 확인하며, 향후 HER2 변이 폐암의 치료 전략 변화에 중요한 변곡점이 될 것으로 전망된다. 5일 싱가포르에서 개최된 ESMO ASIA 2025에서 바이엘은 최근 미국 식품의약국(FDA) 승인을 획득한 경구 HER2 표적치료제 하이어누오의 아시아 환자 데이터를 공개했다. 이번에 공개된 임상은 피보탈 연구인 SOHO-01의 코호트 D·E·F에 참여한 아시아 환자 140명을 대상으로 한 중간 분석 결과다. 연구에 따르면 하이어누오는 이전 항암 경험이 있는 환자(D)와 1차 치료 환자(F) 모두에서 일관된 효과를 보였다. 특히 1차 치료군의 객관적반응률(ORR)은 66.7%, 이전 치료를 받은 환자 중 HER2 타깃 치료 경험이 없는 코호트 D에서도 61.4%에 달하는 반응률을 기록했다. 기존 HER2 ADC 치료를 받은 코호트 E에서도 46.9%의 반응률이 확인돼, 선행 치료 유형과 관계없이 의미 있는 항종양 효과를 보인 셈이다. 반응지속기간(DOR) 역시 D코호트에서 12.6개월, E코호트에서 8.5개월로 나타났으며, 1차 치료군(F)은 데이터 검열로 인해 정확한 중앙값 산출이 어렵지만 최소 8개월 이상 유지된 반응이 확인됐다. 아시아 환자들의 특징도 뚜렷했다. 전체의 70~86%가 비흡연자, 60%가 넘는 비율이 여성 환자였으며, 이는 기존 연구에서 반복적으로 보고된 HER2 변이 폐암의 동아시아 특성과 일치한다. 평균 연령은 59~66세로, 실제 임상현장에서의 환자 구성을 반영하는 것으로 평가됐다. 안전성 분석에서는 예상 가능한 HER 계열 TKI 프로필을 보였다. 약물이상반응(TRAEs)은 99.3%에서 보고됐지만 대부분(68.6%)이 1~2등급이었다. 가장 흔한 이상반응은 설사(76.4%)였으며, 이 중 3등급은 11.4% 수준이었다. 용량 감량은 27.1%, 중단은 3.6%에서 발생했다. 특히 동일 HER2 표적 약물군에서 주의가 필요한 간질성폐질환(ILD)이 단 한 건도 보고되지 않은 점은 하이어누오의 안전성 강점으로 주목된다. HER2 변이 폐암은 전체 비소세포폐암의 2~4%에 불과한 희소 암종이지만, 하이어누오를 비롯해 엔허투, 등 신약 진입으로 글로벌 경쟁이 빠르게 뜨거워지는 분야다. 이번 하이어누오의 아시아 데이터는 1차 치료제 가능성, 선행 치료와 관계없는 일관된 반응률, 관리 가능한 안전성을 동시에 보여주며 HER2 변이 폐암 치료 전략 변화에 또 하나의 중요한 축이 부상하고 있음을 시사한다. 발표를 맡은 다니엘 샤오 웽 탄 싱가포르 국립암센터 교수는 "아시아 환자에서 확인된 내구성 있는 반응과 예측 가능한 안전성은 하이어누오의 치료 옵션으로서의 가능성을 뒷받침한다"며 "HER2 변이 폐암 환자들의 선택지를 넓히는 데 기여할 수 있을 것"이라고 강조했다. 베링거 '허넥세오스' 아시아 환자 대상 ORR 70% 상회 하이어누오에 이어 베링거인겔하임의 HER2 표적치료제 허넥세오스 역시 아시아 환자에서 강력한 치료 효과를 확인하며 HER2 변이 폐암 시장 경쟁을 더욱 가열시키고 있다. 허넥세오스는 HER2를 선택적으로 억제하면서 야생형 EGFR은 억제하지 않는 특성을 갖고 있어 기존 HER 계열 치료제에서 문제가 됐던 독성을 최소화한 것이 특징이다. 이 약물은 이미 미국 FDA 승인을 받았고, 중국에서는 혁신신약 지정을 획득하며 개발 가속화를 인정받았다. 이번 ESMO ASIA에서는 글로벌 임상1b상 Beamion LUNG-1 연구 중 사전 전신항암치료를 받은 HER2 변이 비소세포폐암 환자를 대상으로 한 코호트 1의 아시아 하위 분석 결과가 발표됐다. 허넥세오스는 중간 분석 이후 1일 120mg 단일투여 용량으로 확정됐으며, 독립중앙검토(BICR)에 기반한 ORR, DOR, 무진행생존기간(PFS) 등을 평가했다. 총 75명의 글로벌 코호트 중 동아시아 환자는 39명로로 중국 18명, 한국 12명, 일본 9명이 포함됐다. 분석 결과 동아시아 환자 전체의 ORR은 76.9%, 질병조절률(DCR)은 100%로 나타났다. 동아시아 환자군의 DOR 중앙값은 14.1개월, PFS 중앙값은 15.5개월로 보고돼, 이전 치료 경험이 있는 HER2 변이 환자에서도 안정적이고 장기적인 효과가 가능함을 시사했다. 특히 중국 환자군에서 ORR 83.3%, DCR 100%를 기록하며 더욱 높은 반응률을 보였다는 점도 주목된다. 중국 환자 중 일부에서 DOR 14.1개월이 관찰됐고, PFS 역시 15.5개월로 전체 동아시아군과 동일한 경향을 보였다. HER2 변이 폐암의 치료 반응이 인종적·지역적 차이에 민감할 수 있다는 점을 고려하면, 이번 결과는 아시아 환자에서 허넥세오스의 경쟁력을 분명히 보여주는 근거로 해석된다. 안전성 역시 양호한 편이었다. 전체 아시아 환자 중 약물이상반응은 92%, 이 중 중등도 이상(≥3등급)은 18%에서 발생했다. 가장 흔한 이상반응은 설사(38%)였으며, 대부분 1등급으로 관리 가능 수준이었다. 특히 HER2 계열 약물에서 문제가 돼온 약물 관련 간질성폐질환(ILD)이 한 건도 보고되지 않았다는 점은 허넥세오스의 안전성 강점을 뒷받침하는 결과다. 연구진은 "허넥세오스는 이미 국제학술지 New England Journal of Medicine에 글로벌 데이터가 발표되며 기전의 확실성과 임상적 가치를 인정받았고, 이번 아시아 데이터는 그 결과와 일관된 흐름을 보였다"라며 "강력한 반응률, 1년 이상 유지되는 내구성, 낮은 중단률과 예측 가능한 안전성은 허넥세오스가 HER2 변이 비소세포폐암에서 중요한 표적 치료제로 자리 잡을 가능성을 높이고 있다"라고 강조했다.2025-12-06 06:00:55손형민 기자
HER2 폐암 표적항암제, 아시아 임상서 나란히 성과[싱가포르=손형민 기자] HER2 변이 비소세포폐암 신약들이 아시아 환자에게 나란히 효과를 보였다. 바이엘과 베링거인겔하임은 각각 '하이어누오(세바버티닙)', '허넥세오스(존거티닙)'의 아시아 임상 데이터를 공개하며 경쟁 구도에 본격 합류했다. 기존 엔허투 이후 새로운 치료옵션들이 모두 아시아 환자에서 일관된 항종양 효과와 예측 가능한 안전성을 확인하며, 향후 HER2 변이 폐암의 치료 전략 변화에 중요한 변곡점이 될 것으로 전망된다. 5일 싱가포르에서 개최된 ESMO ASIA 2025에서 바이엘은 최근 미국 식품의약국(FDA) 승인을 획득한 경구 HER2 표적치료제 하이어누오의 아시아 환자 데이터를 공개했다. 이번에 공개된 임상은 피보탈 연구인 SOHO-01의 코호트 D·E·F에 참여한 아시아 환자 140명을 대상으로 한 중간 분석 결과다. 연구에 따르면 하이어누오는 이전 항암 경험이 있는 환자(D)와 1차 치료 환자(F) 모두에서 일관된 효과를 보였다. 특히 1차 치료군의 객관적반응률(ORR)은 66.7%, 이전 치료를 받은 환자 중 HER2 타깃 치료 경험이 없는 코호트 D에서도 61.4%에 달하는 반응률을 기록했다. 기존 HER2 ADC 치료를 받은 코호트 E에서도 46.9%의 반응률이 확인돼, 선행 치료 유형과 관계없이 의미 있는 항종양 효과를 보인 셈이다. 반응지속기간(DOR) 역시 D코호트에서 12.6개월, E코호트에서 8.5개월로 나타났으며, 1차 치료군(F)은 데이터 검열로 인해 정확한 중앙값 산출이 어렵지만 최소 8개월 이상 유지된 반응이 확인됐다. 아시아 환자들의 특징도 뚜렷했다. 전체의 70~86%가 비흡연자, 60%가 넘는 비율이 여성 환자였으며, 이는 기존 연구에서 반복적으로 보고된 HER2 변이 폐암의 동아시아 특성과 일치한다. 평균 연령은 59~66세로, 실제 임상현장에서의 환자 구성을 반영하는 것으로 평가됐다. 안전성 분석에서는 예상 가능한 HER 계열 TKI 프로필을 보였다. 약물이상반응(TRAEs)은 99.3%에서 보고됐지만 대부분(68.6%)이 1~2등급이었다. 가장 흔한 이상반응은 설사(76.4%)였으며, 이 중 3등급은 11.4% 수준이었다. 용량 감량은 27.1%, 중단은 3.6%에서 발생했다. 특히 동일 HER2 표적 약물군에서 주의가 필요한 간질성폐질환(ILD)이 단 한 건도 보고되지 않은 점은 하이어누오의 안전성 강점으로 주목된다. HER2 변이 폐암은 전체 비소세포폐암의 2~4%에 불과한 희소 암종이지만, 하이어누오를 비롯해 엔허투, 등 신약 진입으로 글로벌 경쟁이 빠르게 뜨거워지는 분야다. 이번 하이어누오의 아시아 데이터는 1차 치료제 가능성, 선행 치료와 관계없는 일관된 반응률, 관리 가능한 안전성을 동시에 보여주며 HER2 변이 폐암 치료 전략 변화에 또 하나의 중요한 축이 부상하고 있음을 시사한다. 발표를 맡은 다니엘 샤오 웽 탄 싱가포르 국립암센터 교수는 "아시아 환자에서 확인된 내구성 있는 반응과 예측 가능한 안전성은 하이어누오의 치료 옵션으로서의 가능성을 뒷받침한다"며 "HER2 변이 폐암 환자들의 선택지를 넓히는 데 기여할 수 있을 것"이라고 강조했다. 베링거 '허넥세오스' 아시아 환자 대상 ORR 70% 상회 하이어누오에 이어 베링거인겔하임의 HER2 표적치료제 허넥세오스 역시 아시아 환자에서 강력한 치료 효과를 확인하며 HER2 변이 폐암 시장 경쟁을 더욱 가열시키고 있다. 허넥세오스는 HER2를 선택적으로 억제하면서 야생형 EGFR은 억제하지 않는 특성을 갖고 있어 기존 HER 계열 치료제에서 문제가 됐던 독성을 최소화한 것이 특징이다. 이 약물은 이미 미국 FDA 승인을 받았고, 중국에서는 혁신신약 지정을 획득하며 개발 가속화를 인정받았다. 이번 ESMO ASIA에서는 글로벌 임상1b상 Beamion LUNG-1 연구 중 사전 전신항암치료를 받은 HER2 변이 비소세포폐암 환자를 대상으로 한 코호트 1의 아시아 하위 분석 결과가 발표됐다. 허넥세오스는 중간 분석 이후 1일 120mg 단일투여 용량으로 확정됐으며, 독립중앙검토(BICR)에 기반한 ORR, DOR, 무진행생존기간(PFS) 등을 평가했다. 총 75명의 글로벌 코호트 중 동아시아 환자는 39명로로 중국 18명, 한국 12명, 일본 9명이 포함됐다. 분석 결과 동아시아 환자 전체의 ORR은 76.9%, 질병조절률(DCR)은 100%로 나타났다. 동아시아 환자군의 DOR 중앙값은 14.1개월, PFS 중앙값은 15.5개월로 보고돼, 이전 치료 경험이 있는 HER2 변이 환자에서도 안정적이고 장기적인 효과가 가능함을 시사했다. 특히 중국 환자군에서 ORR 83.3%, DCR 100%를 기록하며 더욱 높은 반응률을 보였다는 점도 주목된다. 중국 환자 중 일부에서 DOR 14.1개월이 관찰됐고, PFS 역시 15.5개월로 전체 동아시아군과 동일한 경향을 보였다. HER2 변이 폐암의 치료 반응이 인종적·지역적 차이에 민감할 수 있다는 점을 고려하면, 이번 결과는 아시아 환자에서 허넥세오스의 경쟁력을 분명히 보여주는 근거로 해석된다. 안전성 역시 양호한 편이었다. 전체 아시아 환자 중 약물이상반응은 92%, 이 중 중등도 이상(≥3등급)은 18%에서 발생했다. 가장 흔한 이상반응은 설사(38%)였으며, 대부분 1등급으로 관리 가능 수준이었다. 특히 HER2 계열 약물에서 문제가 돼온 약물 관련 간질성폐질환(ILD)이 한 건도 보고되지 않았다는 점은 허넥세오스의 안전성 강점을 뒷받침하는 결과다. 연구진은 "허넥세오스는 이미 국제학술지 New England Journal of Medicine에 글로벌 데이터가 발표되며 기전의 확실성과 임상적 가치를 인정받았고, 이번 아시아 데이터는 그 결과와 일관된 흐름을 보였다"라며 "강력한 반응률, 1년 이상 유지되는 내구성, 낮은 중단률과 예측 가능한 안전성은 허넥세오스가 HER2 변이 비소세포폐암에서 중요한 표적 치료제로 자리 잡을 가능성을 높이고 있다"라고 강조했다.2025-12-06 06:00:55손형민 기자 -
 약가 조정으로 애엽 재평가 마무리...내달 대규모 약가인하[데일리팜=정흥준 기자]애엽 추출물 성분 위염치료제에 대한 급여재평가가 약가조정으로 마무리되면서, 내년 대규모 약가인하가 이뤄질 예정이다. 애엽 성분 약제는 오리지널약인 동아ST 스티렌정을 제외하고 제네릭만 100여개다. 약국가에 다빈도 처방되는 약제이고 품목도 다양하기 때문에 약가인하에 따른 혼란은 불가피하다. 4일 열린 심평원 약제급여평가위원회에서는 애엽 추출물 등 5개 성분의 급여재평가 이의신청에 대한 심의를 진행했다. 애엽은 지난 8월 재평가 결과 급여적정성이 없다고 나와 퇴출 위기에 놓였으나, 이의신청과 자료 보완 후 열린 소위원회에서 구사일생했다. 비용효과성 등을 고려해 대체약 수준의 약가 인하로 가닥이 잡혔다. 업계 관계자에 따르면 지난 11월 심폄원과 제약사는 재평가 후속조치로 약 14%의 약가인하 폭에 합의했다. 약평위 결과는 복지부 보고 후 이달 말 건정심 의결을 거친다. 제약사들은 이미 약가인하 신청을 넣었기 때문에 내년 1월부터 약가에 반영될 전망이다. 제약사들은 당장 급여 삭제 위기는 모면했지만 인하에 따른 매출 감소가 적지 않다. 연 매출 1000억을 기록했던 스티렌으로 가정했을 때, 동일한 처방 성과를 달성해도 140억 이상의 매출이 줄어드는 셈이다. 약가인하폭이 큰 만큼 약국들도 적극적인 대처에 나설 것으로 보인다. 반품 정산 등으로 약국과 유통업체들은 분주해질 전망이다. 이번 재평가에서 약가가 조정되는 성분은 애엽 추출물 외에도 구형흡착탄이 있다. 만성신부전증에 사용하는 구형흡착탄의 약가도 함께 조정될 예정이다. 크레메진세립으로 대표되는 구형흡착탄 시장은 품목이 다양하지는 않지만 300억에 가까운 시장을 형성하고 있다. 이외에 급여적정성이 없다고 나왔던 간질환 치료제 L-아스파르트산-L-오르니틴, 위십이지장염 치료제인 설글리코타이드, 콜레스테롤담석증에 쓰는 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염 등은 적정성을 인정받지 못했다. 다만, 식약처 임상재평가 중으로 조건부 평가 유예됐다. 경구용 L-아스파르트산-L-오르니틴 제품은 간성뇌증에 한해 급여 인정됐다.2025-12-05 06:00:59정흥준 기자
약가 조정으로 애엽 재평가 마무리...내달 대규모 약가인하[데일리팜=정흥준 기자]애엽 추출물 성분 위염치료제에 대한 급여재평가가 약가조정으로 마무리되면서, 내년 대규모 약가인하가 이뤄질 예정이다. 애엽 성분 약제는 오리지널약인 동아ST 스티렌정을 제외하고 제네릭만 100여개다. 약국가에 다빈도 처방되는 약제이고 품목도 다양하기 때문에 약가인하에 따른 혼란은 불가피하다. 4일 열린 심평원 약제급여평가위원회에서는 애엽 추출물 등 5개 성분의 급여재평가 이의신청에 대한 심의를 진행했다. 애엽은 지난 8월 재평가 결과 급여적정성이 없다고 나와 퇴출 위기에 놓였으나, 이의신청과 자료 보완 후 열린 소위원회에서 구사일생했다. 비용효과성 등을 고려해 대체약 수준의 약가 인하로 가닥이 잡혔다. 업계 관계자에 따르면 지난 11월 심폄원과 제약사는 재평가 후속조치로 약 14%의 약가인하 폭에 합의했다. 약평위 결과는 복지부 보고 후 이달 말 건정심 의결을 거친다. 제약사들은 이미 약가인하 신청을 넣었기 때문에 내년 1월부터 약가에 반영될 전망이다. 제약사들은 당장 급여 삭제 위기는 모면했지만 인하에 따른 매출 감소가 적지 않다. 연 매출 1000억을 기록했던 스티렌으로 가정했을 때, 동일한 처방 성과를 달성해도 140억 이상의 매출이 줄어드는 셈이다. 약가인하폭이 큰 만큼 약국들도 적극적인 대처에 나설 것으로 보인다. 반품 정산 등으로 약국과 유통업체들은 분주해질 전망이다. 이번 재평가에서 약가가 조정되는 성분은 애엽 추출물 외에도 구형흡착탄이 있다. 만성신부전증에 사용하는 구형흡착탄의 약가도 함께 조정될 예정이다. 크레메진세립으로 대표되는 구형흡착탄 시장은 품목이 다양하지는 않지만 300억에 가까운 시장을 형성하고 있다. 이외에 급여적정성이 없다고 나왔던 간질환 치료제 L-아스파르트산-L-오르니틴, 위십이지장염 치료제인 설글리코타이드, 콜레스테롤담석증에 쓰는 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염 등은 적정성을 인정받지 못했다. 다만, 식약처 임상재평가 중으로 조건부 평가 유예됐다. 경구용 L-아스파르트산-L-오르니틴 제품은 간성뇌증에 한해 급여 인정됐다.2025-12-05 06:00:59정흥준 기자 -
 전이성·절제 불가능성 GIST, 광범위 억제제 '리프레티닙'Qinlock(킨록, 성분명: ripretinib, ONO Pharma)은 광범위 KIT/PDGFRA 억제제다. 2020년 미국 FDA와 2021년 EMA에서 최소 3종의 TKI 치료 후에도 질환이 진행한 성인 전이성 또는 절제 불가능한 위장관기질종양(Gastrointestinal Stromal Tumor, GIST)에 대한 4차 치료제로 승인됐다. 국내에서는 올해 7월 희귀의약품으로 지정됐다. 위장관기질종양(GIST)은 위장관 벽의 간질조직에서 발생하는 대표적인 연부조직 육종으로, 간질성 카할세포(interstitial cells of Cajal)의 발생학적·기능적 특징을 공유하는 전구세포에서 기원하는 것으로 알려져 있다. 분자생물학적 관점에서 대부분의 GIST는 KIT 또는 PDGFRA 유전자의 활성화 돌연변이를 보유하며, 이러한 변이는 주요 신호전달 경로를 지속적으로 활성화해 세포 증식, 생존, 침윤을 촉진함으로써 종양의 발병과 진행을 주도한다. 한편 GIST는 위장관 어느 부위에서도 발생할 수 있으며, 내시경으로 관찰되는 점막층이 아닌 그 아래의 점막하층이나 근육층에서 기원하기 때문에 조기 발견이 어렵다. 대부분은 양성으로 진단되지만 약 20~30%는 악성으로 진행할 수 있다. 증상은 종양이 커지거나 암세포가 점막하층 또는 근육층을 뚫고 점막을 침범할 때 시작되며, 복통이 발생하거나 경우에 따라 장폐색을 유발하기도 한다. 전이성 또는 절제 불가능한 GIST의 치료 패러다임은 표적치료제(tyrosine kinase inhibitor, TKI)의 등장 이후 근본적으로 변화하였다. 2001년 도입된 이마티닙(Imatinib)은 기존 세포독성 화학요법에 반응하지 않던 GIST 환자의 생존 기간을 획기적으로 연장시키며 분자표적치료 시대를 열었다. 이후 수니티닙(Sunitinib), 레고라티닙(Regorafenib), 리프레티닙(Ripretinib) 등 다양한 TKI가 연속적으로 도입되면서 치료 순차 전략이 구체화되었으나, 획득 내성(acquired resistance)은 여전히 해결되지 않은 주요 임상적 과제로 남아 있다. 이에 따라 약제 순서의 최적화, 병용치료 전략, 새로운 분자 표적의 발굴 등에 대한 연구가 활발히 진행되고 있다. 킨록은 INVICTUS 임상 3상 연구를 통해 유효성을 입증하였다. 총 129명의 GIST 환자를 대상으로 한 해당 연구에서 리프레티닙 투여군의 무진행생존기간(PFS) 중앙값은 6.3개월로, 위약군의 1.0개월 대비 현저한 개선을 보였다. 또한 질병 진행 또는 사망 위험을 약 85% 감소시켜 통계적으로 유의한 치료 효과를 확인하였다. 전이성 또는 절제 불가능한 위장관기질종양(Gastrointestinal stromal tumor, GIST)는 어떤 질환인가? 위장관기질종양(GIST)은 소화관 벽에 위치한 특수 신경세포인 카할 간질세포(interstitial cells of Cajal, ICC)에서 기원하는 드문 중간엽성 종양(mesenchymal tumor)이다. ICC는 자율신경계의 일부로 위장관 고유근층 내에서 조율 세포(pacemaker cell) 역할을 수행하며, 위장관 연동운동을 조절하는 기능을 담당한다. GIST의 발생 부위는 위가 약 60%, 소장이 약 30%로 가장 흔하며, 드물게 결장·직장·식도에서도 발생한다. 장간막이나 대망(greater omentum) 등 위장관 외부에서도 발생할 수 있으며, 이러한 경우는 장외(extra-gastrointestinal) GIST로 분류된다. GIST는 KIT(Kinase Insert Domain-containing Receptor Tyrosine Kinase) 또는 혈소판유래성장인자수용체 알파(Platelet-Derived Growth Factor Receptor Alpha, PDGFRA) 유전자의 활성화 돌연변이에 의해 발생하는 것으로 알려져 있다. 연간 발생률은 인구 백만 명당 약 10–15건으로 추정되며, 주로 50~70대에서 진단된다. KIT(CD117) 또는 PDGFRA 돌연변이는 전체 산발성 GIST의 약 85%에서 관찰되며, 티로신 키나제 수용체의 구성적 활성화를 통해 과형성과 종양 발생을 유도한다. 대부분은 후천적(somatic) 변이지만, 드물게 이러한 돌연변이가 유전되어 가족성 GIST를 일으킬 수 있다. 한편 이러한 주요 변이를 보유하지 않는 야생형(wild-type) GIST는 NF1, BRAF, HRAS 등 다양한 분자 변이를 포함하는 이질적 집단이며, 신경섬유종증 1형, Carney triad, Carney-Stratakis syndrome 등 특정 종양 증후군과 연관되기도 한다. 조직병리학적으로 GIST는 방추형, 상피양 또는 혼합형 세포 형태를 보이며, 면역조직화학적으로 KIT(CD117)와 DOG1(Discovered On GIST-1) 양성이 특징적이다. 임상 증상은 비특이적이며, 모호한 복부 불편감, 위장관 출혈, 조기 포만감, 혹은 촉지 가능한 종괴 등으로 다양하게 나타날 수 있다. 진단에는 조영 CT 또는 MRI, 내시경 초음파를 통한 조직 채취, 그리고 분자 진단을 위한 유전자 돌연변이 분석이 포함된다. 치료 결정 시 종양의 크기, 해부학적 위치, 유사분열지수, 분자 변이 등이 종합적으로 고려된다. 국소 질환에서는 음성 절제연(R0 resection)을 확보한 수술적 절제가 기본 치료이며, 방사선 치료는 역할이 제한적이지만 일부 진행성 질환에서 증상 완화 목적으로 사용될 수 있다. 임상적으로 GIST는 초기 단계에서 외과적 절제를 통해 완치를 기대할 수 있으나, 종양의 위치·크기·주변 장기 침윤 여부에 따라 완전 절제(R0)가 불가능한 경우가 적지 않다. 또한 진단 시 이미 간 또는 복막 전이가 동반된 사례가 흔하며, 이러한 전이성 또는 절제 불가능한 GIST는 더 이상 수술 중심의 국소치료로는 관리가 어렵고, 장기적인 전신 치료를 필요로 하는 만성적·재발성 종양의 특성을 보인다. 실제로 수술이 가능하더라도 광범위 절제가 필요하거나 주요 장기 기능 손상의 위험이 높아 근치적 수술의 이점이 기대되기 어려운 경우 ‘절제 불가능(unresectable)’ 범주로 분류되며, 이는 전이성 GIST와 동일한 치료 전략을 적용해야 하는 임상적 상황으로 간주된다. 이와 같은 배경에서 티로신 키나제 억제제(TKI)의 도입은 GIST 전신 치료의 패러다임을 근본적으로 변화시켰다. 이마티닙(Imatinib)은 진행성·절제 불가능·전이성 GIST의 1차 치료제로 사용되며, 환자의 생존율을 의미 있게 향상시켰다. KIT(CD117) 또는 PDGFRA 돌연변이란 무엇인가? KIT(CD117) 또는 PDGFRA 돌연변이는 위장관 기질 종양(GIST)의 발생을 유도하는 핵심 분자 이상으로, 두 유전자가 암호화하는 수용체 티로신 키나제(receptor tyrosine kinase, RTK)에 구성적 활성화(activating mutation)를 일으키는 병적 변화이다. KIT 돌연변이는 전체 GIST의 약 70–80%, PDGFRA 돌연변이는 약 10–15%에서 발견되며, 이 두 유전자의 활성화 돌연변이가 전체 GIST의 약 85–90%를 차지하는 대표적 분자 병인으로 알려져 있다. 특히 KIT 엑손 11, PDGFRA 엑손 18(D842V 등)의 특정 변이는 단백질 구조적 안정성과 자가활성화 억제 기전을 교란하여 종양 발생을 직접적으로 촉진한다. 동시에 이러한 변이들은 이마티닙을 포함한 여러 티로신 키나제 억제제(tyrosine kinase inhibitor,TKI)에 대한 약물 반응성을 결정하는 중요한 예측 인자로 기능한다. 정상 상태에서 KIT과 PDGFRA는 성장인자 자극에 의해 제한적으로 활성화되며, 세포의 생존·증식·분화·이동을 정교하게 조절하는 신호전달 체계의 중심적 역할을 수행한다. 그러나 활성화 돌연변이가 발생하면 리간드 결합과 무관하게 수용체가 지속적으로 활성화되어, RAS–RAF–MAPK, PI3K–AKT, STAT 등 하위 신호 경로를 과도하게 자극함으로써 비조절적 세포 증식과 항아폽토시스 신호가 강화되고, 결국 종양 형성이 촉진된다. 또한 KIT 엑손 9, 11, 13·14, 17·18 및 PDGFRA 엑손 18 돌연변이 등은 단백질의 활성화 루프와 구조적 균형을 변화시켜 수용체가 비활성 상태로 유지되지 못하고 지속적으로 ‘on’ 상태를 유지하게 만드는 중요한 분자적 기전을 제공한다. 이처럼 KIT 또는 PDGFRA 돌연변이는 GIST 발생을 유도하는 근본 병인일 뿐 아니라, 돌연변이의 위치와 종류에 따라 약물 감수성과 내성 패턴이 뚜렷하게 달라지므로 임상적 치료 전략 전반을 좌우한다. 실제로 이마티닙을 비롯한 TKI의 반응성은 돌연변이 유형에 따라 큰 차이를 보이며, 일부 변이는 매우 좋은 초기 반응을 보이지만, 다른 변이는 고도의 내성을 나타낸다. 티로신키나제 억제제(Tyrosine kinase inhibitor, TKI)의 작동 원리는? 티로신 키나제는 세포 외부의 신호를 세포 내부로 전달하는 핵심 효소로, 활성화 여부에 따라 다양한 성장·분화 경로가 조절된다. 이 효소는 두 개의 판이 맞물린 형태를 이루는 상·하부 로브(N-lobe, C-lobe)를 기본 골격으로 하며, 두 로브 사이의 좁은 틈은 ATP가 결합하는 중심 자리를 형성한다. ATP가 이 틈에 정확히 결합하면 인산전달 반응이 활성화되고, 이러한 구조적 배치가 유지될 때 정상적인 신호전달이 지속된다. 티로신 키나제의 활성 상태는 두 가지 주요 구조 스위치에 의해 정의된다. 첫 번째는 DFG(Aspartate–Phenylalanine–Glycine)라 불리는 스위치로, 이 잔기가 안쪽을 향하면 활성형(DFG-in), 바깥으로 뒤집히면 비활성형(DFG-out)을 형성한다. 두 번째는 αC-helix로, 이 구조가 안쪽으로 향하면 활성 배치를, 바깥으로 이동하면 비활성 배치를 이룬다. 두 스위치는 독립적으로 움직이지만, 어느 하나라도 비활성 방향으로 전환되면 전체 효소는 효과적으로 ‘잠긴’ 형태가 된다. ATP 결합 틈은 전면부와 후면부로 나눌 수 있다. 앞쪽 공간은 ATP가 결합하는 전통적인 자리로, 대부분의 억제제가 공유하는 결합 부위이다. 반면 뒤쪽 공간(back pocket)은 DFG가 바깥으로 뒤집힌 비활성 상태에서만 열리는 특수한 포켓으로, 억제제의 결합 방식 차이를 결정하는 중요한 구조적 요소이다. Type I 억제제는 활성형(DFG-in)의 ATP 앞자리만을 점유해 ATP 접근을 차단한다. 엘로티닙(Erlotinib), 게페티닙(Gefitinib), 크리조티닙(Crizotinib), 라파티닙(Lapatinib) 등이 대표적이며, 활성 상태의 키나제에 결합하기 때문에 활성형 구조에 크게 의존한다. Type II 억제제는 ATP 앞자리뿐 아니라 DFG-out 상태에서 형성되는 뒤쪽 공간까지 함께 점유한다. 이러한 결합 방식은 비활성형을 안정적으로 고정시키며, 상대적으로 길고 굴곡진 분자 구조를 가진다. 이마티닙(Imatinib), 수니티닙(Sunitinib), 레고라티닙(Regorafenib), 리프레티닙(Ripretinib) 등이 대표적이다. 이 중 Ripretinib은 Type II 기전을 확장한 switch-control 억제제로, back pocket뿐 아니라 DFG 모티프와 αC-helix까지 동시에 고정한다. 이 기전은 ATP 경쟁 억제 수준을 넘어 키나제의 활성화 스위치 자체를 잠그는 방식으로, 다양한 돌연변이에 대해 보다 일관된 억제 효과를 보인다. 이처럼 티로신 키나제 억제제는 ATP 결합 틈의 어느 부분을, 어떤 구조 상태에서 차단하는지에 따라 Type I, Type II, switch-control 계열로 구분된다. 이러한 구조-기전적 이해는 돌연변이에 의해 발생하는 내성 패턴을 설명하며, 새로운 약물 설계의 근거가 된다. 최근에는 ATP-pocket 자체와 경쟁하지 않는 알로스테릭 기반 억제제가 개발되면서 억제제 분류는 더욱 확장되고 있다. Type III 억제제는 ATP-pocket 인접의 알로스테릭(allosteric) 포켓에 결합해 ATP와 비경쟁적으로 작용하며, 트라메티닙(Trametinib)과 코비멭닙(Cobimetinib)이 대표적이다. Type IV 억제제는 ATP 결합부와 물리적으로 떨어진 원거리 알로스테릭 포켓에 결합하며, BCR-ABL의 myristoyl 포켓을 표적하는 아시미닙(Asciminib)이 대표적이다. 이러한 원거리 결합 방식은 ATP-pocket 돌연변이에 거의 영향을 받지 않아 높은 선택성을 확보한다. Type V 억제제는 두 개 이상의 독립된 결합 부위를 동시에 점유하는 bivalent inhibitor로, ATP-pocket과 별도의 알로스테릭 포켓을 동시에 결합해 구조를 강하게 고정한다. 주로 RAF나 CDK 계열을 중심으로 전임상 연구가 진행되고 있다. 마지막으로 Type VI 억제제는 특정 아미노산(주로 Cys)에 공유 결합을 형성하는 비가역 억제제로, 오시메티닙(Osimertinib), 아파티닙(Afatinib), 이부루티닙(Ibrutinib) 등이 대표적이다. 비가역적 특성으로 인해 강력한 결합 안정성과 돌연변이 선택성을 확보할 수 있으며, 기존 competitive TKI의 내성 문제를 보완하는 중요한 전략으로 자리잡았다. 결국 Type I에서 Type VI에 이르는 분류는 티로신 키나제가 갖는 구조적 유연성과 활성 조절 메커니즘을 다양한 수준에서 겨냥하는 전략적 도구이다. ATP-pocket의 활성·비활성 상태를 이용하는 고전적 억제제부터 구조 스위치를 직접 제어하는 switch-control 계열, 그리고 알로스테릭·이중 결합·공유 결합 방식의 차세대 억제제까지 설계 전략이 확장되면서, 내성 극복과 선택성 향상 측면 모두에서 의미 있는 진전이 이루어지고 있다. 특히 KIT과 PDGFRA가 종양의 성장에 직접 관여하는 GIST와 같은 질환에서는 이러한 구조적 통찰이 치료 기전 이해뿐 아니라 전략적 약물 선택과 신약 개발의 핵심 기반이 된다. KIT/PDGFRA 억제제에는 어떤 약제가 있는가? KIT와 PDGFRA의 돌연변이는 GIST의 발생과 진행에 핵심적인 역할을 하며, 이러한 분자 기전을 표적으로 한 티로신 키나제 억제제(TKI)의 도입은 지난 20여 년간 GIST 치료 패러다임을 혁신적으로 변화시켰다. 현재까지 1차부터 3차까지의 표준 치료 전략이 확립되어 있다. 가장 먼저 승인된 이마티닙(Imatinib, GleevecⓇ)은 2002년 미국 FDA에서 전이성 또는 절제불가능 GIST의 1차 치료제로 허가되었다. 원래 BCR-ABL 융합유전자를 표적으로 개발된 만성 골수성 백혈병 치료제로, KIT, PDGFRA, ABL 등 여러 키나제의 ATP 결합 부위를 경쟁적으로 억제한다. 이러한 기전을 바탕으로 전체 GIST 환자의 약 80%에서 우수한 초기 반응을, 약 85%에서 질병 조절 효과를 나타낸다. 특히 KIT 엑손 11 변이에서 반응률이 가장 높으나, KIT 엑손 9 변이나 무변이(wild-type) 환자에서는 효과가 다소 감소한다. 반면 PDGFRA D842V 변이는 이마티닙에 대한 고도 내성을 보이므로, 치료 전략 수립 시 KIT/PDGFRA 유전자 분석은 필수적이다. 이마티닙은 탁월한 초기 효과에도 불구하고, 장기 치료 과정에서 KIT에 다양한 2차 돌연변이가 축적되면서 내성이 발생할 수 있다. 이에 따라 이마티닙 실패 후 사용할 2차 치료제로 수니티닙(Sunitinib, SutentⓇ)이 2006년 미국 FDA의 승인을 받았다. 수니티닙은 KIT과 PDGFRA 외에도 VEGFR-1/2, FLT3, RET 등 여러 티로신 키나제를 억제하는 다중표적 TKI로, 이마티닙 내성 환자에서 새로운 치료 기전을 제공한다. 임상시험에서 무진행 생존기간(PFS)을 1.5개월에서 6.3개월로 유의하게 연장시키고 전체 생존율도 개선한 바 있다. 다만 피부 색소 변화 및 피로감 등 부작용이 흔하며, 돌연변이 이질성에 따라 반응 정도가 다르게 나타날 수 있다. 레고라페닙(Regorafenib, StivargaⓇ)은 2013년 이마티닙과 수니티닙 모두 실패한 환자를 위한 3차 치료제로 FDA 승인을 받았다. 경구 다중표적 TKI로서 KIT뿐 아니라 VEGFR-2, TIE2, PDGFRβ, FGFR, RET, RAF 계열 등을 억제한다. 이로써 종양 성장에 관여하는 여러 신호전달 축을 동시에 차단할 수 있으며, 대표적인 이상반응으로 손발 피부 반응과 고혈압이 보고된다. 임상 2상에서 진행성 GIST 환자에서 중앙 PFS 10개월, 부분 반응률 12%, 안정병변 비율 66.7%를 보이며 3차 치료제로서 임상적 유효성이 입증되었다. GIST에서 KIT 또는 PDGFRA 활성화는 MAPK, PI3K–AKT, STAT3 등 다양한 하위 신호전달 경로를 자극하여 종양의 성장과 생존을 촉진한다. 이마티닙, 수니티닙, 레고라페닙은 모두 ATP 결합 부위(ATP pocket)에 경쟁적으로 결합함으로써 이러한 키나제 활성을 억제하고, 종양 진행 억제 및 생존 연장에 기여한다. 반면, PDGFRA exon 18 변이를 표적으로 하는 아바라티닙(Avapritinib, AyvakitⓇ)이나 다양한 KIT/PDGFRA 내성 돌연변이를 억제하는 리프리티닙(Ripretinib, QinlockⓇ)과 같은 신약들은 이미 해외에서 1차 또는 4차 치료제로 확립된 바 있음에도 불구하고 2025년 11월 현재 국내 GIST 적응증으로는 아직 허가·급여가 이뤄지지 않아 실제 임상 현장에서의 사용은 제한적이다. 리프레티닙은 어떤 약제인가? 리프레티닙(Ripretinib)은 이마티닙을 포함한 세 가지 이상의 티로신 키나제 억제제(TKI) 치료를 받은 성인 진행성 GIST 환자를 대상으로 2020년 5월 미국 FDA 승인을 받은 약제이다. 이 약제는 키나제의 스위치 포켓(switch pocket)과 활성화 루프(activation loop)를 동시에 조절하도록 설계된 새로운 type II switch-control kinase inhibitor로, 기존 type II 억제제의 기전을 확장한 이중 조절 구조가 특징이다. 리프레티닙은 스위치 포켓에 결합해 활성화 루프의 접근을 차단함으로써 키나제가 활성형으로 전환되는 과정을 억제한다. 이러한 기전은 단순히 ATP 결합 부위를 차단하는 수준을 넘어 활성화 스위치를 직접 잠그는 방식으로, 다양한 하위 신호전달 경로를 효과적으로 억제한다. 더불어 활성화 루프 기반의 2차 내성 돌연변이를 포함해, 기존 type I 억제제로는 표적하기 어려웠던 광범위한 KIT/PDGFRA 돌연변이를 포괄적으로 억제하도록 설계되었다. 한편 KIT exon 11 또는 PDGFRA exon 18과 같이 키나제 구조 안정성 자체를 변화시키는 특정 변이는 억제제 타입에 따라 임상 반응성이 달라질 수 있어, 치료 전략 수립 시 중요한 고려 요소가 된다. 리프레티닙은 전임상 단계에서 GIST 및 비만세포증 모델에서 세포 증식 억제 및 세포사멸 유도를 통해 강력한 항종양 활성을 확인하였다. 또한 초기 TKI와 비교했을 때 야생형뿐 아니라 다양한 KIT 및 PDGFRA 돌연변이에 대해 훨씬 넓은 억제 스펙트럼을 보였으며, 특히 기존 약제에 고도의 내성을 나타내는 PDGFRA exon 18 D842V 변이에서도 우수한 억제 활성이 입증되었다. 현재 전이성 또는 절제 불가능한 위장관기질종양(GIST)에 대한 국내 급여 기준은 어떠한가? GIST의 국내 치료 환경은 분자표적치료제의 도입과 건강보험 제도의 정비를 통해 점차 체계화되어 왔다. 현재 KIT(CD117) 양성이 확인된 전이성 또는 절제불가능 GIST에 대해 이마티닙이 1차 표준 치료제로 인정되고 있으며, 이는 국제 임상근거가 국내 제도에 반영된 결과이다. 수술 후 보조요법(adjuvant) 영역에서도 고위험군(high-risk) GIST 환자를 대상으로 최대 3년간 이마티닙에 대해 보험급여가 적용된다. 이는 재발 위험 감소 효과에 대한 글로벌 근거를 국내 정책에 성공적으로 도입한 사례로 평가된다. 1차 치료 실패 이후의 약제 선택에서도 비교적 명확한 단계적(stepwise) 급여 구조가 확립되어 있다. 즉, 이마티닙에 저항성 또는 불내약성이 발생한 경우 수니티닙을 2차 치료제로 적용하며, 두 약제 모두 실패 시 레고라페닙을 3차 치료제로 급여 인정한다. 이처럼 국내 치료 알고리듬은 국제 가이드라인(NCCN, ESMO)과 대체로 일치하나, 비용-효과성 평가와 위험분담제(RSA) 도입 등을 통해 건강보험 재정의 지속가능성과 환자의 약제 접근성 간 균형을 도모했다는 점에서 국내 제도 상황이 반영된 결과라고 할 수 있다. 따라서 현재 국내 GIST 보험체계는 이마티닙–수니티닙–레고라페닙으로 이어지는 3단계 TKI 기반 치료를 표준 패스웨이로 운영하고 있으며, 그 외 리프레티닙 등 신약들은 향후 허가 및 급여 여부에 따라 제한적으로 활용될 가능성이 있다. 전이성 또는 절제 불가능한 위장관기질종양(GIST) 4차 치료제로서 리프레티닙의 임상적 의미는? GIST는 KIT 또는 PDGFRA 활성화 돌연변이에 의해 발생하는 대표적 분자 표적 종양으로, 이마티닙을 시작으로 수니티닙과 레고라페닙에 이르는 연속적인 티로신 키나제 억제제(TKI)가 표준 치료로 확립되어 왔다. 그럼에도 불구하고 대부분의 환자에서 시간이 경과함에 따라 1차 또는 2차 치료제에 대한 내성 돌연변이가 축적되어, 결국 치료 옵션이 고갈되는 문제가 지속되고 있다. 특히 KIT 엑손 13·14 및 17·18을 포함한 다양한 2차 내성 돌연변이는 기존 TKI로 충분히 억제되지 않는 경우가 많으며, 후기선 치료에서 약물학적 개입의 한계가 분명하게 드러나는 영역이었다. 이러한 상황에서 리프레티닙은 키나제의 스위치 포켓과 활성화 루프를 동시에 제어하는 ‘스위치 컨트롤(switch-control)’ 이중 기전을 기반으로 개발된 새로운 type II형 TKI로, 기존 약제가 제한적으로 억제하던 광범위한 KIT 및 PDGFRA 내성 돌연변이를 포괄적으로 억제하도록 설계되었다. 이 약제의 구조적 특성은 활성화 루프 기반 돌연변이를 포함한 다양한 내성 변이를 안정적으로 차단할 수 있는 분자적 기반을 제공하며, 특히 기존 약제에 고도의 내성을 보이는 PDGFRA 엑손 18 D842V 변이에서도 우수한 억제 활성을 보인다는 점에서 임상적 의미가 크다. 이러한 기전적 우월성은 INVICTUS 임상시험에서 임상적으로 확인되었으며, 다수의 치료 실패를 경험한 환자군에서도 리프레티닙이 유의한 무진행 생존기간(PFS) 연장과 종양 성장 억제를 입증함으로써, 후기선(late-line) GIST 치료의 새로운 표준으로 자리매김이 가능하다. 리프레티닙(QinlockⓇ)의 허가임상은 어떠한가? QINLOCK의 효능은 INVICTUS 연구에서 평가되었다. INVICTUS는 국제적, 다기관, 무작위배정(2:1), 이중눈가림, 위약대조 임상시험(NCT03353753)이다. 대상 환자는 절제가 불가능한 국소 진행성 또는 전이성 GIST을 가지고 있으며, 이전에 이미티닙, 수니티닙, 레고라페닙 치료를 받은 환자들이었다. 무작위 배정은 이전 치료 횟수(3회 vs 4회 이상)와 ECOG 수행능력 점수(0 vs 1 또는 2)에 따라 층화되었다. 환자들은 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 QINLOCK 150mg 또는 위약을 1일 1회 경구 투여받았다. 종양 반응 평가는 초기 4개월 동안은 28일마다, 그 이후에는 56일마다 시행되었다. 주요 효능 평가 변수는 수정된 RECIST 1.1 기준에 따른 맹검 독립 중앙판독(BICR)의 질병 평가를 기반으로 한 무진행 생존기간(PFS)이었다. 수정된 RECIST 1.1에서는 림프절과 골 병변을 목표병변에서 제외하며, 기존 종양 내에서 새롭게 발생하는 종양 결절이 ‘명확한 진행 증거’로 간주되기 위해서는 특정 요건을 충족해야 한다. 추가 효능 평가 변수로는 BICR에 의한 객관적 반응률(ORR)과 전체 생존기간(OS)이 포함되었다. 위약군으로 배정된 환자는 질병 진행 시 QINLOCK 치료로 전환이 가능했다. 총 129명의 환자가 무작위 배정되었으며, 85명은 QINLOCK군, 44명은 위약군에 배정되었다. INVICTUS의 전체 분석(ITT) 집단의 환자 특성은 중앙 연령 60세(범위 29~83세)였고, 이 중 39%는 65세 이상이었다. 남성 비율은 57%였으며, 75%는 백인이었고, 92%는 ECOG 수행능력 점수가 0 또는 1이었다. 이전 치료 횟수는 3회가 63%, 4회 이상이 37%였다. 위약군으로 무작위 배정된 환자의 66%는 질병 진행 후 QINLOCK으로 교차투여되었다. INVICTUS 연구의 효능 결과는 Table 6에 요약되어 있다. 리프레티닙의 향후 쟁점은 무엇인가? 리프레티닙은 기존 표적치료제에 모두 실패한 후기선(late-line) 위장관기질종양(GIST) 환자에게 새로운 치료적 돌파구를 제시한 약제로, 다양한 KIT 및 PDGFRA 활성화 돌연변이를 기반으로 한 GIST의 악성 생물학적 특성을 고려할 때 그 의의가 크다. 진행성 GIST는 이마티닙, 수니티닙, 레고라페닙으로 이어지는 표준 치료에도 불구하고 시간이 경과함에 따라 다수의 2차 내성 돌연변이가 축적되어 약물 감수성을 잃는 경우가 흔하며, 이에 따라 치료 선택지가 급격히 협소해지는 문제가 지속되어 왔다. 이러한 상황에서 스위치 포켓과 활성화 루프를 동시에 제어하는 이중 기전의 type II switch-control TKI로 설계된 리프레티닙은 기존 약제로는 충분히 억제되지 않던 활성화 루프 기반 내성 돌연변이를 포함해 KIT와 PDGFRA 돌연변이의 광범위한 스펙트럼을 효과적으로 차단하도록 고안되었다. 이를 통해 후기선 치료 영역에서 근거 기반의 생존 혜택을 제공한 최초의 약제로 평가된다. INVICTUS 연구에서 리프레티닙은 종양 크기 축소보다는 질병 진행 억제에 초점을 둔 임상 이득을 보여 위약 대비 무진행생존기간(PFS)을 유의하게 연장하였고, 독성 프로파일 또한 기존 다중표적 TKI 대비 관리가 용이해 다수의 치료 실패를 경험한 환자군에서 임상적 실용성이 높다. 그럼에도 리프레티닙의 임상적 한계는 여전히 존재한다. 객관적 반응률(ORR)은 낮고 효과의 중심이 종양 축소보다는 질병 안정화에 있으며, 반응의 지속 기간 또한 제한적이어서 결국 대부분의 환자에서 새로운 내성이 발생한다. 또한 PDGFRA D842V 변이와 같은 고도 내성 아형에서는 전임상에서의 억제 가능성과 달리 실제 임상에서는 아바프리티닙 대비 효능이 제한적이다. 더불어 INVICTUS 시험은 다수의 치료에 실패한 고도로 선택된 환자군을 대상으로 한 위약 대조 연구로 표본 규모가 작아, 엑손별·클론별 내성 패턴에 대한 정밀 분석 및 실제 임상 현실의 다양성을 충분히 반영하기에는 한계가 있었다. 이러한 점들은 향후 연구 방향을 제시한다. 즉, 리프레티닙 내성의 구조적·분자적 기전을 규명하고, 초기선 또는 중간선 치료로의 확장 가능성을 평가하며, 병용 전략이나 돌연변이 기반 개인맞춤 치료 시퀀스 확립을 위한 연구가 필요하다. 리프레티닙은 4차 치료에서 의미 있는 생존 혜택을 입증한 중요한 선택지이지만, 내성 극복 및 정밀한 치료 전략의 확립이라는 과제가 남아 있다. 이러한 개선 과정은 향후 GIST 치료 패러다임의 확장과 진화를 이끌 중요한 전환점이 될 것으로 기대된다. 결국 리프레티닙은 기존 약제의 내성 장벽을 넘어 약제 선택지가 소진된 환자에게 새로운 생존 기회를 제공함으로써, GIST TKI 치료의 연속성과 확장성을 재정립한 약제로 평가된다. 참고문헌 1. HAIXIANG DING1 “Clinical significance of the molecular heterogeneity of gastrointestinal stromal tumors and related research: A systematic review” ONCOLOGY REPORTS 43: 751-764, 2020 2. Ramon Martinez III “Avoiding or Co-Opting ATP Inhibition: Overview of Type III, IV, V, and VI Kinase Inhibitors” Next Generation Kinase Inhibitors, First Online: 15 July 2020 pp 29–59. 3. Ke Li1 “Genetic progression in gastrointestinal stromal tumors: mechanisms and molecular interventions” Oncotarget, 2017, Vol. 8, (No. 36), pp: 60589-60604. 4. Sebastian Baue “Early and Next-Generation KIT/PDGFRA Kinase Inhibitors and the Future of Treatment for Advanced Gastrointestinal Stromal Tumor” Front. Oncol. 11:672500. 5. Vaibhav Kumar “FDA Approval Summary: Ripretinib for advanced gastrointestinal stromal tumor (GIST)” Clin Cancer Res. 2023 June 01; 29(11): 2020–2024. 6. Koji Umezawa “Druggable Transient Pockets in Protein Kinases” Molecules 2021, 26, 651. 7. Hiba Mechahougui “Precision Oncology in Gastrointestinal Stromal Tumors” Curr. Oncol. 2023, 30(5), 4648-4662. 8. 기타 인터넷 자료(보도 자료, 제품 설명서 등2025-12-05 06:00:55최병철 박사
전이성·절제 불가능성 GIST, 광범위 억제제 '리프레티닙'Qinlock(킨록, 성분명: ripretinib, ONO Pharma)은 광범위 KIT/PDGFRA 억제제다. 2020년 미국 FDA와 2021년 EMA에서 최소 3종의 TKI 치료 후에도 질환이 진행한 성인 전이성 또는 절제 불가능한 위장관기질종양(Gastrointestinal Stromal Tumor, GIST)에 대한 4차 치료제로 승인됐다. 국내에서는 올해 7월 희귀의약품으로 지정됐다. 위장관기질종양(GIST)은 위장관 벽의 간질조직에서 발생하는 대표적인 연부조직 육종으로, 간질성 카할세포(interstitial cells of Cajal)의 발생학적·기능적 특징을 공유하는 전구세포에서 기원하는 것으로 알려져 있다. 분자생물학적 관점에서 대부분의 GIST는 KIT 또는 PDGFRA 유전자의 활성화 돌연변이를 보유하며, 이러한 변이는 주요 신호전달 경로를 지속적으로 활성화해 세포 증식, 생존, 침윤을 촉진함으로써 종양의 발병과 진행을 주도한다. 한편 GIST는 위장관 어느 부위에서도 발생할 수 있으며, 내시경으로 관찰되는 점막층이 아닌 그 아래의 점막하층이나 근육층에서 기원하기 때문에 조기 발견이 어렵다. 대부분은 양성으로 진단되지만 약 20~30%는 악성으로 진행할 수 있다. 증상은 종양이 커지거나 암세포가 점막하층 또는 근육층을 뚫고 점막을 침범할 때 시작되며, 복통이 발생하거나 경우에 따라 장폐색을 유발하기도 한다. 전이성 또는 절제 불가능한 GIST의 치료 패러다임은 표적치료제(tyrosine kinase inhibitor, TKI)의 등장 이후 근본적으로 변화하였다. 2001년 도입된 이마티닙(Imatinib)은 기존 세포독성 화학요법에 반응하지 않던 GIST 환자의 생존 기간을 획기적으로 연장시키며 분자표적치료 시대를 열었다. 이후 수니티닙(Sunitinib), 레고라티닙(Regorafenib), 리프레티닙(Ripretinib) 등 다양한 TKI가 연속적으로 도입되면서 치료 순차 전략이 구체화되었으나, 획득 내성(acquired resistance)은 여전히 해결되지 않은 주요 임상적 과제로 남아 있다. 이에 따라 약제 순서의 최적화, 병용치료 전략, 새로운 분자 표적의 발굴 등에 대한 연구가 활발히 진행되고 있다. 킨록은 INVICTUS 임상 3상 연구를 통해 유효성을 입증하였다. 총 129명의 GIST 환자를 대상으로 한 해당 연구에서 리프레티닙 투여군의 무진행생존기간(PFS) 중앙값은 6.3개월로, 위약군의 1.0개월 대비 현저한 개선을 보였다. 또한 질병 진행 또는 사망 위험을 약 85% 감소시켜 통계적으로 유의한 치료 효과를 확인하였다. 전이성 또는 절제 불가능한 위장관기질종양(Gastrointestinal stromal tumor, GIST)는 어떤 질환인가? 위장관기질종양(GIST)은 소화관 벽에 위치한 특수 신경세포인 카할 간질세포(interstitial cells of Cajal, ICC)에서 기원하는 드문 중간엽성 종양(mesenchymal tumor)이다. ICC는 자율신경계의 일부로 위장관 고유근층 내에서 조율 세포(pacemaker cell) 역할을 수행하며, 위장관 연동운동을 조절하는 기능을 담당한다. GIST의 발생 부위는 위가 약 60%, 소장이 약 30%로 가장 흔하며, 드물게 결장·직장·식도에서도 발생한다. 장간막이나 대망(greater omentum) 등 위장관 외부에서도 발생할 수 있으며, 이러한 경우는 장외(extra-gastrointestinal) GIST로 분류된다. GIST는 KIT(Kinase Insert Domain-containing Receptor Tyrosine Kinase) 또는 혈소판유래성장인자수용체 알파(Platelet-Derived Growth Factor Receptor Alpha, PDGFRA) 유전자의 활성화 돌연변이에 의해 발생하는 것으로 알려져 있다. 연간 발생률은 인구 백만 명당 약 10–15건으로 추정되며, 주로 50~70대에서 진단된다. KIT(CD117) 또는 PDGFRA 돌연변이는 전체 산발성 GIST의 약 85%에서 관찰되며, 티로신 키나제 수용체의 구성적 활성화를 통해 과형성과 종양 발생을 유도한다. 대부분은 후천적(somatic) 변이지만, 드물게 이러한 돌연변이가 유전되어 가족성 GIST를 일으킬 수 있다. 한편 이러한 주요 변이를 보유하지 않는 야생형(wild-type) GIST는 NF1, BRAF, HRAS 등 다양한 분자 변이를 포함하는 이질적 집단이며, 신경섬유종증 1형, Carney triad, Carney-Stratakis syndrome 등 특정 종양 증후군과 연관되기도 한다. 조직병리학적으로 GIST는 방추형, 상피양 또는 혼합형 세포 형태를 보이며, 면역조직화학적으로 KIT(CD117)와 DOG1(Discovered On GIST-1) 양성이 특징적이다. 임상 증상은 비특이적이며, 모호한 복부 불편감, 위장관 출혈, 조기 포만감, 혹은 촉지 가능한 종괴 등으로 다양하게 나타날 수 있다. 진단에는 조영 CT 또는 MRI, 내시경 초음파를 통한 조직 채취, 그리고 분자 진단을 위한 유전자 돌연변이 분석이 포함된다. 치료 결정 시 종양의 크기, 해부학적 위치, 유사분열지수, 분자 변이 등이 종합적으로 고려된다. 국소 질환에서는 음성 절제연(R0 resection)을 확보한 수술적 절제가 기본 치료이며, 방사선 치료는 역할이 제한적이지만 일부 진행성 질환에서 증상 완화 목적으로 사용될 수 있다. 임상적으로 GIST는 초기 단계에서 외과적 절제를 통해 완치를 기대할 수 있으나, 종양의 위치·크기·주변 장기 침윤 여부에 따라 완전 절제(R0)가 불가능한 경우가 적지 않다. 또한 진단 시 이미 간 또는 복막 전이가 동반된 사례가 흔하며, 이러한 전이성 또는 절제 불가능한 GIST는 더 이상 수술 중심의 국소치료로는 관리가 어렵고, 장기적인 전신 치료를 필요로 하는 만성적·재발성 종양의 특성을 보인다. 실제로 수술이 가능하더라도 광범위 절제가 필요하거나 주요 장기 기능 손상의 위험이 높아 근치적 수술의 이점이 기대되기 어려운 경우 ‘절제 불가능(unresectable)’ 범주로 분류되며, 이는 전이성 GIST와 동일한 치료 전략을 적용해야 하는 임상적 상황으로 간주된다. 이와 같은 배경에서 티로신 키나제 억제제(TKI)의 도입은 GIST 전신 치료의 패러다임을 근본적으로 변화시켰다. 이마티닙(Imatinib)은 진행성·절제 불가능·전이성 GIST의 1차 치료제로 사용되며, 환자의 생존율을 의미 있게 향상시켰다. KIT(CD117) 또는 PDGFRA 돌연변이란 무엇인가? KIT(CD117) 또는 PDGFRA 돌연변이는 위장관 기질 종양(GIST)의 발생을 유도하는 핵심 분자 이상으로, 두 유전자가 암호화하는 수용체 티로신 키나제(receptor tyrosine kinase, RTK)에 구성적 활성화(activating mutation)를 일으키는 병적 변화이다. KIT 돌연변이는 전체 GIST의 약 70–80%, PDGFRA 돌연변이는 약 10–15%에서 발견되며, 이 두 유전자의 활성화 돌연변이가 전체 GIST의 약 85–90%를 차지하는 대표적 분자 병인으로 알려져 있다. 특히 KIT 엑손 11, PDGFRA 엑손 18(D842V 등)의 특정 변이는 단백질 구조적 안정성과 자가활성화 억제 기전을 교란하여 종양 발생을 직접적으로 촉진한다. 동시에 이러한 변이들은 이마티닙을 포함한 여러 티로신 키나제 억제제(tyrosine kinase inhibitor,TKI)에 대한 약물 반응성을 결정하는 중요한 예측 인자로 기능한다. 정상 상태에서 KIT과 PDGFRA는 성장인자 자극에 의해 제한적으로 활성화되며, 세포의 생존·증식·분화·이동을 정교하게 조절하는 신호전달 체계의 중심적 역할을 수행한다. 그러나 활성화 돌연변이가 발생하면 리간드 결합과 무관하게 수용체가 지속적으로 활성화되어, RAS–RAF–MAPK, PI3K–AKT, STAT 등 하위 신호 경로를 과도하게 자극함으로써 비조절적 세포 증식과 항아폽토시스 신호가 강화되고, 결국 종양 형성이 촉진된다. 또한 KIT 엑손 9, 11, 13·14, 17·18 및 PDGFRA 엑손 18 돌연변이 등은 단백질의 활성화 루프와 구조적 균형을 변화시켜 수용체가 비활성 상태로 유지되지 못하고 지속적으로 ‘on’ 상태를 유지하게 만드는 중요한 분자적 기전을 제공한다. 이처럼 KIT 또는 PDGFRA 돌연변이는 GIST 발생을 유도하는 근본 병인일 뿐 아니라, 돌연변이의 위치와 종류에 따라 약물 감수성과 내성 패턴이 뚜렷하게 달라지므로 임상적 치료 전략 전반을 좌우한다. 실제로 이마티닙을 비롯한 TKI의 반응성은 돌연변이 유형에 따라 큰 차이를 보이며, 일부 변이는 매우 좋은 초기 반응을 보이지만, 다른 변이는 고도의 내성을 나타낸다. 티로신키나제 억제제(Tyrosine kinase inhibitor, TKI)의 작동 원리는? 티로신 키나제는 세포 외부의 신호를 세포 내부로 전달하는 핵심 효소로, 활성화 여부에 따라 다양한 성장·분화 경로가 조절된다. 이 효소는 두 개의 판이 맞물린 형태를 이루는 상·하부 로브(N-lobe, C-lobe)를 기본 골격으로 하며, 두 로브 사이의 좁은 틈은 ATP가 결합하는 중심 자리를 형성한다. ATP가 이 틈에 정확히 결합하면 인산전달 반응이 활성화되고, 이러한 구조적 배치가 유지될 때 정상적인 신호전달이 지속된다. 티로신 키나제의 활성 상태는 두 가지 주요 구조 스위치에 의해 정의된다. 첫 번째는 DFG(Aspartate–Phenylalanine–Glycine)라 불리는 스위치로, 이 잔기가 안쪽을 향하면 활성형(DFG-in), 바깥으로 뒤집히면 비활성형(DFG-out)을 형성한다. 두 번째는 αC-helix로, 이 구조가 안쪽으로 향하면 활성 배치를, 바깥으로 이동하면 비활성 배치를 이룬다. 두 스위치는 독립적으로 움직이지만, 어느 하나라도 비활성 방향으로 전환되면 전체 효소는 효과적으로 ‘잠긴’ 형태가 된다. ATP 결합 틈은 전면부와 후면부로 나눌 수 있다. 앞쪽 공간은 ATP가 결합하는 전통적인 자리로, 대부분의 억제제가 공유하는 결합 부위이다. 반면 뒤쪽 공간(back pocket)은 DFG가 바깥으로 뒤집힌 비활성 상태에서만 열리는 특수한 포켓으로, 억제제의 결합 방식 차이를 결정하는 중요한 구조적 요소이다. Type I 억제제는 활성형(DFG-in)의 ATP 앞자리만을 점유해 ATP 접근을 차단한다. 엘로티닙(Erlotinib), 게페티닙(Gefitinib), 크리조티닙(Crizotinib), 라파티닙(Lapatinib) 등이 대표적이며, 활성 상태의 키나제에 결합하기 때문에 활성형 구조에 크게 의존한다. Type II 억제제는 ATP 앞자리뿐 아니라 DFG-out 상태에서 형성되는 뒤쪽 공간까지 함께 점유한다. 이러한 결합 방식은 비활성형을 안정적으로 고정시키며, 상대적으로 길고 굴곡진 분자 구조를 가진다. 이마티닙(Imatinib), 수니티닙(Sunitinib), 레고라티닙(Regorafenib), 리프레티닙(Ripretinib) 등이 대표적이다. 이 중 Ripretinib은 Type II 기전을 확장한 switch-control 억제제로, back pocket뿐 아니라 DFG 모티프와 αC-helix까지 동시에 고정한다. 이 기전은 ATP 경쟁 억제 수준을 넘어 키나제의 활성화 스위치 자체를 잠그는 방식으로, 다양한 돌연변이에 대해 보다 일관된 억제 효과를 보인다. 이처럼 티로신 키나제 억제제는 ATP 결합 틈의 어느 부분을, 어떤 구조 상태에서 차단하는지에 따라 Type I, Type II, switch-control 계열로 구분된다. 이러한 구조-기전적 이해는 돌연변이에 의해 발생하는 내성 패턴을 설명하며, 새로운 약물 설계의 근거가 된다. 최근에는 ATP-pocket 자체와 경쟁하지 않는 알로스테릭 기반 억제제가 개발되면서 억제제 분류는 더욱 확장되고 있다. Type III 억제제는 ATP-pocket 인접의 알로스테릭(allosteric) 포켓에 결합해 ATP와 비경쟁적으로 작용하며, 트라메티닙(Trametinib)과 코비멭닙(Cobimetinib)이 대표적이다. Type IV 억제제는 ATP 결합부와 물리적으로 떨어진 원거리 알로스테릭 포켓에 결합하며, BCR-ABL의 myristoyl 포켓을 표적하는 아시미닙(Asciminib)이 대표적이다. 이러한 원거리 결합 방식은 ATP-pocket 돌연변이에 거의 영향을 받지 않아 높은 선택성을 확보한다. Type V 억제제는 두 개 이상의 독립된 결합 부위를 동시에 점유하는 bivalent inhibitor로, ATP-pocket과 별도의 알로스테릭 포켓을 동시에 결합해 구조를 강하게 고정한다. 주로 RAF나 CDK 계열을 중심으로 전임상 연구가 진행되고 있다. 마지막으로 Type VI 억제제는 특정 아미노산(주로 Cys)에 공유 결합을 형성하는 비가역 억제제로, 오시메티닙(Osimertinib), 아파티닙(Afatinib), 이부루티닙(Ibrutinib) 등이 대표적이다. 비가역적 특성으로 인해 강력한 결합 안정성과 돌연변이 선택성을 확보할 수 있으며, 기존 competitive TKI의 내성 문제를 보완하는 중요한 전략으로 자리잡았다. 결국 Type I에서 Type VI에 이르는 분류는 티로신 키나제가 갖는 구조적 유연성과 활성 조절 메커니즘을 다양한 수준에서 겨냥하는 전략적 도구이다. ATP-pocket의 활성·비활성 상태를 이용하는 고전적 억제제부터 구조 스위치를 직접 제어하는 switch-control 계열, 그리고 알로스테릭·이중 결합·공유 결합 방식의 차세대 억제제까지 설계 전략이 확장되면서, 내성 극복과 선택성 향상 측면 모두에서 의미 있는 진전이 이루어지고 있다. 특히 KIT과 PDGFRA가 종양의 성장에 직접 관여하는 GIST와 같은 질환에서는 이러한 구조적 통찰이 치료 기전 이해뿐 아니라 전략적 약물 선택과 신약 개발의 핵심 기반이 된다. KIT/PDGFRA 억제제에는 어떤 약제가 있는가? KIT와 PDGFRA의 돌연변이는 GIST의 발생과 진행에 핵심적인 역할을 하며, 이러한 분자 기전을 표적으로 한 티로신 키나제 억제제(TKI)의 도입은 지난 20여 년간 GIST 치료 패러다임을 혁신적으로 변화시켰다. 현재까지 1차부터 3차까지의 표준 치료 전략이 확립되어 있다. 가장 먼저 승인된 이마티닙(Imatinib, GleevecⓇ)은 2002년 미국 FDA에서 전이성 또는 절제불가능 GIST의 1차 치료제로 허가되었다. 원래 BCR-ABL 융합유전자를 표적으로 개발된 만성 골수성 백혈병 치료제로, KIT, PDGFRA, ABL 등 여러 키나제의 ATP 결합 부위를 경쟁적으로 억제한다. 이러한 기전을 바탕으로 전체 GIST 환자의 약 80%에서 우수한 초기 반응을, 약 85%에서 질병 조절 효과를 나타낸다. 특히 KIT 엑손 11 변이에서 반응률이 가장 높으나, KIT 엑손 9 변이나 무변이(wild-type) 환자에서는 효과가 다소 감소한다. 반면 PDGFRA D842V 변이는 이마티닙에 대한 고도 내성을 보이므로, 치료 전략 수립 시 KIT/PDGFRA 유전자 분석은 필수적이다. 이마티닙은 탁월한 초기 효과에도 불구하고, 장기 치료 과정에서 KIT에 다양한 2차 돌연변이가 축적되면서 내성이 발생할 수 있다. 이에 따라 이마티닙 실패 후 사용할 2차 치료제로 수니티닙(Sunitinib, SutentⓇ)이 2006년 미국 FDA의 승인을 받았다. 수니티닙은 KIT과 PDGFRA 외에도 VEGFR-1/2, FLT3, RET 등 여러 티로신 키나제를 억제하는 다중표적 TKI로, 이마티닙 내성 환자에서 새로운 치료 기전을 제공한다. 임상시험에서 무진행 생존기간(PFS)을 1.5개월에서 6.3개월로 유의하게 연장시키고 전체 생존율도 개선한 바 있다. 다만 피부 색소 변화 및 피로감 등 부작용이 흔하며, 돌연변이 이질성에 따라 반응 정도가 다르게 나타날 수 있다. 레고라페닙(Regorafenib, StivargaⓇ)은 2013년 이마티닙과 수니티닙 모두 실패한 환자를 위한 3차 치료제로 FDA 승인을 받았다. 경구 다중표적 TKI로서 KIT뿐 아니라 VEGFR-2, TIE2, PDGFRβ, FGFR, RET, RAF 계열 등을 억제한다. 이로써 종양 성장에 관여하는 여러 신호전달 축을 동시에 차단할 수 있으며, 대표적인 이상반응으로 손발 피부 반응과 고혈압이 보고된다. 임상 2상에서 진행성 GIST 환자에서 중앙 PFS 10개월, 부분 반응률 12%, 안정병변 비율 66.7%를 보이며 3차 치료제로서 임상적 유효성이 입증되었다. GIST에서 KIT 또는 PDGFRA 활성화는 MAPK, PI3K–AKT, STAT3 등 다양한 하위 신호전달 경로를 자극하여 종양의 성장과 생존을 촉진한다. 이마티닙, 수니티닙, 레고라페닙은 모두 ATP 결합 부위(ATP pocket)에 경쟁적으로 결합함으로써 이러한 키나제 활성을 억제하고, 종양 진행 억제 및 생존 연장에 기여한다. 반면, PDGFRA exon 18 변이를 표적으로 하는 아바라티닙(Avapritinib, AyvakitⓇ)이나 다양한 KIT/PDGFRA 내성 돌연변이를 억제하는 리프리티닙(Ripretinib, QinlockⓇ)과 같은 신약들은 이미 해외에서 1차 또는 4차 치료제로 확립된 바 있음에도 불구하고 2025년 11월 현재 국내 GIST 적응증으로는 아직 허가·급여가 이뤄지지 않아 실제 임상 현장에서의 사용은 제한적이다. 리프레티닙은 어떤 약제인가? 리프레티닙(Ripretinib)은 이마티닙을 포함한 세 가지 이상의 티로신 키나제 억제제(TKI) 치료를 받은 성인 진행성 GIST 환자를 대상으로 2020년 5월 미국 FDA 승인을 받은 약제이다. 이 약제는 키나제의 스위치 포켓(switch pocket)과 활성화 루프(activation loop)를 동시에 조절하도록 설계된 새로운 type II switch-control kinase inhibitor로, 기존 type II 억제제의 기전을 확장한 이중 조절 구조가 특징이다. 리프레티닙은 스위치 포켓에 결합해 활성화 루프의 접근을 차단함으로써 키나제가 활성형으로 전환되는 과정을 억제한다. 이러한 기전은 단순히 ATP 결합 부위를 차단하는 수준을 넘어 활성화 스위치를 직접 잠그는 방식으로, 다양한 하위 신호전달 경로를 효과적으로 억제한다. 더불어 활성화 루프 기반의 2차 내성 돌연변이를 포함해, 기존 type I 억제제로는 표적하기 어려웠던 광범위한 KIT/PDGFRA 돌연변이를 포괄적으로 억제하도록 설계되었다. 한편 KIT exon 11 또는 PDGFRA exon 18과 같이 키나제 구조 안정성 자체를 변화시키는 특정 변이는 억제제 타입에 따라 임상 반응성이 달라질 수 있어, 치료 전략 수립 시 중요한 고려 요소가 된다. 리프레티닙은 전임상 단계에서 GIST 및 비만세포증 모델에서 세포 증식 억제 및 세포사멸 유도를 통해 강력한 항종양 활성을 확인하였다. 또한 초기 TKI와 비교했을 때 야생형뿐 아니라 다양한 KIT 및 PDGFRA 돌연변이에 대해 훨씬 넓은 억제 스펙트럼을 보였으며, 특히 기존 약제에 고도의 내성을 나타내는 PDGFRA exon 18 D842V 변이에서도 우수한 억제 활성이 입증되었다. 현재 전이성 또는 절제 불가능한 위장관기질종양(GIST)에 대한 국내 급여 기준은 어떠한가? GIST의 국내 치료 환경은 분자표적치료제의 도입과 건강보험 제도의 정비를 통해 점차 체계화되어 왔다. 현재 KIT(CD117) 양성이 확인된 전이성 또는 절제불가능 GIST에 대해 이마티닙이 1차 표준 치료제로 인정되고 있으며, 이는 국제 임상근거가 국내 제도에 반영된 결과이다. 수술 후 보조요법(adjuvant) 영역에서도 고위험군(high-risk) GIST 환자를 대상으로 최대 3년간 이마티닙에 대해 보험급여가 적용된다. 이는 재발 위험 감소 효과에 대한 글로벌 근거를 국내 정책에 성공적으로 도입한 사례로 평가된다. 1차 치료 실패 이후의 약제 선택에서도 비교적 명확한 단계적(stepwise) 급여 구조가 확립되어 있다. 즉, 이마티닙에 저항성 또는 불내약성이 발생한 경우 수니티닙을 2차 치료제로 적용하며, 두 약제 모두 실패 시 레고라페닙을 3차 치료제로 급여 인정한다. 이처럼 국내 치료 알고리듬은 국제 가이드라인(NCCN, ESMO)과 대체로 일치하나, 비용-효과성 평가와 위험분담제(RSA) 도입 등을 통해 건강보험 재정의 지속가능성과 환자의 약제 접근성 간 균형을 도모했다는 점에서 국내 제도 상황이 반영된 결과라고 할 수 있다. 따라서 현재 국내 GIST 보험체계는 이마티닙–수니티닙–레고라페닙으로 이어지는 3단계 TKI 기반 치료를 표준 패스웨이로 운영하고 있으며, 그 외 리프레티닙 등 신약들은 향후 허가 및 급여 여부에 따라 제한적으로 활용될 가능성이 있다. 전이성 또는 절제 불가능한 위장관기질종양(GIST) 4차 치료제로서 리프레티닙의 임상적 의미는? GIST는 KIT 또는 PDGFRA 활성화 돌연변이에 의해 발생하는 대표적 분자 표적 종양으로, 이마티닙을 시작으로 수니티닙과 레고라페닙에 이르는 연속적인 티로신 키나제 억제제(TKI)가 표준 치료로 확립되어 왔다. 그럼에도 불구하고 대부분의 환자에서 시간이 경과함에 따라 1차 또는 2차 치료제에 대한 내성 돌연변이가 축적되어, 결국 치료 옵션이 고갈되는 문제가 지속되고 있다. 특히 KIT 엑손 13·14 및 17·18을 포함한 다양한 2차 내성 돌연변이는 기존 TKI로 충분히 억제되지 않는 경우가 많으며, 후기선 치료에서 약물학적 개입의 한계가 분명하게 드러나는 영역이었다. 이러한 상황에서 리프레티닙은 키나제의 스위치 포켓과 활성화 루프를 동시에 제어하는 ‘스위치 컨트롤(switch-control)’ 이중 기전을 기반으로 개발된 새로운 type II형 TKI로, 기존 약제가 제한적으로 억제하던 광범위한 KIT 및 PDGFRA 내성 돌연변이를 포괄적으로 억제하도록 설계되었다. 이 약제의 구조적 특성은 활성화 루프 기반 돌연변이를 포함한 다양한 내성 변이를 안정적으로 차단할 수 있는 분자적 기반을 제공하며, 특히 기존 약제에 고도의 내성을 보이는 PDGFRA 엑손 18 D842V 변이에서도 우수한 억제 활성을 보인다는 점에서 임상적 의미가 크다. 이러한 기전적 우월성은 INVICTUS 임상시험에서 임상적으로 확인되었으며, 다수의 치료 실패를 경험한 환자군에서도 리프레티닙이 유의한 무진행 생존기간(PFS) 연장과 종양 성장 억제를 입증함으로써, 후기선(late-line) GIST 치료의 새로운 표준으로 자리매김이 가능하다. 리프레티닙(QinlockⓇ)의 허가임상은 어떠한가? QINLOCK의 효능은 INVICTUS 연구에서 평가되었다. INVICTUS는 국제적, 다기관, 무작위배정(2:1), 이중눈가림, 위약대조 임상시험(NCT03353753)이다. 대상 환자는 절제가 불가능한 국소 진행성 또는 전이성 GIST을 가지고 있으며, 이전에 이미티닙, 수니티닙, 레고라페닙 치료를 받은 환자들이었다. 무작위 배정은 이전 치료 횟수(3회 vs 4회 이상)와 ECOG 수행능력 점수(0 vs 1 또는 2)에 따라 층화되었다. 환자들은 질병 진행 또는 용인할 수 없는 독성이 나타날 때까지 QINLOCK 150mg 또는 위약을 1일 1회 경구 투여받았다. 종양 반응 평가는 초기 4개월 동안은 28일마다, 그 이후에는 56일마다 시행되었다. 주요 효능 평가 변수는 수정된 RECIST 1.1 기준에 따른 맹검 독립 중앙판독(BICR)의 질병 평가를 기반으로 한 무진행 생존기간(PFS)이었다. 수정된 RECIST 1.1에서는 림프절과 골 병변을 목표병변에서 제외하며, 기존 종양 내에서 새롭게 발생하는 종양 결절이 ‘명확한 진행 증거’로 간주되기 위해서는 특정 요건을 충족해야 한다. 추가 효능 평가 변수로는 BICR에 의한 객관적 반응률(ORR)과 전체 생존기간(OS)이 포함되었다. 위약군으로 배정된 환자는 질병 진행 시 QINLOCK 치료로 전환이 가능했다. 총 129명의 환자가 무작위 배정되었으며, 85명은 QINLOCK군, 44명은 위약군에 배정되었다. INVICTUS의 전체 분석(ITT) 집단의 환자 특성은 중앙 연령 60세(범위 29~83세)였고, 이 중 39%는 65세 이상이었다. 남성 비율은 57%였으며, 75%는 백인이었고, 92%는 ECOG 수행능력 점수가 0 또는 1이었다. 이전 치료 횟수는 3회가 63%, 4회 이상이 37%였다. 위약군으로 무작위 배정된 환자의 66%는 질병 진행 후 QINLOCK으로 교차투여되었다. INVICTUS 연구의 효능 결과는 Table 6에 요약되어 있다. 리프레티닙의 향후 쟁점은 무엇인가? 리프레티닙은 기존 표적치료제에 모두 실패한 후기선(late-line) 위장관기질종양(GIST) 환자에게 새로운 치료적 돌파구를 제시한 약제로, 다양한 KIT 및 PDGFRA 활성화 돌연변이를 기반으로 한 GIST의 악성 생물학적 특성을 고려할 때 그 의의가 크다. 진행성 GIST는 이마티닙, 수니티닙, 레고라페닙으로 이어지는 표준 치료에도 불구하고 시간이 경과함에 따라 다수의 2차 내성 돌연변이가 축적되어 약물 감수성을 잃는 경우가 흔하며, 이에 따라 치료 선택지가 급격히 협소해지는 문제가 지속되어 왔다. 이러한 상황에서 스위치 포켓과 활성화 루프를 동시에 제어하는 이중 기전의 type II switch-control TKI로 설계된 리프레티닙은 기존 약제로는 충분히 억제되지 않던 활성화 루프 기반 내성 돌연변이를 포함해 KIT와 PDGFRA 돌연변이의 광범위한 스펙트럼을 효과적으로 차단하도록 고안되었다. 이를 통해 후기선 치료 영역에서 근거 기반의 생존 혜택을 제공한 최초의 약제로 평가된다. INVICTUS 연구에서 리프레티닙은 종양 크기 축소보다는 질병 진행 억제에 초점을 둔 임상 이득을 보여 위약 대비 무진행생존기간(PFS)을 유의하게 연장하였고, 독성 프로파일 또한 기존 다중표적 TKI 대비 관리가 용이해 다수의 치료 실패를 경험한 환자군에서 임상적 실용성이 높다. 그럼에도 리프레티닙의 임상적 한계는 여전히 존재한다. 객관적 반응률(ORR)은 낮고 효과의 중심이 종양 축소보다는 질병 안정화에 있으며, 반응의 지속 기간 또한 제한적이어서 결국 대부분의 환자에서 새로운 내성이 발생한다. 또한 PDGFRA D842V 변이와 같은 고도 내성 아형에서는 전임상에서의 억제 가능성과 달리 실제 임상에서는 아바프리티닙 대비 효능이 제한적이다. 더불어 INVICTUS 시험은 다수의 치료에 실패한 고도로 선택된 환자군을 대상으로 한 위약 대조 연구로 표본 규모가 작아, 엑손별·클론별 내성 패턴에 대한 정밀 분석 및 실제 임상 현실의 다양성을 충분히 반영하기에는 한계가 있었다. 이러한 점들은 향후 연구 방향을 제시한다. 즉, 리프레티닙 내성의 구조적·분자적 기전을 규명하고, 초기선 또는 중간선 치료로의 확장 가능성을 평가하며, 병용 전략이나 돌연변이 기반 개인맞춤 치료 시퀀스 확립을 위한 연구가 필요하다. 리프레티닙은 4차 치료에서 의미 있는 생존 혜택을 입증한 중요한 선택지이지만, 내성 극복 및 정밀한 치료 전략의 확립이라는 과제가 남아 있다. 이러한 개선 과정은 향후 GIST 치료 패러다임의 확장과 진화를 이끌 중요한 전환점이 될 것으로 기대된다. 결국 리프레티닙은 기존 약제의 내성 장벽을 넘어 약제 선택지가 소진된 환자에게 새로운 생존 기회를 제공함으로써, GIST TKI 치료의 연속성과 확장성을 재정립한 약제로 평가된다. 참고문헌 1. HAIXIANG DING1 “Clinical significance of the molecular heterogeneity of gastrointestinal stromal tumors and related research: A systematic review” ONCOLOGY REPORTS 43: 751-764, 2020 2. Ramon Martinez III “Avoiding or Co-Opting ATP Inhibition: Overview of Type III, IV, V, and VI Kinase Inhibitors” Next Generation Kinase Inhibitors, First Online: 15 July 2020 pp 29–59. 3. Ke Li1 “Genetic progression in gastrointestinal stromal tumors: mechanisms and molecular interventions” Oncotarget, 2017, Vol. 8, (No. 36), pp: 60589-60604. 4. Sebastian Baue “Early and Next-Generation KIT/PDGFRA Kinase Inhibitors and the Future of Treatment for Advanced Gastrointestinal Stromal Tumor” Front. Oncol. 11:672500. 5. Vaibhav Kumar “FDA Approval Summary: Ripretinib for advanced gastrointestinal stromal tumor (GIST)” Clin Cancer Res. 2023 June 01; 29(11): 2020–2024. 6. Koji Umezawa “Druggable Transient Pockets in Protein Kinases” Molecules 2021, 26, 651. 7. Hiba Mechahougui “Precision Oncology in Gastrointestinal Stromal Tumors” Curr. Oncol. 2023, 30(5), 4648-4662. 8. 기타 인터넷 자료(보도 자료, 제품 설명서 등2025-12-05 06:00:55최병철 박사 -
 애엽·구형흡착탄 등 약평위서 조건부 급여유지 결정[데일리팜=정흥준 기자]스티렌 등 애엽 추출물 성분 위염치료제에 대한 조건부 급여유지 결정이 나왔다. 만성신부전 치료에 사용하는 구형흡착탄도 비용효과성 충족 시 급여 적정성을 인정받았다. 4일 건강보험심사평가원 약제급여평가위원회는 12차 회의에서 애엽추출물 등 급여재평가 5개 성분에 대한 이의신청 심의를 진행했다. 애엽추출물과 구형흡착탄은 급여적정성은 없으나, 비용효과성 충족 시 급여 적정성이 있다고 결론지었다. 오리지널약 스티렌으로 대표되는 애엽 성분 위염치료제들은 지난 8월 급여적정성 없음으로 퇴출 위기에 놓였으나 가까스로 급여를 지켜냈다. 지난 11월 제약사들은 심평원이 제시한 약가인하율을 확인하고, 수용하는 제약사들은 자진 약가인하 신청을 한 바 있다. 이달 말 건정심을 거쳐 약가조정이 이뤄질 예정이다. 또 약평위는 급여재평가 이의신청에 따라 간질환 치료제 L-아스파르트산-L-오르니틴, 위십이지장염 치료제인 설글리코타이드, 콜레스테롤담석증에 쓰는 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염 등에 대한 심의도 진행했다. L-아스파르트산-L-오르니틴은 경구용의 경우 간성뇌증에 한해 급여적정성을 인정받았다. 주사제는 급여적정성이 없지만 식약처 임상재평가 중으로 조건부 평가 유예한다. 설글리코타이드는 임상적 유용성이 불분명하고 비용효과적이지 않다는 결론이다. 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염은 임상적 유용성 근거가 없다고 판단했다. 하지만 두 성분 모두 식약처 임상재평가 중으로 조건부 평가 유예했다.2025-12-04 18:53:22정흥준 기자
애엽·구형흡착탄 등 약평위서 조건부 급여유지 결정[데일리팜=정흥준 기자]스티렌 등 애엽 추출물 성분 위염치료제에 대한 조건부 급여유지 결정이 나왔다. 만성신부전 치료에 사용하는 구형흡착탄도 비용효과성 충족 시 급여 적정성을 인정받았다. 4일 건강보험심사평가원 약제급여평가위원회는 12차 회의에서 애엽추출물 등 급여재평가 5개 성분에 대한 이의신청 심의를 진행했다. 애엽추출물과 구형흡착탄은 급여적정성은 없으나, 비용효과성 충족 시 급여 적정성이 있다고 결론지었다. 오리지널약 스티렌으로 대표되는 애엽 성분 위염치료제들은 지난 8월 급여적정성 없음으로 퇴출 위기에 놓였으나 가까스로 급여를 지켜냈다. 지난 11월 제약사들은 심평원이 제시한 약가인하율을 확인하고, 수용하는 제약사들은 자진 약가인하 신청을 한 바 있다. 이달 말 건정심을 거쳐 약가조정이 이뤄질 예정이다. 또 약평위는 급여재평가 이의신청에 따라 간질환 치료제 L-아스파르트산-L-오르니틴, 위십이지장염 치료제인 설글리코타이드, 콜레스테롤담석증에 쓰는 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염 등에 대한 심의도 진행했다. L-아스파르트산-L-오르니틴은 경구용의 경우 간성뇌증에 한해 급여적정성을 인정받았다. 주사제는 급여적정성이 없지만 식약처 임상재평가 중으로 조건부 평가 유예한다. 설글리코타이드는 임상적 유용성이 불분명하고 비용효과적이지 않다는 결론이다. 케노데속시콜산-우르소데속시콜산삼수화물마그네슘염은 임상적 유용성 근거가 없다고 판단했다. 하지만 두 성분 모두 식약처 임상재평가 중으로 조건부 평가 유예했다.2025-12-04 18:53:22정흥준 기자 -
 2년 전 8천개 인하했는데...제약산업 발목잡는 약가 정책[데일리팜=천승현 기자] 제약사들은 정부의 반복된 약가인하 기조 정책이 산업 생태계를 위협하는 가장 큰 요인이라고 지적한다. 제약사들은 5년 전 약가제도 전면 개편으로 수천개 의약품의 약가가 인하되면서 적잖은 손실을 감수했다. 뇌기능개선제 ‘콜린알포세레이트’ 임상재평가에 실패하면 기존 판매 금액도 환수한다는 압박에 많게는 수백억원 규모의 보이지 않는 부채를 떠안은 실정이다. 정부의 급여재평가로 주력 캐시카우가 속속 퇴출되면서 지속적으로 예상치 못한 손실을 감수하는 현실이다. 최근에는 고환율로 원가 부담마저 커지면서 원가 압박이 커지는 상황에서 제네릭 약가가 또 다시 내려가면 기업 생존마저 위협받는다는 볼멘소리가 나온다. 2020년 약가제도 개편 이후 8천여개 약가인하..."정부 정책, 지속적 손실 야기" 제약사들이 정부의 약가제도 개편 움직임에 강한 저항을 갖는다. 정부 정책이 약가인하와 급여 삭제를 집중적으로 겨냥하면서 지속적으로 제약사들의 손실을 가중시킨다는 이유에서다. 5년 전 제네릭 약가제도가 전면 개편되면서 2023년 9월과 지난해 3월 두 차례에 걸쳐 제네릭 8000여개 품목의 약가가 인하됐다. 2023년 9월 5일부터 제네릭 7355개 품목의 약가가 최대 28.6% 인하됐다. 지난 2020년부터 추진한 제네릭 약가재평가의 1차 결과다. 지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 올해 2월말까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다. 제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 개편 약가제도에서 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다. 한 가지 요건이 충족되지 않을 때마다 상한가는 15%씩 내려간다. 2개 요건 모두 충족하지 못하면 27.75% 인하되는 구조다. 당시 일부 제품은 기준 요건 2가지 미충족에 사용량 약가연동제에 따른 약가인하가 중복되면서 인하율이 27.75%를 초과했다. 이때 총 179개 업체가 약가인하로 손실이 불가피했다. 한국휴텍스제약이 154개 품목이 약가인하 대상에 포함됐다. 하나제약과 대웅바이오가 각각 122개, 104개 품목이 약가가 내려갔고 일화는 101개 품목의 상한가가 인하됐다. 마더스제약, 셀트리온제약, 삼성제약, 한국글로벌제약, 이연제약, 메디카코리아, 보령바이오파마, 대한뉴팜, 동국제약, 아주약품, 건일바이오팜, 제일약품, 한국유니온제약, 동구바이오제약 등이 약가인하 제품이 80개가 넘었다. 지난해 3월에는 제네릭 약가재평가의 두 번째 결과로 의약품 948개 품목의 약가가 최대 27.9% 떨어졌다. 제네릭 약가재평가 대상 중 주사제와 같은 무균제제 등 동등성시험 대상으로 새롭게 편입된 의약품에 대해 작년 3월 추가로 약가인하가 시행됐다. 제네릭 약가재평가 2차 결과 제약사 156개 업체가 약가인하 의약품을 보유했다. 삼천당제약과 이연제약이 각각 23개 품목으로 가장 많았다. 국제약품과 신풍제약은 각각 21개 품목이 약가인하 대상에 포함됐다. 한국휴텍스제약은 19개 품목의 약가가 인하됐고 유니메드제약은 16개 품목이 인하 대상으로 분류됐다. 2020년 7월 개편 약가인하가 시행됐고 기등재 의약품에도 새 약가제도로 적용하면서 4년 만에 총 8303개 품목의 약가가 떨어진 셈이다. 업계 한 관계자는 “약가제도 개편으로 불과 2년 전에 수천개 품목의 약가가 인하됐는데 또 다시 제도를 개편하는 이유를 납득할 수 없다"라고 비판했다. 4년간 급여재평가로 6개 성분 퇴출...제약사들, 캐시카우 상실로 실적 타격 제약사들은 정부의 재평가 정책으로 지속적으로 수익성 하락 변수가 발생했다. 지난 2021년부터 4년 동안 진행한 급여 적정성 평가 결과 총 6개 품목이 건강보험 급여가 취소되면서 제약사들의 손실이 현실화했다. 보건당국은 지난 2021년 급여재평가 결과 실리마린과 빌베리건조엑스는 급여적정성이 없는 것으로 결론 나면서 건강보험 급여 삭제가 결정됐다. 실리마린은 독성간질환, 간세포보호, 만성간염, 간경변 등에 사용되는 일반의약품이다. 빌베리건조엑스는 당뇨병에 의한 망막변성 및 눈의 혈관장애 개선에 사용되는 약물이다. 지난 2020년 기준 실리마린과 빌베리건조엑스는 각각 275억원, 287억원 규모의 외래 처방시장을 형성했다. 지난 2022년부터 급여재평가 결과 스트렙토키나제·스트렙토도르나제(스트렙토제제), 옥시라세탐, 아세틸엘카르니틴 등의 성분에 대해 전 품목 급여 삭제가 결정됐다. 이중 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 식약처의 임상재평가를 통과하지 못하면서 처방 시장이 소멸했다. 지난 2020년 기준 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 총 732억원의 처방시장을 형성했다. 지난해 급여재평가 결과 급여 삭제가 결정된 이토프리드도 처방 시장이 사라졌다. 이토프리드는 복부팽만, 상복부통, 식욕부진, 속쓰림, 구역, 구토 등 기능성소화불량으로 인한 소화기증상에 사용되는 의약품이다. 이토프리드는 지난해 221억원의 처방시장을 나타냈다. 매 분기 50억원대 처방시장을 형성했는데 올해 2월부터 소멸했다. 제약사들은 록소프로펜의 급여 축소로 인한 손실도 감수한 상황이다. 록소프로펜은 ▲만성 류마티스관절염, 골관절염(퇴행관절염), 요통, 견관절주위염, 경견완증후군 등의 소염·진통 ▲수술 후, 외상 후 및 발치 후의 소염·진통 ▲급성 상기도염의 해열·진통 등에 사용되는 약물이다. 급성 상기도염의 해열·진통’ 적응증에 대해 급여 적정성이 없다고 결론 내리고 지난해부터 급여가 삭제됐다. 록소프로펜은 지난 2021년 724억원의 처방시장을 형성했는데 2022년 1035억원으로 43.0% 치솟았고 2023년에는 1135억원으로 확대됐다. 지난해 록소프로펜 성분 외래 처방시장 규모는 총 833억원으로 전년대비 26.7% 감소하며 급여 축소 직격탄을 맞았다. 록소프로펜은 2023년 4분기 307억원의 처방액을 기록했는데 올해 들어 1분기 208억원, 2분기와 3분기에는 202억원, 204억원으로 쪼그라들었다. 콜린알포 환수 대비 부채 인식...“정부 정책에 실적 손실 현실화” 제약사들은 뇌기능개선제 ‘콜린알포세레이트’(콜린제제)의 임상재평가가 끝나지 않았는데도 이미 임상 실패를 가정한 부채를 인식한 상황이다. 정부 정책으로 가상 부채를 회계에 반영하는 이례적인 현상이다. 금융감독원에 따르면 종근당, 대웅바이오, 한미약품, 알리코제약, 동구바이오제약, 국제약품, 동광약품, 경동제약, 제뉴파마, 동국제약, 환인제약 등이 콜린제제 임상실패를 대비한 환수 금액 추정치를 미리 부채 항목 등에 반영한 것으로 나타났다. 콜린제제의 임상시험 실패시 발생할 수 있는 최악의 시나리오를 대비해 사전 대책 마련 움직임이다. 수익의 일부를 부채로 인식하면서 추후 일시적으로 발생할 수 있는 거액의 환수에 따른 피해를 최소화하겠다는 의도다. 일부 실적 공백을 감수하면서 임상 실패를 대비한 막대한 손실을 분산시키겠다는 고육책이다. 콜린제제는 효능 논란이 불거지자 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사들은 재평가 임상시험에 착수했다. 지난 2020년 복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 만약 제약사들의 콜린제제 재평가 임상시험이 실패로 결론나면 보건당국에 임상시험 기간 동안 올린 처방액 20%를 되돌려줘야 하는 상황이다. 종근당은 지난 3분기 말 기준 비유동부채 항목에 환불부채 520억원을 인식했다. 회사 측은 “콜린알포세레이트제제의 유효성 입증을 위한 임상재평가 실패시 건강보험공단에 납부할 추정금액을 환불부채로 인식했다”라고 설명했다. 콜린제제 판매로 발생한 수익의 일부를 추후 환불할 것으로 예상되는 부채로 미리 인식했다는 의미다. 대웅바이오는 콜린제제 임상재평가 실패시 납부할 금액 추정치를 장기선수금으로 인식한다. 선수금은 상품이나 서비스를 제공하기 전에 미리 받은 금액 부채에 해당한다. 지난해 말 대웅바이오의 기타비유동부채 중 장기선수금은 666억원에 달했다. 동구바이오제약은 비유동부채 중 기타 비유동부채 항목에 콜린제제 환수액을 사전에 인식했다. 3분기 말 동구바이오제약의 기타 비유동부채는 139억원으로 설정됐다. 동구바이오제약은 “국민건강보험공단과의 '콜린알포세레이트'의 처방액의 일부 환수조건에 합의했으며 납부할 추정금액이 포함돼 있다. 임상재평가 결과에 따라 환수금액은 변동될 수 있다”라고 제시했다. 알리코제약은 비유동부채 중 장기 환불부채에 콜린제제 환수금액 추정치를 선반영하고 있다. 알리코제약은 지난 9월 말 기준 비유동부채 장기환불부채 113억원을 인식했다. 한미약품은 지난 상반기 말 기준 비유동부채 항목 중 계약부채 및 환불부채 35억원을 인식했다. 한미약품은 “콜리네이트연질캡슐 임상재평가 실패 시 국민건강보험공단으로 납부해야 할 금액 추정치에 해당한다”고 설명했다. 국제약품은 비유동충당부채에 콜린제제 환수금액을 미리 반영했다. 국제약품은 “콜린알포세레이트 제제의 임상 재평가 실패시 처방액의 일정금액을 건강보험공단에서 환수 조치한다. 이에 회사는 납부해야 할 금액을 추정해 반영하고 있다”라고 소개했다. 지난 9월말 기준 국제약품의 비유동충당부채는 47억원 반영됐다. 동광제약, 경동제약, 제뉴파마, 동국제약, 환인제약 등도 수십억원 규모의 콜린제제 환수금액을 사전에 부채 항목 등에 선인식했다. 콜린제제의 지난해 콜린제제의 외래 처방금액은 6123억원으로 집계됐다. 올해 3분기 누적 처방 시장 규모는 4419억원으로 나타났다. 최근 시장 성장세는 주춤했지만 여전히 3개월 처방액이 1500억원에 육박하는 초대형 시장을 형성했다. 만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 계산이 나온다. 이 경우 제약사들의 환수 금액은 5000억원 이상으로 추산된다. 제약사 입장에선 실적 손실을 감수하면서도 콜린제제의 수익금 일부를 미리 반영하면서 최악의 상황을 대비할 수 밖에 없는 처지다. 제약사들은 콜린제제의 허가가 효력을 유지하는 상황에서 재평가 임상시험 실패로 막대한 금액을 부담하는 것은 납득하기 어렵다는 인식이 팽배하다. 고환율로 원가 부담 가중...제약사들 “약가인하시 치명적 타격 불가피” 제약사들은 최근 고환율로 원가 부담에 가중되는 상황에서 제네릭 약가기준이 더욱 낮아지면 치명적인 손실을 초래할 것이란 우려가 팽배하다. 지난 25일 서울 외환시장에서 원·달러 환율은 1472.9원을 기록했다. 지난해 10월 2일 1306.9원과 비교하면 1년 만에 13.1% 상승했다. 원달러 환율은 달러당 1500원 선을 위협할 정도로 최근 고공행진이 이어지고 있다. 원화 가치 하락은 제약사들의 원가 상승 압박으로 이어진다. 제약사들은 의약품의 핵심 원자재인 원료의약품의 수입 의존도가 높아 원달러 환율 상승은 원가 인상으로 직결된다. 국내 기업의 수입 의존도가 가장 높은 중국 원료의약품을 구매할 때에도 달러를 사용하기 때문에 원달러 환율 상승의 영향을 받을 수밖에 없다. 수입 규모가 큰 인도산 원료의약품도 달러로 거래가 이뤄지는 것으로 전해졌다. 지난해 원료의약품 자급도는 31.4%로 2023년 25.4%보다 6%포인트 상승했다. 작년 평균 원 달러 환율 1367원을 적용해 계산한 값이다. 자급도는 국내 생산 제품이 전체 시장에서 차지하는 비율을 말한다. 국내 시장 규모(생산-수출+수입)에서 국내 생산 제품의 국내 사용량(생산-수출)의 비중이다. 국내 원료의약품 자급도는 2020년 36.5%를 기록한 이후 2021년 24.4%, 2022년 11.9%로 급감했는데 2023년 25.4%로 3년 만에 반등했고 2년 연속 상승세를 이어갔다. 지난해 원료의약품 자급도는 전년대비 반등했지만 국내 사용 69.6%가 수입 제품이라는 점에서 여전히 수입 원료의약품 의존도가 높다는 지적이 나온다. 국내 기업의 원료의약품 생산 규모가 매년 증가하고 있지만 원가 절감을 위해 저렴한 수입 제품을 사용하면서 낮은 자급도가 고착화했다. 정부의 반복된 약가인하 정책이 제약사들의 저렴한 수입 원료의약품 사용 동력으로 작용한다는 지적이 꾸준히 제기됐다. 달러 강세는 수출이 많은 원료의약품 업체에도 영향을 미칠 수 있다. 국내 기업은 기초 물질을 수입·가공해 원료의약품을 생산한 이후 해외에 수출하는 사례가 많다는 게 업계 관계자들의 설명이다. 원달러 상승으로 기초 물질 수입 가격이 상승하면 국내 생산 원료의약품의 원가도 열악해지는 구조다. 최근 달러 초강세로 제약사들은 더욱 원가 압박에 시달리고 있지만 다른 소비재와는 달리 완제의약품의 가격을 올릴 수도 없어 체감하는 걱정은 더욱 크다. 건강보험 의약품의 보험상한가는 원가 가격이 상승하더라도 제약사가 자발적으로 보험상한가를 인상할 수 없는 구조다. 퇴장방지의약품에 한해 정부가 원가 보전 차원에서 보험약가를 올려줄 수 있다. 다른 약물에 비해 가격이 낮아 품절이 빈번하게 발생하거나 원가 압박으로 제약사가 생산·수입을 기피해 임상진료에 지장을 초래하는 의약품은 퇴장방지의약품으로 지정될 수 있다. 업계 한 관계자는 “최근 고환율로 원가 압박이 감당하기 힘든 수준으로 거세지는 상황이다”라면서 “지난 몇 년간 약가 규제로 수익성이 크게 악화했는데 또 다시 제네릭 약가기준이 낮아지면 제약사들은 기업 존폐마저 걱정해야 하는 처지다”라고 토로했다.약가제도 개편과 위기의 제약업계(2)2025-11-26 06:13:36천승현
2년 전 8천개 인하했는데...제약산업 발목잡는 약가 정책[데일리팜=천승현 기자] 제약사들은 정부의 반복된 약가인하 기조 정책이 산업 생태계를 위협하는 가장 큰 요인이라고 지적한다. 제약사들은 5년 전 약가제도 전면 개편으로 수천개 의약품의 약가가 인하되면서 적잖은 손실을 감수했다. 뇌기능개선제 ‘콜린알포세레이트’ 임상재평가에 실패하면 기존 판매 금액도 환수한다는 압박에 많게는 수백억원 규모의 보이지 않는 부채를 떠안은 실정이다. 정부의 급여재평가로 주력 캐시카우가 속속 퇴출되면서 지속적으로 예상치 못한 손실을 감수하는 현실이다. 최근에는 고환율로 원가 부담마저 커지면서 원가 압박이 커지는 상황에서 제네릭 약가가 또 다시 내려가면 기업 생존마저 위협받는다는 볼멘소리가 나온다. 2020년 약가제도 개편 이후 8천여개 약가인하..."정부 정책, 지속적 손실 야기" 제약사들이 정부의 약가제도 개편 움직임에 강한 저항을 갖는다. 정부 정책이 약가인하와 급여 삭제를 집중적으로 겨냥하면서 지속적으로 제약사들의 손실을 가중시킨다는 이유에서다. 5년 전 제네릭 약가제도가 전면 개편되면서 2023년 9월과 지난해 3월 두 차례에 걸쳐 제네릭 8000여개 품목의 약가가 인하됐다. 2023년 9월 5일부터 제네릭 7355개 품목의 약가가 최대 28.6% 인하됐다. 지난 2020년부터 추진한 제네릭 약가재평가의 1차 결과다. 지난 2020년 6월 보건복지부는 최고가 요건을 갖추지 못한 제네릭은 올해 2월말까지 ‘생동성시험 수행’과 ‘등록 원료의약품 사용’ 자료를 제출하면 종전 약가를 유지해주는 내용의 약제 상한금액 재평가 계획 공고를 냈다. 제네릭 약가재평가는 2020년 7월부터 시행된 새 약가제도를 기등재 제네릭에 적용하기 위한 정책이다. 개편 약가제도에서 제네릭 제품은 생동성시험 직접 수행과 등록 원료의약품 사용 요건을 모두 충족해야만 최고가를 받을 수 있다. 한 가지 요건이 충족되지 않을 때마다 상한가는 15%씩 내려간다. 2개 요건 모두 충족하지 못하면 27.75% 인하되는 구조다. 당시 일부 제품은 기준 요건 2가지 미충족에 사용량 약가연동제에 따른 약가인하가 중복되면서 인하율이 27.75%를 초과했다. 이때 총 179개 업체가 약가인하로 손실이 불가피했다. 한국휴텍스제약이 154개 품목이 약가인하 대상에 포함됐다. 하나제약과 대웅바이오가 각각 122개, 104개 품목이 약가가 내려갔고 일화는 101개 품목의 상한가가 인하됐다. 마더스제약, 셀트리온제약, 삼성제약, 한국글로벌제약, 이연제약, 메디카코리아, 보령바이오파마, 대한뉴팜, 동국제약, 아주약품, 건일바이오팜, 제일약품, 한국유니온제약, 동구바이오제약 등이 약가인하 제품이 80개가 넘었다. 지난해 3월에는 제네릭 약가재평가의 두 번째 결과로 의약품 948개 품목의 약가가 최대 27.9% 떨어졌다. 제네릭 약가재평가 대상 중 주사제와 같은 무균제제 등 동등성시험 대상으로 새롭게 편입된 의약품에 대해 작년 3월 추가로 약가인하가 시행됐다. 제네릭 약가재평가 2차 결과 제약사 156개 업체가 약가인하 의약품을 보유했다. 삼천당제약과 이연제약이 각각 23개 품목으로 가장 많았다. 국제약품과 신풍제약은 각각 21개 품목이 약가인하 대상에 포함됐다. 한국휴텍스제약은 19개 품목의 약가가 인하됐고 유니메드제약은 16개 품목이 인하 대상으로 분류됐다. 2020년 7월 개편 약가인하가 시행됐고 기등재 의약품에도 새 약가제도로 적용하면서 4년 만에 총 8303개 품목의 약가가 떨어진 셈이다. 업계 한 관계자는 “약가제도 개편으로 불과 2년 전에 수천개 품목의 약가가 인하됐는데 또 다시 제도를 개편하는 이유를 납득할 수 없다"라고 비판했다. 4년간 급여재평가로 6개 성분 퇴출...제약사들, 캐시카우 상실로 실적 타격 제약사들은 정부의 재평가 정책으로 지속적으로 수익성 하락 변수가 발생했다. 지난 2021년부터 4년 동안 진행한 급여 적정성 평가 결과 총 6개 품목이 건강보험 급여가 취소되면서 제약사들의 손실이 현실화했다. 보건당국은 지난 2021년 급여재평가 결과 실리마린과 빌베리건조엑스는 급여적정성이 없는 것으로 결론 나면서 건강보험 급여 삭제가 결정됐다. 실리마린은 독성간질환, 간세포보호, 만성간염, 간경변 등에 사용되는 일반의약품이다. 빌베리건조엑스는 당뇨병에 의한 망막변성 및 눈의 혈관장애 개선에 사용되는 약물이다. 지난 2020년 기준 실리마린과 빌베리건조엑스는 각각 275억원, 287억원 규모의 외래 처방시장을 형성했다. 지난 2022년부터 급여재평가 결과 스트렙토키나제·스트렙토도르나제(스트렙토제제), 옥시라세탐, 아세틸엘카르니틴 등의 성분에 대해 전 품목 급여 삭제가 결정됐다. 이중 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 식약처의 임상재평가를 통과하지 못하면서 처방 시장이 소멸했다. 지난 2020년 기준 스트렙토제제, 옥시라세탐, 아세틸엘카르니틴 등 3개 성분은 총 732억원의 처방시장을 형성했다. 지난해 급여재평가 결과 급여 삭제가 결정된 이토프리드도 처방 시장이 사라졌다. 이토프리드는 복부팽만, 상복부통, 식욕부진, 속쓰림, 구역, 구토 등 기능성소화불량으로 인한 소화기증상에 사용되는 의약품이다. 이토프리드는 지난해 221억원의 처방시장을 나타냈다. 매 분기 50억원대 처방시장을 형성했는데 올해 2월부터 소멸했다. 제약사들은 록소프로펜의 급여 축소로 인한 손실도 감수한 상황이다. 록소프로펜은 ▲만성 류마티스관절염, 골관절염(퇴행관절염), 요통, 견관절주위염, 경견완증후군 등의 소염·진통 ▲수술 후, 외상 후 및 발치 후의 소염·진통 ▲급성 상기도염의 해열·진통 등에 사용되는 약물이다. 급성 상기도염의 해열·진통’ 적응증에 대해 급여 적정성이 없다고 결론 내리고 지난해부터 급여가 삭제됐다. 록소프로펜은 지난 2021년 724억원의 처방시장을 형성했는데 2022년 1035억원으로 43.0% 치솟았고 2023년에는 1135억원으로 확대됐다. 지난해 록소프로펜 성분 외래 처방시장 규모는 총 833억원으로 전년대비 26.7% 감소하며 급여 축소 직격탄을 맞았다. 록소프로펜은 2023년 4분기 307억원의 처방액을 기록했는데 올해 들어 1분기 208억원, 2분기와 3분기에는 202억원, 204억원으로 쪼그라들었다. 콜린알포 환수 대비 부채 인식...“정부 정책에 실적 손실 현실화” 제약사들은 뇌기능개선제 ‘콜린알포세레이트’(콜린제제)의 임상재평가가 끝나지 않았는데도 이미 임상 실패를 가정한 부채를 인식한 상황이다. 정부 정책으로 가상 부채를 회계에 반영하는 이례적인 현상이다. 금융감독원에 따르면 종근당, 대웅바이오, 한미약품, 알리코제약, 동구바이오제약, 국제약품, 동광약품, 경동제약, 제뉴파마, 동국제약, 환인제약 등이 콜린제제 임상실패를 대비한 환수 금액 추정치를 미리 부채 항목 등에 반영한 것으로 나타났다. 콜린제제의 임상시험 실패시 발생할 수 있는 최악의 시나리오를 대비해 사전 대책 마련 움직임이다. 수익의 일부를 부채로 인식하면서 추후 일시적으로 발생할 수 있는 거액의 환수에 따른 피해를 최소화하겠다는 의도다. 일부 실적 공백을 감수하면서 임상 실패를 대비한 막대한 손실을 분산시키겠다는 고육책이다. 콜린제제는 효능 논란이 불거지자 안전성과 유효성 검증을 위한 임상재평가가 진행 중이다. 식품의약품안전처는 2020년 6월 콜린제제 보유 업체들을 대상으로 임상시험 자료 제출을 요구했고 제약사들은 재평가 임상시험에 착수했다. 지난 2020년 복지부는 국민건강보험공단에 콜린제제를 보유한 업체들에 '임상시험에 실패할 경우 처방액을 반환하라‘는 내용의 요양급여계약을 명령했다. 협상 명령 8개월만에 제약사들은 콜린제제의 재평가 임상 실패로 최종적으로 적응증이 삭제될 경우 임상시험 계획서를 승인받은 날부터 삭제일까지 처방액의 20%를 건보공단에 돌려주겠다고 합의했다. 만약 제약사들의 콜린제제 재평가 임상시험이 실패로 결론나면 보건당국에 임상시험 기간 동안 올린 처방액 20%를 되돌려줘야 하는 상황이다. 종근당은 지난 3분기 말 기준 비유동부채 항목에 환불부채 520억원을 인식했다. 회사 측은 “콜린알포세레이트제제의 유효성 입증을 위한 임상재평가 실패시 건강보험공단에 납부할 추정금액을 환불부채로 인식했다”라고 설명했다. 콜린제제 판매로 발생한 수익의 일부를 추후 환불할 것으로 예상되는 부채로 미리 인식했다는 의미다. 대웅바이오는 콜린제제 임상재평가 실패시 납부할 금액 추정치를 장기선수금으로 인식한다. 선수금은 상품이나 서비스를 제공하기 전에 미리 받은 금액 부채에 해당한다. 지난해 말 대웅바이오의 기타비유동부채 중 장기선수금은 666억원에 달했다. 동구바이오제약은 비유동부채 중 기타 비유동부채 항목에 콜린제제 환수액을 사전에 인식했다. 3분기 말 동구바이오제약의 기타 비유동부채는 139억원으로 설정됐다. 동구바이오제약은 “국민건강보험공단과의 '콜린알포세레이트'의 처방액의 일부 환수조건에 합의했으며 납부할 추정금액이 포함돼 있다. 임상재평가 결과에 따라 환수금액은 변동될 수 있다”라고 제시했다. 알리코제약은 비유동부채 중 장기 환불부채에 콜린제제 환수금액 추정치를 선반영하고 있다. 알리코제약은 지난 9월 말 기준 비유동부채 장기환불부채 113억원을 인식했다. 한미약품은 지난 상반기 말 기준 비유동부채 항목 중 계약부채 및 환불부채 35억원을 인식했다. 한미약품은 “콜리네이트연질캡슐 임상재평가 실패 시 국민건강보험공단으로 납부해야 할 금액 추정치에 해당한다”고 설명했다. 국제약품은 비유동충당부채에 콜린제제 환수금액을 미리 반영했다. 국제약품은 “콜린알포세레이트 제제의 임상 재평가 실패시 처방액의 일정금액을 건강보험공단에서 환수 조치한다. 이에 회사는 납부해야 할 금액을 추정해 반영하고 있다”라고 소개했다. 지난 9월말 기준 국제약품의 비유동충당부채는 47억원 반영됐다. 동광제약, 경동제약, 제뉴파마, 동국제약, 환인제약 등도 수십억원 규모의 콜린제제 환수금액을 사전에 부채 항목 등에 선인식했다. 콜린제제의 지난해 콜린제제의 외래 처방금액은 6123억원으로 집계됐다. 올해 3분기 누적 처방 시장 규모는 4419억원으로 나타났다. 최근 시장 성장세는 주춤했지만 여전히 3개월 처방액이 1500억원에 육박하는 초대형 시장을 형성했다. 만약 콜린제제 임상시험 계획 승인 이후 5년간 진행한 임상시험이 실패할 경우 5년간 처방액의 20%를 환수해야 한다는 계산이 나온다. 이 경우 제약사들의 환수 금액은 5000억원 이상으로 추산된다. 제약사 입장에선 실적 손실을 감수하면서도 콜린제제의 수익금 일부를 미리 반영하면서 최악의 상황을 대비할 수 밖에 없는 처지다. 제약사들은 콜린제제의 허가가 효력을 유지하는 상황에서 재평가 임상시험 실패로 막대한 금액을 부담하는 것은 납득하기 어렵다는 인식이 팽배하다. 고환율로 원가 부담 가중...제약사들 “약가인하시 치명적 타격 불가피” 제약사들은 최근 고환율로 원가 부담에 가중되는 상황에서 제네릭 약가기준이 더욱 낮아지면 치명적인 손실을 초래할 것이란 우려가 팽배하다. 지난 25일 서울 외환시장에서 원·달러 환율은 1472.9원을 기록했다. 지난해 10월 2일 1306.9원과 비교하면 1년 만에 13.1% 상승했다. 원달러 환율은 달러당 1500원 선을 위협할 정도로 최근 고공행진이 이어지고 있다. 원화 가치 하락은 제약사들의 원가 상승 압박으로 이어진다. 제약사들은 의약품의 핵심 원자재인 원료의약품의 수입 의존도가 높아 원달러 환율 상승은 원가 인상으로 직결된다. 국내 기업의 수입 의존도가 가장 높은 중국 원료의약품을 구매할 때에도 달러를 사용하기 때문에 원달러 환율 상승의 영향을 받을 수밖에 없다. 수입 규모가 큰 인도산 원료의약품도 달러로 거래가 이뤄지는 것으로 전해졌다. 지난해 원료의약품 자급도는 31.4%로 2023년 25.4%보다 6%포인트 상승했다. 작년 평균 원 달러 환율 1367원을 적용해 계산한 값이다. 자급도는 국내 생산 제품이 전체 시장에서 차지하는 비율을 말한다. 국내 시장 규모(생산-수출+수입)에서 국내 생산 제품의 국내 사용량(생산-수출)의 비중이다. 국내 원료의약품 자급도는 2020년 36.5%를 기록한 이후 2021년 24.4%, 2022년 11.9%로 급감했는데 2023년 25.4%로 3년 만에 반등했고 2년 연속 상승세를 이어갔다. 지난해 원료의약품 자급도는 전년대비 반등했지만 국내 사용 69.6%가 수입 제품이라는 점에서 여전히 수입 원료의약품 의존도가 높다는 지적이 나온다. 국내 기업의 원료의약품 생산 규모가 매년 증가하고 있지만 원가 절감을 위해 저렴한 수입 제품을 사용하면서 낮은 자급도가 고착화했다. 정부의 반복된 약가인하 정책이 제약사들의 저렴한 수입 원료의약품 사용 동력으로 작용한다는 지적이 꾸준히 제기됐다. 달러 강세는 수출이 많은 원료의약품 업체에도 영향을 미칠 수 있다. 국내 기업은 기초 물질을 수입·가공해 원료의약품을 생산한 이후 해외에 수출하는 사례가 많다는 게 업계 관계자들의 설명이다. 원달러 상승으로 기초 물질 수입 가격이 상승하면 국내 생산 원료의약품의 원가도 열악해지는 구조다. 최근 달러 초강세로 제약사들은 더욱 원가 압박에 시달리고 있지만 다른 소비재와는 달리 완제의약품의 가격을 올릴 수도 없어 체감하는 걱정은 더욱 크다. 건강보험 의약품의 보험상한가는 원가 가격이 상승하더라도 제약사가 자발적으로 보험상한가를 인상할 수 없는 구조다. 퇴장방지의약품에 한해 정부가 원가 보전 차원에서 보험약가를 올려줄 수 있다. 다른 약물에 비해 가격이 낮아 품절이 빈번하게 발생하거나 원가 압박으로 제약사가 생산·수입을 기피해 임상진료에 지장을 초래하는 의약품은 퇴장방지의약품으로 지정될 수 있다. 업계 한 관계자는 “최근 고환율로 원가 압박이 감당하기 힘든 수준으로 거세지는 상황이다”라면서 “지난 몇 년간 약가 규제로 수익성이 크게 악화했는데 또 다시 제네릭 약가기준이 낮아지면 제약사들은 기업 존폐마저 걱정해야 하는 처지다”라고 토로했다.약가제도 개편과 위기의 제약업계(2)2025-11-26 06:13:36천승현 -
 보령, 트루버디 출시 2주년 심포지엄...최신 지견 공유[데일리팜=최다은 기자] 보령은 당뇨병 복합제 ‘트루버디’ 출시 2주년을 기념해 지난 8일 서울 웨스틴조선 파르나스 호텔에서 심포지엄을 개최했다고 18일 밝혔다. ‘당신생각 REMIND’를 주제로 열린 이번 행사에는 전국에서 개원의 100여 명이 참석해 성황을 이뤘다. 참석자들은 다파글리플로진과 피오글리타존 병용요법의 임상적 이점 등 최신 지견을 공유하며 치료 전략을 논의했다. 트루버디는 보령이 세계 최초로 개발한 개량신약으로, SGLT-2 억제제인 다파글리플로진에 TZD 계열 피오글리타존을 결합한 복합제다. 출시 이후 동일 성분 시장에서 약 80%의 점유율을 차지하며 1위 품목으로 자리잡았다. 두 성분은 혈당 강하 효과는 물론 서로의 부작용을 상쇄하며 병용 시 시너지 효과를 내는 것이 강점이다. 심포지엄 강연은 내분비내과 분야의 전문가들이 맡았다. 김성래 부천성모병원 교수(차기 대한당뇨병학회 이사장)와 윤석기 천안엔도내과의원 원장이 좌장을 맡아 두 개 세션을 진행했다. 첫 번째 세션에서 이은정 강북삼성병원 교수는 피오글리타존의 베타세포 기능 보호 효과와 최대 5년 지속되는 혈당 조절 능력, 뇌심혈관질환 및 MASLD(대사기능장애 관련 지방간질환) 개선 효과 등을 강조했다. 또한 TZD 계열의 심혈관 안전성은 ‘PROactive’ 연구에서 이미 재확인된 만큼 젊은 남성 환자, 비만·고혈압·고콜레스테롤혈증 등 동반질환을 가진 제2형 당뇨병 환자에게 특히 유효하다고 설명했다. 두 번째 세션에서 김미경 은평성모병원 교수는 제2형 당뇨병 환자의 다양한 병태와 동반질환을 고려할 때 단일제만으로는 치료가 어렵다고 지적하며 조기 병용요법의 필요성을 강조했다. 특히 트루버디의 두 성분이 다른 기전으로 작용해 추가적인 혈당 강하 효과를 제공하고, 심뇌혈관질환 및 만성신질환 개선에도 기여할 수 있다고 설명했다. 김 교수는 “SGLT-2 억제제와 TZD 조합은 말 그대로 ‘트루버디(True Buddy)’”라며 3제 병용 급여 확대 이후 더 많은 환자와 의료진에게 우선 고려될 치료 옵션이 될 것이라고 전망했다. 보령은 이번 심포지엄을 계기로 신제품 개발과 출시를 통해 당뇨 사업 확대에 더욱 속도를 낼 방침이다. 성백민 보령 마케팅본부장은 “비만도가 높고 합병증 환자가 많은 국내 상황에서 트루버디가 대사적 원인을 개선하는 대표 치료옵션으로 주목받고 있다”며 “앞으로도 당뇨병 치료 시장을 선도할 제품을 지속 선보이며 환자 치료에 진심을 다하는 기업이 되겠다”고 말했다.2025-11-18 10:20:57최다은
보령, 트루버디 출시 2주년 심포지엄...최신 지견 공유[데일리팜=최다은 기자] 보령은 당뇨병 복합제 ‘트루버디’ 출시 2주년을 기념해 지난 8일 서울 웨스틴조선 파르나스 호텔에서 심포지엄을 개최했다고 18일 밝혔다. ‘당신생각 REMIND’를 주제로 열린 이번 행사에는 전국에서 개원의 100여 명이 참석해 성황을 이뤘다. 참석자들은 다파글리플로진과 피오글리타존 병용요법의 임상적 이점 등 최신 지견을 공유하며 치료 전략을 논의했다. 트루버디는 보령이 세계 최초로 개발한 개량신약으로, SGLT-2 억제제인 다파글리플로진에 TZD 계열 피오글리타존을 결합한 복합제다. 출시 이후 동일 성분 시장에서 약 80%의 점유율을 차지하며 1위 품목으로 자리잡았다. 두 성분은 혈당 강하 효과는 물론 서로의 부작용을 상쇄하며 병용 시 시너지 효과를 내는 것이 강점이다. 심포지엄 강연은 내분비내과 분야의 전문가들이 맡았다. 김성래 부천성모병원 교수(차기 대한당뇨병학회 이사장)와 윤석기 천안엔도내과의원 원장이 좌장을 맡아 두 개 세션을 진행했다. 첫 번째 세션에서 이은정 강북삼성병원 교수는 피오글리타존의 베타세포 기능 보호 효과와 최대 5년 지속되는 혈당 조절 능력, 뇌심혈관질환 및 MASLD(대사기능장애 관련 지방간질환) 개선 효과 등을 강조했다. 또한 TZD 계열의 심혈관 안전성은 ‘PROactive’ 연구에서 이미 재확인된 만큼 젊은 남성 환자, 비만·고혈압·고콜레스테롤혈증 등 동반질환을 가진 제2형 당뇨병 환자에게 특히 유효하다고 설명했다. 두 번째 세션에서 김미경 은평성모병원 교수는 제2형 당뇨병 환자의 다양한 병태와 동반질환을 고려할 때 단일제만으로는 치료가 어렵다고 지적하며 조기 병용요법의 필요성을 강조했다. 특히 트루버디의 두 성분이 다른 기전으로 작용해 추가적인 혈당 강하 효과를 제공하고, 심뇌혈관질환 및 만성신질환 개선에도 기여할 수 있다고 설명했다. 김 교수는 “SGLT-2 억제제와 TZD 조합은 말 그대로 ‘트루버디(True Buddy)’”라며 3제 병용 급여 확대 이후 더 많은 환자와 의료진에게 우선 고려될 치료 옵션이 될 것이라고 전망했다. 보령은 이번 심포지엄을 계기로 신제품 개발과 출시를 통해 당뇨 사업 확대에 더욱 속도를 낼 방침이다. 성백민 보령 마케팅본부장은 “비만도가 높고 합병증 환자가 많은 국내 상황에서 트루버디가 대사적 원인을 개선하는 대표 치료옵션으로 주목받고 있다”며 “앞으로도 당뇨병 치료 시장을 선도할 제품을 지속 선보이며 환자 치료에 진심을 다하는 기업이 되겠다”고 말했다.2025-11-18 10:20:57최다은 -
![[기자의 눈] 오남용과 치료 사이...비만신약의 딜레마](https://pds.dailypharm.com/news_image/202511/328814_1.jpg) [기자의 눈] 오남용과 치료 사이...비만신약의 딜레마[데일리팜=손형민 기자] 글루카곤 유사 펩타이드(GLP-1) 계열 비만치료제 '위고비(세마글루타이드)'가 최근 국내에서 12세 이상 청소년까지 적응증을 확대하면서, 소아청소년 비만을 둘러싼 논의가 다시 중심으로 떠오르고 있다. 글로벌 시장에서는 이미 소아청소년 비만을 조기 개입이 필요한 의학적 질환으로 규정하고 있지만, 한국은 여전히 사회적 인식과 제도적 지원 모두가 뒤처진 상태다. 비만은 더 이상 외형이나 생활습관의 문제로 설명할 수 없다. 특히 성장기 비만은 성인 비만으로 이어질 가능성이 매우 높고, 당뇨병·고혈압·비알코올성 지방간·심혈관질환 등 만성질환의 출발점이 된다. 대한비만학회가 공개한 비만 팩트시트 2025는 이러한 현실을 여실히 보여준다. 최근 5년 사이 소아청소년 비만율은 다소 감소했지만, 여전히 10명 중 약 3명은 비만 단계에 해당한다. 남아는 14세에, 여아는 16세 이후 비만율이 최고치를 기록했다. 부모가 2단계 비만 이상일 경우 자녀의 비만 가능성이 5배 이상 높다는 점도 확인됐다. 문제는 단순 체중 증가에서 끝나지 않는다는 것이다. 소아청소년 비만 환자에서 2형 당뇨병이나 고혈압, 간질환 같은 성인 만성질환이 실제로 증가하고 있으며, 최근 임상 현장에서는 청소년 2형 당뇨병이 더 이상 드물지 않은 질환으로 받아들여질 정도로 변화가 가속화되고 있다. 전문가들은 성장기의 비만은 단기 문제가 아니라 노출 시기 자체가 질환의 중증도를 결정하는 요인이라고 분석한다. 어릴 때 시작된 비만은 지속 기간이 길어져 합병증 위험이 커지고, 평생 관리 비용과 의료적 부담이 폭증한다. 비만을 단순히 외형의 문제로 치부하던 시대와는 전혀 다른 지점에 서 있는 셈이다. 이러한 상황에도 불구하고 한국의 치료 환경은 여전히 제자리에 머물러 있다는 점이다. 최근 들어 GLP-1 계열 약물 등 혁신 치료제가 등장하면서 성인 환자들 사이에서는 비만을 약물로 치료 가능한 질환으로 받아들이는 분위기가 확산되고 있다. 반면 미국에서는 주요 비만 신약이 청소년에게 이미 허가돼 있으며, 실제 임상 현장에서 적극적으로 사용되고 있다. 한국은 오남용 우려를 이유로 규제를 강화하는 경향이 강하지만, 정작 환자 입장에서는 필요할 때 치료제를 선택할 권리를 박탈당하고 있다는 비판도 제기된다. 비만은 의지나 생활태도의 문제만으로 설명되지 않는다. 식욕은 뇌하수체-시상하부 축, 지방조직, 다양한 호르몬이 관여하는 생물학적 시스템이며, 성장기 청소년이 스스로 식욕을 통제하는 것은 성인보다 오히려 더 어려운 구조다. 근본적 생리학적 요인을 개선하지 못하면 생활습관 교정만으로는 한계가 뚜렷할 수밖에 없다. 그렇다고 약물치료가 모든 답이 될 수는 없다. 비만 치료제는 건강한 생활습관 개선과 결합될 때 효과가 극대화되며, 특히 성장기에는 생활습관 교육·지속적 상담·장기적 관리가 필수적이다. 다만 고혈압, 간기능 이상, 당뇨병 전단계 등 합병증 신호가 이미 나타난 청소년의 경우에는 약물치료가 늦어질수록 향후 질환 부담이 기하급수적으로 늘어난다는 우려가 크다. 문제의 본질은 비만을 바라보는 사회적 프레임이다. 여전히 많은 이들이 비만을 생활습관 미흡이나 의지 부족으로 해석하고, 소아청소년 비만은 "크면서 자연히 해결된다"는 인식이 존재한다. 그러나 성장기 비만은 시간이 해결해 주지 않는다. 조기 개입이 늦어질수록 장기적 건강 위험은 기하급수적으로 증가하고, 성인 이상의 의료·사회적 부담을 더욱 가중시킨다. 비만을 질환으로 보는 인식이 만들어지는 속도보다 규제는 더 엄격하고, 치료 접근성은 더 좁아졌다. 오남용을 막는 것도 중요하지만, 치료가 필요한 환자조차 약을 쓰기 어려운 상황은 또 다른 형태의 방치다. 지금 필요한 것은 규제가 아니라 균형이다. 안전성과 오남용 방지는 정책이 마련해야 할 기본이지만 그 원칙이 치료 시기마저 가로막아서는 안 된다. 성장기 비만은 평생 건강을 결정짓는 중대한 분기점이다. 치료제는 이미 나와 있다. 이제 남은 과제는 그 치료가 실제 환자에게 닿을 수 있도록 사회적 인식과 제도가 함께 따라잡는 일이다.2025-11-18 06:11:10손형민
[기자의 눈] 오남용과 치료 사이...비만신약의 딜레마[데일리팜=손형민 기자] 글루카곤 유사 펩타이드(GLP-1) 계열 비만치료제 '위고비(세마글루타이드)'가 최근 국내에서 12세 이상 청소년까지 적응증을 확대하면서, 소아청소년 비만을 둘러싼 논의가 다시 중심으로 떠오르고 있다. 글로벌 시장에서는 이미 소아청소년 비만을 조기 개입이 필요한 의학적 질환으로 규정하고 있지만, 한국은 여전히 사회적 인식과 제도적 지원 모두가 뒤처진 상태다. 비만은 더 이상 외형이나 생활습관의 문제로 설명할 수 없다. 특히 성장기 비만은 성인 비만으로 이어질 가능성이 매우 높고, 당뇨병·고혈압·비알코올성 지방간·심혈관질환 등 만성질환의 출발점이 된다. 대한비만학회가 공개한 비만 팩트시트 2025는 이러한 현실을 여실히 보여준다. 최근 5년 사이 소아청소년 비만율은 다소 감소했지만, 여전히 10명 중 약 3명은 비만 단계에 해당한다. 남아는 14세에, 여아는 16세 이후 비만율이 최고치를 기록했다. 부모가 2단계 비만 이상일 경우 자녀의 비만 가능성이 5배 이상 높다는 점도 확인됐다. 문제는 단순 체중 증가에서 끝나지 않는다는 것이다. 소아청소년 비만 환자에서 2형 당뇨병이나 고혈압, 간질환 같은 성인 만성질환이 실제로 증가하고 있으며, 최근 임상 현장에서는 청소년 2형 당뇨병이 더 이상 드물지 않은 질환으로 받아들여질 정도로 변화가 가속화되고 있다. 전문가들은 성장기의 비만은 단기 문제가 아니라 노출 시기 자체가 질환의 중증도를 결정하는 요인이라고 분석한다. 어릴 때 시작된 비만은 지속 기간이 길어져 합병증 위험이 커지고, 평생 관리 비용과 의료적 부담이 폭증한다. 비만을 단순히 외형의 문제로 치부하던 시대와는 전혀 다른 지점에 서 있는 셈이다. 이러한 상황에도 불구하고 한국의 치료 환경은 여전히 제자리에 머물러 있다는 점이다. 최근 들어 GLP-1 계열 약물 등 혁신 치료제가 등장하면서 성인 환자들 사이에서는 비만을 약물로 치료 가능한 질환으로 받아들이는 분위기가 확산되고 있다. 반면 미국에서는 주요 비만 신약이 청소년에게 이미 허가돼 있으며, 실제 임상 현장에서 적극적으로 사용되고 있다. 한국은 오남용 우려를 이유로 규제를 강화하는 경향이 강하지만, 정작 환자 입장에서는 필요할 때 치료제를 선택할 권리를 박탈당하고 있다는 비판도 제기된다. 비만은 의지나 생활태도의 문제만으로 설명되지 않는다. 식욕은 뇌하수체-시상하부 축, 지방조직, 다양한 호르몬이 관여하는 생물학적 시스템이며, 성장기 청소년이 스스로 식욕을 통제하는 것은 성인보다 오히려 더 어려운 구조다. 근본적 생리학적 요인을 개선하지 못하면 생활습관 교정만으로는 한계가 뚜렷할 수밖에 없다. 그렇다고 약물치료가 모든 답이 될 수는 없다. 비만 치료제는 건강한 생활습관 개선과 결합될 때 효과가 극대화되며, 특히 성장기에는 생활습관 교육·지속적 상담·장기적 관리가 필수적이다. 다만 고혈압, 간기능 이상, 당뇨병 전단계 등 합병증 신호가 이미 나타난 청소년의 경우에는 약물치료가 늦어질수록 향후 질환 부담이 기하급수적으로 늘어난다는 우려가 크다. 문제의 본질은 비만을 바라보는 사회적 프레임이다. 여전히 많은 이들이 비만을 생활습관 미흡이나 의지 부족으로 해석하고, 소아청소년 비만은 "크면서 자연히 해결된다"는 인식이 존재한다. 그러나 성장기 비만은 시간이 해결해 주지 않는다. 조기 개입이 늦어질수록 장기적 건강 위험은 기하급수적으로 증가하고, 성인 이상의 의료·사회적 부담을 더욱 가중시킨다. 비만을 질환으로 보는 인식이 만들어지는 속도보다 규제는 더 엄격하고, 치료 접근성은 더 좁아졌다. 오남용을 막는 것도 중요하지만, 치료가 필요한 환자조차 약을 쓰기 어려운 상황은 또 다른 형태의 방치다. 지금 필요한 것은 규제가 아니라 균형이다. 안전성과 오남용 방지는 정책이 마련해야 할 기본이지만 그 원칙이 치료 시기마저 가로막아서는 안 된다. 성장기 비만은 평생 건강을 결정짓는 중대한 분기점이다. 치료제는 이미 나와 있다. 이제 남은 과제는 그 치료가 실제 환자에게 닿을 수 있도록 사회적 인식과 제도가 함께 따라잡는 일이다.2025-11-18 06:11:10손형민 -
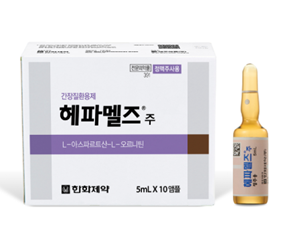 급여 적정 불인정 한화 헤파멜즈주, 임상재평가 연장[데일리팜=이탁순 기자] 올해 건강보험심사평가원 재평가에서 급여 적정성을 인정받지 못한 한화제약 '헤파멜즈주(L-아스파르트산-L-오르니틴)의 식품의약품안전처 임상재평가가 연장된다. 임상재평가 기간 동안 전공의 휴업 사태로 환자 모집에 어려움을 겪었다는 이유에서다. 식품의약품안전처는 지난 9월 26일 열린 헤파멜즈주 임상재평가 연장 관련 중앙약사심의위원회 회의록을 최근 공개하고, 헤파멜즈주 임상재평가를 12개월 연장했다고 밝혔다. 1983년 허가받은 헤파멜즈주는 간염, 간염 휴유증, 간경변 등 중증의 간질환 해독의 보조 치료 효능·효과를 갖고 있다. 식약처은 효능·효과를 입증하기 위해 임상 재평가를 지시했고, 한화제약은 지난 2023년 8월부터 임상시험에 돌입한 것으로 전해진다. 올해는 심평원의 급여 적적정 재평가에 대상에도 포함됐다. 지난 8월 약제급여평가위원회 1차 평가 결과, 임상적 유용성 근거가 없어 급여적정성이 없다는 결론이 나왔다. 이를 볼 때 이 약은 급여 삭제 가능성이 커졌다고 볼 수 있다. 하지만 의료현장 등의 요구에 따라 임상 재평가는 계속 진행할 것으로 보인다. 중앙양심에서도 재석 위원 8명이 모두 임상 재평가 12개월 연장안에 찬성했다. 한 위원은 "전공의 부재 및 대상자 입원이 원활치 않은 게 가장 큰 요인인 것으로 판단된다"며 "전공의 복귀로 연장 기간 내 환자 등록이 가능할 것으로 보인다"고 설명했다. 다만, 식약처는 임상 재평가 연장에 따른 결과보고서 제출 기한은 공개하지 않았다. 공개범위가 아니라는 이유에서다. 지금껏 급여재평가에서 급여삭제 결정이 내려진 임상재평가 진행 약제는 임상재평가 완료 시까지 급여를 유지하다가 결과에 따라 급여액 환수를 하는 협상을 별도로 진행한다. 이에 이 약도 최종 급여 삭제 판단이 나오면 임상재평가를 조건으로 환수 협상을 맺을 것으로 보인다. 어떻게 보면 이번 임상재평가 연장으로 급여 적용 시기도 조금 더 늘어난 것으로 평가된다.2025-11-05 10:34:50이탁순
급여 적정 불인정 한화 헤파멜즈주, 임상재평가 연장[데일리팜=이탁순 기자] 올해 건강보험심사평가원 재평가에서 급여 적정성을 인정받지 못한 한화제약 '헤파멜즈주(L-아스파르트산-L-오르니틴)의 식품의약품안전처 임상재평가가 연장된다. 임상재평가 기간 동안 전공의 휴업 사태로 환자 모집에 어려움을 겪었다는 이유에서다. 식품의약품안전처는 지난 9월 26일 열린 헤파멜즈주 임상재평가 연장 관련 중앙약사심의위원회 회의록을 최근 공개하고, 헤파멜즈주 임상재평가를 12개월 연장했다고 밝혔다. 1983년 허가받은 헤파멜즈주는 간염, 간염 휴유증, 간경변 등 중증의 간질환 해독의 보조 치료 효능·효과를 갖고 있다. 식약처은 효능·효과를 입증하기 위해 임상 재평가를 지시했고, 한화제약은 지난 2023년 8월부터 임상시험에 돌입한 것으로 전해진다. 올해는 심평원의 급여 적적정 재평가에 대상에도 포함됐다. 지난 8월 약제급여평가위원회 1차 평가 결과, 임상적 유용성 근거가 없어 급여적정성이 없다는 결론이 나왔다. 이를 볼 때 이 약은 급여 삭제 가능성이 커졌다고 볼 수 있다. 하지만 의료현장 등의 요구에 따라 임상 재평가는 계속 진행할 것으로 보인다. 중앙양심에서도 재석 위원 8명이 모두 임상 재평가 12개월 연장안에 찬성했다. 한 위원은 "전공의 부재 및 대상자 입원이 원활치 않은 게 가장 큰 요인인 것으로 판단된다"며 "전공의 복귀로 연장 기간 내 환자 등록이 가능할 것으로 보인다"고 설명했다. 다만, 식약처는 임상 재평가 연장에 따른 결과보고서 제출 기한은 공개하지 않았다. 공개범위가 아니라는 이유에서다. 지금껏 급여재평가에서 급여삭제 결정이 내려진 임상재평가 진행 약제는 임상재평가 완료 시까지 급여를 유지하다가 결과에 따라 급여액 환수를 하는 협상을 별도로 진행한다. 이에 이 약도 최종 급여 삭제 판단이 나오면 임상재평가를 조건으로 환수 협상을 맺을 것으로 보인다. 어떻게 보면 이번 임상재평가 연장으로 급여 적용 시기도 조금 더 늘어난 것으로 평가된다.2025-11-05 10:34:50이탁순
오늘의 TOP 10
- 1진입 장벽 없는 '알부민 식품' 홍수...제품 등록만 1190개
- 2"쌓여가는 폐의약품서 아이디어"…30년차 약사, 앱 개발
- 3제약 5곳 중 2곳 CEO 임기 만료…장수 사령탑·새 얼굴 촉각
- 4"더 정교하고 강력하게"…항암 신약의 진화는 계속된다
- 5쌍둥이 약도 흥행...P-CAB 시장 5년새 771억→3685억
- 6약물운전 4월부터 처벌 강화...약국 복약지도 부각
- 7비약사 약국개설 시도 민원, 보건소 "규정 의거 검토"
- 8장정결제 '크린뷰올산' 후발약 첫 허가 신청
- 91600억 딜 쪼갰다…동성제약 회생 M&A의 설계도
- 10충남서도 창고형약국 개설 허가…'청정지역' 5곳 남았다
-
순위상품명횟수
-
1타이레놀정500mg(10정)30,426
-
2판콜에스내복액16,732
-
3텐텐츄정(10정)13,671
-
4까스활명수큐액12,867
-
5판피린큐액12,851




























![[리쥬올]리쥬올 PDRN 약국 1위 PDRN](https://cdn.platpharm.co.kr/2025/09/2509260220180000170.webp)
![[SK케미칼] 속편한정 복합소화제](https://cdn.platpharm.co.kr/2025/12/2512040916400005920.webp)
![[더본메디칼] ATC인쇄리본 특가](https://cdn.platpharm.co.kr/2025/04/2504100527360001454.jpg)
![[종근당] 벤포벨에스 어른들의 피로회복제](https://cdn.platpharm.co.kr/2025/07/2507290841210004645.webp)
![[신신] 아렉스 두번효과로 강력한](https://cdn.platpharm.co.kr/2025/10/2510230254510000664.webp)
![[유한양행] 콘택콜드 걸렸구나 생각되면](https://cdn.platpharm.co.kr/2025/10/2510282252420008436.webp)
![[SK케미칼] 트라스트패취 피록시캄 성분](https://cdn.platpharm.co.kr/2025/10/2510020656150002375.webp)
![[셀로맥스] 베베락스 온가족 안심 관장약](https://cdn.platpharm.co.kr/2025/09/2509171131320018843.webp)

![[리쥬올]레티노 멜라세럼 저자극 레티놀](https://cdn.platpharm.co.kr/2025/09/2509260219360000145.webp)
![[유한양행] 미녹펜겔 탈모스팟 집중케어](https://cdn.platpharm.co.kr/2025/09/2509220824180004563.webp)
![[신신] 새사래 상처연고 습윤밴드](https://cdn.platpharm.co.kr/2025/10/2510210339570001784.webp)
![[아워팜] CJ웰케어, 바이오코어 1000억 유산균](https://i.baropharm.com/products/202512/1765955416559.png)
![[아워팜] 건강한 힘, 바로바이오틱스 kids 비피더스 50억](https://i.baropharm.com/products/202511/1763106585375.png)
![[아워팜] 에너지 바로 충전, 바로콤](https://i.baropharm.com/products/202512/1764922282624.png)
![[켄뷰] 오리지널 폼타입, 로게인5%폼에어로졸60g](https://i.baropharm.com/products/dc84d96e-d0b4-46bc-bcc8-d62016406fe4.png)
![[켄뷰] 다양한 통증에, 타이레놀정 500mg 10정](https://i.baropharm.com/products/6c6ea4f4-7ab2-44f2-a165-f062d80f525b.png)
![[레킷코리아] 목 아플 때, 스트렙실 허니&레몬 트로키 12정](https://i.baropharm.com/products/202502/1739520767049.png?label=PLAN_01)
![[한독] 붙이는 통증 전문가, 케토톱 액티브 플라스타(쿨) 40매](https://i.baropharm.com/products/202503/1741829602305.png)
![[휴온스 ] 비듬을 한번에, 니조랄 2%액](https://i.baropharm.com/products/478a284d-4361-4b4a-8a00-8bab80f34319.png?label=PLAN_01)
![[아워팜] 혈행건강 히어로, 혈행건강 초임계 rTG 오메가3 프리미엄](https://i.baropharm.com/products/f724f191-7052-4ad5-bc92-cda889cf13a6.png)
![[오펠라] 부드럽고 편안한, 둘코락스에스장용정 20정](https://i.baropharm.com/products/202511/1762260404625.png)
![[아워팜] 우리아이 맞춤설계, 바로타민 kids 엘더베리맛](https://i.baropharm.com/products/8eae7689-61be-4b71-9608-05364b05ea12.png)
![[아워팜] 아이들이 먼저찾는, 바로타민 kids 미네랄](https://i.baropharm.com/products/202512/1766121243228.png)
