- LOGIN
- MemberShip
- 2026-03-10 05:37:04
- The Minister Lee, Enhanced post-de-factor management
- by Jung, Heung-Jun | translator Choi HeeYoung | 2019-11-18 22:21:54
On the 15th, the Minister Lee attended Korean Academy of Social & Managed Care Pharmacy and presented the four directions of drug safety management in four categories: patient safety, accessibility, safety ecosystem, and globalization.

She said, "In the meantime, in the event of Invossa’s case , it was most of the time that the license was revoked or changed.
In the future, we will thoroughly control the side effects, operate the long-term follow-up management system, and carefully regulate the damage.
I will lead the paradigm.
" For 3,000 patients for injecting Invossa, she will select 20 medical institutions and conduct a long-term follow-up survey for 15 years.
"We have registered for 80 to 90 percent of our patients." she said, "Patients have used 400 medical institutions, but the concern is about cancer.
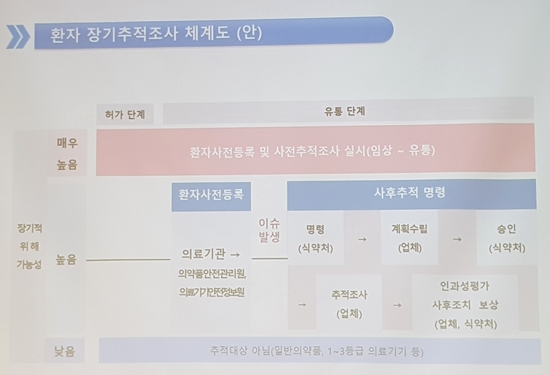
So long-term follow-up should be in a hospital with oncology." "We plan to track them all at large hospitals, and we will also carry out causality research of cancer." On this day, the “Long-term patient tracking survey system (Draft)”, which will be applied to future risk medicines, was announced.
According to the plan, when the MFDA issues a follow-up order, companies make a plan and MFDA goes through approval process.
Companies conduct follow-up investigations.
Causality evaluations and follow-up actions are conducted with the MFDS.
The Minister Lee said, "We still have to be specified liability compensation.
The government thinks that product defects should be shouldered by pharmaceutical companies.
But, pharmaceutical companies have different positions that they are not responsible for what they didn't know at the time.
We are discussing the responsibility with the relevant committees” ◆Strengthen practical use of RWD (Real World Data), R &D investment extension.
In addition, MFDS will strengthen the use of RWD (Real World Data) and RWE(Real World Evidence) next year to strengthen patient safety management It plans to establish big data utilization system such as clinical site RWD and RWE in clinical trial RCT.
To this end, it will actively invest in R & D costs.

MFDS R & D expenses rose from ₩85 billion to ₩100 billion this year.
But most of them are the cost of experimentation.
I'm going to turn this into RWD study”.
She also announced that she will soon disclose ways to improve safety for conditional phase3 permits.
"There is a lot of controversy about whether a conditional phase3 permit will guarantee the patient first, or if he will give the opportunity after ensuring full safety, if there is no alternative." We will soon release to the media on how to make it work more securely.
” ◆As new drug development countries become more important, permit strengthening of MFDS expertise She said that as Korea is actively developing new drugs, licensing is becoming more important, so the MFDA will also strengthen its expertise.
She said, “If the drugs were reviewed at least once because foreign new drugs were introduced into the country in the past, currently there is a need to be more burdensome in terms of initial authorization and to reinforce professionalism since new drugs are being developed in Korea.
Only about 350 people are screened by the MFDS, but there are 6,000 Ph.D in US.
The MFDS will focus on strengthening its expertise in the future.” She also said “MFDS or pharmaceutical companies can’t do it alone, Infrastructure maturity must increase” "The long-term policy is needed to fundamentally improve the problem," She said.
It is true that there is a lack of policy research think tank, ” She also recognized the necessity of analyzing and evaluating the future system.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.








