- LOGIN
- MemberShip
- 2026-03-10 09:53:50
- Pilot Drug Approval·Review Coordination Committee extended
- by Lee, Hye-Kyung | translator Hong, Ji Yeon | 2025-09-04 06:10:03
The pilot operation period for the Pharmaceutical Approval and Review Coordination Committee will be extended by one year.
According to the pharmaceutical industry on September 3, the Ministry of Food and Drug Safety (MFDS) decided to extend the pilot period for the Coordination Committee by one year, starting from August 29.
The committee had been operating on a trial basis for one year since June 17 of the previous year.
This extension is based on a revision of the committee's operational guidelines.
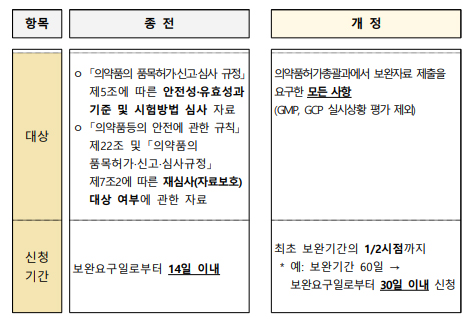
For the past year, applications for adjustment were limited to cases involving safety and efficacy review data, quality review data, and documentation related to data protection.
However, starting this year, the scope has been expanded to include 'all matters' for which the Pharmaceutical Approval Management Division has requested supplementary data.
It allows applicants to request an adjustment when supplementary data is asked for during the drug product approval and review process.
The committee, chaired by the Director of the Drug Safety Bureau, includes the Head of the Pharmaceutical Review Department, the Director of the Pharmaceutical Policy Division, the Director of the Pharmaceutical Approval Management Division, relevant review department heads, and experts from the Central Pharmaceutical Affairs Council.
They proceed with adjustments through a majority vote.
With the pilot program extended for another year, it will apply to applications submitted to the Pharmaceutical Approval Management Division.
The MFDS plans to evaluate the operational results at the end of this period to decide whether to terminate the pilot program, transition it to a full-scale operation, or further expand the scope of adjustment applications.
The scope of applications for adjustment includes ▲Review data specified in Article 5 of the 'Regulations on Drug Product Approval, Notification, and Review' ▲Data related to the eligibility for clinical trial data protection, as per Article 31-6 of the 'Pharmaceutical Affairs Act' and Article 21-2 of the 'Rules on the Safety of Pharmaceuticals, etc.' ▲Other matters for which adjustment is deemed necessary in response to a request for supplementary information (excluding requests for supplementary data needed for evaluating the implementation status of Good Manufacturing Practice (GMP) and clinical trials).
An applicant wishing to request an adjustment must submit an application form, as specified in Annex No.
1 of the guidelines, to the Pharmaceutical Approval Management Division within 30 days of the request for supplementary information.
The committee plans to process the adjustment applications, in principle, within the 60-day supplementary request period.
Only the applicant listed on the application form can request an adjustment; an agent cannot make this request.
Meanwhile, once an application is selected for adjustment, it will be thoroughly discussed at a Coordination Committee meeting, which is composed of both internal and external experts.
A two-thirds majority vote of the committee members present decides on the supplementary requirements.
The results of the adjustment are then communicated to the relevant divisions and the applicant.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.







