- LOGIN
- MemberShip
- 2026-03-10 12:46:42
- MFDS, "Increase in fees will expedite biosimilar approval"
- by Lee, Tak-Sun | translator Hong, Ji Yeon | 2025-09-18 06:02:54

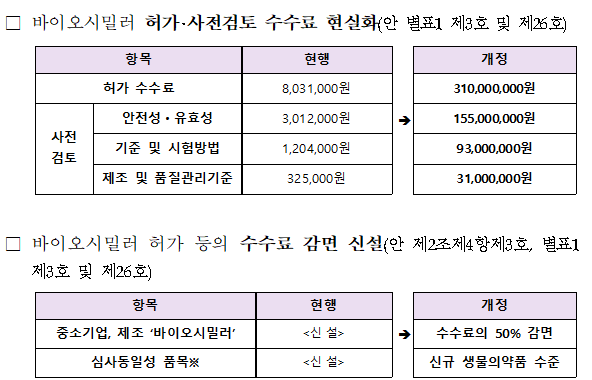
The MFDS issued an administrative announcement on September 12 regarding a partial amendment to the 'Regulations on Fees for Pharmaceutical Approvals, etc.', which primarily details the reorganization of approval fees for biosimilars (biological medicines).
According to the amendment, the approval fee for biosimilars will increase to KRW 310 million, a significant jump from the previous KRW 8.031 million.
Also, the MFDS announced that it will shorten the approval period from the current 406 days to 295 days.
An MFDS official stated on September 16 to a group of specialized journalists, "Similar to our innovative plan for new drug approvals, we will expand customized consultations through the operation of a dedicated review team." The MFDS plans to establish a dedicated review team (10-15 reviewers) from various fields to conduct biosimilar reviews in areas such as ▲safety and efficacy ▲quality management ▲Good Manufacturing Practice (GMP) ▲Good Clinical Practice (GCP).
Specifically, the teams will be organized by product, centered around the Biopharmaceutical Policy Division's 'Bio Approval TF' within the Biopharmaceuticals and Herbal Medicines Bureau.
An official from the Bio Approval TF said, "We have received positive feedback from the industry since implementing the innovative plan for new drug approvals in January," and added, "The dedicated teams will be structured similarly to the new drug innovation plan and are expected to provide swift and accurate approval reviews for biosimilar products." The MFDS also announced plans to prioritize GMP inspections for biosimilar products.
The core of this initiative is to conduct GMP evaluations and on-site inspections within 90 days of submitting the approval application.
The agency also plans to recruit highly qualified reviewers.
Another MFDS official stated, "This matter has not yet been finalized, so I must be cautious in expressing an opinion," and added, "If the biosimilar approval fee increase is finalized, we plan to supplement our staff with highly qualified reviewers to enhance our approval and review capabilities, thereby improving patient access to treatment in Korea.
We will do our utmost to respond to the growing demand for biosimilar products." The industry believes that if GMP inspections are completed within 90 days, the approval speed could increase even further.
An industry official said, "The demand for biosimilar products has been increasing recently due to the rise in chronic diseases and the aging population," and added, "Because of this, pharmaceutical companies are seriously beginning the development and approval applications for biosimilar products.
If the fee increase becomes a reality, the shortened approval timeline will likely accelerate product launches." According to the '2024 Drug Approval Report' released by the MFDS, biosimilar products (equivalent biological medicines) recorded a total of 18 items (10 APIs), an increase of 6 items from the previous year, marking the highest number of approvals since the first product approval in 2012.
More than half of these (13 items, 7 APIs) were domestically developed in Korea, suggesting that the domestic biosimilar industry, led by Celltrion and Samsung Biologics, has gained global competitiveness.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.







