- LOGIN
- MemberShip
- 2025-12-19 06:39:48
- Mandatory reporting of market supply suspended drugs
- by Lee, Hye-Kyung | translator Hong, Ji Yeon | 2025-03-13 05:58:35
The mandatory reporting is being considered to include drug products of suspended production·importation and supply, and 'supply shortage drugs' of which supply has been halted for more than 1 month.
The Ministry of Food and Drug Safety (MFDS; Minister, Yu-Kyoung Oh) stated that it would announce on March 11 an administrative notice of revision to the 'Regulation on Notification of Production·Importation·Supply suspended drug products' and will receive opinions until March 31.
The regulation concerns the notification criteria for pharmaceutical companies reporting a supply shortage of drug products.
The revision details include reducing the time for reporting the discontinuance of production, importation, and supply of drug products from 60 days in advance to 180 days in advance, and it establishes a new duty to report on production and importation shortage.
The MFDS has established criteria for production·importation shortage to address the issue of lack of definition of drugs sold out and drugs in supply shortage.
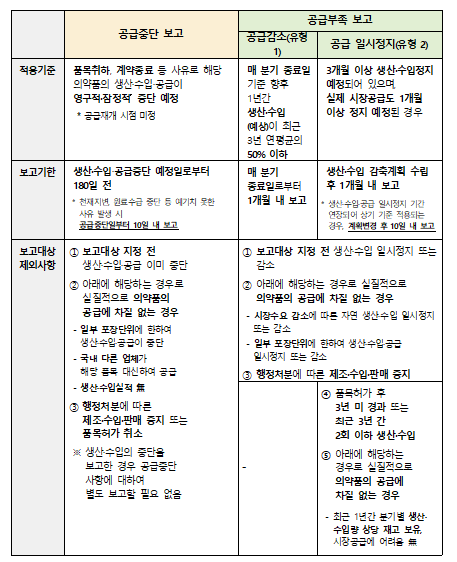
In the case of supply reduction, if production or imports are expected to decrease to 50% or less of the three-year annual average for the upcoming one year as of the end of each quarter, a report must be submitted to the MFDS within one month of the quarter's end.
Suppose production or imports are expected to be suspended for more than three months, and market supply is expected to be halted for over one month.
In that case, a supply reduction plan must be established and reported within one month.
However, if the temporary suspension of production·imports·supply is extended and meets the reporting criteria, the revised plan must be reported within 10 days of the change.
Supply reduction and temporary supply suspension are excluded from reporting requirements in cases where ▲Temporary suspension or reduction of production·import occurs before the designation of a reportable item ▲Temporary suspension or reduction occurs naturally due to decreased market demand, or only specific packaging units are affected without significant disruption to the overall drug supply ▲Manufacturing·import·sales suspensions resulting from administrative sanctions.
Additionally, reporting on temporary supply suspensions is exempt ▲If the product has been on the market for less than three years after approval or has been produced·imported two or fewer times in the past three years ▲If the company holds inventory equivalent to its quarterly production or import volume for the past year and faces no difficulty in market supply.
Additionally, as previously announced by the MFDS, the revised regulations now require companies to report supply discontinuation 180 days in advance, moving up the reporting timeline from the previous 60 days.
For permanent·temporary discontinuation of drug production·import·supply due to reasons such as withdrawal of product approval or contract termination, companies must report at least 180 days before the scheduled discontinuation date.
Along with enhanced reporting duty, administrative penalties have also been revised.
If a company reports supply discontinuation between 180 days before the discontinuation date and the actual discontinuation date, the first violation will result in a 7-day suspension of manufacturing operations.
A second violation will lead to a 15-day suspension, a third violation will result in a 1-month suspension, and a fourth violation will incur a 3-month suspension of manufacturing operations.
Failure to report production reduction will also result in penalties.
A first violation will result in a warning, a second violation will lead to a 15-day suspension, a third violation will result in a 1-month suspension, and a fourth violation will lead to a 3-month suspension of manufacturing operations.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.










