- LOGIN
- MemberShip
- 2025-12-27 10:20:36
- In the aftermath of the COVID-19, the BA test was disrupted
- by Chon, Seung-Hyun | translator Choi HeeYoung | 2020-03-04 06:27:13
COVID-19 infections have also influenced the generic development strategies of pharmaceutical companies.
Due to the risk of infection with COVID-19, the bioequivalence task of medical institutions has been disrupted.
This is an embarrassing situation for pharmaceutical companies that are conducting bioequivalence tests to reduce drug prices ahead of the reform of the generic drug price system.
They are concerned whether the new generics' approval schedule may be delayed or the authorization for drug price maintenance will affect the generic bioequivalence test.
According to the industry on the 1st, H Plus Yangji Hospital recently announced the suspension of bioequivalence testing due to the spread of COVID-19 to pharmaceutical companies and analysis agencies.
Yangji Hospital has decided to suspend face-to-face testing related to bioequivalence tests, including first-dose monitoring, screening, monitoring, and initiation meeting, by March 15.
Tests that have been completed on stage I will proceed normally.
Although there were no COVID-19 confirmed patients at the hospital, the company decided to minimize face-to-face work to prevent infection.

Yangji Hospital is a medical institution where the largest number of generic bioequivalence tests are conducted in Korea.
Last year, 190 of 259 approved bioequivalence studies were performed at Yangji Hospital.
Three out of four bioequivalence studies are in charge of Yangji Hospital.
Yangji Hospital performed 116 of the 178 approved bioequivalence studies in 2018, accounting for 65.2%.
Many medical institutions, except Yangji Hospital, are reportedly conducting bioequivalence testing, such as medication and blood collection.
However, if the spread of COVID-19 accelerates in the future, the possibility of business disruption is raised.
As a result, pharmaceutical companies are inevitable on generic development strategies.
In particular, the development of new generics in preparation for the reform of the drug price system and the strategy of licensed generics may also be affected.
The revised drug price plan, which is scheduled to be implemented in July, has the key point that the company must maintain the upper limit of 53.55% compared to the original before the expiration of the patent only when both the bioequivalence test and DMF.
Whenever one requirement is not met, the upper limit drops by 15%.
In the case of registered generics, the upper limit can be maintained at 53.55% if the bioequivalence test and DMF requirements are met within three years.
In the case of new generic drugs, if they do not carry out direct bioequivalence tests, they will receive lower prices than before.
The prolonged discontinuation of bioequivalence testing could be a variable in the plan to get higher prices for new generics.
There is also same situation with licensed generics.
Pharmaceutical companies can maintain their existing high prices only after conducting bioequivalence tests and judging suitability prior to July 2023 for generics licensed under preconditioning.
Indeed, pharmaceutical companies are aggressively undertaking bioactivity testing.
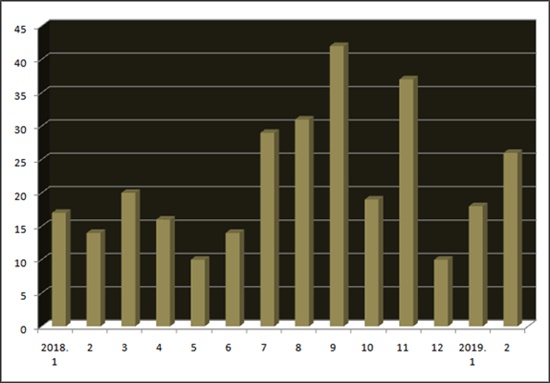
A total of 44 bioequivalence plans were approved in January and February this year, 13 more than 31 January and February last year.
A total of 91 bioequivalence plans were approved in the first half of last year, and increased significantly to 168 in the second half of last year.
Licensed generics are actively tested.
It is a bioequivalence test for the purpose of changing a manufacturer to produce generics approved by a consignment directly in its own manufacturing facility.
If the biopharmaceutical test is conducted with generics produced through the drug product research and the equivalent result is obtained, the drug price reduction can be avoided through the change permit.
Some pharmaceutical companies are considering launching bioequivalence trials for as many as tens of generics.
The delay in the schedule of bioequivalence due to the spread of COVID-19 is a burden.
An official of a pharmaceutical company said, “If the COVID-19 situation is prolonged, and the long-term interruption of bioequivalence testing will affect the generic development strategy and in addition to generics, it is also a concern to conduct normal clinical trials of new or improved drugs”.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.









