- LOGIN
- MemberShip
- 2025-12-27 00:24:50
- Samsung-AZ joint venture contemplates on Mabthera biosimilar
- by Kim, Jin-Gu | translator Byun Kyung A | 2020-10-22 06:30:52

While Archigen’s sole portfolio is a Mabthera (rituximab) biosimilar in development, the industry is paying attention to the correlation between Archigen’s silence and the saturated Mabthera biosimilar market.
A source from the pharmaceutical industry told on Oct.
19, Archigen has completed a Phase III trial on 'SAIT101' treating patients with follicular lymphoma and published the outcome.
The study was conducted in the U.S., Europe, Japan and South Korea.
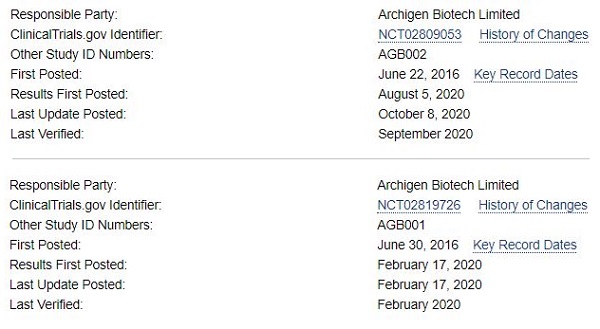
According to the clinical trial information website ‘ClinicalTrials.gov’ managed by the U.S.
National Institutes of Health (NIH), the study started from June 2016 and ended in last January.
The outcome of the study was presented in last August after data analysis.
The trial had total 315 participating patients with follicular lymphoma, in which 158 patients were treated with Mabthera and the rest of 157 patients treated with SAIT101.
The outcome seemed generally successful.
The primary endpoint, overall response rate (ORR) in the Mabthera group marked 70.6 percent and the SAIT101 group marked 66.3 percent.
Prior to the disclosure, a Phase I trial outcome comparing the Korean-made biosimilar against Mabthera in treating rheumatoid arthritis was published in last February.
The outcome was also deemed successful as the biosimilar’s efficacy was on par with Mabthera.
The industry sources say it is an exceptional case.
Usually, a company would announce additional clinical trial or item approval plan around the point of announcing the clinical trial result.
Archigen’s parent company, Samsung Biologics gave an explanation in principle only.
The company official said, “We would have an opportunity in the future to speak of the prospective plan.” Archigen is a biosimilar-specializing company established in 2014 as Samsung Biologics and AstraZeneca’s joint venture with 50/50 partnership.
With that in mind, the South Korean company would not be able to make a prospective plan by itself.
Regardless, the pharmaceutical industry has a different view in why Archigen is contemplating for a long time.
It is a convincing story that SAIT101, as a latecomer, would not have a favorable position entering the market.
At the moment, Celltrion, Pfizer and Sandoz are having a heated competition in the Mabthera biosimilar market.
In the European market, Celltrion’s Truxima, Sandoz’ Rixathon, and Pfizer’s Ruxience have been released.
And due to the series of biosimilars launched in the market, the original Mabthera’s sales have been halved.
Meanwhile, Sandoz has decided to pursue sales in the world’s biggest market, the U.S.
with low marketability expected.
The industry experts analyze the company felt the strain to enter the market after Celltrion promptly expanded its market share.
When launching its latecomer drug Ruxience in the biosimilar market, Pfizer lowered 15 percent of Truxima’s price.
On the contrary, some claim Samsung Biologics and AstraZeneca would push ahead with the product launch to retrieve the investment made so far, worth approximately 250 billion won.
A pharmaceutical industry source explained, “The Mabthera biosimilar market is a tough one as even Sandoz, considered as the biggest competitor of Celltrion, backed out from the U.S.
market and Pfizer also had to lower the price of its follow-on drug by 15 percent,” so “Samsung Biologics would have to make a difficult decision to break through the challenging market.”
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.









