- LOGIN
- MemberShip
- 2025-12-25 17:27:35
- Liver cancer pioneer ‘Nexavar,' the star in its guidelines
- by Eo, Yun-Ho | translator Alice Kang | 2021-10-01 06:09:15


When developed, new drugs developed in the latter situation attract more widespread attention.
Liver cancer (hepatocellular carcinoma) is a typical example of this.
And the only targeted anticancer therapy that was available in this difficult-to-develop field of liver cancer for over 10 years was ‘Nexavar (sorafenib).’ Of course, new drugs are now available, such as ‘Stivargar (regorafenib)’ as second-line treatment, and ‘Lenvima (Lenvatinib),’ which is used as first-line treatment like Nexavar.
Also, an immunotherapy option was added in the field with the approval of the ‘Tecentriq (atezolizumab)+Avastin (bevacizumab)’ combination therapy.
Still, Nexavar’s legacy remains strong ◆The liver treatment that was introduced for the first time in 30 years Nexavar, which was the first in the world to receive FDA approval for hepatocellular carcinoma, opened the door to targeted anticancer therapy in the field.
At the time, Nexavar was a significant achievement that was made after a series of attempts and failures by pharmaceutical companies for around 30 years.
In Korea, after receiving the first-ever approval for hepatocellular carcinoma from the Ministry of Food and Drug Safety in March 2008, the drug has accumulated the most amount of treatment experience as the only first-line targeted therapy for over a decade since then.
And the drug kept on evolving.
Data from the GIDEON study that was conducted on 3,371 liver cancer patients in 39 countries around the globe, the drug showed a consistent safety profile in Child-Pugh class B7 patients with liver damage (11%, n=359) and 에서 Child-Pugh class A patients (61%, n=1968).
Based on this, Nexavar is currently the only drug recommended as a first-line systemic anticancer therapy in patients with Child-Pugh class B7 in the 2020 NCCN guidelines (Version 5).

With Nexavar’s insurance benefit approved to Child-Pugh class B7 patients, or severe disease patients, the drug’s utility in liver disease has even more increased.
Before then, Child-Pugh class B7 was a sort of ‘grey area’ in the field of liver cancer.
With the approval, Nexavar can now be used with reimbursement in patients with advanced hepatocellular carcinoma (HCC, including pediatric patients) who cannot receive local treatment such as surgery or transarterial chemoembolization (TACE) that are: ▲Child-Pugh class A or B7; ▲at Stage Ⅲ or higher; or ▲ whose ECOG performance status (PS) is 0-2.
Also, the biggest advantage of the first-line treatment Nexavar is that it has a second-line treatment Stivarga available for use in sequence with reimbursement.
A clinical trial showed that the use of Nexavar in sequence with the second-line treatment Stivarga prolonged overall survival (OS).
However, limitations still exist as Nexavar is the only systemic anticancer treatment reimbursed for Child-Pugh class B7 patients, and no sequential treatment is available for use with reimbursement after Nexavar.
Also, there are unfavorable views on the limited reimbursement status of its competitor drug Lenvima.
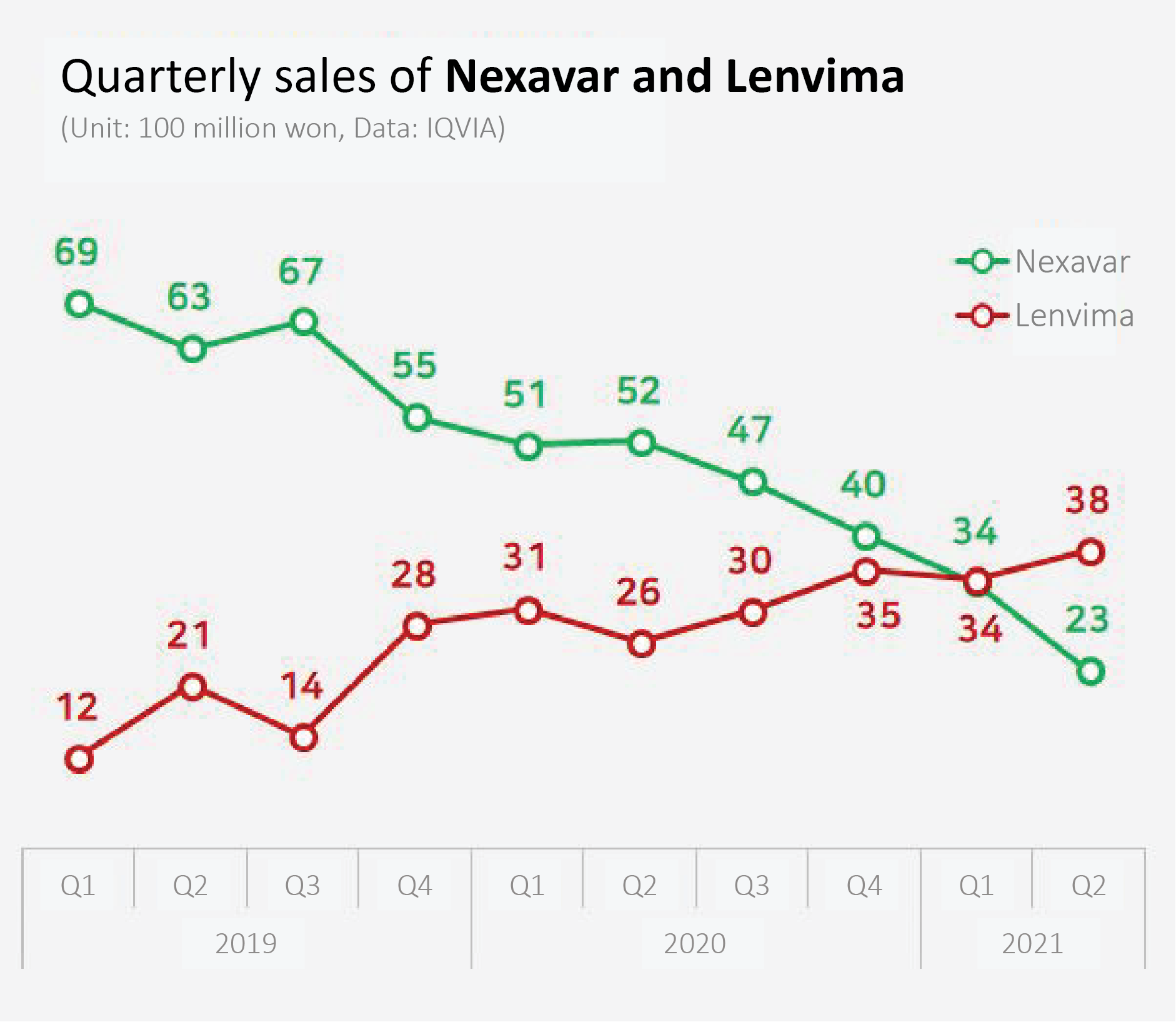
It's not about the prescription amount, but about the patent expiry and the resulting drug price cut.
According to IQVIA, Bayer’s hepatocellular carcinoma treatment sold 5.6 billion won in the first half of the year.
This is a 45% decrease from the 10.3 billion won that was sold in 1H last year.
In the same period, sales of Eisai’s Lenvima increased 27% from 5.7 billion won to 7.2 billion won.
With the steep fall in sales of Nexavar and a significant increase in sales of Lenvima, the position of the two drugs has changed.
This is a first in 13 years since the drug started being used as a liver treatment and 3 years after the release of Lenvima.
Nexavar took a hard blow in February this year with its insurance ceiling being reduced by 30%.
The government cut Nexavar’s drug price 30% ex officio from 18,560 won to 12,992 won.
This was because Hanmi Pharm’s released Nexavar’s generic after overcoming Nexavar’s patent.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.









