- LOGIN
- MemberShip
- 2025-12-25 06:25:34
- Tecentriq, first immunotherapy reimbursed in liver cancer
- by jung, sae-im | translator Kang, Shin-Kook | 2022-04-22 06:07:56

Analysts have assessed that it had prepared the footsold to expand its sales with the first expansion in its scope of reimbursement in 3 years since 2019.
Tecentriq is continuing its stride to overcome the stronghold of Keytruda, the current leader in the cancer immunotherapy market.
The National Health Insurance Service had preannounced the posting of the ‘Revision to the notice for drugs prescribed and administered to cancer patients’ that contains a new category created to establish reimbursement standards for Tecentriq in liver cancer.
The reimbursement will be applied from May 1st.
According to the amendment, Tecentriq will be reimbursed as monotherapy in first-line for patients with metastatic NSCLC whose tumors are PD-L1 positive (TC≥50% or IC≥ 10%) and do not have EGFR of ALK mutations.
Also, the drug will become the first immunotherapy to be approved for liver cancer (patocellular carcinoma, HCC).
Among patients with advanced or unresectable hepatocellular carcinoma (HCC), those satisfy all of the following conditions: ▲who are Stage III or higher ▲Child-Pugh class A and ▲have a ECOG PS (performance status) 0-1, may receive reimbursement for Tecentriq in the first-line in combination with Avastin (bevacizumab).
The drug is approved for reimbursement for basically one year in liver cancer, and when no clinical results are announced on the optimal period of administration within the year, reimbursement can be approved for up to 2 years at the most.
As a latecomer in cancer immunotherapy, the company has been hurrying to extend its reimbursement to expand its share in the market.
Although the agenda had made slow progress after passing the Cancer Drug Deliberation Committee in February last year, the agenda gained momentum this year and was finally approved after 1 year and 2 months.
Keytruda currently owns the broadest indication among all cancer immunotherapies.
The drug was approved for 18 indications in 14 cancer types including lung cancer, head and neck cancer, melanoma, and gastric cancer.
However, among the approved indications, Keytruda is only reimbursed for NSCLC, Hodgkin lymphoma., and melanoma.
It took the drug 4 years just to extend the scope of reimbursement (both monotherapy and combination therapy) to first-line from second-line in NSCLC.
This goes to show how difficult reimbursement extensions are for the costly immunotherapies.
Roche has been expanding its reimbursement relatively quickly by actively accepting government proposals.
It succeeded in entering reimbursement in one year since its approval, and in 2019, it became the first immuno-oncology drug to remove the PD-L1 expression rate restriction and broaden its scope of reimbursement.
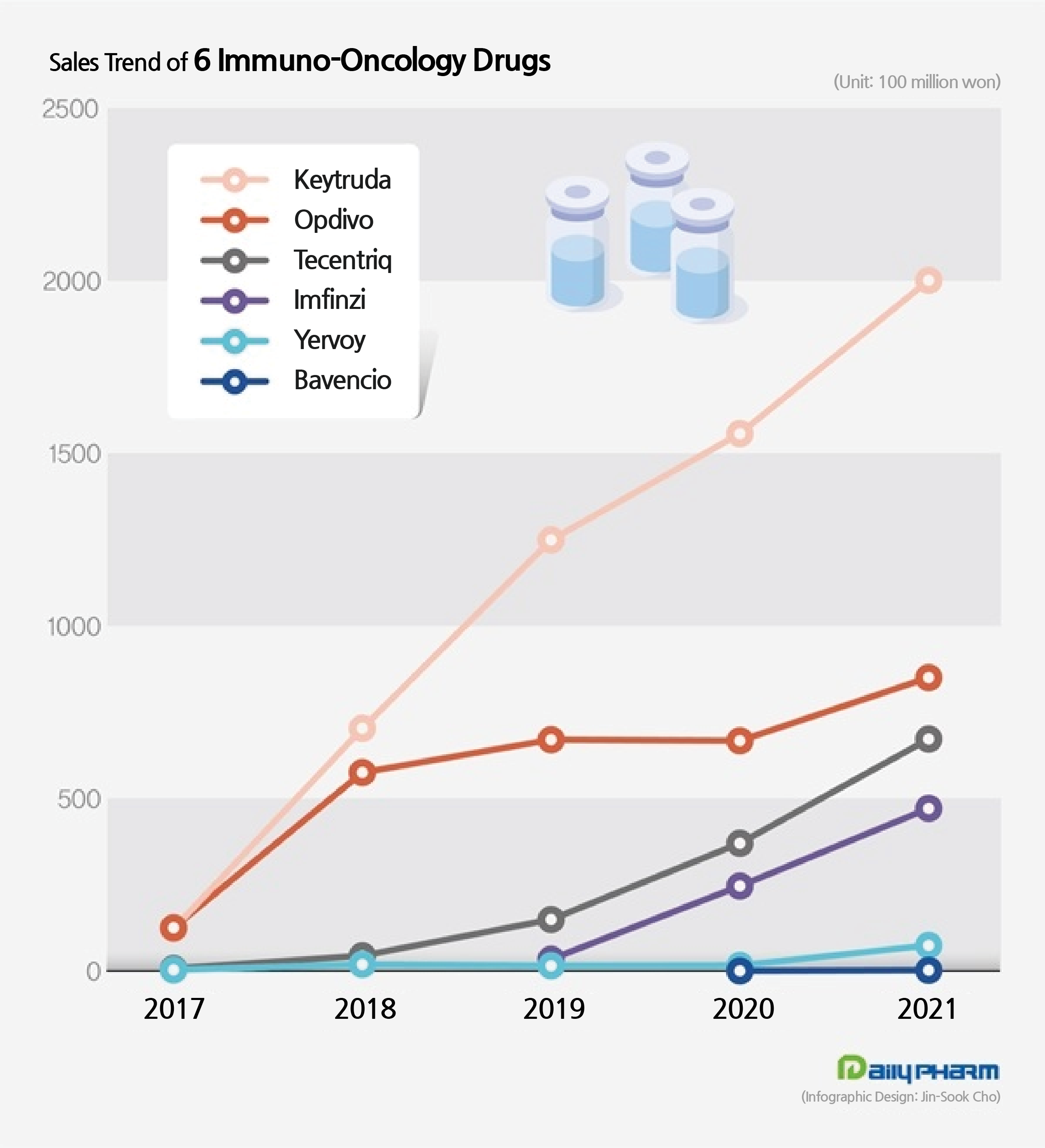
Based on this, Tecentriq posted ₩67.2 billion in sales last year based on the drug research institution IQVIA.
This is an 81.6% increase from the ₩37 billion made in the previous year.
It is only one-third of the sales of Keytruda, which is posted nearly ₩200 billion won, but Tecentriq’s sales are increasing at a rapid pace.
The drug significantly narrowed its gap with Opdivo (₩85 billion), the runner-up in the market.
The extended reimbursement approval this year has laid the grounds for Tecentriq’s sales expansion.
In particular, Tecentriq is the only drug that entered reimbursement among cancer immunotherapies, and is expected to bring a significant impact on the drug’s sales growth.
The Tecentriq and Avastin combination extended the survival period of liver cancer patients by about 6 months compared to Nexavar (sorafenib), the only first-line drug that had been available for 10 years.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.









