- LOGIN
- MemberShip
- 2025-12-24 07:23:28
- Reinforced drug regulations change generic drug approvals
- by Chon, Seung-Hyun | translator Alice Kang | 2023-01-09 06:10:59
The number of generic drugs approved per every bioequivalence test fell greatly.
Affected by the reform made in Korea's drug pricing policy, the proportion of generic drugs approved per bioequivalence test dropped significantly.
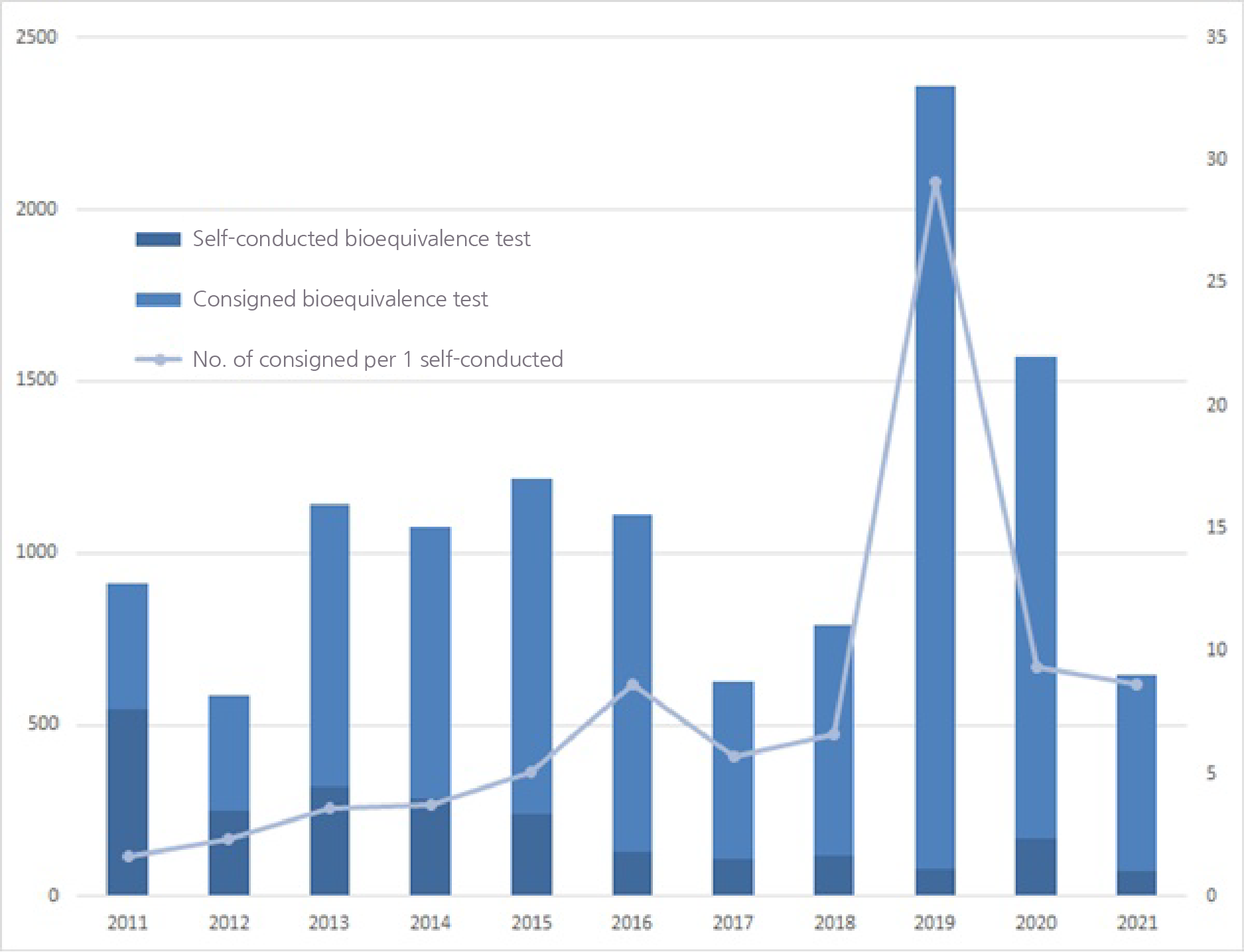
According to the Food & Drug Statistical Year Book published by the Ministry of Food and Drug Safety on the 6th, 648 items were approved after being recognized as bioequivalent to their alternative in 2021.
This was a 58.8% decrease from the 1,573 approved in 2020.
Compared to the 2,358 in 2019, this was a 72.5% decrease in 2 years.
Drugs recognized as bioequivalent are products recognized as being equivalent to their original drug, and are mostly granted for newly approved generic drugs.
of bioequivalent items (left) and No.
of items approved per bioequivalence test (right) (Unit: items, Data: MFDS) The drastic reduction in the number of bioequivalent drugs in 2021 is considered to have been directly influenced by the reform of the drug pricing system.
The main change that had been made with the reform of the drug pricing system that had been implemented in July 2020 was that only generic drugs that meet both requirements – those that directly perform bioequivalence tests and those that use registered APIs – are allowed to maintain a price level that is at 53.55% of the original drug price prior to patent expiry.
The reformed system also contained a stepped drug pricing system that lowers the price ceiling of drugs by order of listing and reducing the price of those that are listed later.
If 20 or more generic drugs are listed for a certain ingredient, the price ceiling set for the newly listed drugs afterward is set at 85% of the existing lowest price.
As companies cannot receive a high drug price without directly performing bioequivalence tests, this reduced the companies’ attempts to receive approval for generic drugs after consigning the whole manufacturing process.
Therefore, the number of generic drugs approved per bioequivalence tests has been reduced greatly.
Among the 648 bioequivalent drug items approved in 2021, 75 performed a direct bioequivalence test.
This roughly translates to 8.6 generics being approved for each test.
In 2019 and 2020, the number has been 29 and 9.4 drugs per bioequivalent test each.
The proportion of consigned generics among bioequivalent drug items reached 96.6% in 2019 but was reduced to 88.4% by 2021.
By year, the number of bioequivalent drug items increased exceptionally in 2019 and 2020.
The number, which had been 625 and 789, suddenly rose threefold in just a year to 2,358 in 2019.
This explosive increase is analyzed to be caused by the government's move to tighten regulations on generic drugs.
A total of 175 valsartan-containing hypertension drugs were suspended sales due to excess detection of impurities.
At the time, the Ministry of Health and Welfare and the Ministry of Food and Drug Safety prepared measures to inhibit the flooding of generic drugs by organizing a ‘Consultative Body to Improve the Generic Drug System.’ In response to the government’s move to reinforce regulations, pharmaceutical companies have worked to receive approval for their generic drugs in advance, which greatly increased the number of generic approvals for a short period of time.
In other words, the government’s work to reinforce regulations had caused an increase in generic approvals, and the level only returned to the previous level after the system reform.
As the regulations for the approval of generics have also been strengthened, the proportion of approved consigned generics is expected to be further reduced.
According to the amended Pharmaceutical Affairs Act, which took effect in July last year, the number of consigned generics that can be approved for each bioequivalence test has been limited to a maximum of three.
Therefore, the proportion of consigned generics among generic approvals will not be able to exceed 75%.
-

- 0
댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
댓글 명예자문위원(팜-코니언-필기모양 아이콘)으로 위촉된 데일리팜 회원의 댓글은 ‘게시판형 보기’와 ’펼쳐보기형’ 리스트에서 항상 최상단에 노출됩니다. 새로운 댓글을 올리는 일반회원은 ‘게시판형’과 ‘펼쳐보기형’ 모두 팜코니언 회원이 쓴 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
-
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
-
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
-
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
-
수사기관 등의 공식적인 요청이 있는 경우
-
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
-
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.









